Summary
Spettroscopia di impedenza elettrochimica (EIS) di specie che subiscono l'ossidazione reversibile o riduzione in soluzione è stata utilizzata per la determinazione delle costanti di velocità di ossidazione o riduzione.
Abstract
Spettroscopia di impedenza elettrochimica (EIS) è stata utilizzata per la caratterizzazione avanzata dei composti organici elettroattivi insieme voltammetria ciclica (CV). Nel caso di processi elettrochimici velocemente reversibili, corrente risente principalmente il tasso di diffusione, che è la fase più lenta e limitante. EIS è una tecnica potente che permette l'analisi separata delle fasi di trasferimento di carica che hanno diversa risposta in frequenza AC. La capacità del metodo utilizzata per estrarre il valore di resistenza al trasferimento di carica, che caratterizza il tasso di cambio carica sull'interfaccia elettrodo-soluzione. L'applicazione di questa tecnica è ampia, dalla biochimica fino a elettronica organica. In questo lavoro, vi presentiamo il metodo di analisi di composti organici per applicazioni optoelettroniche.
Introduction
Tasso di redox del composto elettroattivi è un parametro importante che caratterizza la capacità di subire processi di ossidazione o riduzione e prevedere il suo comportamento in presenza di forti ossidanti o riducenti o sotto potenziale applicato. Tuttavia, la maggior parte delle tecniche elettrochimiche sono solo in grado di descrivere qualitativamente la cinetica del processo redox. Tra le varie tecniche elettrochimiche impiegate per composti attivi redox, caratterizzazione voltammetria ciclica (CV) è il metodo più prevalente per rapido e sufficiente caratterizzazione elettrochimica di varie specie solubile1, 2,3. La tecnica di CV ha vaste applicazioni, ad esempio, i livelli di energia stime4,5,6, l'analisi di elementi portanti di carica supportato da spettroscopie7,8, 9 , 10, fino a superficie modifiche11,12,13. Come ogni metodo, CV non è perfetto e per aumentare l'applicabilità e la qualità dei risultati, il collegamento con un'altra tecnica spettroscopica è importante. Già presentiamo parecchie indagini dove era la tecnica di spettroscopia (EIS) impedenza elettrochimica autonomo14,15,16 , ma in questo lavoro, siamo destinati a mostrano passo-passo come rafforzare la tecnica di CV di EIS.
Il segnale di uscita EIS è costituito da due parametri: parti reali ed immaginarie dell'impedenza come funzioni di frequenza17,18,19,20. Permette la stima dei parametri diversi responsabile per trasferimento di carica tramite l'interfaccia elettrodo-soluzione: doppio strato capacità, resistenza di soluzione, resistenza al trasferimento di carica, impedenza di diffusione e altri parametri a seconda del sistema studiato. Resistenza al trasferimento di carica fu oggetto di grande attenzione dal momento che questo parametro è direttamente correlato alla costante di tasso di redox. Anche se le costanti di velocità di ossidazione e riduzione sono stimate in soluzione, possono in genere caratterizzano la capacità di un composto per scambio di carica. EIS è considerato una tecnica Elettrochimica avanzata che richiede profonda comprensione matematica. Suoi principi fondamentali sono descritti in elettrochimica moderna letteratura17,18,19,20,21,22,23.
Protocol
1. base preparazione di un esperimento di elettrochimico
- Preparare 4 mL di una soluzione di lavoro che contiene 0.1 mol∙L− 1 Bu4NBF4 e 0.001 mol∙L− 1 studiato composto organico aggiungendo calcolato quantità di polveri solide in 4 mL di diclorometano in un piccolo vaso o in una provetta. Con 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiophene-S, S-diossido (massa molare 802 g∙mol− 1), pesare 3,208 mg di questo composto e 0,1645 g di Bu4NBF4.
- Riempire una cella elettrochimica di 3ml con 2 mL di soluzione utilizzando una pipetta. La parte restante della soluzione sarà necessari più tardi per misurazione dell'impedenza e riprodurre i risultati.
- Polacco di un elettrodo di 1 mm diametro platino lavoro disco (WE) per 30 s usando un panno inumidito con alcune gocce di liquami di allumina. Strofinare la superficie piana dell'elettrodo disco con un pezzo di stoffa montato su un supporto immobile (ad es. piastra di Petri) applicando una pressione moderata.
- Sciacquare l'elettrodo con acqua distillata tre volte per rimuovere le particelle di allumina.
- Temprare un controelettrodo (CE, filo di platino) in una fiamma di bruciatore butano. Accuratamente messo il filo di platino in una fiamma per meno di 1 s e rimuovere rapidamente quando si inizia arrossamento per evitare la fusione.
Nota: La superficie CE non è prevista ma deve essere molto più alta rispetto alla superficie dell'elettrodo di lavoro. In questo caso, l'impedenza di interfaccia elettrodo di lavoro avrebbe l'impatto sull'impedenza totale del sistema e avrebbe permesso escluse impedenza degli elettrodi contatore dalla considerazione.- Temprare un elettrodo di riferimento (RE, filo d'argento) in fiamma del bruciatore butano nello stesso modo.
- Mettere tutti i tre elettrodi (lavoro, contatore e riferimento) in una cella evitando reciproco contatto e collegare ai cavi del potenziostato corrispondente contrassegnato come noi, CE e RE. Inserire un gas consegna tubo collegato con bombola gas argon per ulteriore deaerazione.
- Aprire la valvola del gas e disareare soluzione da argon bubbling attraverso la soluzione per 20 minuti nelle vicinanze la valvola del gas prima della misurazione.
2. provvisorio caratterizzazione mediante voltammetria ciclica (CVA)
- Registro il CVA della soluzione di lavoro all'interno di una gamma di potenziale da −2.0 V a 2,0 V e scansione tasso 100 mV∙s− 1.
- Lanciare il programma voltammetria ciclica nel potenziostato software.
- Scegliere 0.0 V come valore potenziale iniziale, −2.0 V come minimo potenziale, + 2,0 V come massimo potenziale, 100 mV∙s− 1 come tasso di scansione di scansione. Altri parametri sono facoltativi.
- Fare clic sul pulsante Start.
Nota: Un voltammogram tipico è presentato nella Figura 1.
- Determinare il valore potenziale da CVA ottenuto. Nota i valori potenziali quando maxima di positivo (anodica picco) e negativo (picco catodica) corrente vengono visualizzati e calcola il valore medio.
- Spatola nella soluzione di lavoro per aggiungere 10 mg di ferrocene e disareare esso da argon bubbling per 5 min. Ciò è necessario per la miscelazione e dissoluzione completa del ferrocene aggiunto.
Nota: La quantità di ferrocene non è precisa. Tuttavia, l'aggiunta di meno di 1 mg o più di 20 mg complicherebbe stima del potenziale di equilibrio. - Registro il CVA della soluzione di lavoro all'interno della gamma potenziale da − 1,0 V a + 1,0 V e scansione tasso 100 mV∙s− 1. Un piccolo picco reversibile del ferrocene apparirà come mostrato nella Figura 1.
- Determinare il valore potenziale del ferrocene ossidazione reversibile da CVA ottenuto. Nota i valori potenziali quando maxima di positivo (anodica picco) e negativo (picco catodica) corrente vengono visualizzati e calcola il valore medio.
- Mettere un'altra porzione della soluzione preparata al passo 1.1 nella cella e pulire gli elettrodi ripetendo la procedura descritta in 1.2-1.7.
3. registrazione dello spettro di impedenza
Nota: Un esempio della configurazione nel software è mostrato in Figura 2; qualsiasi altro software o dispositivo inoltre può essere utilizzato. Tuttavia, la disposizione di installazione può differire in diversi software, anche se i principi fondamentali rimangono gli stessi. Utilizzare l'EIS in una modalità di scala, cioè potenziostatica spettri sono registrati automaticamente uno dopo l'altro.
- Nel software, scegliere un'autonomia potenziale di 0.2 V che copre il picco reversibile in CVA. Esempio: Un picco di ossidazione reversibile è stato rilevato sul CV a 0.7 V. La gamma potenziale per CV dovrebbe essere quindi da 0,6 a 0,8 V. Gli spettri sarà registrato con l'incremento di 0,01 V, cioè a 0,61 V, 0,62 V, ecc.
- Registrare la procedura di misurazione automatica di EIS seguenti condizioni consigliato.
- Immettere i seguenti valori di input: iniziale potenziali 0,6 V; finitura potenziali 0.8 V; potenziale incremento: 0.01 V; gamma di frequenza: da 10 kHz fino a 100 Hz; il numero di frequenze in scala logaritmica: 20; attendere per un tempo fra gli spettri: 5 s, ac tensione ampiezza 10 mV, minimi 2 misure per frequenza.
- Fare clic sul pulsante Start.
Nota: In tal caso, 21 spettri, ognuno dei quali contiene 41 punti di frequenza si otterranno. L'insieme tipico degli spettri registrati automaticamente è presentato nella Figura 3.
4. analisi dello spettro di impedenza
- Lanciare il programma analizzatore di spettro EIS.
- Scarica lo spettro scegliendo File | Aperto.
- Nella sub-finestra superiore di destra e costruire un EEC utilizzando sinistro/destro del mouse scegliendo connessione serie o in parallelo e necessario elemento dal menu di scelta rapida: C - condensatore, R - Resistore, W - elemento di Warburg. Iniziare dal circuito più semplice (Figura 5c).
- Scegliere iniziali valori minimi e massimi per i parametri di sinistra-clic del mouse le celle della tabella e i valori di immissione: C1 - da 1∙10-7 a 1∙10-8, R1 - dal 2000 al 100, R2 - da 1000 a 100, Aw - da 50000 a 10000.
- Si adattano al modello scegliendo modello | Misura. Ripetere la procedura diverse volte (di solito circa 5 volte) fino a quando i valori calcolati non più cambiano. I valori dei parametri vengono visualizzati in una tabella nella finestra superiore sinistra.
- Controllare gli errori di parametro indicati nell'ultima colonna della tabella. Se un errore di un parametro supera il 100%, che significa che il parametro non è necessario per un circuito. In tal caso provare un altro circuito equivalente.
Nota: Se si cerca di montare uno spettro sperimentale corrispondente al circuito semplice (Figura 5c) di un circuito più complicato (Figura 5a), quindi errori di inutili ulteriori parametri W e R3 sarebbe notevolmente alta. - Controllare i valori di r2(parametrico) e r2(ampiezza) presentati nella finestra inferiore destra. Se superano il limite 1∙10− 2, ripetere la procedure 4.2−4.5 utilizzando un altro circuito elettrico equivalente (CEE) (Figura 5).
- Ripetere la procedura 4.1-4.7 per tutti gli spettri registrati
- Per ogni spettro analizzato, annotare il valore calcolato di resistenza al trasferimento di carica e il corrispondente potenziale che lo spettro è stato registrato a.
5. calcolo delle costanti di velocità di Redox
- Inserire i valori di resistenza al trasferimento di carica inversa stimato rispetto al potenziale. Un tipico terreno potenziale di resistenza al trasferimento di carica inversa per il processo reversibile è presentato nella Figura 6.
- Aprire un foglio di software foglio di calcolo vuoto.
- Immettere manualmente i valori dei potenziali e i corrispondenti valori di resistenza al trasferimento di carica inversa nelle colonne A e B.
- Selezionare l'intervallo a1: B21 e scegliere Insert | Grafico | Punta da mouse cliccando nel menu attività.
- Rappresentare graficamente i valori di una funzione teorica calcolata con la formula (1) sullo stesso terreno. Utilizzare valori costanti: F = 96485 C∙mol− 1, c0 = 0.01 mol∙− 1, z = 1, R = 8.314 J∙mol− 1∙K− 1, α = 0,5, T - temperatura ambiente. Utilizzare il valore precedentemente stimato (3.1) E0.
 (1)
(1) (2)
(2)
dove Rct− 1 è il valore inverso di resistenza al trasferimento di carica normalizzato di superficie; z- numero di elettroni trasferiti in un unico passaggio (accettato essendo uguale 1); F- costante di Faraday; c 0- concentrazione di composti studiati; Α - coefficiente di trasferimento di carica (accettato essendo uguale 0,5); E- elettrodo potenziale; parametro θ è stata introdotta per semplificare la formula finale relative E e Rct.- Copiare la prima colonna di valori (potenziali) nello stesso foglio nella colonna D.
- Immettere i valori costanti di F, c0, z, R, α, T, E0, k0 arruolato sopra in celle C1: C8. Uso valori E0 = 0, k0 = 1∙10− 5.
- Immettere la formula (2) per il calcolo θ nella cella E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Copiare la formula nelle celle E2:E21 selezionando E1, facendo clic su copia, selezionando intervallo E2:E21 e fare clic su Incolla.
- Immettere la formula (1) nella cella F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Copiare la formula nelle celle F2:F21 selezionando F1, facendo clic su copia, selezionando Intervallo F2:F21 e fare clic su Incolla.
- Click sinistro sul grafico costruito al punto 5.1, scegliere Scegli dati, quindi Aggiungi e aggiungere il nuovo set di dati specificando entrando D1:D21 come x gamma e F1:F21 intervallo y.
Nota: Due grafici: sperimentale e simulata automaticamente contrassegnati da diversi colori appariranno su un terreno delle coordinate.
- Ottimizzare la funzione teorica (1) in ordine ai dati sperimentali abete di diversi valori del potenziale di equilibrio (E0) e la tariffa standard costante (k0), essendo il parametro target.
Nota: Modifica dei valori nelle celle C7 (E0) e C8 (k0) provocherebbe immediatamente il cambiamento del grafico simulato.- Modificare i valori nelle celle C7 e C8 manualmente al fine di realizzare la parità tra il grafico sperimentale e simulato.
Nota: Cambiamento di E0 sposta la curva a campana-come lungo l'asse x . Cambiamento di k0 controlla l'altezza della flangia-come curva. Quindi, variando questi due parametri unici può essere utilizzato per trovare un modello teorico corrispondenti ai risultati sperimentali (Figura 6). Parametro α (1) controlli simmetria di picco teorico. Tuttavia, nei sistemi reali asimmetria può essere causato dall'avvenimento di lato-processo, piuttosto che di α. Poiché essa influenza il valore di0 krisultante si consiglia di non modificare il valore α e lasciarlo uguale a 0,5.
- Modificare i valori nelle celle C7 e C8 manualmente al fine di realizzare la parità tra il grafico sperimentale e simulato.
Representative Results
Il primo passo è la caratterizzazione di voltammetria ciclica presentato nella Figura 1. Applicazione di EIS era successo quando composti hanno subito il processo elettrochimico velocemente reversibile. Tale comportamento spesso non è stato osservato per composti organici ma composti organici che possiedono electroconductivity in uno stato solido è stato trovato per essere un buon esemplare per indagine cinetica elettrochimica. Uno di questi composti organico è mostrato nella rientranza della Figura 1.
Registrazione di spettri di impedenza è stato effettuato secondo la messa a punto sperimentale (Figura 2), e dati risultanti raw tipici sono mostrati nella Figura 3. Analisi degli spettri di impedenza è stato effettuato utilizzando un software speciale24. La finestra del programma accesso aperto EIS spettro Analizzatore24 durante l'elaborazione di risultati è illustrata nella Figura 4. Un CEE utilizzata per adattare lo spettro è costruito manualmente nella finestra superiore di destra. I parametri calcolati di EEC (resistenze R1 e R2, capacità C1 e diffusione impedenza parametro W1) sono riportati in una tabella nella finestra superiore sinistra. Il grafico nella finestra inferiore sinistra illustra raccordo dei risultati sperimentali (punti rossi) con la trama di dati calcolati teoricamente (linea verde).
EEC diversi diversi possono adattarsi spettro sperimentale a seconda dei processi che si svolgono sulla superficie dell'elettrodo e le loro tariffe (Figura 5). Il più semplice elemento di Warburg semi-infinito può essere utilizzato come non c'è nessuna distorsione della soluzione (ad es. rotazione della miscelazione elettrodo) e nessun rivestimento dell'elettrodo limitando la diffusione. In caso di reazioni elettrochimiche notevolmente veloce, resistenza R3 (Figura 5A) era abbastanza alto per essere trascurato rispetto agli altri rami paralleli della CEE (Figura 5B). Inoltre, quando il tasso di trasferimento di carica (R2) è significativamente superiore a diffusione, la fase di trasferimento di carica diventa limitando e un ancora più semplice CEE (Figura 5C) descrive il sistema.
La resistenza serie R1 è sempre presente nella CEE. Corrisponde alla resistenza esterna compresi connettori e soluzione, tranne interfaccia superficie dell'elettrodo. Condensatore C1 caratterizza un doppio strato formato all'interfaccia elettrodo. Il ramo tra cui resistenza e impedenza di Warburg elemento diffusione (Figura 5A) corrisponde ad un processo veloce elettrochimico tra cui due fasi: cinetica e diffusione, rispettivamente. Il terzo resistore corrisponde a un più lento processo elettrochimico che si svolge sulla superficie dell'elettrodo e coinvolge solvente o molecole che hanno subito veloce ossidazione o riduzione. In alcuni casi, i parametri, R3 e W1 erano impossibili da stimare. Quindi potrebbe essere considerati come assente e non presi in considerazione come Vedi figura 5B e 5C .
Anche se EIS fornisce una stima di parametri diversi, l'elemento di destinazione che è considerato in questo lavoro è carica trasferimento resistore R2 solitamente assegnate come Rct in letteratura17,18,19, che si leva in piedi in parallelo al condensatore e in serie a elemento di Warburg. La dipendenza dal voltaggio è illustrato nella Figura 6.
Secondo la teoria della cinetica elettrochimica (protocollo, punto 5.2), resistenza al trasferimento di carica è direttamente correlata alla costante di aliquota elettrochimica. Anche se la corrispondenza tra sperimentali e teorici risultati non era ideale, consentito la stima del valore della costante tasso elettrochimici standard e definito il valore del potenziale di equilibrio di posizione massima.
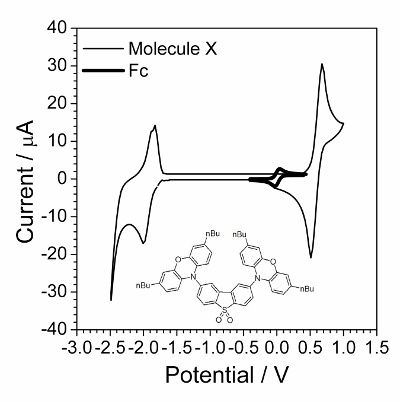
Figura 1 : Voltammogram ciclico di esaminatore composto sovrapposta da ciclico voltammogram in presenza di piccole quantità di ferrocene. Soluzione: 1,0 mol∙L− 1 Bu4NBF4 e 0,01 mol∙L− 1 X in diclorometano. Struttura di composti X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiophene-S, S-diossido) è mostrato nella rientranza. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Messa a punto sperimentale controllo registrazione di 20 spettri all'interno della gamma di tensione da 0,6 a 0,8 V nella gamma di frequenza da 10 kHz a 100 Hz con 20 punti per ogni decennio. Eio, Ef- potenziali iniziali e finali rispettivamente, N - numero di passaggi, ts- tempo di attesa prima di ogni misurazione, frequenza iniziale e finale dt - intervallo di tempo di record, fho, ff- ND- numero di frequenza punti in uno spettro, Vun- ac ampiezza, pw - parte del tempo rispetto a un punto di registrazione utilizzato per passare a un'altra frequenza, Nun- numero di misurazioni ad una frequenza, serie E, gamma, larghezza di banda - parametri tecnici. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Scansione dello schermo durante la registrazione di spettri di impedenza. Superiore destro della sub-finestra: dipendenza scala del potenziale di elettrodo in tempo. Superiore sinistro della finestra secondaria: diagramma di Nyquist, immaginario impedenza (ordinata), impedenza reale (abciss). Inferiore sinistro della finestra secondaria: Bode trama, modulo di impedenza (scala di sinistra), spostamento di fase (scala a destra), frequenza (scala orizzontale). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Finestra del programma «EIS Spectrum analyzer» durante l'elaborazione di risultati. Superiore sinistro della finestra secondaria: tabella dei valori di parametro: C1 - capacità, R1, R2 - resistenze, W1 - elemento di Warburg; inferiore sinistro della finestra secondaria: sperimentale (punti verdi) e spettri di modello teorico (linea rossa); superiore destro della sub-finestra: circuito elettrico equivalente; inferiore destro della sub-finestra: calcolate statistiche di raccordo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Circuiti elettrici equivalenti trovano per adattare gli spettri di impedenza dei processi ossidoriduttivi sulla superficie dell'elettrodo. (A) processo di reversibile processo elettrochimico, (C) - elettrochimica - reversibile processo elettrochimico accompagnato da parallelo processo irreversibile, (B) - con la fase di limitazione cinetica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Valori di inverso di carica trasferire resistenza stimato da EIS contro il potenziale di elettrodo. La linea raffigura teoricamente predetto dipendenza secondo la formula (2).
Discussion
Questa parte del lavoro sarà dedicata a una spiegazione delle condizioni sperimentali scelte e discussione delle possibili applicazioni del metodo presentato.
Analisi dello spettro di impedenza possono essere eseguite da vari software. Qui le raccomandazioni di base per il metodo di analisi CEE sono discussi. Bisogna sapere che esistono numerosi algoritmi di raccordo e stima dell'errore in diversi modi. Presentiamo un esempio di utilizzo di software di accesso aperto sviluppato da r. Bondarenko e G. Ragoisha24 (Figura 4).
Valutazione esatta del valore dict Rera l'obiettivo principale del lavoro. Uno dei motivi per la scelta delle condizioni sperimentali fosse l'intenzione di nascondere l'impatto della diffusione. Così, la concentrazione della soluzione doveva essere alto come possibile. Mentre stava acquistando i risultati sperimentali illustrati qui, la concentrazione era limitata a causa di motivi economici. La gamma di frequenze da 10 kHz a 100 Hz è stato scelto per eliminare l'effetto di diffusione come bene. Impedenza di diffusione è inversamente proporzionale alla frequenza, mentre la resistenza non è dipenda dalla frequenza. L'effetto di resistenza nella parte ad alta frequenza dello spettro era superiore nella parte di bassa frequenza. Gli spettri non sono stati registrati alle frequenze inferiori a 100 Hz, perché questi dati sarebbe inutili per il calcolo di resistenza. Tutti i risultati di elettrochimici ottenuti in solventi non acquosi sono presentati contro ferrocene-ossidato / ferrocene accoppiata potenziale di equilibrio. Per questo motivo, vengono eseguiti i passaggi 2.3-2.5.
Abbiamo considerato applicazione EIS alla caratterizzazione di molecole organiche. Analisi di altri parametri di EEC e loro potenziali dipendenze in prospettiva possono portare alla rivelazione di altri effetti e caratterizzazione elettrochimica di composti in soluzione. Stima delle costanti di velocità di redox è utile per descrivere la cinetica di ossidazione o di riduzione dei composti elettroattivi e predire il comportamento del materiale in ossidante o riducente medio.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Gli autori riconoscono con gratitudine il sostegno finanziario del progetto "Excilight" "Donatore-accettore Light Emitting Tespesio come materiali per facile-a-tailor Lightning OLED ultra-efficiente" (H2020-MSCA-ITN-2015/674990) finanziato da Marie Skłodowska-Curie Azioni nell'ambito del programma quadro per la ricerca e innovazioni "Horizon 2020".
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)