Summary
البيولوجيا التركيبية تمكن هندسة البروتينات مع خصائص لم يسبق لها مثيل باستخدام الإدراج كوترانسلاشونال من الأحماض الأمينية غير متعارف عليه. هنا، وقد عرضنا كيف يتم إنتاج البديل طيفيا الأحمر تحول من فلوروفوري من نوع التجارة والنقل مع الخصائص الطيفية الفلورية الرواية، يطلق عليه "الذهب" الفلورسنت البروتين (جدفب)، في كولاي عن طريق إدماج الضغط الانتقائي (SPI).
Abstract
البروتينات الفلورية هي الأدوات الأساسية لعلوم الحياة، وبخاصة للأسفار الفحص المجهري للخلايا الحية. بينما المتغيرات البرية من نوع وهندسة البروتينات الفلورية الخضراء من فيكتوريا أيقووريا (أفجفب)، فضلا عن هومولوجس من الأنواع الأخرى تغطي بالفعل أجزاء كبيرة من الطيف البصري، طيفية لا تزال هناك فجوة في المنطقة القريبة من الأشعة تحت الحمراء، عن لا تتوفر فيها فلوروفوريس على أساس أفجفب. المتغيرات تحول الأحمر نيون البروتين (FP) سوف توسع إلى حد كبير مجموعة الأدوات اتقانا طيفية متعددة الأنواع الجزيئية، ولكن FPs تحول الأحمر طبيعيا المستمدة من الشعاب المرجانية أو شقائق النعمان البحرية قد انخفاض الغلة الكم الأسفار و أدنى صور-الاستقرار مقارنة بالمتغيرات أفجفب. مواصلة التلاعب وإمكانية توسيع نظام مترافق chromophore اتجاه المنطقة الطيفية استعملنا أيضا محدود بمرجع 20 الأحماض الأمينية الكنسي المنصوص عليها في الشفرة الجينية. للتغلب على هذه القيود، يمكن تحقيق البيولوجيا التركيبية كذلك الطيفية الأحمر-التحول عن طريق إدخال الأحماض الأمينية غير متعارف عليه في ثالوث chromophore. يصف لنا تطبيق SPI للمتغيرات أفجفب مهندس مع رواية الخواص الطيفية. يتم التعبير البروتين في التربتوفان أوكسوتروفيك كولاي سلالة وتكملة وسائط النمو مع السلائف اندول مناسبة. داخل الخلايا، يتم تحويلها إلى النظير التربتوفان المقابلة هذه السلائف ودمج البروتينات بالآلات ريبوسومال ردا على UGG codons. استبدال الحزب-66 في الخيار "السماوي" المعززة أفجفب (اكفب) التبرع بالكترون 4 أمينوتريبتوفان بالنتائج في جدفب يضم تحولاً ستوكس نانومتر 108 وانبعاثات بشدة تحول الأحمر الحد أقصى (574 nm)، بينما يجري [ثرمودنميكلي] أكثر استقرارا من سابقتها اكفب. ويتم تحليل التأسيس الخاصة بالمخلفات من الأحماض الأمينية غير متعارف عليه من الطيف الكتلي. الخصائص الطيفية جدفب تتسم بالتحليل الطيفي fluorescence حل الوقت كأحد التطبيقات القيمة المرمزة وراثيا إطارا في الثانية في علوم الحياة.
Introduction
ومنذ اكتشاف البروتين الفلورية الخضراء في قنديل البحر فيكتوريا أيكووريا (أفجفب) في عام 19621 والتعبير مغايرة الأول في عام 19942 في الخلايا حقيقية النواة الأخرى، أصبحت البروتينات الفلورية الأسرة التجارة والنقل أدوات قيمة للغاية والأهداف في علوم الحياة. الهندسة الوراثية والجزيئية واسعة النطاق شملت تعديل الاستخدام كودون إبلاغها، وتسارع قابلة للطي، نضوج المحسنة، وزيادة السطوع، والوقاية أوليجوميريزيشن والخياطة للخواص الطيفية والكيميائية الضوئية بما في ذلك القدرة على شكل قابل للعكس فوتوسويتش3،4،،من56. بروتينات فلورية خضراء مدين الأسفار من به 4-(فهيدروكسيبينزيليديني) chromophore إيميدازوليدين-5-واحد (HBDI). هذا الأخير أوتوكاتاليتيكالي يتكون من ثالوث chromophore ما يسمى الأحماض الأمينية (Ser-65/صور-66/الغليسين-67، في أفجفب) بعد تشكيل السندات تساهمية إضافية داخل العمود الفقري الببتيد تحت تأثير الأكسجين الجزيئي7. ويتفاعل نظام مترافق تنقل استقرت بشكل حيوي مع بيئتها الجزيئية، مما يسمح بالاستيعاب في النطاق المرئي والفلورية الخضراء المميزة لهذه البروتينات.
ضمن ثالوث chromophore، وجود الأحماض الأمينية العطرية إلزامية. ومع ذلك، تضم مرجع قياسي من الأحماض الأمينية سوى أربعة بقايا العطرية (له الفنيل ألانين والراديكالي وصور). ويحد هذا النهج الطفرات التقليدية لتحقيق متغيرات أفجفب تحول الأحمر أكبر بكثير بالنسبة FPs الطبيعية الأكثر تحول الأحمر مثل دسريد8 من كوراليمورفس سترياتا ديسكوسوما أو مكتي/منيبتوني9 من شقار البحر كوادريكولور انتاكمايا. ولذلك، الجزء استعملنا والقريبة من الأشعة تحت الحمراء من الطيف البصري أعلاه 600 نانومتر قليلة مغطى بمتغيرات التجارة والنقل. وهذا، بطبيعة الحال، وجود قيود شديدة للنهج مجهرية الأسفار التي تتطلب demultiplexing الطيفية للعديد من أنواع فلوروفوري في نفس الوقت. على سبيل المثال، علامات الطول الموجي الطويل ضرورية أيضا لجعل استخدام نظام امتصاص منخفضة لانسجة الجلد بين 700-1,000 شمال البحر الأبيض المتوسط في الإعدادات للأنسجة العميقة التصوير10.
الفلورسنت البروتينات المشتقة من أفجفب تنقسم إلى عدة فئات على أساس الخصائص الطيفية وطبيعة المواد الكيميائية على صباغات11. مع ثالوث Ser-65/صور-66/الغليسين-67، chromophore البرية من نوع موجود مزيج متوازن بين شكل محايد، الفينولية (λmax = 395 شمال البحر الأبيض المتوسط، واليورو = 21,000 M-1سم-1) ونموذج فينولاتي أنيونى (λmax = 475 شمال البحر الأبيض المتوسط، واليورو = 7,100 م -1سم-1)، وانبعاث الطيف المعارض ذروة واحدة في 508 nm. مجموعة الهيدروكسيل Ser-65 يكتسي أهمية حاسمة، كما أنها تتبرع في ح-سندات لغلو-222 في المنطقة المجاورة chromophore (المسافة: 3.7 Å)، الذي يعزز التأين لهذه كاربوكسيلات. فئة أنا تتميز chromophore أنيونى فينولاتي، كما هو الحال في اجفب (Phe-64-لوي/Ser-65-Thr؛ λmax = 488 نانومتر، واليورو = 35,600 M-1سم-1، λم = 509 نانومتر). سبب استبدال Ser-65-Thr(Ala,Gly)، تم منعها في ذروة الإثارة نانومتر 395 النموذج الفينول محايدة وذروة فينولاتي أنيونى نانومتر 470-475 الخمس إلى الست إضعاف المحسن وتحول إلى 490 نانومتر. وتضم الفئة الثانية البروتينات مع chromophore الفينولية محايدة، كما هو الحال في ياقوت-التجارة والنقل. هنا، يمنع استبدال Thr-203-إيل تماما تقريبا الإثارة نانومتر 475، تاركاً فقط الذروة في 399 نانومتر. Chromophore أنيونى لا يمكن أن يكون بشكل صحيح ومذاوبة، وهو يفضل شكله محايد. وتضم الفئة الثالثة المتغيرات فلوري "الأصفر" (ايفب؛ Ser-65-Gly/Val-68-Leu/Ser-72-Ala/Thr-203-Tyr؛ اليوروماكس λ = 514 شمال البحر الأبيض المتوسط، واليورو = 84، 600 متر-1سم-1، λم = 527 nm) مع تفاعل التراص π سلسلة جانبية عطرية وفينولاتي، كما أحدثت باستبدال Thr-203-His(Trp,Phe,Tyr)، مما يؤدي إلى مدة تصل إلى 20 nm تحول الأحمر الانبعاثات ماكسيما (Thr-203-صور). نتائج بدائل أخرى (جلن-69-Lys) في آخر 1-2 نانومتر الأحمر تحول إلى 529 شمال البحر الأبيض المتوسط، والبديل أفجفب أهم تحول الأحمر المعروف11. تبادل الفينول اندول (صور--66--الحزب) ينشئ الفئة الرابعة، كما هو الحال في اكفب سماوي-فلوري (Ser-65-Thr/صور-66-الراديكالي؛ λmax1 = 434 نانومتر، واليورو = 24,800 م-1سم-1; λmax2 = 452 شمال البحر الأبيض المتوسط، واليورو = 23,600 M-1سم-1 ; Λem1 = 477 nm, λem2 = 504 نيوتن متر). ربما يتم تمكين إيواء اندول ضخمة بالأخرى، الطفرات تعويضية. ماكسيما الإثارة والانبعاثات اكفب تقع في المنتصف تلك البروتينات مع صباغات محايدة أو أنيونى. الفئة V البروتينات المرفأ ايميدازول بدلاً من الفينول (صور--66-صاحب)، على سبيل المثال.، مثل البروتينات الفلورية الزرقاء ابفب. الفئة السادسة ينتجها تبادل الفينول إلى فينيل تحابي النموذج chromophore محايدة حصرا، وبالتالي يؤدي إلى مواقف الذروة أهم تحول الأزرق الإثارة والانبعاثات (360 نانومتر و 442 شمال البحر الأبيض المتوسط، على التوالي).
الكلاسيكية الطفرات الموجهة من الموقع مناسبة خاصة لإنتاج أفجفب رواية chromophore المتغيرات، حسب التقليب تريبيبتيدي 65-67 وبقايا المتفاعلة في الإطار من 20 الأحماض الأمينية المتعارف عليه. ويمكن توسيع هذه الإمكانيات كذلك عندما يتم إدخال المتغيرات غير المقبول من الأحماض الأمينية العطرية أثناء توليف البروتين ريبوسومال12. من حيث المبدأ، هناك طريقتان لتحقيق ذلك. أول استراتيجية تعتمد على التسامح الركازة إليه ترجمة البروتين، وبخاصة سينثيتاسيس أمينواسيل-الحمض الريبي النووي النقال (آرس) نحو النظير الأحماض الأمينية ذات الصلة. لتحقيق هذا الهدف بكفاءة عالية، أوكسوتروفيك كولاي التعبير سلالات العاملين التي غير قادر على تجميع الأحماض الأمينية الطبيعية المقابلة. يسمح هذا استبدال هذا الأخير بإضافة الأحماض الأمينية غير قانوني مناسب (ncAAs) أو السلائف منه إلى متوسط الثقافة. تمكن هذه الاستراتيجية، المعروف أيضا إدماج الضغط الانتقائي (SPI)13،14، الاستبدال الخاصة بالمخلفات، مما يسفر عن الإدماج الشامل للرابطة الوطنية لرياضة. الاستراتيجية الثانية يستخدم كودون وقف ترناس القامع الذي يتوجب مع الرابطة الوطنية لرياضة بهندسة الإنزيمات aaRS. هذا يؤدي إلى ريدثرو codons أوقفوا في إطار ويسمح الموقع نكا التأسيس. ونتيجة لذلك، وهذا الأسلوب من قمع كودون التوقف (المنبوذة) يؤدي إلى التوسع في الشفرة الجينية15. عن طريق الطفرات، يوضع كودون توقف في الجينات المستهدفة في الموقع المطلوب. من حيث المبدأ، يمكن أيضا استخدام SPI لإنشاء المؤتلف الببتيدات والبروتينات التي تحمل على تثبيت الرابطة الوطنية لرياضة فريدة من نوعها، نظراً إلى أن يتم اختيار الأحماض الأمينية الكنسي نادرة مثل Met أو الراديكالي لاستبدال. مع الحزب، أظهرت النهج SPI للعمل مع مجموعة كبيرة ومتنوعة من النظير بما في ذلك 4--و--و 5-الراديكالي و و 6 و، 7-عزة-الحزب، الحزب 4-OH و 5 أوه، فضلا عن 4-و 5-NH2-الحزب أو حتى بيتا (ثينوبيروليل) ألانين المشتقات16 ،،من1718،،من1920. وهكذا، يمكن أن يكون SPI مفيد جداً لاستبدال الأحماض الأمينية العطرية من صباغات بروتينات فلورية خضراء بالمتغيرات غير المقبول لاستكشاف إمكانية مواصلة تكييف الأطياف وتحول ستوكس هذه إطارا في الثانية. أما بالنسبة لجميع التعديلات تسلسل البروتين، يجب اختبار التوافق مع نضوج قابلة للطي و chromophore FP تجريبيا.
في هذا العمل، فنحن نستخدم فئة اكفب الرابع21، الذي يحمل بدلاً من أفجفب البرية من نوع طير، بقايا الحزب داخل الثالوث chromophore به. استخدام SPI، هذا الحزب-66 (والحزب-57، فقط الأخرى الراديكالي بقايا في اكفب) يتم استبدال بواسطة 4-أمينو-الحزب الراديكالي عبر الوطني تفضل وجود المجموعة الأمينية التبرع إلكترون 4-أمينو-الحزب داخل chromophore استقرار الرنين نقل بروتون الدولة متحمس الآن تحول الأحمر (إيست) وهبوا تحولاً ستوكس 108 في شمال البحر الأبيض المتوسط. هذا البروتين فلوري "الذهب" (جدفب) ويشكل البديل مع التحول الأحمر أكبر من الأسفار كحد أقصى (574 nm) بين جميع البروتينات المشتقة من أفجفب. ونحن تصف طريقة إنتاج البروتين جدفب من SPI وتوفر البروتوكولات للتحليل الإلزامي للبروتينات المعدلة الناتجة بالتحليل الطيفي الشامل. علاوة على ذلك، نعرض كيف يمكن الاستفادة من جدفب وتحليلها في نهج التحليل الطيفي حل وقت الأسفار.
Protocol
1-التحول من الحزب أوكسوتروفيك كولاي
- تحويل كيميائيا أو خلايا اليكتروكومبيتينت (50 ميليلتر) من سلالة الحزب أوكسوتروفيك كولاي ، على سبيل المثال. المداري 49980 (WP2، متحولة المستمدة من سلالة كولاي B/R22)، مع 1 ميليلتر من محلول مائي 1 نانوغرام/ميليلتر من بلازميد اكفب His6 بك-80 لتر باستخدام الصدمة الحرارية أو انهانسر، على التوالي. يرجى الرجوع إلى23،"جوف علوم التعليم قاعدة"24 للحصول على التفاصيل.
ملاحظة: بناقلات التعبير بك-80L His6-اكفب ترميز N-الميؤوس من شفائهم 6 x اكفب صاحب معلم21 يقودها مروج T5 بكتيرية مع عامل التشغيل في أمريكا اللاتينية والكاريبي. وهو كذلك يحمل علامة تحديد أمبيرR ومصدر colE1 للنسخ المتماثل (تسلسل بك-80 لتر ناقلات العمود الفقري ويمكن الاطلاع على: https://www.qiagen.com/mx/resources/resourcedetail?id=c3b71572-4d82-4671-a79b-96357fe926d1&lang=en & أوتوسوجيست = true). نظرية الوزن الجزيئي للبروتين البرية من نوع His6-اكفج (بعد نضوج chromophore25) هو دا 28303.92. تسلسل البروتين المستهدف المترجمة كما يلي (صاحب العلامة وأكد، المستمدة من ناقل تسلسل بخط غامق): مرجسهههههعمفسكجيلفتجففبيلفيلدجدفنغكفسفسجيجيجداتيجكلتلكفيكتجكلبفبوبتلفتلتوجفقكفسريبدهمك
قهدفكسامبيجيفقيرتيفكدجنيكترايفكفيجدتلفنريلكجيدفكيدجنيلغكليينييشنفييتادكقكنجيكانفكيرهنييدجس
فقلادهيققنتبيجدجبفلبدنهيلستقسالسكدبنيكردهمفليففتاجيتلجمديليك. - لوحة الخلايا المحورة على ألواح أجار رطل (الجدول 1) وتستكمل مع الجلوكوز 10 غرام/لتر، 100 ميكروغرام/مل الأمبيسلّين واحتضان لوحات عند 37 درجة مئوية بين عشية وضحاها.
2. تعبير البروتين المؤتلف
-
الثقافة بين عشية وضحاها من كولاي ATCC 49980 بك-80 L His6-اكفب
- إعداد 5 مل متوسطة رطل (الجدول 1؛ تستكمل مع الجلوكوز 10 غرام/لتر، 100 ميكروغرام/مل الأمبيسلّين) في مل 14 عقيمة الثقافة البوليستيرين أنبوب للنمو الهوائي وتلقيح مع مستعمرة منفردة من صفيحة أجار استخدام حلقة تلميح أو التطعيم ماصة معقمة.
ملاحظة: استخدام المستعمرات من الخلايا المحولة حديثا ينصح. ويمكن تخزين اللوحات مع المستعمرات البكتيرية (من الخطوة 1.2.) عند 4 درجة مئوية لعدة أيام. - احتضان الخلايا عند 37 درجة مئوية في شاكر مداري 200-250 لفة في الدقيقة بين عشية وضحاها.
- إعداد 5 مل متوسطة رطل (الجدول 1؛ تستكمل مع الجلوكوز 10 غرام/لتر، 100 ميكروغرام/مل الأمبيسلّين) في مل 14 عقيمة الثقافة البوليستيرين أنبوب للنمو الهوائي وتلقيح مع مستعمرة منفردة من صفيحة أجار استخدام حلقة تلميح أو التطعيم ماصة معقمة.
-
التعبير عن اكفب البرية من نوع
- تطعيم 10 مل الطازجة المتوسطة رطل (الجدول 1؛ وتستكمل مع الجلوكوز 10 غرام/لتر، 100 ميكروغرام/مل الأمبيسلّين) مع 100 ميليلتر للثقافة بين عشية وضحاها في 100 مل قارورة Erlenmeyer. احتضان قارورة على 37 درجة مئوية في شاكر مداري 200 لفة في الدقيقة.
ملاحظة: بشكل اختياري، هذه الخطوة يمكن أن يتم في 10 مل NMM19 المتوسطة (الجدول 1) وتستكمل مع 100 ميكروغرام/لتر الأمبيسلّين و 0.5 مم ل تريبتوفان (بدلاً من ذلك، اندول يمكن استخدامها). - قياس الكثافة البصرية 600 نانومتر (OD600) كل 20 دقيقة تفضيلي قياس الخلية الكثافة بواسطة تحديد انقراض 600 نانومتر (OD600) في جهاز المطياف الضوئي استخدام ومبومو بطول مسار من 1 سم. دائماً أداء مرجع القياس باستخدام المتوسط الثقافة المقابلة. تضعف من عينات والمزيج جيدا للحصول على قيمة قياس من 0.1-0.8 العينات، ثم حساب OD600 باستخدام عامل إضعاف. لمزيد من التفاصيل، يرجى الرجوع إلى المنشور السابق 26.
- عند الوصول إلى قيمة600 OD 0.5-0.8 (حوالي 2-3 ح بعد التلقيح)، أخذ عينة "قبل التعريفي" للحزب الديمقراطي الصربي صفحة (الصوديوم دوديسيل كبريتات polyacrylamide هلام التفريد، الخطوة 4).
- حمل التعبير البروتين الهدف عن طريق ضبط ثقافة السائل إلى 0.5 مم إيبتج (الأيزوبروبيل β-د-1-ثيوجالاكتوبيرانوسيدي، من حل الأسهم 1 متر) واحتضان أنه عند 30 درجة مئوية في شاكر مداري 200 لفة في الدقيقة ح 4-8.
ملاحظة: هي عادة أعرب البروتينات الفلورية السماوي في درجة حرارة أقل من 37 درجة مئوية27. - أن نموذج "بعد تعبير" للحزب الديمقراطي الصربي صفحة (الخطوة 4.).
- حصاد الخلايا البكتيرية بالطرد المركزي لمدة 10 دقائق مبلغ 000 5 × ز و 4 درجة مئوية.
- تجاهل المادة طافية بالصب وتجميد الكريات الخلية في-20 درجة مئوية أو-80 درجة مئوية حتى تنقية البروتين الهدف.
- تطعيم 10 مل الطازجة المتوسطة رطل (الجدول 1؛ وتستكمل مع الجلوكوز 10 غرام/لتر، 100 ميكروغرام/مل الأمبيسلّين) مع 100 ميليلتر للثقافة بين عشية وضحاها في 100 مل قارورة Erlenmeyer. احتضان قارورة على 37 درجة مئوية في شاكر مداري 200 لفة في الدقيقة.
-
SPI لإنتاج جدفب
- تطعيم 10 مل من NMM19 المتوسطة (الجدول 1) تستكمل مع 100 ميكروغرام/مل الأمبيسلّين، 15 ميكرون التربتوفان و 10 ميليلتر للثقافة بين عشية وضحاها في 100 مل قارورة Erlenmeyer واحتضان قارورة الثقافة بين عشية وضحاها في 30 درجة مئوية في شاكر مداري 200 لفة في الدقيقة.
ملاحظة: تتوفر مجموعة متنوعة من وسائط محددة كيميائيا لزراعة كولاي و SPI. وبالإضافة إلى نم المستخدمة هنا، أملاح والمماسح متوسطة28، الجلوكوز المعدنية المتوسطة29، ديفيس متوسط الحد الأدنى30، M9 الحد الأدنى المتوسط31، أو يمكن استخدام جمل32 . - وفي اليوم التالي قياس OD600 كل 30 دقيقة حتى يتغير القيمة إلا بأقل من 0.05 أكثر من 30 دقيقة. يجب أن تكون قيمة الهضبة حوالي 1.
ملاحظة: الانحرافات بوحدات ± 0.3 مقبولة. اعتماداً على السلالة البكتيرية والوسيلة المستخدمة، تركيز التربتوفان الأولى (الخطوة. 2.3.1) قد تحتاج إلى تعديل. - أن نموذج "قبل التعريفي" للحزب الديمقراطي الصربي صفحة (الخطوة 4.).
- حصاد الخلايا البكتيرية بالطرد المركزي لمدة 10 دقائق مبلغ 000 5 × ز و 4 درجة مئوية. تجاهل المادة طافية بالصب.
- ريسوسبيند الخلايا في 10 مل متوسطة NMM19 مع 100 ميكروغرام/مل الأمبيسلّين إلى 100 مل قارورة Erlenmeyer وإضافة 4-الأمينية اندول إلى تركيز نهائي من 1 مم باستخدام حل الأسهم 50 مم. يستمر في الحضانة لمدة 30 دقيقة في 30 درجة مئوية في شاكر مداري 200 لفة في الدقيقة.
ملاحظة: هذه الخطوة يوصي بسبب ثبات الأمبيسلّين الكيميائية منخفضة ويضمن امتصاص الخلوية من 4-الأمينية اندول. - حمل التعبير البروتين الهدف بإضافة إيبتج إلى تركيز نهائي من 0.5 مم باستخدام الأسهم 1 م واحتضان العينة بين عشية وضحاها في 30 درجة مئوية في شاكر مداري 200 لفة في الدقيقة.
ملاحظة: هي عادة أعرب البروتينات الفلورية السماوي في درجة حرارة أقل من 37 درجة مئوية27. - وفي اليوم التالي قياس OD600.
- أن نموذج "بعد تعبير" للحزب الديمقراطي الصربي صفحة (الخطوة 4.).
- حصاد الخلايا البكتيرية بالطرد المركزي لمدة 10 دقائق مبلغ 000 5 × ز و 4 درجات مئوية وتجاهل المادة طافية بالصب.
- في حال لم تستخدم تلك سفينة للطرد المركزي، نقل بيليه الخلية في أنبوب 50 مل البوليستيرين مخروطية باستخدام ملعقة. تجميد بيليه الخلية في-20 درجة مئوية أو-80 درجة مئوية حتى تنقية البروتين الهدف.
- تطعيم 10 مل من NMM19 المتوسطة (الجدول 1) تستكمل مع 100 ميكروغرام/مل الأمبيسلّين، 15 ميكرون التربتوفان و 10 ميليلتر للثقافة بين عشية وضحاها في 100 مل قارورة Erlenmeyer واحتضان قارورة الثقافة بين عشية وضحاها في 30 درجة مئوية في شاكر مداري 200 لفة في الدقيقة.
3-هدف تنقية البروتين عن طريق أيون معدني المعطل تداولها التقارب اللوني (ايماك)
-
تحلل الخلية البكتيرية
- ذوبان الجليد بيليه الخلية على الجليد لمدة 10-20 دقيقة.
- ريسوسبيند بيليه الخلية في أنبوب 50 مل البوليستيرين مخروطية باستخدام 5 مل من المخزن المؤقت ملزم المثلج (الجدول 1) على الجليد.
- إضافة 20 ميليلتر من ليسوزيمي 50 ملغ/مل، 20 ميليلتر من 1 ملغ/مل الدناز الأول، و 20 ميليلتر من 1 ملغ/مل رناسي أ إغلاق الأنبوب والمزيج بلطف بعكس 5 مرات، وإبقائه على الجليد لمدة 30 دقيقة.
ملاحظة: يحدث اضطراب الخلايا الجزئية كما تحفزها lysozyme. - الخلايا باستخدام تلميح الخالطون الموجات فوق الصوتية استخدام ثلاث دورات من 3 دقيقة في أنبوب البوليستيرين 15 مل تبرد بالثلج طين مع 2 صوتنه s للنبض، 4 s سعة pause و 45 في المائة.
ملاحظة: بدلاً من ذلك، تجانس الضغط العالي يمكن استخدامها، على سبيل المثال. والدورات 20 في 14,000 هذه المبادرة. إذا لزم الأمر، يضعف استخدام المخزن المؤقت ملزم للوصول إلى وحدة التخزين صك الحد الأدنى. وعلاوة على ذلك، يمكن استخدام الكواشف استخراج البروتين لتعطيل الخلية. انظر المواد الجدول للحصول على أمثلة. - أجهزة الطرد المركزي العينة لمدة 30 دقيقة في 15,000-18,000 س ز، 4 درجة مئوية.
- نقل المادة طافية في أنابيب جديدة وملاحظة انخفاض حجم السائل.
- تصفية الحل من خلال عامل تصفية 0.45 ميكرومتر حقنه باستخدام حقنه قفل اللوير بلاستيك 5 مل وعامل تصفية حقنه فلوريد (PVDF) الفينيليدن.
- تأخذ عينة "" للحزب الديمقراطي الصربي صفحة (الخطوة 4.).
- ريسوسبيند خلية الحطام بيليه في ddH2س (حجم متساوية كالسابق ليساتي).
- تأخذ عينة "بيليه" للحزب الديمقراطي الصربي صفحة (الخطوة 4.).
-
تنقية ايماك
- استخدم 1 مل شحنت أو ذاتية معبأة العمود ايماك فبلك (بروتين سريع اللوني السائل) وفقا لإرشادات الشركة المصنعة. استخدام المخزن المؤقت ملزم (الجدول 1) للعمود الموازنة، وكذلك فيما يتعلق بخطوة الغسيل الذي يتبع بعد أن تم تطبيقه على العمود الخلية ليستي.
- جمع وتجميع الكسور النذرة مع جدفب التي يمكن تحديدها باللون الذهبي الضوء المرئي.
ملاحظة: بشكل اختياري، البروتين الهدف يمكن أن يكون التيد استخدام تدرج خطي ايميدازول (0-250 ملم) باستخدام نظام فبلك. - تحديد تركيز البروتين باستخدام قيمة الأدب لمعامل الانقراض في 466 شمال البحر الأبيض المتوسط (ɛ466 نانومتر = 23,700 M-1 سم-1)33 مع شطف المخزن المؤقت كمرجع. للحصول على مزيد من التفاصيل حول الإجراءات، يرجى الرجوع إلى المنشور السابق26.
- تأخذ عينة "النذرة" للحزب الديمقراطي الصربي صفحة، واستخدام 1-10 ميكروغرام من البروتين للين في حالة أخذ تلطيخ.
ملاحظة: يمكن أن تختلف المبالغ عينة الحزب الديمقراطي الصربي اعتماداً على أسلوب المصبوغة وصبغ حساسية. - دياليزي قاسمة الكسور النذرة ضد المخزن المؤقت للغسيل الكلوي أو مرض التصلب العصبي المتعدد المخزن المؤقت باستخدام غشاء مع وزن الجزيئي استقطاع (موكو) 5,000-10، 000. تحضير غشاء الديال وفقا لإرشادات الشركة المصنعة. دياليزي عينة 1 مل ثلاث مرات ضد المخزن المؤقت 100 مل ح 2 على الأقل. للحصول على مزيد من التفاصيل حول هذا الإجراء، الرجاء الرجوع إلى المنشور السابق34.
- للتخزين، وتجميد عينة البروتين في المخزن المؤقت للغسيل الكلوي في-80 درجة مئوية.
ملاحظة: ينبغي مختبرين مستقرة لمدة 6 أشهر على الأقل.
4-الحزب الديمقراطي الصربي صفحة إعداد نموذج استخراج خلية كله كولاي
- نقل تعليق خلية ما يعادل 1 مل OD600 = 1 تعليق (على سبيل المثال-500 ميليلتر OD600= 2) في أنبوب ميكروسينتريفوجي 1.5 مل.
- حصاد الخلايا بالطرد المركزي لمدة 10 دقيقة على 5000 س ز، درجة حرارة الغرفة. تجاهل المادة طافية بواسطة بيبيتينج.
- إضافة 80 ميليلتر من ddH2س و 20 ميليلتر من الحزب الديمقراطي الصربي 5 x تحميل صبغ المخزن المؤقت (الجدول 1) إلى الخلية بيليه ومزيج من بيبيتينج.
- تؤذي الخلايا بالتدفئة إلى 95 درجة مئوية لمدة 5 دقائق في كتلة مياه حمام أو الحرارة. وفي وقت لاحق، تبريد العينات في درجة حرارة الغرفة.
- استخدام 10 ميليلتر للحزب الديمقراطي الصربي-صفحة ملطخة بأخذ طبقاً للمنشور السابق35.
ملاحظة: يمكن أن تختلف المبالغ عينة الحزب الديمقراطي الصربي اعتماداً على أسلوب المصبوغة وصبغ حساسية.
5. التحليل الشامل البروتين سليمة من كروماتوغرافيا سائلة عالية الأداء ([هبلك]) بالإضافة إلى اليكتروسبراي التأين وقت الطيران الطيف الكتلي (LC-ESI-TOF-MS)
ملاحظة: [هبلك] التدرج والإعدادات والمخازن المؤقتة قد تختلف استناداً إلى عمود الفصل والأداة المستخدمة. انظر المواد الجدول للمعدات المثالية.
- تحديد تركيز البروتين من عينة دياليزيد ضد مرض التصلب العصبي المتعدد المخزن المؤقت كما هو موضح أعلاه (الخطوة 3.2.3.) باستخدام المخزن المؤقت لمرض التصلب العصبي المتعدد (انظر الجدول المواد) كمرجع.
- تمييع عينة البروتين إلى 0.1 مغ/مل باستخدام MS المخزن المؤقت لوحدة تخزين نهائي من 80 ميليلتر ومزيج من دقيق بيبيتينج ونقل الحل في قنينة أوتوسامبلير مرض التصلب العصبي المتعدد مع إدراج الزجاج وإغلاقه بحد أقصى. إزالة فقاعات الهواء التي يسددها القنينة.
- ملء قنينة أوتوسامبلير ثانية دون إدراج الزجاج (المخزن المؤقت فارغاً) مع 1 مل من المخزن المؤقت لمرض التصلب العصبي المتعدد.
- تسمح أداة الاحماء. إجراء المعايرة الصك. تأكد من أن تتوفر كميات كافية من المذيبات الصف اللوني السائل (> 100 مل).
- برنامج تدرج خطي 20 دقيقة [هبلك] من 5% إلى 80% من المخزن المؤقت (0.1% حمض الفورميك في ddH2س)، جنبا إلى جنب مع المخزن المؤقت ب (0.1% حمض الفورميك في الاسيتو الانيتريل).
- [هبلك] في بداية تدفق 0.3 مل/دقيقة، وانتظر حتى يتم ضغط عمود مستقرة.
- تعيين حجم حقن أوتوسامبلير 5 ميليلتر لأسلوب مرض التصلب العصبي المتعدد LC-إيسي TOF، إنشاء ووركليست لتليها فارغة تشغيل تشغيل عينة وتعيين أوتوسامبلير المقابلة مواقف قنينة. تشغيل في ووركليست.
- وبعد إتمام ووركليست، فتح ملف بيانات النموذج التي تم إنشاؤها. حدد مجموعة في المؤامرة (عرة) أيون المجموع الحالي ل deconvolution وديكونفولوتي طيف مرض التصلب العصبي المتعدد باستخدام خوارزمية deconvolution الانتروبيا كحد أقصى.
ملاحظة: اعتماداً على الظروف التجريبية، الأنواع الإضافية يمكن أن يحدث من عدم نضج تنظيم الأسرة أو adducts أيون المخزن المؤقت.
6-الأسفار عمر القياسات والمرتبطة تسوس الأطياف (DAS) من جدفب
ملاحظة: لأجهزة التحليل الطيفي حل وقت الأسفار، يرجى الرجوع إلى الجدول للمواد للمعدات المثالية. امتصاص فضلا عن الإثارة fluorescence أطياف الانبعاث من البروتينات الفلورية يمكن أيضا تسجيل واستخدام مختبر الأشعة فوق البنفسجية/Vis والأسفار الطيفية.
-
قياس عمر fluorescence الطول الموجي--حل جدفب
- إعداد 2 مل حل جدفب 1 ميكرومتر بالتخفيف في برنامج تلفزيوني المخزن المؤقت (الجدول 1) عند درجة الحموضة 7. تعبئة الحل في ومبومو كوارتز 1 سم.
- تثبيت نابض ps 470 نانومتر الليزر للإثارة عينة و 488 نانومتر الانبعاثات طويلة-تمرير عامل التصفية، وضبط 600 لتر/مم القبر من فوتون واحد يرتبط الوقت والطول الموجي عد كاشف36 (توكسبك) لاقتناء نظام الطول الموجي 500-700 نانومتر.
- الحصول على انبعاث الأسفار حوالي 200 × 103 الفوتونات/s بمعدل عد حتى حوالي 103 التهم التي تراكمت في الحصول على الحد الأقصى من منحنيات تسوس الأسفار مع فوتون واحد العد البرمجيات.
-
قياس استجابة فعالة الدالة37 (المتكامل)
- استبدال ومبومو عينة مع ومبومو كوارتز 1 سم مليئة السيليكا الغروية 1 غرام/لتر (m ~ 2202/g) في المخزن المؤقت لبرنامج تلفزيوني في درجة الحموضة 7.
ملاحظة: تعليق والسليكا أعد استخدام تعليق مائي 400 غرام/لتر. - إزالة 488 نانومتر الانبعاثات طويلة-تمرير عامل التصفية ومرشحات إدراج رمادية لضبط معدل العد في كشف توكسبك إلى أقل من 100 × 103 تهم/s.
- ضبط [غرتينغ] للحصول على 470 الفوتونات شمال البحر الأبيض المتوسط في قناة 8 كاشف توكسبك 16-قناة.
- الحصول على إطار الموارد المتكاملة حتى التهم حوالي 10 × 103 التي تراكمت في الانبعاثات الحد الأقصى.
- ومن المناسب تحويل fluorescence تسوس المنحنيات والمتكامل لملفات البيانات ASCII مع العالمي البرنامج38 .
- تناسب السلوك العالمي وفقا لنموذج مبلغ من ثلاثة مكونات الأسى بإعمار كمعلمات مرتبط.
- تسوس الأرض المرتبطة الأطياف (DAS) كتوزيعات السعة من المكونات الفردية تسوس في التبعية للطول الموجي ببرامج تحليل البيانات.
- استبدال ومبومو عينة مع ومبومو كوارتز 1 سم مليئة السيليكا الغروية 1 غرام/لتر (m ~ 2202/g) في المخزن المؤقت لبرنامج تلفزيوني في درجة الحموضة 7.
Representative Results
باستخدام تقنية الضغط الانتقائي التأسيس، الراديكالي-66 في ثالوث chromophore اكفب (والحزب-57، فقط الأخرى الراديكالي بقايا في اكفب) يمكن الاستعاضة عن 4-الأمينية الراديكالي، وبالتالي توليد جدفب تحول الأحمر مع الخواص الطيفية متميزة. يجب أن تستخدم الطيف الكتلي لإثبات إدماج المقايسة المرجوة من الأحماض الأمينية غير متعارف عليه في البروتين، مع النتائج هو مبين في الشكل 1. وبعد ذلك، نحن نقدم البيانات من مجهرية، مطيافية الامتصاص تجاه الأشعة فوق البنفسجية، فضلا عن التحليل الطيفي fluorescence الحالة المستقرة وحل الوقت والطول الموجي لتوصيف خصائص فلوروفوري جدفب مع تركيز على الاعتماد على درجة الحموضة الأطياف.
لتأكيد تبادل بقايا الحزب اثنين في اكفب قبل 4-الأمينية الراديكالي، يجري تحليل والمطيافيه الجماعية. ويبين الشكل 1 طائفة ESI-MS ديكونفولوتيد ممثل من جدفب. في حين اكفب البرية من نوع كتلة بروتين محسوب من دا 28,283.9 بعد نضوج chromophore، هو كتلة المقابلة جدفب دا 28,313.9. طيف مرض التصلب العصبي المتعدد-ESI ديكونفولوتيد جدفب المعارض ذروة جماعي الرئيسي في 28,314.1 ± 0.1 دا، الذي ينحرف عن القيمة النظرية بأقل من 10 أجزاء من المليون. ويجري داخل نطاق الدقة النموذجية لهذا النوع من التحليل25، وهذا يؤكد إدراج نكا عبر SPI (القيمة التجريبية اكفب البرية من نوع: 28,283.7 Da).
ويبين الشكل 2 الأسفار [كنفوكل] التصوير المجهري الصور (كفيم) من الخلايا البكتيرية معربا عن اكفب، اجفب، EYFP، وجدفب على استثارة للبكتيريا في المخزن المؤقت لبرنامج تلفزيوني. جميع الصور تم الحصول عليها في مجهر مزودة الأشعة فوق البنفسجية والهدف والليزر إثارة في حول نفس الطاقة لكل عينة.
ويبين الشكل 3 ألف تراكب صور كفيم من البكتيريا كولاي معربا عن قوة حماية المنشآت المختلفة بما في ذلك جدفب، ترصد دائماً مع الطاقة الإثارة مشابهة جداً (أطوال موجية كما في الشكل 2). ويبين الشكل 3B هياكل chromophore المتغيرات FP سيظهر. فيما يتعلق بسطوع جدفب اكفب بالمقارنة مع (الأسفار الكم الغلة φ = 0.4)، اجفب (φ = 0.6) وايفب (φ = 0.6) من المهم أن نلاحظ أن جدفب، نطاقا اقتناء الضوء الفلورية (30 نانومتر) تم استخدامه على النقيض من 20 نانومتر المستخدمة لكل جمعية مهندسي البترول الأخرى باب، بغية ضبط كثافة الصور إلى قيم مماثلة. مع معامل انقراض أقل بشكل طفيف وكم انخفاض عائد نتيجة لخصائص فريدة من نوعها فوتوفيسيكال، هو أقل مقارنة سطوع جدفب لقوة حماية المنشآت الأخرى هو مبين.
طيف امتصاص اكفب (الشكل 3) قد ماكسيما مميزة اثنين في 434 نانومتر و 452 شمال البحر الأبيض المتوسط. على النقيض من ذلك، تتميز جدفب بالفرقة واسعة الاستيعاب تحول الأحمر واحد مع الحد الأقصى في 466 شمال البحر الأبيض المتوسط. استيعاب اجفب كذلك الأحمر تحول إلى 488 نانومتر. ومع ذلك، بسبب التحول ستوكس أكبر كثيرا من جدفب (108 شمال البحر الأبيض المتوسط) مقارنة اكفب (41 شمال البحر الأبيض المتوسط) واجفب (20 نانومتر)، طيف انبعاث جدفب هو معظم الأحمر-تحول كل ثلاثة بروتينات فلورية خضراء المشتقات التحقيق هنا (3D الشكل). بينما يظهر انبعاث fluorescence اكفب ماكسيما مميزة اثنين في 475 نانومتر و 505 شمال البحر الأبيض المتوسط، وقد اجفب واحد الانبعاثات الرئيسية واسعة النطاق تبلغ ذروتها في 508 nm (λmax) مع كتف طفيف في 540 نانومتر. الأسفار جدفب يظهر في حوالي 565 نانومتر (λكحد أقصى) (الشكل ثلاثي الأبعاد). طيف انبعاث به يحتوي على مساهمة صغيرة من اكفب البرية من نوع الذي مرئياً أيضا ككتف صغيرة في 475 نيوتن متر. هذا جزء صغير من اكفب يتم تصنيعه قبل التعريفي أثناء الإجراء SPI، ك وصف33.
يبين الشكل 3 أي التغييرات التي تعتمد على درجة الحموضة في طيف امتصاص جدفب. لتغيير درجة حموضة من 8 إلى 5، انبعاث الأقصى ينزاح قليلاً إلى الأحمر وتوسيع طفيف في الفرقة الاستيعاب ويلاحظ. ومع ذلك، الحد السعة الاستيعابية هو فقط حوالي 10% بين درجة الحموضة 8 ودرجة الحموضة 5، مما يشير إلى أن خصائص الدولة الأرض chromophore جدفب ضعيفة جداً تعديل بواسطة الأس الهيدروجيني.
الوقت حل الانبعاثات fluorescence رصدها عن طريق العد فوتون واحد يرد في الشكل 4. منحنيات تسوس رصدها في القنوات الطيفية التي تركزت في 550 نانومتر و 600 نانومتر (الشكل 4 أ) معرض تسوس fluorescence أسرع قليلاً في 600 نانومتر مقارنة بالانحلال في 550 نانومتر. نتائج نوبة العالمية من الأسفار تسوس المنحنيات مع اثنين من النتائج مكونات الأسى في عنصرين تسوس fluorescence طيفيا مميزة مع الثوابت الزمنية 1.0 ns و 3.3 ns (الشكل 4 و دال).
انبعاث جدفب fluorescence بقوة يعتمد على درجة الحموضة، كما أنها نموذجية للعديد من المتغيرات بروتين فلوري الأسرة التجارة والنقل. ويقارن الشكل 4B انبعاث الأسفار جدفب بين 5 درجة الحموضة ودرجة الحموضة 8، الذي يبين بوضوح انخفاضا في كثافة fluorescence في انخفاض درجة الحموضة، بينما تظل الخصائص الطيفية المستمر.
المرتبطة تسوس الأطياف (DAS)39 من جدفب (الشكل 4 ود) تتميز بشريطين الانبعاثات متميزة. مساهمة 3.3 بطيئة ns المكون هو أكثر وضوحاً في نطاق الطول الموجي القصير حوالي 550 نانومتر (60 في المائة) مع مساهمة بسيطة لعنصر أسرع (40%). 600 نانومتر، كلا المكونين لها حول نفس السعة. عند انتقال من الرقم الهيدروجيني 7 (الشكل 4) على درجة الحموضة 6 (الشكل 4)، الخصائص الطيفية لداس يصعب تغيير والثوابت الزمنية من إجراء تركيب العالمية هي أيضا نفس (دقة الثوابت الزمنية داس على وشك ns ± 0.15). بيد الفارق في الاتساع المطلق للعنصرين داس جليا، الذي الكامل يمثل السعة الفلورية انخفاض الانبعاثات عند نفس درجة الحموضة التحول في الشكل 4B.
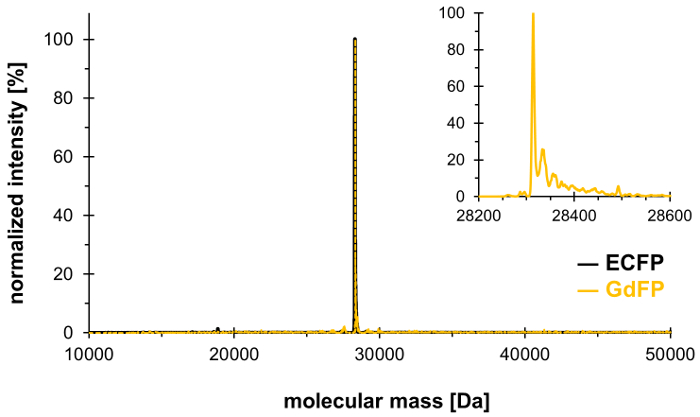
رقم 1: الممثل الطيف ESI-MS ديكونفولوتيد من جدفب- يظهر الطيف ESI--مرض التصلب العصبي المتعدد من جدفب (اللون الذهبي، وتضخيم الأرض كما هو موضح اقحم) ذروة رئيسية في 28314.1 دا (تحسب قيمة 28313.9 دا). الطيف اكفب البرية من نوع يظهر باللون الأسود. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: الصور مجهرية الأسفار [كنفوكل] من السكان البكتيرية الإعراب عن مختلف FPs. استخدمت إعدادات الطول الموجي التالية للحصول على الصور: اكفب (λالسابقين = 457 نانومتر، والكشف عن: 461-480 نانومتر)، اجفب (λالسابقين = 488 نانومتر، والكشف عن: 495-515 نانومتر)، جدفب (λالسابقين = 476 شمال البحر الأبيض المتوسط، والكشف عن: 560-590 nm)، ايفب (λالسابقين = 514 شمال البحر الأبيض المتوسط، الكشف عن: 520-530 نانومتر). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3: الخواص الطيفية من جدفب- (أ) كفيم الصورة من خليط خلايا البكتيرية الإعراب عن اكفب واجفب وجدفب بعد استثارة للبكتيريا في المخزن المؤقت لبرنامج تلفزيوني. (ب) هياكل Chromophore جدفب (مع 4-أمينو-الحزب بدلاً من بقايا 66) واكفب الأبوية (مع الحزب في موقف 66) افجب (مع صور في موقف 66). (ج) المقارنة بين أطياف امتصاص تطبيع جدفب واكفب واجفب، بينما في (د)، طيف انبعاث fluorescence تطبيع اكفب (الإثارة في 430 nm) هو مقارنة الأطياف fluorescence الانبعاثات من اجفب وجدفب (كلاهما متحمس في 450 nm). (ه) الرقم الهيدروجيني-الاعتماد من أطياف الامتصاص (تطبيع الاستيعاب في 280 nm). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: حل وقت الأسفار من جدفب- (أ) الأسفار تسوس جدفب رصد قبل الوقت-والطول الموجي--حل وحيد فوتون العد في القنوات الطيفية التي تركزت في 550 نيوتن متر و 600 نانومتر (± 12.5 nm) بعد الإثارة مع 470 نبضات الليزر في شمال البحر الأبيض المتوسط. وظيفة الرد الآلي (المتكامل) يوفر معلومات حول القرار وقت الإعداد المستخدمة. (ب) اختلاف طيف انبعاث جدفب اعتماداً على درجة الحموضة (الإثارة في 460 نانومتر). (ج، د) المرتبطة تسوس الأطياف (DAS) من جدفب في الأس الهيدروجيني 7 (ج) ودرجة الحموضة 6 (د) تحدد بعد deconvolution الأسفار حل الوقت والطول الموجي يتعفن والعالمي المناسب لاضمحلال في جميع القنوات بمجموعة عالمية من اثنين من الدوال الأسية مع الثوابت الزمنية المرتبطة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 5: هياكل نقل تهمة إينتراموليكولار اكفب (أسود) وجدفب (الذهب) صباغات. الزيادة في حجم النظام chromophore الجهة المانحة الإلكترون جيدة من مجموعة الأمينية كجزء من ncAA يتيح تشكيل هياكل أكثر ميسوميريك تحقيق استقرار الرنين الدولة متحمس. تظهر نقاط الاتصال على سقالة FP ك semicircles. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| حل الأسهم | التركيز، والمذيبات | ملاحظة | |
| 20% د-الجلوكوز | 200 غرام/لتر د-الجلوكوز في ddH2س | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| اندول | 50 مم في الايزوبروبانول | ||
| 4-الأمينية اندول | 50 مم في الإيثانول 20% (20 مل إيثانول في وحدة تخزين نهائي من 100 مل تعبئة لأعلى مع ddH2س) | ||
| إيبتج | 1 م في ddH2س | ||
| ل تريبتوفان | 15 ملم حله في ddH2س باستخدام 1 M HCl (إضافة HCl dropwise تحت التحريك حتى يصبح مسحوق ديسوفيد) | ||
| ليسوزيمي | 50 ملغ/مل في ddH2س | ||
| الدناز أنا | 1 ملغ/مل في ddH2س | ||
| رناسي A | 1 ملغ/مل في ddH2س | ||
| Amp100 | الأمبيسلّين 100 مغ/مل في ddH2س | ||
| الصوديوم-دوديسيلسولفاتي (الحزب الديمقراطي الصربي) | 200 غرام/لتر في ddH2س | ||
| كبريتات الأمونيوم ((NH4)2هكذا4) | 1 م في ddH2س | تعقيم بالتعقيم | |
| فوسفات هيدروجين البوتاسيوم (خ2ص4) | 1 م في ddH2س | تعقيم بالتعقيم | |
| فوسفات هيدروجين دي-البوتاسيوم (K2هبو4) | 1 م في ddH2س | تعقيم بالتعقيم | |
| سلفات المغنزيوم (مجسو4) | 1 م في ddH2س | تعقيم بالتعقيم | |
| د-الجلوكوز | 1 م في ddH2س | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| كلوريد الصوديوم (NaCl) | 5 أمتار في ddH2س | تعقيم بالتعقيم | |
| كلوريد الكالسيوم (كاكل2) | 1 غرام/لتر | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| كلوريد الحديد الثنائي (فيكل2) | 1 غرام/لتر | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| الثيامين | 10 جرام/لتر | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| بيوتين | 10 جرام/لتر | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| مزيج العناصر النزرة | كبريتات النحاس (CuSO4) والزنك (زنكل2) كلوريد، كلوريد المنغنيز (2من الحركة)، موليبدات أمونيوم ((NH4)2مو4)؛ كل 1 مغ/لتر في ddH2س | تعقيم بالترشيح من خلال مرشح حقنه حجم مسام 0.45 ميكرومتر | |
| مزيج الأحماض الأمينية 19 | 1-) حل ز 0.5 لتر-فينيلالاناين و 0.5 غ لتيروزين في 100 مل ddH2س مع إضافة دروبويسي من 1 M HCl تحت التحريك حتى يذوب مسحوق. | ||
| 2.) تزن بها 0.5 ز كل من الأحماض الأمينية ل المتبقية (باستثناء ل تريبتوفان). مزيج مع fo مل 22 1 م خ2ص4 و 48 مل من 1 م ك2مكتب البراءات الهنغاري4. إضافة ddH2س إلى حوالي 800 مل. يقلب حتى يصبح الحل واضح. | |||
| 3.) إضافة لفينيلالاناين المذاب ولتيروزين من الخطوة 1). وضبط مستوى الصوت إلى 1 لتر مع ddH2o. | |||
| 4.) تعقيم الخليط من الأحماض الأمينية عن طريق الترشيح فراغ مع وحدة تصفية أعلى زجاجة. | |||
| مخازن ووسائل الإعلام | التكوين والتحضير | ||
| الحزب الديمقراطي الصربي تحميل المخزن المؤقت لصبغ، تتركز 5 x | 0.25 M تريس الأس الهيدروجيني 6.8، 50% v/v والغليسيرول، 0.25% w/v برومفينول الأزرق، ديديوثريتول 0.5 M (DTT؛ وبدلاً من ذلك 5% β-ميركابتوثانول)، ونسبة 10% w/v الصوديوم-دوديسيلسولفاتي (الحزب الديمقراطي الصربي) | ||
| المخزن المؤقت للربط | ديهيدروجينفوسفاتي الصوديوم 50 مم (نة2بو4)، 500 ملم كلوريد الصوديوم، ايميدازول 10 ملم، درجة الحموضة 8 | ||
| شطف المخزن المؤقت | ديهيدروجينفوسفاتي الصوديوم 50 مم (نة2بو4)، 500 ملم كلوريد الصوديوم، ايميدازول 250 ملم، درجة الحموضة 8 | ||
| المخزن المؤقت للغسيل الكلوي | ديهيدروجينفوسفاتي الصوديوم 50 مم (نة2بو4)، 150 مم كلوريد الصوديوم، والغليسيرول 100 مل/لتر، درجة الحموضة 8 | ||
| المخزن المؤقت لمرض التصلب العصبي المتعدد | 10 ملم تريس-HCl، درجة الحموضة 8 | ||
| المتوسطة الدنيا الجديدة التي تحتوي على الأحماض الأمينية ل 19 استثناء ل تريبتوفان (NMM19) | تخلط جميع الحلول الأسهم للحصول على تركيزات النهائية التالية: 7.5 مم (NH4)2هكذا4مم 1.7 كلوريد الصوديوم، 22 مم خ2ص4، 50 مم ك2مكتب البراءات الهنغاري4، 1 مم MgSO4، 20 ملم د-الجلوكوز، 50 مغ/لتر من مزيج الأحماض الأمينية 19, 1 ميكروغرام/لتر كاكل2، 1 ميكروغرام/لتر فيكل2، 10 ميكروغرام/لتر الثيامين، البيوتين 10 مغ/لتر، مزيج العناصر النزرة 0.01 مغ/لتر | ||
| المتوسطة رطل | تكوين: تريبتوني 10 غرام/لتر، استخراج الخميرة 5 غرام/لتر، 10 غرام/لتر كلوريد الصوديوم، درجة الحموضة 7.0 في ddH2س | ||
| إعداد: | |||
| 1.) وزن من 50 غ تريبتوني، 25 غ خميرة استخراج، 5 غم كلوريد الصوديوم في زجاجة زجاج 1 لتر. | |||
| 2.) إضافة ddH2O يصل إلى ~ 800 مل ومكونات حل تحت التحريك. | |||
| 3.) قياس درجة الحموضة وضبط على درجة الحموضة 7 بالإضافة دروبويسي 1 M HCl أو 1 م هيدروكسيد الصوديوم، إذا لزم الأمر. إضافة ddH2O حتى 1 ل. | |||
| التحقق من حجم الخسارة بعد ذلك تعقيم 4.) بالتعقيم، وإضافة ddH العقيمة2س للتعويض إذا لزم الأمر. تخزين في 4 درجات مئوية حتى الاستخدام. | |||
| لوحات أجار رطل | تكوين: تريبتوني 10 غرام/لتر، استخراج الخميرة 5 غرام/لتر، 10 غرام/لتر كلوريد الصوديوم، 15 غرام/لتر أجار أجار، ودرجة الحموضة 7.0 في ddH2س | ||
| إعداد: | |||
| 1.) وزن من 50 غ تريبتوني، 25 غ خميرة استخراج، 5 غم كلوريد الصوديوم، أجار أجار ز 7.5 في زجاجة زجاج 1 لتر. | |||
| 2.) إضافة ddH2س حتى المكونات 500 مل وتذوب تحت التحريك. | |||
| 3.) قياس درجة الحموضة وضبط على درجة الحموضة 7 بالإضافة دروبويسي 1 M HCl أو 1 م هيدروكسيد الصوديوم، إذا لزم الأمر. إضافة ddH2O حتى 1 ل. | |||
| التحقق من حجم الخسارة بعد ذلك تعقيم 4.) بالتعقيم، وإضافة ddH العقيمة2س للتعويض، إذا لزم الأمر. (ملاحظة: يمكن تخزين أجار رطل في 4 درجات مئوية حتى استخدامها لإعداد لوحات أجار رطل. تذوب بعناية أجار طدت استخدام ميكروويف) | |||
| 5.) عندما يتم الحل ما زالوا الدافئة (30-40 درجة مئوية)، أضف الأمبيسلّين لتركيز نهائي من 100 ميكروغرام/مل | |||
| 6.) صب حوالي 15 مل السائل من الخطوة 5.) في 10 سم معقم بيتري الطبق تحت ظروف معقمة. لوحات عندما هو توطد في أجار، يمكن تخزينها لمدة أسبوع واحد في 4 درجات مئوية حتى الاستخدام. | |||
| فوسفات مخزنة المالحة (PBS) | تكوين: 137 كلوريد الصوديوم، 2.7 مم بوكل، 10 مم نا2هبو4، 1.8 مم خ2ص4، 1 مم كاكل2، مجكل 0.5 مم2، الرقم الهيدروجيني 7 ملم. تعقيم بالتعقيم أو بالترشيح. | ||
الجدول 1: حل المخزون والمخزن المؤقت.
Discussion
لتحقيق الكفاءة إدماج نكا عالية جداً، يعتمد الأسلوب SPI المستندة إلى أوكسوتروفي على استخدام الخلايا المضيفة أيضي هندسيا، التي غير قادرة على تجميع المناظر الطبيعية المقابلة للرابطة الوطنية لرياضة. كولاي، مثل سلالات متوفرة بسهولة. حتى إدراج المتزامنة ncAAs متعددة في نفس البروتين من الممكن استخدام سلالات مولتياوكسوتروفيك. يمكن اعتبار الوضع خاصة ببقايا الاستبدال ومرجع الكيميائية تقتصر على النظير كيميائية مماثلة السلبيات. ومع ذلك، يمكن أن تنتج عددا كبيرا من المتغيرات البروتين كجهاز ترجمة البكتيرية الطبيعية تتسامح مع العديد من الأحماض الأمينية النظير. على سبيل المثال، يمكن إدراج ncAAs أكثر من 50 في البروتينات باستخدام الترجمة في المختبر ، تستأثر بحوالي 73 في المائة من جميع codons للشفرة الجينية لتكون متاحة لإعادة انتداب40. وعلاوة على ذلك، يمكنك أيضا السماح SPI وسمها تنشيط كفاءة البروتين المستهدف41. من حيث المبدأ، لا يقتصر على كولايالمنهجية SPI، ولكن يمكن أن تعمل في أي مضيف آخر و لكل من الأحماض الأمينية 20 المتعارف عليه، شريطة أن تتوفر سلالات أوكسوتروفيك وزراعة محددة بوسائل الإعلام. على سبيل المثال، هما الميثيونين النظير، أزيدوهوموالانيني (Aha) وهوموبروبارجيلجليسيني (Hpg)، المتاحة تجارياً والمستخدمة لتصنيف البروتينات وبروتيوميس في الكائنات المتنوعة. وبالإضافة إلى ذلك، يمكن إنتاج إينتراسيلولارلي اها وإدراجها في وقت لاحق في البروتين42. نكا هذا مناسبة خاصة للاقتران بيورثوجونال مثل الكيمياء انقر كما وضعتها تيريل وزملاء العمل: على سبيل المثال، في زرع الأنسجة نبات التمويل، في بومباي موري اليرقات43، المورفولوجية خلايا44،45 من الزرد اليرقات فضلا عن خلايا الثدييات بما في ذلك الخلايا العصبية46، يمكن أن يوصفوا البروتينات مع اها47،48. وبالمثل، والنظير الراديكالي أدرجت بنجاح في الببتيدات المضادة للميكروبات في الحزب أوكسوتروفيك لاكتيس لاكتوكوككوس سلالات49. SPI مفيد أيضا لميدان إكسينوبيولوجي50،51، الذي يستكشف بدائل للتركيبة الكيميائية الأساسية للحياة. على سبيل المثال، استناداً إلى الأعمال السابقة على كولاي52 و نجحت53، عبئا كولاي قد وضعته مؤخرا استراتيجية تطورية مع الضغط الانتقائي الاستفادة من ثينوبيرولي بدلاً من اندول، أدى إلى استبدال البروتين على نطاق المنظومة من التربتوفان من ثينوبيرولي--ألانين في الشفرة الجينية54. عموما، والأحماض الأمينية المتعارف عليه الحزب، التي هي مرمزة بواسطة الثلاثي مفرد (UGG)، يعرض هدفا واعدة لهندسة البروتينات بسبب جوانب غنية من الكيمياء اندول، الذي يقدم العديد من الاختلافات الكيميائية. مؤخرا، وكبديل للتأسيس على أساس SPI، أفادت رواية المنبوذة منصة قادرة على دمج النظير الحزب سيتيسبيسيفيكالي في المضيفين سواء البكتيرية أو التوكسينات وكان55. وهذا يوسع كذلك صندوق الأدوات في فيفو الهندسة المستندة إلى نكا البروتين، بما في ذلك تغيير الخصائص الطيفية.
وإلى جانب استخدام المضيفين التعبير أوكسوتروفيك، يتطلب البروتوكول SPI شروط التخمير صارمة، سواء من حيث توقيت التعبير الهدف وتكوين المتوسط بغية التوصل إلى كفاءة عالية في إدماج نكا والغلة البروتين المستهدف 56-تتم زراعة استخدام الوسائط الحد الأدنى محددة كيميائيا، التي تتضمن أساسا إلى جانب الأملاح الرئيسية مصادر النيتروجين (ملح الأمونيوم) والكربون (د-الجلوكوز) والفيتامينات والعناصر النزرة. على الرغم من عدم دقة المطلوبة في غياب مزيد من أوكسوتروفيس، الأحماض الأمينية المتبقية (20-n، إذا الأحماض الأمينية n لتحل محلها) تتم عادة إضافة إلى تعزيز النمو البكتيري57. خلال مرحلة نمو أولى قبل تنظيم دورات تعريفية للتعبير البروتين الهدف، تتم إضافة الأحماض الأمينية ن الكنسي لتحل محلها في الحد من تركيزات. عائدات النمو الخلوي حتى تنضب الأحماض الأمينية الأساسية المستهدفة، كما تجريبيا المؤشرة OD ثابتة600. فيما بعد، يتم استبدال المتوسطة الثقافة المتوسطة جديدة تفتقر إلى الأحماض الأمينية المنضب ويحتوي على نكا في تركيزات وفيرة. لإدراج ريبوسومال من التربتوفان النظير كما هو مبين في هذا البروتوكول، ويتم تغذية اندول تناظرية، الذي يصبح إينتراسيلولارلي تحويله إلى مشتقات التربتوفان المقابلة التربتوفان synthase58. المقبل، هو فعل التعبير البروتين الهدف. وفي هذه المرحلة، الخلايا بالقرب من نهاية النمو لوغاريتمي، كتوازن بين عدد الخلايا الإجمالي واللياقة البدنية. كما الوجود والتأسيس للمتعارف عليه الأمينية ستؤدي إلى إنتاج البروتين البرية من نوع، أنها حاسمة لضمان أن الأحماض الأمينية الأساسية هو النضوب الكامل قبل التعريفي. وبالمثل، وملزمة لدراسة فعالية إدماج نكا البروتين المستهدف، عادة بالطيف الكتلي. في حالة تواجد كبير من الأحماض الأمينية الكنسي، زراعة ظروف الحاجة إلى تعديلها، مثلاً، بتغيير تركيز amino acid(s) الأساسية لمرحلة النمو الأولى أو في المدة الأخيرة. في حالة نشاط aaRS منخفضة نحو ncAA، overexpression إنزيم الذاتية أو التعبير المشترك عن aaRS مختلفة، وأكثر نشاطا تجاه ncAA، يمكن أن تجري59.
حمض أميني الكنسي الراديكالي تزخر بثلاث ميزات رائعة: (ط) وفرة الطبيعية في البروتينات منخفضة؛ (ثانيا) خواصه الفيزيائية والكيميائية فريدة من نوعها (مثلاً.، أنها عادة ما تكون أصل المهيمنة fluorescence الجوهرية من الببتيدات والبروتينات)، و (iii) فإنه يساهم في مجموعة متنوعة من التفاعلات الكيميائية الحيوية ووظائف بما في ذلك التراص π، والتفاعلات ح-الترابط والايونات الموجبة π. كل هذه الميزات التي تغيرت تغيرا جذريا عند استبدال 4-الأمينية الراديكالي ← الراديكالي في شك ما بعدها جدفب.، تصميم فئة "الذهب" من أفجفبس مثال رائع لهندسة البروتينات أوتوفلوريسسينت مصممة خصيصا. مع الخواص الطيفية متميزة، يمكن ضبطها في الثانية نحو بعض النوافذ الطيفية عن طريق إدماج الطفرات والرابطة الوطنية لرياضة. في حالة جدفب، يتم ذلك عن طريق بسيطة كيميائية تبادل ح ← NH2 في الإطار الدائري اندول الواردة في ثالوث chromophore اكفب. يعرض الرقم 5 آثار إدراج نكا داخل chromophore. يمكن الأخذ بمجموعة التبرع إلكترون مصدرها 4-أمينو-اندول (إينتراسيلولارلي تحويلها إلى 4-الأمينية الراديكالي) مجموعة متنوعة من الهياكل ميسوميريك التي يمكن أن تفسر حالة متحمس استقرت. سبيكتروسكوبيكالي، الموسع ستوكس التحول وتحول الأحمر الفلورية الانبعاثات نتيجة من هذه الخصائص المميزة لنظام مترافق الموسعة. كما ذكر في وقت سابق، نقل المسؤول إينتراموليكولار المعزز داخل chromophore جدفب أصلاً حساسة لدرجة الحموضة (الشكل 4 باء) ويرافقه تغيير أكبر في لحظة ثنائي القطب بين الأرض0 S و S1 متحمس الدولة بالنسبة إلى اكفب33. كمجموعات بديلة التبرع إلكترون، يمكن استخدام التربتوفان النظير إذ تضع عصابة اندول استبداله مع مجموعات هيدروكسي، حسبما ورد في دراسة مقارنة مع بارستار البروتين نموذج41.
يتم توسيع أطياف الامتصاص والأسفار من جدفب اكفب واجفب بالمقارنة مع (الشكل 3 و دال). توسيع متجانسة من عصابات الامتصاص والأسفار هو عموما الناجم عن وسائط الذبذبات في chromophore، بالإضافة إلى ذلك، اقتران chromophore موجودة في البروتين60الذبذبات وسائط أخرى. اقتران بالبيئة المحلية من البروتين معتمد بواسطة الرسوم المترجمة على chromophore. إينهوموجينيتي الهيكلية من البروتين يؤدي إلى وجود تباينات محلية من الطيف vibronic، مثل اقتران بين أطياف vibronic من chromophore والباقي من البروتين معتمدة بواسطة توطن التهمة والدول ميسوميريك كما هو مبين في الشكل 5. اقتران هذا أيضا يدعم التحول ستوكس كبيرة ويقلل بالضرورة من الغلة الكم الأسفار. بالمقارنة مع غيرها FPs تحول الأحمر، يسلك جدفب حتى البروتين تحسين الاستقرار واتجاهاً منخفضا لتجميع33،،من6162. أنه لا يختلف في اللون من المتغيرات الأخرى تنظيم الأسرة بل أيضا معارض ثبات زيادة كبيرة والتعاونية المعززة للطي33. كثافة الأسفار هي 90 في المائة على الأقل الحفاظ عليها عند التسخين إلى 60 درجة مئوية، بينما fluorescence اكفب ينخفض إلى حوالي 30%. والبروتينات، والأحماض الأمينية العطرية غالباً ما يسهم في شبكات سلاسل الجانب متفاعلة فيما بينها، والذي عادة يكون له تأثير استقرار في هيكل التعليم العالي البروتين. أفجفب تأوي هذه جانب سلسلة شبكة، التي تتألف من chromophore نفسها، بوصفها جيدا كما الفنيل ألانين-165 وله 148 وصور-145. هذه السلاسل الجانبية ليست جامدة تماما في هيكل جدفب33فحسب، ولكن الأهم من ذلك، فإنها تشكل الاتصالات مسعور مع chromophore. أبرز سمة الرواية المحددة في جدفب أن chromophore أميناتيد الدانية أكثر إلى 165 الفنيل ألانين. هذا التفاعل سمة لا تراعي في أفجفبس المعروفة الأخرى. كما بقايا اثنين Å 3.2-4.5 أربا، التفاعلات الأمينية العطرية قد تكون أيضا موجودة. جنبا إلى جنب مع استقرار الرنين التي يسببها amination chromophore، استقرار هذه على الأرجح هذه الشبكة مسعور من الأحماض الأمينية بطريقة تعاونية. قد تكون معتمدة نقل المسؤول إينتراموليكولار أكثر فعالية من هذه التفاعلات في حالة متحمس بالمقارنة مع حالة الأرض chromophore، وأنه يمثل جزئيا على الأقل 108 نيوتن متر ستوكس التحول33،62 .
في التصميم العقلاني من خصائص fluorophore، زيادة في حجم العمل بنظام π الطابع من المتوقع أن يسفر عن موجه إثارة الأحمر تحول. هو إطاعة هذه القاعدة الأساسية من سلسلة الأحماض الأمينية في موقف 66 تفضي إلى صباغات محايدة: الفنيل ألانين (λmax = 355 نانومتر) < له (λاماه x= 386 nm) < صور (λmax = 395 شمال البحر الأبيض المتوسط) < الراديكالي (λmax = 436 نانومتر)63. في طبيعتها، وقد تحقق هذا التمديد لنظام مترافق chromophore π-سندات باستراتيجيات مختلفة. دسريد من سترياتا ديسكوسوما، هي تمدد باندماج الأحماض الأمينية إضافية، وبذلك يتحول λmax إلى 573 نانومتر64. Chromophore asFP595 (λmax = 595 nm) من Anemonia sulcata ومددت جماعة imino، توسيع نظام π في65. منذ chromophore جدفب وأخرى أففبس من نفس الحجم، هو مبدأ مختلفة يجب أن يستتبع الطول موجي انبعاثات في نطاق توسيع دسريد وصباغات asFP595. التحول العميق في ستوكس 108 نانومتر ينسب إلى بنية متميزة chromophore جدفب، الذي يكشف عن مبدأ فوتوفيسيكال جديد في تصميم البروتينات أوتوفلوريسسينت. وأظهرت الحسابات الأولية (كما ورد في 62) أن لحظة ثنائي قطب chromophore الدولة متحمس من جدفب أكبر بكثير مما في حالة الأرض، خلافا لكل قيم اكفب. حين لحظة ثنائي القطب جدفب يزيد من د ~ 3 (ديباي) في الدولة0 S إلى ~ 15 في S1، كان التغيير ل chromophore اكفب معتدلة بدلاً من ذلك (من د ~ 4 ~ 6 د). وهكذا، بسبب الأسفار ذهبية فريدة من نوعها من جدفب نقل المسؤول إينتراموليكولار كبيرة داخل chromophore، مما يزيد من مجموعة متنوعة الهياكل ميسوميريك الممكنة (انظر الشكل 5) التي تسمح لاستقرار الرنين. وهذا يقلل من مستوى الطاقة التي تحدث الانبعاثات. نتيجة لتغيير عميق في هذه اللحظة ثنائي القطب عند الإثارة، هو فصل تهمة إينتراموليكولار السبب الرئيسي للتغييرات في إمكانات البيئة chromophore الالكتروستاتيكي. يضبط مصفوفة البروتين المحيطة بها، بدوره، إلى التغييرات في توزيع الاتهام بعد الإثارة chromophore. تخفيف الهيكلية اللاحقة يخفض مستوى الطاقة chromophore متحمس، الذي يتحول الطيف الأسفار إلى اللون الأحمر بسبب طابعها نقل المسؤول. لنفس السبب، نتيجة كبيرة ستوكس التحول وزيادة معدلات رادياتيونلس العمليات، العائد الكم الأسفار من جدفب ينخفض بالمقارنة مع اكفب33.
الكم عالية الغلة وتحول ستوكس الصغيرة اكفب واجفب وعادة ما تعزى إلى بيئة بروتين جامدة من chromophore، مما يقلل من درجات الحرية، ومن ثم التحويل الداخلي لصالح تخفيف التأثير الإشعاعي للدولة متحمس 66-ونتيجة لذلك، قد التصميم الجزيئي من صباغات أكثر صرامة المضمنة مع اقتران مخفضة لمصفوفة البروتين المتبقية بمثابة دليل لإنتاج أبعد المشتقات بروتينات فلورية خضراء تحول الأحمر مع الكم الفلورية عالية الغلة. ولذلك، للهندسة النهج لإنتاج البروتينات تحول الأحمر أوتوفلوريسسينت، وكذلك توسيع نظام π-إلكترون وبنية chromophore جامدة مع ضعف اقتران للبيئة البروتين مرغوب فيه للغاية. يمكن أيضا إدخال مثل هذه التعديلات أما مباشرة إلى صباغات القائم على التجارة والنقل أو التنسيب من ncAAs المطلوب في المنطقة المجاورة chromophore.
Disclosures
الكتاب يعلن أن لديهم لا تضارب المصالح المالية.
Acknowledgments
هذا العمل كان يدعمها "البحث المؤسسة الألمانية" (كتلة من التميز "توحيد المفاهيم في الحفز) أمورنا وملحوظة، و" الوزارة الاتحادية للتعليم "والعلوم (الفدرالية برنامج '' HSP 2020 ''، ويميبلوس تو سينتوبيو المشروع) إلى واو-ج. س.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 4-aminoindole | Sigma-Aldrich | 525022 | |
| acetonitrile | VWR | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| agar-agar | Carl Roth | 5210 | |
| ammonium molybdate ((NH4)2MoO4) | Sigma-Aldrich | 277908 | |
| ammonium sulfate ((NH4)2SO4) | Sigma-Aldrich | A4418 | |
| ampicillin sodium salt | Carl Roth | K029 | |
| biotin | Sigma-Aldrich | B4501 | |
| bromophenol blue | Sigma-Aldrich | B0126 | |
| calcium chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| colloidal silica | Sigma-Aldrich | Ludox HS-40, 420816 | |
| Coomassie Brillant Blue R 250 | Carl Roth | 3862 | |
| copper sulfate (CuSO4) | Carl Roth | CP86.1 | |
| D-glucose | Carl Roth | 6780 | |
| di-sodium hydrogen phosphate (Na2HPO4) | Carl Roth | X987 | |
| di-potassium hydrogen phosphate (K2HPO4) | Carl Roth | P749.1 | |
| 1,4-dithiothreitol (DTT) | Carl Roth | 6908 | |
| DNase I | Sigma-Aldrich | D5025 | |
| ethanol | Carl Roth | 9065.1 | |
| formic acid | VWR | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| glycerol | Carl Roth | 3783 | |
| imidazole | Carl Roth | X998 | |
| indole | Sigma-Aldrich | I3408 | |
| iron(II) chloride (FeCl2) | Sigma-Aldrich | 380024 | |
| isopropanol | Carl Roth | AE73.1 | |
| isopropyl β-D-1-thiogalactopyranoside (IPTG) | Sigma-Aldrich | I6758 | |
| lysozyme | Sigma-Aldrich | L6876 | |
| magnesium chloride (MgCl2) | Carl Roth | KK36.1 | |
| magnesium sulfate (MgSO4) | Carl Roth | 8283.2 | |
| manganese chloride (MnCl2) | Sigma-Aldrich | 63535 | |
| β-mercaptoethanol | Carl Roth | 4227.3 | |
| potassium chloride (KCl) | Carl Roth | 6781.3 | |
| potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P5655 | |
| RNase A | Carl Roth | 7156 | |
| sodium chloride (NaCl) | Carl Roth | P029 | |
| sodium dihydrogen phosphate (NaH2PO4) | Carl Roth | T879 | |
| sodium dodecyl sulphate (NaC12H25SO4) | Carl Roth | 0183 | |
| thiamine | Sigma-Aldrich | T4625 | |
| Tris(hydroxymethyl)-aminomethane (Tris) | Carl Roth | 5429 | |
| Tris hydrochloride (Tris-HCl) | Sigma-Aldrich | 857645 | |
| tryptone | Carl Roth | 8952 | |
| yeast extract | Carl Roth | 2363 | |
| zinc chloride (ZnCl2) | Sigma-Aldrich | 229997 | |
| Name | Company | Catalog Number | Comments |
| amino acids | |||
| L-alanine | Sigma-Aldrich | A7627 | |
| L-arginine | Sigma-Aldrich | A5006 | |
| L-asparagine | Sigma-Aldrich | A8381 | |
| L-aspartic acid | Sigma-Aldrich | A0884 | |
| L-cysteine | Sigma-Aldrich | C7352 | |
| L-glutamic acid | Sigma-Aldrich | G2128 | |
| L-glutamine | Sigma-Aldrich | G3126 | |
| L-glycine | Sigma-Aldrich | G7126 | |
| L-histidine | Sigma-Aldrich | H8000 | |
| L-isoleucine | Sigma-Aldrich | I2752 | |
| L-leucine | Sigma-Aldrich | L8000 | |
| L-lysine | Sigma-Aldrich | L5501 | |
| L-methionine | Sigma-Aldrich | M9625 | |
| L-proline | Sigma-Aldrich | P0380 | |
| L-phenylalanine | Sigma-Aldrich | P2126 | |
| L-serine | Sigma-Aldrich | S4500 | |
| L-threonine | Sigma-Aldrich | T8625 | |
| L-tryptophan | Sigma-Aldrich | T0254 | |
| L-tyrosine | Sigma-Aldrich | T3754 | |
| L-valine | Sigma-Aldrich | V0500 | |
| Name | Company | Catalog Number | Comments |
| Lab materials | |||
| 0.45 µm syringe filter with PVDF membrane | Carl Roth | CCY1.1 | |
| 1.5 mL microcentrifuge tubes | Eppendorf | 30120086 | |
| conical polystyrene (Falcon) tubes, 50 mL | Fisher Scientific | 14-432-22 | |
| Luer-Lock syringe 5 mL | Carl Roth | EP96.1 | |
| dialysis membrane, Molecular Weight Cut-Off (MWCO) 5,000 | Spectrum Medical Industries | Spectra/Por MWCO 5000 dialysis membrane, 133198 | |
| Immobilized Metal ion Affinity Chromatography (IMAC) column 1 mL, Ni-NTA | Macherey Nagel | Protino series, 745410.5 | |
| petri dishes (polystyrene, sterile) | Carl Roth | TA19 | |
| pQE-80L plasmid vector | Qiagen | no longer available | replaced by N-terminus pQE Vector set Cat No./ID: 32915 |
| protein extraction reagent BugBuster | EMB Millipore | 70921-4 | |
| round-bottom polystyrene tubes, 14 mL | Fisher Scientific | Corning Falcon, 14-959-1B | |
| Trp-auxotrophic E. coli strain | ATCC | ATCC 49980 | Bridges BA et al., Chem Biol Interact., 1972, 5(2):77-84; see main text for alternatives |
| Name | Company | Catalog Number | Comments |
| Mass Spectrometry equipment | |||
| mass spectrometer for LC-ESI-TOF-MS | Agilent | Agilent 6530 Accurate-Mass QTOF | coupled with Infinity LC system |
| mass spectrometry data analysis software | Agilent | MassHunter Qualitative Analysis software v. B.06.00 | |
| High-Performance Liquid Chromatography (HPLC) column for LC-ESI-TOF-MS | Sigma-Aldrich | Supelco Discovery BIO Wide Pore C5 HPLC column, 3 µm particle size, 10 cm x 2.1 mm | |
| HPLC autosampler vials 1.5 mL | Sigma-Aldrich | Supelco 854165 | with conical 0.1 mL glass inserts, screw caps and septa |
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf | 5427 R | |
| cooling centrifuge for 50 mL Falcon tubes | Eppendorf | 5810 R | |
| high pressure microfluidizer for bacterial cell disruption | Microfluidics | LM series with “Z” type chamber | |
| peristaltic pump for LC | GE Healthcare | P-1 | |
| Fast Protein Liquid Chromatography (FPLC) system | GE Healthcare | ÄKTA pure 25 L | |
| orbital shaker for bacterial cultivation | Infors HT | Minitron | |
| UV/Vis spectrophotometer | Biochrom | ULTROSPEC 2100 | |
| ultrasonic homogenizer for bacterial cell disruption | Omnilab | Bandelin SONOPULS HD 3200, 5650182 | with MS72 sonifier tip |
| Name | Company | Catalog Number | Comments |
| Fluorescence spectroscopy equipment | |||
| ps-pulsed laser 470 nm | Picoquant GmbH | PDL-470 | |
| time- and wavelength-correlated single photon counting (TWSPC) acquisition software | Picoquant GmbH | SymPhoTime 64 | |
| time- and wavelength-correlated single photon counting (TWSPC) detector | Picoquant GmbH | PML-16C | 16 spectral channels, to be selected by grating settings |
| single photon counting software | Picoquant GmbH | SPCM 9.75 | |
| global fitting software | Picoquant GmbH | SPC2Glo(R) | |
| fluorescence decay data analysis software | Picoquant GmbH | FluoFit program | |
| data analysis software | OriginLab Inc. | Origin 9.2 | |
| neutral density filter set | Schott | NG1 to NG11 | (400 - 650 nm, transmission 50 %, 20%, 10 %, 5 %) |
| 488 nm long-pass emission filter | AHF Analysentechnik | AHF-488 | |
| quartz cuvette | Thorlabs GmbH | CV10Q1400 | 1 cm pathlength |
References
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan, Aequorea. J Cell Compar Physl. 59 (3), 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263 (5148), 802-805 (1994).
- Andresen, M., et al. Structure and mechanism of the reversible photoswitch of a fluorescent protein. P Natl Acad Sci USA. 102 (37), 13070-13074 (2005).
- Andresen, M., et al. Structural basis for reversible photoswitching in Dronpa. P Natl Acad Sci USA. 104 (32), 13005-13009 (2007).
- Brakemann, T., et al. A reversibly photoswitchable GFP-like protein with fluorescence excitation decoupled from switching. Nat Biotechnol. 29 (10), 942-947 (2011).
- Kremers, G. -J., Gilbert, S. G., Cranfill, P. J., Davidson, M. W., Piston, D. W. Fluorescent proteins at a glance. J Cell Sci. 124 (Pt 2), 157-160 (2011).
- Shimomura, O. Structure of the chromophore of aequorea 0. shimomura green fluorescent protein. FEBS Lett. 104 (2), 220-222 (1979).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N. G., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Shcherbo, D., et al. Bright far-red fluorescent protein for whole-body imaging. Nat Methods. 4 (9), 741-746 (2007).
- Shcherbakova, D. M., Subach, O. M., Verkhusha, V. V. Red fluorescent proteins: advanced imaging applications and future design. Angew Chem Int Edit. 51 (43), 10724-10738 (2012).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Curr Protein Pept Sc. 9 (4), 338-369 (2008).
- Wang, L., Xie, J., Deniz, A. A., Schultz, P. G. Unnatural amino acid mutagenesis of green fluorescent protein. J Org Chem. 68 (1), 174-176 (2003).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Sharma, N., Furter, R., Kast, P., Tirrell, D. A. Efficient introduction of aryl bromide functionality into proteins in vivo. FEBS Lett. 467 (1), 37-40 (2000).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Twine, S. M., Murphy, L., Phillips, R. S., Callis, P., Cash, M. T., Szabo, A. G. The Photophysical Properties of 6-Azaindole. J Phys Chem B. 107 (2), 637-645 (2003).
- Lepthien, S., Hoesl, M. G., Merkel, L., Budisa, N. Azatryptophans endow proteins with intrinsic blue fluorescence. P Natl Acad Sci USA. 105 (42), 16095-16100 (2008).
- Budisa, N., et al. Probing the role of tryptophans in Aequorea victoria green fluorescent proteins with an expanded genetic code. Biol Chem. 385 (2), 191-202 (2004).
- Ross, J. B., et al. Spectral enhancement of proteins: biological incorporation and fluorescence characterization of 5-hydroxytryptophan in bacteriophage lambda cI repressor. P Natl Acad Sci USA. 89 (24), 12023-12027 (1992).
- Soumillion, P., Jespers, L., Vervoort, J., Fastrez, J. Biosynthetic incorporation of 7-azatryptophan into the phage lambda lysozyme: Estimation of tryptophan accessibility, effect on enzymatic activity and protein stability. Protein Eng Des Sel. 8 (5), 451-456 (1995).
- Heim, R., Tsien, R. Y. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 6 (2), 178-182 (1996).
- Bridges, B. A., Mottershead, R. P., Rothwell, M. A., Green, M. H. L. Repair-deficient bacterial strains suitable for mutagenicity screening: tests with the fungicide captain. Chem Biol Interact. 5 (2), 77-84 (1972).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Grigorenko, B. L., Krylov, A. I., Nemukhin, A. V. Molecular modeling clarifies the mechanism of chromophore maturation in the green fluorescent protein. J Am Chem Soc. , (2017).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Spectrophotometer. J Vis Exp. , (2017).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93%. Nat Commun. 3, 751 (2012).
- Neidhardt, F. C., Bloch, P. L., Smith, D. F. Culture medium for enterobacteria. J Bacteriol. 119 (3), 736-747 (1974).
- Hörnsten, E. G. On culturing Escherichia coli on a mineral salts medium during anaerobic conditions. Bioprocess Eng. 12 (3), 157-162 (1995).
- Davis, B. D. The Isolation of Biochemically Deficient Mutants of Bacteria by Means of Penicillin. P Natl Acad Sci USA. 35 (1), 1-10 (1949).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY, USA. (2001).
- Wang, Y. -S., et al. The de novo engineering of pyrrolysyl-tRNA synthetase for genetic incorporation of L-phenylalanine and its derivatives. Mol Biosyst. 7 (3), 714-717 (2011).
- Bae, J. H., et al. Expansion of the genetic code enables design of a novel "gold" class of green fluorescent proteins. J Mol Biol. 328 (5), 1071-1081 (2003).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , Cambridge, MA. (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Separating Protein with SDS-PAGE. J Vis Exp. , (2017).
- Petrásek, Z., et al. Excitation energy transfer from phycobiliprotein to chlorophyll d in intact cells of Acaryochloris marina studied by time- and wavelength-resolved fluorescence spectroscopy. Photoch Photobio Sci. 4 (12), 1016-1022 (2005).
- Kolber, Z. S., Barkley, M. D. Comparison of approaches to the instrumental response function in fluorescence decay measurements. Anal Biochem. 152 (1), 6-21 (1986).
- Pelet, S., Previte, M. J. R., Laiho, L. H., So, P. T. C. A fast global fitting algorithm for fluorescence lifetime imaging microscopy based on image segmentation. Biophys J. 87 (4), 2807-2817 (2004).
- Loefroth, J. E. Time-resolved emission spectra, decay-associated spectra, and species-associated spectra. J Phys Chem. 90 (6), 1160-1168 (1986).
- Hartman, M. C. T., Josephson, K., Lin, C. -W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), e972 (2007).
- Budisa, N., et al. Global replacement of tryptophan with aminotryptophans generates non-invasive protein-based optical pH sensors. Angew Chem Int Edit. 41 (21), 4066-4069 (2002).
- Ma, Y., Biava, H., Contestabile, R., Budisa, N., di Salvo, M. L. Coupling bioorthogonal chemistries with artificial metabolism: intracellular biosynthesis of azidohomoalanine and its incorporation into recombinant proteins. Molecules. 19 (1), 1004-1022 (2014).
- Teramoto, H., Kojima, K. Incorporation of Methionine Analogues Into Bombyx mori Silk Fibroin for Click Modifications. Macromol Biosci. 15 (5), 719-727 (2015).
- Deal, R. B., Henikoff, J. G., Henikoff, S. Genome-wide kinetics of nucleosome turnover determined by metabolic labeling of histones. Science. 328 (5982), 1161-1164 (2010).
- Hinz, F. I., Dieterich, D. C., Tirrell, D. A., Schuman, E. M. Non-canonical amino acid labeling in vivo to visualize and affinity purify newly synthesized proteins in larval zebrafish. ACS Chem Neurosci. 3 (1), 40-49 (2012).
- Dieterich, D. C., et al. In situ visualization and dynamics of newly synthesized proteins in rat hippocampal neurons. Nat Neurosci. 13 (7), 897-905 (2010).
- Dieterich, D. C., Link, A. J., Graumann, J., Tirrell, D. A., Schuman, E. M. Selective identification of newly synthesized proteins in mammalian cells using bioorthogonal noncanonical amino acid tagging (BONCAT). P Natl Acad Sci USA. 103 (25), 9482-9487 (2006).
- Glenn, W. S., et al. Bioorthogonal Noncanonical Amino Acid Tagging (BONCAT) Enables Time-Resolved Analysis of Protein Synthesis in Native Plant Tissue. Plant Physiol. 173 (3), 1543-1553 (2017).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Acevedo-Rocha, C. G., Budisa, N. Xenomicrobiology: a roadmap for genetic code engineering. Microb Biotechnol. 9 (5), 666-676 (2016).
- Agostini, F., Völler, J. -S., Koksch, B., Acevedo-Rocha, C. G., Kubyshkin, V., Budisa, N. Biocatalysis with Unnatural Amino Acids: Enzymology Meets Xenobiology. Angew Chem Int Edit. 56 (33), 9680-9703 (2017).
- Bacher, J. M., Ellington, A. D. Selection and characterization of Escherichia coli variants capable of growth on an otherwise toxic tryptophan analogue. J Bacteriol. 183 (18), 5414-5425 (2001).
- Wong, J. T. Membership mutation of the genetic code: loss of fitness by tryptophan. Pc Natl Acad Sci USA. 80 (20), 6303-6306 (1983).
- Hoesl, M. G., et al. Chemical Evolution of a Bacterial Proteome. Angew Chem Int Edit. 54 (34), 10030-10034 (2015).
- Italia, J. S., et al. An orthogonalized platform for genetic code expansion in both bacteria and eukaryotes. Nat Chem Biol. 13 (4), 446-450 (2017).
- Völler, J. -S., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Tech. 106, 55-59 (2017).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Völler, J. -S., Budisa, N. Coupling genetic code expansion and metabolic engineering for synthetic cells. Curr Opin Biotech. 48, 1-7 (2017).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Somsen, O. J., van Grondelle, R., van Amerongen, H. Spectral broadening of interacting pigments: polarized absorption by photosynthetic proteins. Biophys J. 71 (4), 1934-1951 (1996).
- Kurschus, F. C., Pal, P. P., Bäumler, P., Jenne, D. E., Wiltschi, B., Budisa, N. Gold fluorescent annexin A5 as a novel apoptosis detection tool. Cytom Part A. 75 (7), 626-633 (2009).
- Lepthien, S., Wiltschi, B., Bolic, B., Budisa, N. In vivo engineering of proteins with nitrogen-containing tryptophan analogs. Appl Microbiol Biot. 73 (4), 740-754 (2006).
- Wachter, R. M., Elsliger, M. -A., Kallio, K., Hanson, G. T., Remington, S. J. Structural basis of spectral shifts in the yellow-emission variants of green fluorescent protein. Structure. 6 (10), 1267-1277 (1998).
- Verkhusha, V. V., Lukyanov, K. A. The molecular properties and applications of Anthozoa fluorescent proteins and chromoproteins. Nat Biotechnol. 22 (3), 289-296 (2004).
- Martynov, V. I., Savitsky, A. P., Martynova, N. Y., Savitsky, P. A., Lukyanov, K. A., Lukyanov, S. A. Alternative cyclization in GFP-like proteins family. The formation and structure of the chromophore of a purple chromoprotein from Anemonia sulcata. J Biol Chem. 276 (24), 21012-21016 (2001).
- Piatkevich, K. D., Malashkevich, V. N., Morozova, K. S., Nemkovich, N. A., Almo, S. C., Verkhusha, V. V. Extended Stokes shift in fluorescent proteins: chromophore-protein interactions in a near-infrared TagRFP675 variant. Sci Rep. 3 (1), 1847 (2013).



