Summary
Met behulp van een voorgemonteerd Cas9 is ribonucleoprotein complex (RNP) een krachtige methode voor het bewerken van nauwkeurige en efficiënte genoom. Hier, wijzen wij op het nut ervan over een breed scala van cellen en organismen, met inbegrip van de primaire menselijke cellen en beide klassieke en opkomende modelorganismen.
Abstract
Sitespecifiek eukaryotische genoom bewerken met CRISPR (geclusterde regelmatig interspaced korte palindromische herhalingen)-Cas (CRISPR-geassocieerde) systemen is snel uitgegroeid tot een alledaags onder onderzoekers nastreven van een breed scala aan biologische vragen. Gebruikers gebruiken meestal de Cas9 eiwitten van Streptococcus pyogenes in een complex met een gemakkelijk geherprogrammeerde gids RNA (gRNA). Deze onderdelen worden ingevoerd in cellen, en door middel van een base in paren rangschikken met een aanvullende regio van het dubbelstrengig DNA (dsDNA) genoom, het enzym cleaves beide strengen voor het genereren van een double-strand break (DSB). Latere reparatie leidt tot willekeurige invoeging of schrapping gebeurtenissen (microdeleties) of de opneming van geleverde experimentator DNA op de site van de pauze.
Het gebruik van een gezuiverde single-gids RNA en Cas9 eiwit, voorgemonteerd vormen een RNP en rechtstreeks geleverd aan cellen, is een krachtige aanpak voor het bereiken van zeer efficiënte gene bewerken. RNP bewerken verbetert met name de snelheid van gene inbrengen, een resultaat dat is vaak een uitdaging om te bereiken. Ten opzichte van de levering via een plasmide, leidt de kortere persistentie van de Cas9-RNP binnen de cel tot minder af-target gebeurtenissen.
Ondanks zijn voordelen zijn veel casual gebruikers voor het bewerken van CRISPR-gen minder vertrouwd zijn met deze techniek. Lagere de toetredingsdrempel, duidelijk naar voren komt gedetailleerde protocollen voor de uitvoering van de strategie van RNP in allerlei contexten, aandacht voor zijn duidelijke voordelen en diverse toepassingen. We dekken bewerken in twee soorten primaire menselijke cellen, T-cellen en hematopoietische stamcellen/voorlopercellen (HSPCs). Ook laten we zien hoe Cas9 RNP bewerken maakt het mogelijk de facile genetische manipulatie van hele organismen, met inbegrip van het klassieke model rondworm Caenorhabditis elegans en meer onlangs geïntroduceerd model schaaldieren, Parhyale hawaiensis.
Introduction
fThe CRISPR-Cas9-systeem kan wetenschappers te wijzigen van de beoogde regio's van een genoom-1. Deze snelle en goedkope technologie heeft een revolutie teweeggebracht in fundamenteel onderzoek en belooft om een diepgaande invloed op de ontwikkeling van gepersonaliseerde ziekte therapieën, precisielandbouw, en daarna2. CRISPR bewerken is een democratiserend tool en uitvoering van het systeem in een nieuw laboratorium vereist geen bijzondere expertise in genoom engineering, alleen elementaire vaardigheden van de moleculaire biologie. Onderzoekers kunnen nu bestuderen eerder hardnekkige organismen met een paar alternatieve middelen voor genetische manipulatie3,4. In de afgelopen vijf jaar alleen al, is CRISPR genoom bewerken gebruikt om meer dan 200 verschillende gewervelde dieren, ongewervelden, plant en microbiële soorten ingenieur.
Aangepast van het traject van de prokaryote verdediging CRISPR, de kernelementen vereist voor site-specific genoom bewerking zijn de Cas9 eiwit, meestal uit S. pyogenes en codon-geoptimaliseerd met een toegevoegde nucleaire localisatie signaal (NLS), en haar gespecialiseerde RNA gids5,6. Hoewel hier niet besproken, kunnen ook andere Cas9 orthologues of het CRISPR enzym worden gebruikt. De natuurlijk voorkomende gRNA is samengesteld uit twee afzonderlijk getranscribeerde stukken, de CRISPR-RNA (crRNA) en het trans-activeren crRNA (tracrRNA)7. Deze RNAs kunnen in een enkele transcript, bekend als de single-gids RNA (sgRNA)8worden gesmolten. Meeste genoom editors kiezen de gestroomlijnde sgRNA9, hoewel de dual-gids ook wordt regelmatig gebruikt10,11. Onderzoekers een 20-nucleotide (nt) genomic DNA doelwit, kies ervoor te zorgen dat het ligt naast een korte licenties handtekening vereist voor Cas9 erkenning, genaamd een protospacer aangrenzende motief (PAM), en ontwerpen van een gRNA waarin de bijkomende opeenvolging12 .
Eenmaal in de cel, de complexe RNP haar genomic doelstelling zoekt, de gRNA baseparen met het complementaire DNA strand en vervolgens het enzym cleaves breken beide DNA-strengen voor het genereren van een dubbel-deel2. Cel reparatie machines corrigeert de DSB door tot ten minste twee wegen: via de vergissing-geneigd niet-homologe einde-toetreding (NHEJ) traject of de homologie geleide reparatie (HDR), naadloos waarin DNA met 'armen' van homologie aan weerszijden van de pauze. Het traject van de voormalige reparatie meestal leidt tot indel vorming en verstoring van de daaruit voortvloeiende gen, terwijl de laatstgenoemde kunt onderzoekers invoegen of wijzigen van DNA sequenties1.
De editing efficiëntie en nauwkeurigheid is afhankelijk van de middelen die door die Cas9 en gRNA in de cel invoert. Deze onderdelen kunnen worden geleverd aan gekweekte cellen, embryo's of organismen in de vorm van nucleïnezuren of als een voorgemonteerd RNP complexe13,14,15. Gemeenschappelijke nucleïnezuur gebaseerde leveringsmethoden omvatten de virale signaaltransductie, transfectie of electroporation plasmide DNA of mRNA. Cas9 eiwit en gids RNA worden vervolgens geproduceerd binnen de cel en ze vormen een complex te koppelen.
De directe levering van RNP vereist de afzonderlijke zuivering van de Cas9 eiwitten en RNA-gids. Dit kan binnenshuis gebeuren, of de eiwit- en sgRNA kunnen worden gekocht bij een van verscheidene commerciële leveranciers. Eenmaal hebt verkregen, zijn de Cas9 en de gRNA gemengd om het enzymatisch-bevoegde RNP complex vormen en cellen geïntroduceerd door directe injectie in embryo's bevruchte eieren, lipide gebaseerde transfectie16of electroporation. Het eerste verslag van RNP betrokken injectie in C. elegans gonaden17bewerken. Microinjection is nog steeds de voorkeur middelen van de invoering van RNP naar embryo's en hele organismen, maar effectieve electroporation is aangetoond in muis18,19 en rat20 embryo's. Wij beschrijven van protocollen voor het rechtstreeks injecteren RNP in C. elegans gonaden en P. hawaiensis embryo's en adviseren van een gespecialiseerde soort electroporation RNP kleuren eromheen als primaire menselijke cellen bewerken. Deze methode, nucleofection, omvat geoptimaliseerde electroporation programma's en cel type-specifieke oplossingen en laat de RNP het cytoplasma en de nucleus21in te voeren.
Genoom bewerken met RNP biedt een aantal verschillende voordelen. Omdat de eiwitten en RNA onderdelen vooraf gemonteerd zijn en kwaliteit kan worden gewaarborgd voorafgaand aan levering, vermijdt RNP bewerken vele valkuilen die is gekoppeld aan de levering op basis van nucleïnezuur. Namelijk, er is geen risico van Cas9-encoding DNA integratie in het genoom van de gastheer, mRNA wordt nooit blootgesteld voor afbraak en het omzeilt problemen met in vivo gRNA of eiwit expressie, vouwen en vereniging22,23. Verder, met behulp van RNP leidt tot lagere toxiciteit en veel minder uit-target gebeurtenissen dan de plasmide gebaseerde expressie, een gevolg van de kortere halfwaardetijd van de RNP binnen de cel24,25,26,27.
Ten slotte leidt RNP bewerken aantoonbaar tot hoge bewerken in een verscheidenheid van menselijke cellijnen, primaire cellen zoals fibroblasten, embryonale stamcellen (SER's), pluripotente stamcellen (iSPCs), HSPCs geïnduceerde, en T16,24cellen, 25,26,27,28,29; in ongewervelden zoals C. elegans, P. hawaiensisen fruitvliegjes3,17,30; in gewervelde dieren zoals zebrafish, muizen en ratten31,32; in plantensoorten met inbegrip van Arabidopsis, tabak, sla, rijst, grapevine, apple, maïs en tarwe33,34,35,,36; Chlamydomonas, Penicillium, en Candida soorten37,38,39. De frequentie van indel vorming hoger kan zijn bij het gebruik van RNP ten opzichte van de levering van de plasmide, en HDR-gemedieerde DNA invoeging kunnen gemakkelijker te bereiken van25,27,29.
De hier beschreven protocol maakt gebruik van de Cas9-RNP en is een doeltreffende, gemakkelijk aanpasbaar techniek die is eenvoudig toe te passen op een breed scala aan biologische systemen40,41, vooral in cellen die anders moeilijk zijn om te werken met en in organismen zonder gevestigde systemen voor nauwkeurige genetische manipulatie. We beginnen door te beschrijven hoe te ontwerpen, verkrijgen en monteren van de Cas9-RNP voordat over het gebruik ervan in heel ander model celtypes en organismen. Hematopoietische stamcellen/progenitor cells (HSPCs) en T-cellen worden bewerkt met behulp van dezelfde methode, nucleofection, zodat zij samen in stap 2 en 3 van dit protocol vallen. Het bewerken van procedures voor C. elegans zijn beschreven in stap 4 en 5, en P. hawaiensis bewerken vindt u in stap 6 en 7. Tot slot, aangezien het succes van een experiment bewerken van gen in een organisme kan worden beoordeeld door sequentiebepaling van het genotype, substeps met een beschrijving van mogelijke analysemethodes voor alle cellen en organismen die zijn beschreven in het protocol zijn beschreven in stap 8.
Protocol
1. RNP vergadering
-
Het ontwerp van het experiment ruim van tevoren, verwerven van alle RNA, DNA en proteïne componenten tevoren. Een eerste pas, probeer een van de positieve controle vermeld in tabel 1 en de commerciële reagentia beschreven in de tabel van materialen te gebruiken om een betrouwbare proefopzet en de integriteit van de materialen. Voor extra tips voor het plannen van een nieuw experiment van genoom-bewerken, Raadpleeg de artikelen over dit onderwerp12,42,43.
Opmerking: Zodra geassembleerd zoals beschreven in de volgende stappen, kunnen de RNPs voorbereid worden opgeslagen bij-80 ° C.- Na het kiezen van welke gen naar doel, gebruikt u een van de gratis online tools voor het ontwerpen van een optimale gRNA44,45,46,47,48. Zorg ervoor dat een exon richten als hoopt voor het genereren van een knock-out.
Opmerking: Deze hulpmiddelen zullen helpen om te identificeren een doelsite met een aangrenzende S. pyogenes PAM volgorde, hoge kwaliteit score en lage af-doelscore. - Zuiveren van de proteïne S. pyogenes Cas9 t/m8van de gepubliceerde methoden, of het kopen van een commerciële leverancier.
- Een typische Cas9 buffer voorbereiden op de RNA verdunning, RNP voorbereiding en eiwit opslag, waarin 20 mM van HEPES pH 7.5, 150 mM van KCl, 10% glycerol en 1 mM van de TCEP. Gebruik altijd nuclease-gratis water in buffers die zal worden gebruikt om resuspendeer of verdunnen van RNA om te voorkomen dat de afbraak.
- De gids RNA (tracrRNA en crRNA of sgRNA) door middel van een in vitro transcriptie gepubliceerde referentiemethoden produceren, of het kopen van een nucleïnezuur synthese bedrijf17,21,49, 50 , 51.
- Als het invoegen van een gen, synthetiseren of aanschaffen van een donor DNA sjabloon.
- De eiwitten en RNA aliquots bij-80 ° C en dooi op ijs onmiddellijk vóór gebruik opslaan.
Opmerking: Elke bevriezen-ontdooien iets verlaagt de efficiëntie. Gedetailleerde, open-access protocollen voor Cas9 zuivering52 en de transcriptie in vitro van sgRNAs53 zijn elders beschikbaar.
- Na het kiezen van welke gen naar doel, gebruikt u een van de gratis online tools voor het ontwerpen van een optimale gRNA44,45,46,47,48. Zorg ervoor dat een exon richten als hoopt voor het genereren van een knock-out.
- Als u met C. eleganswerkt, gaat u naar stap 1.5. Voor het protocol van P. hawaiensis , wip voor trede 1.6. Als sgRNA gebruikt, gaat u verder met stap 1.4. Ga verder met stap 1.3 om te verzamelen van een gRNA voor het bewerken van de oplaadbare batterij.
-
Monteren van een gRNA door het mengen van mengsel hoeveelheden tracrRNA en crRNA. 100 µL van 80 µM gRNA materieel, voor ongeveer 50 genoom bewerken experimenten maken
- Incubeer de gRNA bij 37 ° C gedurende 30 minuten en dan laat ze langzaam afkoelen tot kamertemperatuur.
-
RNP prep voor HSPC en T directe celbewerking: geconcentreerde Cas9 monteren van een complexe RNP door het mengen van een 1-2 x molaire hoeveelheid gRNA tot 200 pmol van Cas9 eiwitten in een totaal volume van 10 µL. zeer langzaam, toevoegen aan de gRNA (die vooraf in de buffer van de Cas9 wordt verdund) voor ongeveer 30 s , waardoor snelle cirkels met de pipet, waardoor de uiteindelijke Cas9-concentratie tot 20 µM.
- De electroporation cuvettes voor te bereiden.
Opmerking: Dit protocol is specifiek voor het handelsstelsel waarnaar wordt verwezen in de Tabel van materialen, maar RNP bewerken kan ook worden bereikt met andere electroporation apparaten. - 5 µL (100 pmols, T-cellen) of 10 µL (200 pmol, HSPCs) van RNP toevoegen aan elke cuvette.
- Als het invoegen van nieuwe DNA eerder dan het maken van een knock-out, 1 µL van 100 µM (100 pmol) single-stranded oligonucleotide donor DNA (ssODN)25,54,55 toevoegen aan de cuvettes of putjes van de plaat.
- Hiermee gaat u naar stap 2 voor de volgende aanwijzingen in de primaire directe celbewerking protocol.
- De electroporation cuvettes voor te bereiden.
-
RNP prep voor het bewerken van C. elegans : monteren van de RNP complex door het toevoegen van de volgende reagentia te creëren een eindvolume van 20 µL (de eindconcentraties worden vermeld tussen haakjes): Cas9 (2 µM), HEPES pH 7.5 (10 µM), KCl (115 µM), crRNA (12 µM) , tracrRNA (40 µM), en de reparatie sjablonen indien nodig (0,5 µM ssDNA of maximaal 350 ng/µL dsDNA).
Opmerking: De efficiëntie van een Cas9-gemedieerde DSB-templated reparatie is evenredig met de concentratie van de dsDNA reparatie constructie; Dus, hoe hoger de concentratie van de sjabloon van de reparatie, de efficiëntere de templated reparatie. Echter is een injectie van mixen met meer dan 350 ng/µL van dsDNA gebleken om de levensvatbaarheid van de geïnjecteerde wormen. Dus, het is het beste te gebruiken tot, maar niet meer dan 350 ng/µL van dsDNA in de mix de reparatie om productiviteit te maximaliseren terwijl het minimaliseren van de letaliteit.- Het toevoegen van meerdere crRNAs tegelijkertijd richten op meerdere loci, desgewenst voor de beschreven aanpak van de screening van de co-CRISPR/co-conversion in stap 5.4. Wanneer u meer dan één crRNA toevoegt, voeg elk opeenvolgend aan de master mix.
Nota: Het bedrag van elke crRNA hoeft niet hetzelfde te zijn, en zelfs een verdubbeling van de totale concentratie van crRNAs in de master mix zonder dat de concentratie van Cas9 lijkt niet te bemoeien met de frequentie van de mutagenese op een specifieke locus. Voorbeelden zijn in detail beschreven in Paix et al. 56. - Meng door pipetteren en draai de RNP oplossing bij 16.000 x g gedurende 5 s om ervoor te zorgen dat de oplossing wordt verzameld op de onderkant van de buis.
- Incubeer de oplossing bij 37 ° C gedurende 15 m.
- Centrifugeer het monster bij 16.000 x g gedurende 1 minuut aan elke deeltjes die de dun-verveeld microinjection naald verstoppen kunnen pellet. Gebruik het supernatant in de opeenvolgende stappen.
- Gaat u naar stap 4 voor de rest van het protocol van C. elegans .
- Het toevoegen van meerdere crRNAs tegelijkertijd richten op meerdere loci, desgewenst voor de beschreven aanpak van de screening van de co-CRISPR/co-conversion in stap 5.4. Wanneer u meer dan één crRNA toevoegt, voeg elk opeenvolgend aan de master mix.
-
RNP prep voor het bewerken van P. hawaiensis : eenmalig gebruik Cas9 aliquots bereiden door hen met nuclease-gratis water en fenol rood (voor het visualiseren van injecties) te verdunnen om een eindconcentratie van 6,25 µM van Cas9 en 0,15% fenol rood.
- Monteer de RNP complex door het mengen van een 2-5 x de molaire overmaat van gRNA aan de Cas9 proteïne in een totaal volume van 6 µl. toevoegen 12 pmol van Cas9 naar gRNA, de uiteindelijke Cas9-concentratie om 2 µM, 4-8 µM concentratie gRNA en fenol red concentratie 0,05%.
- Incubeer het mengsel bij kamertemperatuur gedurende 10 minuten tot complexe de RNP.
- Hiermee gaat u naar stap 6 voor de volgende aanwijzingen in de redactie van P. hawaiensis protocol.
2. cel cultuur en voorbereiding
Opmerking: Voer stappen 2.1.1 naar 3.3.3 in een biologische veiligheidskast.
-
Aankoop cryopreserved mens gemobiliseerd perifeer bloed CD34+ HSPCs van een leverancier.
- Ontdooien ~ 1 x106 HSPCs in een 37 ° C water bad gedurende 3 minuten en deze overbrengen naar een conische tube van 15 mL. Voeg 10 mL van een serumvrij uitbreiding medium van een commerciële bron en draai het mengsel bij 100 x g voor 10 min. Verwijder het supernatant en resuspendeer de cellen in 2 mL zuiver aangevuld SFEM. Plaat van de cellen in 6-Wells-platen en hen in een incubator 37 ° C gedurende 24-48 uur voorafgaand aan de RNP electroporation cultuur.
- Tellen van de cellen met een hemocytometer en het totale aantal HSPCs nodig (150.000-200.000 HSPCs per cuvette als electroporated) overbrengen in een centrifugebuis.
- Draai de buis bij 100 x g gedurende 10 minuten aan het einde van de cellen.
-
Aankoop van menselijke primaire CD4+ T cellen van een leverancier of hen uit menselijk bloed te isoleren door de dichtheid kleurovergang centrifugeren29.
- Voorafgaand aan de T-cel activatie, vooraf jas 48-well cultuur platen met αCD3 (UCHT1) en αCD28 (CD28.2). Jas van de platen met 500 µL van 10 µg/mL αCD3 en 10 µg Fe/mL αCD28 in PBS voor ten minste 2 uur bij 37 ° C.
Opmerking: Voor sommige loci, NHEJ kan worden bereikt zonder pre stimulatie, maar met inbegrip van deze stap wordt de efficiëntie gemaximaliseerd. - Cultuur de T cellen gedurende 48 uur bij 37 ° C op αCD3/αCD28 antilichaam-gebonden platen in een RPMI compleet medium [RPMI-1640 aangevuld met 5 mM HEPES, 2 mM van commercieel alternatief voor L-Glutamine, 50 µg/mL penicilline/streptomycine, 50 µM van 2-mercaptoethanol, 5 mM niet-essentiële aminozuren, 5 mM van natrium pyruvaat, en 10% (vol/vol) FBS]. Cultuur de T-cellen bij een dichtheid van 2.000.000 T cellen in 500 µL van media per putje van de plaat van een 48-well.
- Graaf de T cellen met behulp van een hemocytometer en de overdracht experimenteren het totale aantal T-cellen die nodig zijn voor de electroporation (100.000-1.000.000 T cellen per cuvette als electroporated) om een centrifugebuis.
- Draai de buis 90 x g gedurende 8 minuten naar de pellet van de cellen. Als de cellen dichtheid verloop-gescheiden binnen 2 dagen geweest, laat ze bij 200 x g gedurende 8 min.
- Voorafgaand aan de T-cel activatie, vooraf jas 48-well cultuur platen met αCD3 (UCHT1) en αCD28 (CD28.2). Jas van de platen met 500 µL van 10 µg/mL αCD3 en 10 µg Fe/mL αCD28 in PBS voor ten minste 2 uur bij 37 ° C.
-
Voor beide soorten cellen, gecombineerd het supernatant met een pipet/vacuüm, alle bubbels verwijderen.
- Zachtjes resuspendeer de cellen met 20 µL van electroporation buffer per cuvette.
- Voeg toe 20 µL van de cellen (150.000-200.000 HSPCs of 100.000-1.000.000 T-cellen) aan elke cuvette, waarin al 10 µL van de RNP, en meng goed door pipetteren omhoog en omlaag zonder bubbels.
3. RNP Electroporation
- Electroporate de cuvettes na het plaatsen van hen in een nucleofector. Voor de HSPCs, gebruikt u de pulse code ER100. Voor de T-cellen, gebruikt u de pulse code EH-115.
-
HSPCs alleen: Voeg 100 µL van een aangevuld SFEM medium (opgewarmd tot 37 ° C) aan elke cuvette onmiddellijk na electroporation en laat die de cellen gedurende 10-15 minuten herstellen
- De cellen omzetten in cultuur hen in een 96-Wells ronde-bodem plaat en voeg een extra 100 µL van het aangevuld SFEM medium gedurende 24 uur.
- Verander hen in een verse aangevuld SFEM medium en hen voor een aanvullende 24-72 uur uit te broeden.
- Verwijderen van de cellen voor genotypering hen 48-96 h post-electroporation. Draaien de cellen bij 300 x g gedurende 5 minuten en verwijder het supernatant voordat u begint met de DNA-extractie (stap 8.2).
-
T cellen alleen: Voeg 80 µL van RPMI voltooien voedingsbodems vooraf opgewarmd tot 37 ° C uit het reservoir aan elke cuvette of goed, met behulp van een precisiepipet van de multi-kanaals (indien nodig).
- Laat hen bij 37 ° C gedurende 15 minuten inwerken.
- De juiste media antilichamen, cytokines, etc. toevoegen aan de plate(s) van de bestemming en warm ze vooraf in een 37 ° C incubator.
- Breng 107 µL van de electroporated cellen uit de putten tot een ronde-96-Wells bodemplaat met behulp van een precisiepipet van de multi-kanaals (indien nodig).
- Als u meer informatie wilt over de evaluatie van de resultaten van het bewerken, gaat u verder met stap 8.
4. C. elegans voorbereiding
-
1 dag vóór microinjection: de agarose pads voorbereiden op de microinjection.
- Maak een oplossing van 3% (m/v) agarose in water door agarose toe te voegen aan water en brengen de oplossing aan de kook op een verwarmingsplaat of in een magnetron.
- Regelen van 24 x 50 mm x 1,5 mm cover glas dia's op een tafel en een glazen pipet van Pasteur kunt Breng een druppel van de kleine (~ 15 µL) van agarose oplossing in de dia verschijnt. Snel het afvlakken van de daling van de agarose door het plaatsen van een andere dekglaasje aan bovenop. Laat de agarose stollen, en vervolgens het verwijderen van een van de coverslips.
- Laat de gezicht-omhooggaande agarose beklede dekglaasje aan op een tafelblad overnachting te drogen. Bewaar de agarose pads in een schone, droge container na 24 h.
Opmerking: Deze kunnen worden gebruikt voor onbepaalde tijd.
- Trek de microinjection naalden: borosilicaatglas haarvaten met door samensmelting van filamenten (buitendiameter 1,0 mm en inwendig diameter 0.58 mm), trekken de naalden op basis van Mello en brand57 en andere middelen-58. De naalden kunnen onmiddellijk worden gebruikt of kunnen worden opgeslagen in een schone, droge container, verstijfd door klei ondersteunt.
- Voor het onderhoud van de wormen, bereiden een Nematode groei Media (NGM) agar in Petri platen gegoten en gespot met OP50 bacteriën (voor de protocollen op standaard C. elegans onderhoud en recepten voor groei media, zie Stiernagle59).
- De wormen voor microinjection etappe: 12-24 uur voorafgaand aan de microinjection, L4-geënsceneerde hermafrodieten aan een nieuwe plaat van de NG-agar met OP50 bacteriën halen en broeden ze 's nachts bij 20 ° C. Kies voor elk doel/injectie mix van Cas9, ~ 30 wormen aan de plaat.
-
Dag van microinjection: Laden de getrokken microinjection naald met de RNP oplossing supernatant bereid in stap 1.5.
- Pipetteer het supernatant uit stap 1.5.4 in een getrokken capillaire pipet en aanvulling funderingsput de oplossing van de capillaire pipet in de naald van de bereid microinjection (over het algemeen minder dan 0.1 µL laden).
- Monteer de geladen naald op de apparatuur van microinjection gekoppeld aan een micromanipulator. Stel de injectie apparatuur druk op 250 kPa en de druk van het evenwicht naar 25 kPa.
-
Breken terug de geladen naald tip voor het genereren van een scherpe naald rand. Plaats een 15 x 15 mm x 1,5 mm vierkante dekglaasje aan op de bovenkant van een 24 mm x 50 mm x 1,5 mm dekglaasje aan.
- Een van de randen van de vierkant dekglaasje aan overlay met halonen olie 700.
- Plaats de naald in de olie, aan de rand van de 15 mm vierkante dekglaasje aan.
- Met behulp van een hand te begeleiden van het stadium van de Microscoop en dekglaasje aan, borstel de dia omhoog en langs de rand van de naald terwijl de injectie pedaal/knop deprimerend. Breken de naald tip terug, de stroom van de vloeistof uit de naald te verhogen. Het bereiken van een optimale debiet doordat de injectie stroom verwisselt langs de rand van de naald, vorming van ~ 1 zeepbel/s.
- Bevestigen dat de L4 wormen geplukt van de 12-24 h vóór microinjection ontwikkelingsachterstand geënsceneerde jonge volwassenen op de dag van de injectie. Pluk de jonge volwassen wormen aan een NG-agar plaat die mist van OP50 bacteriën en laten kruipen rond gedurende 5 minuten. Dit vermindert de hoeveelheid bacteriën overgebracht naar het pad van de injectie, minimaliseren van naald klompen.
- Plaats een agarose injectie pad/dekglaasje aan op een dissectie-scope. Met behulp van een worm pick, lag een klein spoor van halonen olie langs een van de randen van het pad.
-
Met behulp van de worm pick gecoat in olie, heffen verschillende wormen uit de NG-agarplaat en in het spoor van olie. Met een fijn haar aangesloten op een pipet, zoals een wimper of kat whisker, plaatst u de wormen in parallel, zachtjes duwen de wormen in de agarose pad. Tot comfortabel met de procedure van microinjection, alleen monteren en injecteren van een worm op een tijd.
Opmerking: De droge agarose zal Pit het vocht uit de wormen, waardoor ze zich houden aan de pad. Men bijgevolg moet snel werken als de wormen kunnen droog.- Eenmaal in positie en aangesloten op het pad, de wormen met een paar druppels van halonen olie (~ 20 µL) van de punt van de worm Kies andere overlay.
5. C. elegans gonaden Microinjection met RNPs en na injectie Care
Opmerking: Het protocol van microinjection van Mello en brand57is aangepast en60,61in detail elders beschreven.
-
Plaats het dekglaasje aan met de gekoppelde wormen op de injectie Microscoop. Onder een lage vergroting (5 X doelstelling, 10 X oogbeschadigingen en/of), plaatst u de wormen loodrecht op de injectie naald.
- Overschakelen naar een hoge vergroting (40 X doelstelling, 10 X oogbeschadigingen en/of), verplaatsen de naald grenzend aan de arm van de gonaden overeenkomt met de regio in de buurt van de kernen in Midden - tot laat-pachytene.
- Met behulp van de micromanipulator, verplaatsen de naald tegen de worm, de schubbenlaag iets deprimerend. Tik vervolgens met één hand op de zijkant van het toneel van de Microscoop voor de schok van de naald door de schubbenlaag. De injectie pedaal/knop drukken en langzaam vullen de gonaden arm met de injectie mix en verwijder de naald.
- Herhaal deze stap met de andere tak van de gonaden.
-
Zodra de wormen worden geïnjecteerd, verwijder het dekglaasje aan/agarose stootkussen en plaats het onder een Microscoop ontleden.
- Met behulp van een getrokken capillaire precisiepipet, verplaats de olie uit de wormen door een buffer M9 pipetteren overheen. Het uitvoeren van deze behandeling om de wormen uit de agar vrij te geven.
- Na 10 min, wanneer de wormen zijn dorsen rond in de buffer, verplaatst naar een NG-agarplaat met OP50 bacteriën met behulp van de getrokken capillaire pipet. Plaats de plaat bij 20 ° C gedurende 2-3 uur totdat de wormen hebben hersteld en bewegen zijn.
- Eenmaal hersteld, individueel de wormen overbrengen NG-agar platen met OP50 en de platen overbrengen in een 25 ° C incubator.
-
Toestaan dat de P0-geïnjecteerd wormen te groeien en nageslacht te leggen voor 3 dagen. Het scherm van de F-1 nakomelingen.
- Als co-CRISPR of co conversie62,Selecteer63,,64,65, vervolgens de kandidaat wormen voor screening op basis van of ze de mutant fenotype van het referentie-gen hebben. Individueel deze gemarkeerde wormen overbrengen naar nieuwe NG-agar platen met OP50 en laten leggen van F2 nakomelingen bij 20 ° C.
Opmerking: Het fenotype gebruikt voor een co-CRISPR screening of de selectie moet een vroege schatting opleveren voor het welslagen van de Cas9 bewerken. - Als het co-CRISPR fenotype niet aanwezig is, microinject een plasmide van positieve controle om te helpen bij de verbetering van de efficiëntie van microinjection.
Opmerking: bijvoorbeeld, met inbegrip van een plasmide in de injectie-mix die MYO-2 mCherry-gelabeld codeert zal voor het beoordelen van de efficiëntie van de injectie. Wormen met succes ingespoten met pCFJ90 zal hebben sommige nakomelingen met fluorescerende pharynxes.
- Als co-CRISPR of co conversie62,Selecteer63,,64,65, vervolgens de kandidaat wormen voor screening op basis van of ze de mutant fenotype van het referentie-gen hebben. Individueel deze gemarkeerde wormen overbrengen naar nieuwe NG-agar platen met OP50 en laten leggen van F2 nakomelingen bij 20 ° C.
- Onderzoeken van de F-1 wormen voor de aanwezigheid van de gewenste bewerkingen. Kies de F1 moeder aan een individuele putje van een 96-wells-plaat, lyse haar, en haar DNA door invoegen-specifieke PCR versterking, DNA sequentieanalyse of landmeter nuclease assay (CEL-1)66onderzoeken.
Opmerking: Deze testen kunnen worden uitgevoerd wanneer u een co-CRISPR/co-conversion of andere screening of selectie regimes65,66,,67,68. - Als u meer informatie wilt over de evaluatie van de resultaten van het bewerken, gaat u verder met stap 8.
6. P. hawaiensis voorbereiding
- 1 dag vóór de microinjection, verrijken voor de vroege embryo's door het opzetten van een 'paar tank' de avond tevoren; onlangs gescheiden vrouwen zal vers-bevruchte embryo's bevatten. Zie Rehm et al. 69 voor meer informatie.
- Op de dag van microinjection, verzamelen de eencellige Parhyale embryo's (0-4 h na bevruchting) door anesthetizing gravid vrouwtjes met 0,02% Kruidnagel olie in het zeewater en voorzichtig schrapen de embryo's uit haar ventrale brood zakje met behulp van een vlam-getrokken en afgeronde glazen pipet en een saai paar #3 pincet.
7. P. hawaiensis Embryo Microinjection met RNPs en na injectie Care
- Aanvulling funderingsput een getrokken capillair met ongeveer 1 µL van het mengsel van de injectie RNP hierboven beschreven.
-
Het gebruik van gecomprimeerde stikstof naar de microinject van elk embryo, zoals beschreven in Rehm et al. 69.
- Injecteer de Parhyale embryo's onder een ontleden Microscoop met behulp van een microinjector en een micromanipulator. Laden van 1,5 µL van het mengsel van de injectie in de achterkant van een getrokken capillair (4 inch - 1.0 mm met door samensmelting van filamenten, getrokken met behulp van een micropipet trekken toestellen) met behulp van een microloader Pipetteer tip.
- De naald op de injectie apparaat instellen en breken van het puntje van de naald (een zeer kleine hoeveelheid) met behulp van een paar pincet onder ontleden. Kalibreren van het volume geleverd door injecteren in halonen olie 700 en het meten van de diameter van de zeepbel.
- Snijd een 'dal' uit de uithardende agent met een scheermesje. Vul het halverwege met filter-gesteriliseerde zeewater, en de Parhyale embryo's line-up in de trog te stabiliseren.
- Injecteer de embryo's met behulp van de opstelling microinjection, elk embryo met een paar pincet te stabiliseren tijdens de injectie. Na injectie, kunt u een overdracht glazen pipet de embryo's overgebracht naar een vers 60 mm cultuur schotel halverwege gevuld met filter-gesteriliseerde zeewater.
-
Als de eerste klasse is gebeurd vorm een 2-cel embryo (4-6 h na bevruchting), genereert u volledig-mutant dieren door het injecteren van beide blastomeren. Om ervoor te zorgen een totale decolleté van de fase 2-cel, mede de blastomeren injecteren met FITC of TRITC dextran en observeren dat het signaal is beperkt tot een enkele kerntransfer onder een TL toepassingsgebied ontrafeling na de injectie.
- U kunt ook genereren 'half-mutant' dieren door het injecteren van slechts een van de twee blastomeren het stadium van 2-cel (ruwweg verdeeld links-rechts afhankelijk van het weefsel en de positie op de as A-P).
- Injecteren van één cel in een 8-cel embryo (7,5-9 h na bevruchting) beperken de redactie naar een enkellaags germ. Zie Gerberding et al. 70 voor een kaart van vroege kerntransfer geslachten.
-
Incubeer de embryo's 60 mm cultuur gerechten (niet meer dan 25 per schotel), halverwege gevuld met filter-gesteriliseerde zeewater, 'vooraf zuurstof' met behulp van een aquarium waskolf of door schudden.
- Plaats de schotels van embryo's in een losjes-verzegelde plasticware bekleed met natte papieren handdoeken te handhaven van vochtigheid en plaats ze in een incubator 26 ° C met een 12 h licht-donker cyclus.
- Overdracht van de overgebleven embryo's om schoon zeewater gerechten om de paar dagen.
Opmerking: Embryo's kunnen worden gekweekt bij kamertemperatuur, hoewel ze veel langzamer zal ontwikkelen.
-
Ontleden en monteren van de embryo's in verschillende fasen voor de analyse van een expressie door in situ hybridisatie of antilichaam kleuring (Zie Browne et al. 71 voor een gefaseerde installatie gids, en aanvullende naslaginformatie voor dissectie en fixatie72, in situ hybridisatie73en74kleuring antilichaam).
- Dissectie naalden maken door threading een gebogen stuk wolfraam draad ongeveer 0,5 in lengte in het einde van een naald van insuline. Verscherp de naald in natriumhydroxide onder een stroom. Gebruik een 1 mL spuit als het handvat van de dissectie naald.
- Vul één putje van een 3-well glazen schotel halverwege met een vers-en-klare oplossing voor 9 delen PEM Buffer (0,1 M van PIJPEN pH 6,95, 2 mM EGTA, 1 mM van MgSO4), 1-deel 10 x PBS en 1 deel 32% PFA. 3-5 embryo's plaats in de schotel en porren een klein gaatje in elk embryo, met behulp van een scherpe wolfraam naald op zak en een enigszins dulled te stabiliseren, waardoor de dooier te stromen en de fixeerspray in te voeren.
- Met behulp van een paar van aangescherpte wolfraam naalden, plagen zachtjes weg de buitenste twee vliezen rondom het Parhyale embryo. Ze ontleden in fixeerspray robuuster te maken de embryo's maar werk snel om te voorkomen dat het membraan steeds bevestigd aan het embryo, waardoor de verwijdering van het membraan moeilijker. Toestaan dat de embryo's voor een totaal van 15-20 min. voor het antilichaam kleuring of 40-50 min voor in situ hybridisatie vast te stellen.
- Live hatchlings beeld en analyseren voor morfologische en gedragsmatige fenotypen of vast en vlekken hen voor meer gedetailleerde analyses. Verhogen de hatchlings naar seksuele volwassenheid in 2-3 maanden om knock-out en transgene lijnen (Zie Kontarakis en Pavlopoulos75 voor hatchling zorg en andere nuttige details).
8. beoordeling van uitkomsten bewerken
- Indien van toepassing, zoekt u een visuele en functionele fenotype in de bewerkte cellen of organismen.
Opmerking: Dit proces zal aanzienlijk verschillen door toepassing, en enkele voorbeelden aan het einde van hun desbetreffende protocol van bovenstaande stappen worden beschreven. Na correctie van de sikkelcel mutatie in HSPCs, analyseren de hemoglobine productie door gedifferentieerde erytroblasten met behulp van HPLC(Figuur 1). Een knock-out van het IL-2 receptor gen in T cellen kan worden bevestigd door het oppervlak vlekken en stroom cytometry (Figuur 1B). Om te beoordelen C. elegans en P. hawaiensis fenotypen, observeren de dieren morfologie en het gedrag onder een licht- of fluorescerende Microscoop (cijfers 1 c en 1 D). - Om te bepalen van de efficiëntie en het type van de genomic bewerkingen gegenereerd, lyse van de zwembaden van bewerkte cellen en halen hun genomic DNA met behulp van een commerciële winning kit21.
-
Voor een snelle schatting van indel vorming, PCR-versterken ten minste 200 basenparen rond de cut site en uitvoeren van een T7-endonuclease1 (T7E1)76 of landmeter (CEL-1 nuclease) assay77.
- Als een indel vorming op de site van de Cas9-cut of succesvolle HDR zal maken of verwijderen van een bekende beperkingsplaats, kunt u overwegen een restrictie-enzym spijsvertering te schatten de bewerken efficiëntie6. De beperking fragment length polymorphism (RFLP) bepaling kunnen een handige manier om te controleren de efficiëntie als het gebeurt te zijn beschikbaar.
- Voor een nauwkeurige kwantificering van de bewerken efficiëntie en bepaling van de overheersende bewerken resultaten, sturen de PCR-amplicon voor een standaard Sanger sequencing met zowel voorwaartse als terugwaartse inleidingen.
Opmerking: Als het analyseren van een enkele kloon of organisme, de analyse van de resultaten van het Sanger is eenvoudig, zoals aangetoond in Figuur 2. Als het analyseren van een pool van cellen, vervolgens analyseren de chromatogrammen met de online hulpmiddel78, zoals weergegeven in Figuur 2B. - Voor een volledige kwantificering en sequenties van het bewerken van resultaten, verrichten u diep sequencing27,54, zoals afgebeeld in Figuur 2C.
- Om een bepaalde set van uit-target veranderingen, PCR-versterken van de voorspelde af-target sites beoordelen en stuur ze voor NGS. Uitvoeren om te schakelen van het opsporen van chromosomale translocaties, gids-seq79 of high-throughput, genoom-brede translocatie sequencing (HTGTS)80. Voor een compleet beeld van de af-target bewerkingen in een klonale populatie, verrichten u geheel-genoom sequencing (WGS)81,82,83.
Opmerking: Er zijn een verscheidenheid van methoden voor het kwantificeren van de op - en af-streefpad genoom bewerkingen, verklaarde verder in verschillende review artikelen84,85,86.
Representative Results
Deze experimenten Toon hoe voorgemonteerd Cas9 RNP kan worden gebruikt voor het manipuleren van het genoom van primaire cellen en hele organismen. Onderzoekers zuiveren of aankoop Cas9 eiwit en sgRNA, combineren van de twee componenten vooraf tot het complex en de RNP introduceren in hun cellen of organismen van belang. Na het toestaan van voldoende tijd voor bewerken en u zich voordoen en voor de nakomelingen van de volgende generatie om geboren te worden (indien van toepassing), kijk voor fenotypes en/of cellen voor genotypering verzamelen. Fenotypen kunnen worden waargenomen via functionele testen, testen van de expressie, visualisatie (door oog of met microscopie) of andere methoden, afhankelijk van het experiment.
Bijvoorbeeld, de HSPCs die zijn bewerkt om te corrigeren van de β-globine-mutatie die sikkelcelziekte veroorzaakt kunnen worden onderscheiden in erythrocyten en vehiculumcontrolegroep voor de productie van gezonde of sikkel hemoglobine27,87 (Figuur 1 A). T-cellen bewerkt om knock-out het hoge-affiniteit IL-2 receptor gen, CD25 (IL2RA), kunnen worden geanalyseerd door de oppervlakte kleuring en stroom cytometry88en functioneel geanalyseerd om te detecteren een signalering reactie op IL-2 stimulatie (Figuur 1B ). T-cellen kunnen ook worden geherprogrammeerd in veel klinisch belangrijke manieren waarvoor beoordeling van verschillende fenotypes, met inbegrip van de werkzaamheid van HIV infectie89 en de in vivo antitumorale werkzaamheid van auto-T cellen11.
Met behulp van een aanpak van de screening van de co-CRISPR/co-conversion, zijn C. elegans wormen bewerkt gelijktijdig twee loci62. HDR op het dpy-10 referentie gen met behulp van een ssODN herstellen sjabloon resultaten in een gemakkelijk scoorde dominante dpy-10 winst-of-function mutatie. Heterozygoot F1dpy-10(gof) dieren zijn roller (Rol) en homozygoot dpy-10(gof) dieren zijn dumpy (Dpy). De aanwezigheid van het fenotype geeft aan dat Cas9 bewerken voorgedaan in deze dieren en verbetert de kansen van de identificatie van een bewerken evenement op de tweede plaats in de Rol of Dpy F1 -dieren. Een succesvolle bewerken experiment moet leiden tot 33-50% van de geïnjecteerde P0 wormen opbrengst van 20 of meer F1 nakomelingen die Rol of Dpy90 zijn. Het is dan mogelijk om te kiezen van niet-Rol dieren naar dpy-10 terug naar wildtype en selecteer voor de homozygoot bewerken van belang. Als een vuistregel moet de concentratie van de crRNA gericht op het co-CRISPR referentie gen helft dat van de crRNA gericht op het gen van belang. Als een bewerking in het gen van belang is niet hersteld, kunnen verhogen de kans van het herstellen van de gewenste mutatie de verhoudingen van de twee CRISPR RNAs worden aangepast. Bijvoorbeeld, zal verhoging van het bedrag van crRNA voor het gen van belang ten opzichte van de referentie-gene crRNA verhoging van het percentage van wormen bewerkingen in het gen van belang in de bevolking van wormen die ook bewerkingen op de referentie gene locus bezitten bezitten. Co conversie frequenties variëren, maar de tarieven zijn meestal 20-60%, vaak opbrengst homozygoot bewerkingen in de F1 generatie (Figuur 1C).
P. hawaiensis hatchlings, die zijn bewerkt om knock-out het Abdominale-B gen (Abd-B) weer duidelijk morfologische afwijkingen3 (Figuur 1D). Dit gen is vereist voor correcte abdominale patronen, en de resultaten van de verstoring in de thoracale-type springen en lopen benen ter vervanging van het zwemmen en anker benen die gewoonlijk aanwezig zijn op de buik.
Bepalen van genoom bewerken van resultaten op het niveau van de genotypische is sequencing of een in vitro assay die reeks wijzigingen detecteert vereist. Hier, laten we representatieve sequencing gegevens uit onze model celtypes en organismen, markeren van verschillende benaderingen voor het bewerken van kwantificering. Merk op dat de figuur labels zijn gegeneraliseerd omdat alle methoden die hier worden weergegeven op een biologisch systeem kunnen worden toegepast.
Sequencing gebaseerde benaderingen variëren in complexiteit en diepgang van de resultaten. Voor klonen bewerkte populaties of gemakkelijk scheiden individuele organismen, kunnen bewerkte individuen worden sequenced na genomic DNA-extractie. Standaard Sanger rangschikkend resultaten zal onthullen de wijziging van de volgorde op de site van de Cas9-cut in een bepaald individu, met het hypothetische leesraamverschuiving die zijn functie(Figuur 2 verstoren zou). De online tool gebruikt voor het rangschikken is een ander Sanger sequencing gebaseerde benadering die kan worden toegepast op gemengde bevolking in plaats van individuele mutanten78. Sequenties worden geanalyseerd met een online tool die, bewerken totaalrendement evenals overheersende reeks resultaten benaderen kan. De representatieve gegevens worden weergegeven in Figuur 2B.
De meest grondige sequencing hier beschreven methode is diepe sequencing (soms aangeduid als high-throughput of next-generation sequencing). Deze methode biedt DNA-sequenties van individuele genomen in een gemengde bevolking. Dergelijke gegevens kan geïllustreerd worden in een verscheidenheid van manieren. Wij hebben hier, individuele sequencing leest ingedeeld van bewerkte cellen op basis van het bewerken resultaat (Figuur 2C). De meeste cellen worden bewerkt via de NHEJ-pathway, die meestal tot verstoring van de gen leidt. In anderen, heeft het doel-gen werd geruild voor een alternatieve versie via HDR27.
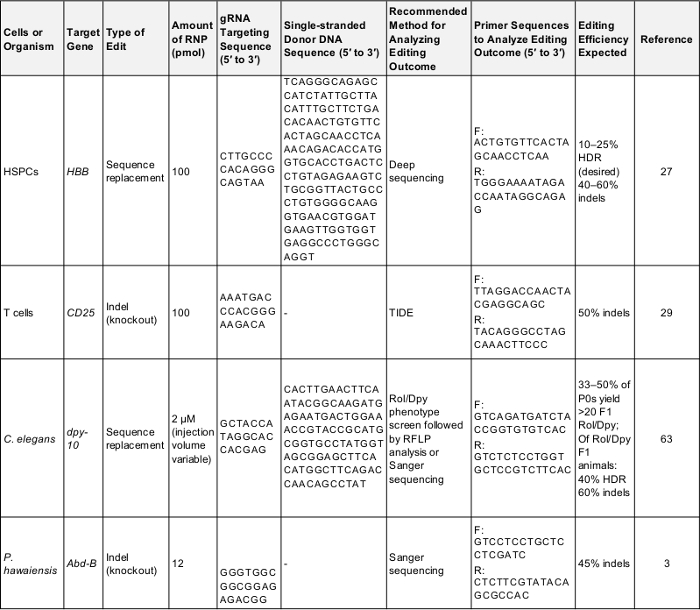
Tabel 1: positieve controles voor voorlopige genoom bewerken experimenten. Deze tabel toont de kerngegevens te bevatten die nodig zijn voor het uitvoeren van een genoom van de eerst bewerken experiment in elk van de cellen en organismen die worden beschreven in dit protocol. Na deze parameters is waarschijnlijk een succesvol resultaat dat kan worden gebruikt om te testen het protocol opleveren of als een basis voor vergelijking eens de experimentator is gericht op een gen van hun eigen belang. F: toekomen, R: omgekeerde, HDR: homologie geleide reparatie. Klik hier om te downloaden van deze tabel.

Figuur 1 : Vertegenwoordiger fenotypische resultaten Cas9 RNP bewerken van primaire menselijke cellen en organismen. (A) dit is een spoor van de HPLC waaruit blijkt dat na succesvolle genoom bewerken, HSPCs, die zijn onderscheiden in laat-stadium erytroblasten meer functioneel hemoglobine produceren zal dan sikkelvormige hemoglobine. Mutant erytrocyten produceren sikkelcel-hemoglobine (HbS), terwijl cellen bewerking is voltooid zal het produceren van gezonde hemoglobine (HbA en HbA2) evenals fetal hemoglobine (HbF). De absorptie is opgenomen in een willekeurige eenheden (au) in een grafiek. Dit paneel werd voor het eerst gepubliceerd in DeWitt et al. 27. het is herdrukt met toestemming van de Amerikaanse Vereniging voor de Advancement of Science. (B) aan de linkerkant, voor elke voorwaarde, dit paneel toont stroom cytometry gegevens waaruit blijkt dat oppervlak gebeitste T cellen doen niet express CD25 na het CD25 -gen uit met RNP heeft geslagen. De overvloed van CD25 is met de grootte van de cel op de y-as uitgezet op de x-as. Aan de rechterkant, voor elke voorwaarde, toont dit paneel de kwantificering van de Phospho-Stat5 (pStat5) na een inductie met IL-2. De signalering is verminderd wanneer de IL-2 receptor afwezig (CD25 KO is). De overvloed van pStat5 is uitgezet op de x-as en de gegevens die voortvloeien uit drie verschillende niveaus van IL-2 input verticaal worden vergeleken. (C) dit paneel toont een Caenorhabditis elegans co-CRISPR/co-conversion scherm gericht op dpy-10 als co conversie markering. Twee RNAs doel twee loci, dpy-10 en uw favoriete gen (yfg), begeleiden in de dezelfde P0-ingespoten dier. HDR op dpy-10 resultaten een Rol of Dpy fenotype. De selectie van Rol - of Dpy-F1 dieren verhoogt de kans op identificatie van bewerkingen op de tweede plaats. (D) dit paneel blijkt dat wildtype Parhyale hawaiensis hatchlings normale buikjes met zwemmen en anker benen hebben. De Abd-B knock-out hatchlings (F0 personen) ontwikkelen een buik getransformeerd naar de thorax. Dus, het zwemmen en ankers benen zijn gegaan en vervangen door de benen van het springen en lopen een normale thorax is gekoppeld. Klik hier voor een grotere versie van dit cijfer.

Figuur 2 : Typische resultaten bewerken resultaat analysemethoden. (A) dit deelvenster ziet u voorbeelden van het Sanger rangschikkend resultaten van individuele F1 P. hawaiensis organismen, met inbegrip van de volgorde van wildtype en drie verschillende microdeleties die de genfunctie verstoren door een verschuiving van het open leesraam. (B) deze tij blijkt het aantal ingevoegde en schrapping gebeurtenissen die hebben plaatsgevonden op de site van een Cas9-target in een pool van gesequenceerd T-cellen. De x-as geeft de lengte van een bepaalde invoeging of deletie in nucleotiden. (C) deze diepe rangschikkend resultaten tonen geen genoom bewerken zonder nucleofection of gRNA, en succesvolle bewerken met intact Cas9 RNP, gegroepeerd op DNA reparatie resultaat in HSPCs. Klik hier voor een grotere versie van dit cijfer.
Discussion
Tot oprichting van een robuuste genoom protocol bewerken in een cel lijn of organisme van belang vereist de optimalisatie en empirisch testen van verschillende essentiële parameters, besproken in deze sectie. Proberen een paar variaties van de algemene benaderingen die hier gepresenteerd wordt sterk aangemoedigd. De belangrijkste beperking van dit protocol is dat deze methoden toepassen op andere cellen of organismen kunnen leiden tot een verschillend resultaat afhankelijk van de soort studeerde en een experimenteel ontwerp dat tot een hoog rendement gene knock-out leidt niet DNA inbrengen kan bevorderen. Dus, is het raadzaam te beginnen met de methoden die hier gepresenteerd en het oplossen van problemen die hieronder worden beschreven.
Probleemoplossing genoom reagens kwaliteit bewerken:
Genereren of aankoop van reagentia van hoge kwaliteit is een cruciale stap in een genoom bewerken protocol. Cas9 eiwit kan worden gezuiverd in het lab of commercieel ingekocht. Vele protocollen Opmerking een eindconcentratie voor Cas9 in RNP recepten, maar het optimale gen bewerken activiteit zal afhangen van de specifieke activiteit van een individuele Cas9 eiwit-preparaat, die afhankelijk van de bron varieert. Zodra het hier gepresenteerde protocol werkt, overwegen de hoeveelheid RNP gebruikt door het niveau van de Cas9 van de titrating om een optimale concentratie optimaliseren: een zeer specifiek doel DNA decolleté zonder geen onnodige af-target splijting veroorzaakt door buitensporige Cas940.
Ook kan gids RNA zuiverheid en homogeniteit determinanten van genoom succes22bewerken. Gekochte sgRNAs of afzonderlijke onderdelen van de crRNA en tracrRNA zijn over het algemeen hoogwaardige reagentia en een verscheidenheid aan chemische wijzigingen zijn beschikbaar om problemen met aantasting van het RNA te bestrijden of te doordringen van de extra functies tot de RNP91. Terwijl chemisch gemodificeerde gRNAs niet noodzakelijk voor standaard genoom bewerken experimenten zitten kan, sommige groepen geconstateerd veel hogere efficiëntie met dergelijke reagentia, bewerken zodat kunnen zij moeite waard te proberen na het beheersen van het proces en/of wanneer de aantasting van de gRNA lijkt een kwestie22,91. In vitro transcriptie en latere gel zuivering is een goedkoop alternatief, wat kan voldoende zijn voor routinematige genoom experimenten17,21,49,50bewerken. Verder verschillende benaderingen die vaak worden toegepast voor de productie van homogene gRNA populaties in vivo, met inbegrip van Ribozym en tRNA-gebaseerde excisie van individuele gidsen, kan worden uitgebreid tot in vitro RNA voorbereiding voor het genereren van schonere producten-92.
Gids RNA en DNA donor design tips:
Gids RNA selectie is een kritieke factor in het bereiken van zeer efficiënte op-doelgroep bewerken terwijl het minimaliseren van de kans op uit-target decollete. Om te helpen bij de selectie van de handleiding, hebben verschillende studies high-throughput schermen in combinatie met de volgende-generatie sequencing gebruikt om te compileren reeks kenmerken van succesvolle gidsen47,79,93,94, 95,96. Deze functies zijn gebruikt om voorspellende algoritmen en online tools om te helpen in de gids selectie44,45,46,47,48te ontwikkelen. Dergelijke algoritmen zijn geaard op schermen met behulp van DNA-gebaseerde systemen voor gids RNA expressie. Gidsen worden uitgedrukt met behulp van een Pol III promotor, en hun uitdrukking is daarom onderhevig aan de beperkingen die zijn gekoppeld aan Pol III transcriptie, zoals voortijdige beëindiging wanneer het ontmoeten van sporen van uracil97,98, 99. Echter gebruik van RNPs gemaakt met in vitro-gesynthetiseerde gids RNAs omzeilt deze bezorgdheid en vereenvoudigt de beperkingen van het ontwerp van de gids. Een gemeenschappelijk kenmerk dat voortgekomen uit deze algoritmen en is bevestigd in tal van studies met zeer effectieve genoom bewerken, is de aanwezigheid van een purine, met name een guanine, 3 ' eind van de gids van doelgroepen gerichte sequentie. De functie van deze gids is zeer succesvol onder organismen variërend van zoogdieren C. elegans, fruitvliegjes en zebrafish65,100,101. Daarnaast, voor C. elegansis ontwerpen van gidsen met een GG-dinucleotide 3 ' eind van de gids targeting regio een effectieve strategie voor het voorspellen van zeer efficiënte gids RNAs65. In het ideale geval test meerdere hulplijnen in parallel om te bepalen welke is het meest succesvol voor een bepaalde toepassing.
Wanneer u probeert om een opeenvolging van DNA in het genoom, is het ontwerp van de donor of de sjabloon DNA ook cruciaal. Single-stranded oligonucleotide donoren (ssODNs) worden betrouwbaarder dan andere typische reparatie templates, lineaire double-stranded en plasmide DNA54,55,102ingevoegd. Bij sommige loci, kan HDR-efficiëntie worden verbeterd met ssODNs die dienen ter aanvulling van de doelsoort of ontheemd bundel van DNA en homologie wapens die asymmetrische in lengte27,55te bezitten. Omdat de reparatie-sjabloon wordt ingevoegd op de gesneden site en de gerichte reeks omvat, moet men om te voorkomen dat Cas9 het splijten van de donor DNA vóór of na de genomic inbrengen. Dit wordt bereikt door het aanbrengen stille mutaties een PAM sequentie of zaad regio, het vermijden van de erkenning door Cas9 met behoud van de functie van de ingevoegde gene21,103. Hoewel zelfs één nucleotide veranderingen aan de PAM dreigen af te schaffen bindende104, proberen ten minste vier nucleotiden om veilig te wijzigen.
Betekenis en toekomstige toepassingen:
Genoom bewerken met CRISPR-Cas9 heeft ontpopt als een krachtige methode waarmee facile genetische manipulatie van elk organisme. Bewerken met de Cas9-RNP kost een beetje meer moeite aanvankelijk maar is eenvoudig te gebruiken zodra reagentia en protocollen gevestigd zijn in een lab. Bewerken van cellen met voorgemonteerd RNP in plaats van de plasmide DNA leidt tot hogere totale bewerken efficiëntieverbeteringen, met inbegrip van het inbrengen van de moeilijk te bereiken gene via HDR, met minder af-target effecten24,25,26 , 27 , 29. verder, experimenteurs vermijdt problemen met genexpressie, RNA afbraak, vouwing van eiwitten en de koppeling tussen gRNA en Cas9 moleculen gesynthetiseerd afzonderlijk binnen de cel22,23. Ook de bezorgdheid over de veiligheid over dat mutagenese RNP bewerken omzeilt en aanhoudende expressie die zich voordoen kan bij virale afleveringsmethoden zijn klinisch14gebruikt. Vanwege deze voordelen gunst vele wetenschappers voeren preklinische, proof-of-concept experimenten RNP bewerken voor menselijke therapeutische toepassingen. Zowel in vivo en ex vivo RNP gebaseerde genoom bewerken benaderingen zijn in ontwikkeling om te behandelen of zelfs genezen van een scala van omstandigheden, van genetische ziekten zoals Duchenne spierdystrofie105 en sikkelcelziekte27 tot HIV29 en kanker11. Cas9 RNP is interessant, steeds werkzaam als een leveringsmethode voor agrarische techniek omdat hierdoor 'DNA-vrij' bewerken van planten33,34,36.
Disclosures
De auteurs Alexander Marson en Jacob E. Corn zijn mede-oprichters van Spotlight Therapeutics. Jacob E. Corn is een adviseur missie Therapeutics en zijn laboratorium gesponsorde onderzoekssteun heeft gekregen van AstraZeneca en Pfizer. Alexander Marson is een adviseur van Juno Therapeutics en PACT Therapeutics en zijn laboratorium gesponsorde onderzoekssteun heeft gekregen van Juno Therapeutics, Epinomics en Sanofi. Zijn laboratorium heeft ook toegepast voor octrooien gerelateerd aan Cas9 RNP technologie.
Acknowledgments
We bedanken de vele eerdere leden van onze labs en de Bay Area genoom bewerken Gemeenschap voor hun bijdragen aan de ontwikkeling van deze methoden. Wij danken Ross Wilson voor het kritisch lezen van dit manuscript.
Alexander Marson van onderzoek wordt ondersteund door een gift van de Jake Aronov en een National Multiple Sclerosis Society verlenen (CA 1074-A-21). Alexander Marson houdt een Career Award voor medische wetenschappers uit het Burroughs-Wellcome-Fonds en is een Chan Zuckerberg Biohub onderzoeker. Jacob E. Corns onderzoek wordt ondersteund door de Li Ka Shing Foundation, het erfgoed Medical Research Medical Institute en het California Institute voor regeneratieve geneeskunde. Behnom Farboud en Barbara J. Meyer's onderzoek wordt gedeeltelijk gefinancierd door de toekenning van de NIGMS R01 GM030702 aan Barbara J. Meyer, die een onderzoeker van het Howard Hughes Medical Institute. Erin Jarvis en Nipam H. Patel's onderzoek wordt gedeeltelijk gefinancierd door de NSF grant IOS-1257379 en Erin Jarvis erkent steun van een NSF-GRFP en een Philomathia Graduate Fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents/Materials | |||
| DNA oligonucleotides | Integrated DNA Technologies | - | IDT will provide custom DNA sequences, including those in Table 1 |
| Guide RNAs | Synthego | - | Synthego will provide high-quality sgRNAs for S. pyogenes Cas9, including custom sgRNAs containing the targeting sequences included in Table 1 |
| Purified Cas9 protein (EnGen Cas9 NLS, S. pyogenes) | New England Biosciences | M0646T | If possible, purifying Cas9 in-house or purchasing from local core facilities is a less expensive option |
| Normal peripheral blood CD34+ stem/progenitor cells | AllCells | PB032-2 | |
| StemSpan SFEM | StemCell Technologies | 09650 | |
| StemSpan CC110 | StemCell Technologies | 02697 | |
| P3 Primary Cell 4D-Nucleofector X Kit | Lonza | V4XP-3032 | |
| RPMI-1640 Medium, With sodium bicarbonate, without L-glutamine, liquid | Sigma | R0883-6X500ML | |
| EasySep™ Human T Cell Isolation Kit | Stemcell | 17951 | |
| cell culture plate, 96 wells, round | Fisher Scientific | 3799 | |
| CTS (Cell Therapy Systems) Dynabeads CD3/CD28 | Life Tech | 40203D | |
| Reombinant Human IL-2 | UCSF Pharmacy | NA | |
| SepMate-50 500-pack IVD | Stemcell Technologies | 85460 | |
| OP50 Escherichia coli | Caenorhabditis Genetics Center | OP-50 | https://cgc.umn.edu/ |
| Nematode Growth Media agar in petri dishes | - | - | See Stiernagle, T (ref. 59) |
| Standard borosilicate glass capillaries with filament: 4 in (100 mm), 1/0.58 OD/ID | World Precision Instruments | 1B100F-4 | |
| Single-barrel standard borosilicate glass capillaries: 6 in (152 mm), 2/1.12 OD/ID | World Precision Instruments | 1B200-6 | |
| Cover glass; 24 × 50 mm | Thermo Fisher Scientific | 12-544E | |
| Cover glass; 22 × 22 mm | Thermo Fisher Scientific | 12-518-105K | |
| Apex LE agarose | Genesee Scientific | 20-102 | |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-100ML | |
| pCFJ90 plasmid | Addgene | 19327 | |
| Compressed nitrogen | - | ||
| 60 mM culture dishes | BD | ||
| Capillary tubes with filament: 4 in (1.0 mm) | World Precision Instruments | T2100F-4 | |
| Sylgard 184 | Dow Corning | ||
| Petri dishes (100 × 15 mm) | - | ||
| Tungsten wire (0.005 in. diameter) | Ted Pella | ||
| Perfluoroalkoxy alkane (PFA) | - | ||
| Marine salt | - | ||
| 9" pasteur pipettes | - | ||
| Phenol red | - | ||
| Nuclease-free water | - | ||
| Equipment | |||
| 4D Nucleofector | Lonza | AAF-1002X | |
| MZ75 Stereomicroscope | Leica | Out-of-production. Current model is the M80 Stereomicroscope | |
| Axio Vert35 inverted phase contrast fluorescent microscope | Zeiss | Out-of-production. Current model is the Axio VertA.1 | |
| Laser-based micropipette puller (for C. elegans protocol) | Sutter Instrument | FG-P2000 | |
| Picoliter Microinjector (for C. elegans protocol) | Warner Instruments | PLI-100A | |
| Three-axis Joystick oil hydraulic micromanipulator | Narishige International | MO-202U | |
| Coarse manipulator | Narishige International | MMN-1 | |
| Micropipette puller (for P. hawaiensis protocol) | Sutter Instrument | P-80/PC | |
| Microinjector (for P. hawaiensis protocol) | Narishige | IM300 | |
| Microloader pipette tips | Eppendorf | 5242956003 | |
| NG-agar |
References
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-based technologies for the manipulation of eukaryotic genomes. Cell. , 1-17 (2016).
- Barrangou, R., Horvath, P. A decade of discovery: CRISPR functions and applications. Nature Microbiology. 2, 1-9 (2017).
- Martin, A., Serano, J. M., et al. CRISPR/Cas9 mutagenesis reveals versatile roles of Hox genes in crustacean limb specification and evolution. Current Biology. 26 (1), 14-26 (2016).
- Goldstein, B., King, N. The future of cell biology: emerging model organisms. Trends in Cell Biology. 26 (11), 818-824 (2016).
- Mali, P., Yang, L., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Cong, L., Ran, F. A., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Deltcheva, E., Chylinski, K., et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature. 471 (7340), 602-607 (2011).
- Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., Charpentier, E. A Programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Nowak, C. M., Lawson, S., Zerez, M., Bleris, L. Guide RNA engineering for versatile Cas9 functionality. Nucleic Acids Research. 44 (20), 9555-9564 (2016).
- Jiang, W., Cox, D., Zhang, F., Bikard, D., Marraffini, L. A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature Biotechnology. , 1-9 (2013).
- Rupp, L. J., Schumann, K., et al. CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells. Scientific Reports. 7 (1), 737 (2017).
- Graham, D. B., Root, D. E. Resources for the design of CRISPR gene editing experiments. Genome Biology. 16, 260 (2015).
- Wang, H., La Russa, M., Qi, L. S. CRISPR/Cas9 in genome editing and beyond. Annual Review of Biochemistry. 85, 2270 (2016).
- Nelson, C. E., Gersbach, C. A. Engineering delivery vehicles for genome editing. Annual Review of Chemical and Biomolecular Engineering. 7, 637-662 (2016).
- Yin, H., Kauffman, K. J., Anderson, D. G. Delivery technologies for genome editing. Nature Reviews Drug Discovery. 16 (6), 387-399 (2017).
- Zuris, J. A., Thompson, D. B., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nature Biotechnology. 33 (1), 73-80 (2015).
- Cho, S. W., Lee, J., Carroll, D., Kim, J. -S., Lee, J. Heritable gene knockout in Caenorhabditis elegans by direct injection of Cas9-sgRNA ribonucleoproteins. Genetics. 195 (3), 1177-1180 (2013).
- Wang, W., Kutny, P. M., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. Journal of Genetics and Genomics. 43 (5), 319-327 (2016).
- Chen, S., Lee, B., Lee, A. Y. -F., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. Journal of Biological Chemistry. 291 (28), 14457-14467 (2016).
- Remy, S., Chenouard, V., et al. Generation of gene-edited rats by delivery of CRISPR/Cas9 protein and donor DNA into intact zygotes using electroporation. Scientific Reports. 7 (1), 16554 (2017).
- DeWitt, M. A., Corn, J. E., Carroll, D. Genome editing via delivery of Cas9 ribonucleoprotein. Methods. , 1-7 (2017).
- Hendel, A., Bak, R. O., et al. Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells. Nature Biotechnology. 33 (9), 985-989 (2015).
- Thyme, S. B., Akhmetova, L., Montague, T. G., Valen, E., Schier, A. F. Internal guide RNA interactions interfere with Cas9-mediated cleavage. Nature Communications. 7, 11750 (2016).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. -S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research. 24 (6), 1012-1019 (2014).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. eLife. 3, 04766 (2014).
- Liang, X., Potter, J., et al. Rapid and highly efficient mammalian cell engineering via Cas9 protein transfection. Journal of Biotechnology. 208, 44-53 (2015).
- DeWitt, M. A., Magis, W., Bray, N. L., Wang, T. Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Science Translational Medicine. 8 (360), (2016).
- Ramakrishna, S., Kwaku Dad, A. -B., Beloor, J., Gopalappa, R., Lee, S. -K., Kim, H. Gene disruption by cell-penetrating peptide-mediated delivery of Cas9 protein and guide RNA. Genome Research. 24 (6), 1020-1027 (2014).
- Schumann, K., Lin, S., et al. Generation of knock-in primary human T cells using Cas9 ribonucleoproteins. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10437-10442 (2015).
- Lee, J. -S., Kwak, S. -J., et al. RNA-guided genome editing in Drosophila with the purified Cas9 protein. G3: Genes, Genomes, Genetics (Bethesda, MD). 4 (7), 1291-1295 (2014).
- Sung, Y. H., Kim, J. M., et al. Highly efficient gene knockout in mice and zebrafish with RNA-guided endonucleases. Genome Research. 24 (1), 125-131 (2014).
- Menoret, S., De Cian, A., et al. Homology-directed repair in rodent zygotes using Cas9 and TALEN engineered proteins. Scientific Reports. 5, 14410 (2015).
- Woo, J. W., Kim, J., et al. DNA-free genome editing in plants with preassembled CRISPR-Cas9 ribonucleoproteins. Nature Biotechnology. 33 (11), 1162-1164 (2015).
- Malnoy, M., Viola, R., et al. DNA-free genetically edited grapevine and apple protoplast using CRISPR/Cas9 ribonucleoproteins. Frontiers in Plant Science. 7, 1904 (2016).
- Svitashev, S., Schwartz, C., Lenderts, B., Young, J. K., Mark Cigan, A. Genome editing in maize directed by CRISPR-Cas9 ribonucleoprotein complexes. Nature Communications. 7, 13274 (2016).
- Liang, Z., Chen, K., et al. Efficient DNA-free genome editing of bread wheat using CRISPR/Cas9 ribonucleoprotein complexes. Nature Communications. 8, 14261 (2017).
- Shin, S. -E., Lim, J. -M., et al. CRISPR/Cas9-induced knockout and knock-in mutations in Chlamydomonas reinhardtii. Scientific Reports. 6, 27810 (2016).
- Pohl, C., Kiel, J. A. K. W., Driessen, A. J. M., Bovenberg, R. A. L., Nygård, Y. CRISPR/Cas9 based genome editing of Penicillium chrysogenum. ACS Synthetic Biology. 5 (7), 754-764 (2016).
- Grahl, N., Demers, E. G., Crocker, A. W., Hogan, D. A. Use of RNA-protein complexes for genome editing in non-albicans Candida species. mSphere. 2 (3), (2017).
- Rivera-Torres, N., Kmiec, E. B. A standard methodology to examine on-site mutagenicity as a function of point mutation repair catalyzed by CRISPR/Cas9 and ssODN in human cells. Journal of Visualized Experiments. (126), (2017).
- Nandal, A., Mallon, B., Telugu, B. P. Efficient generation and editing of feeder-free IPSCs from human pancreatic cells using the CRISPR-Cas9 system. Journal of Visualized Experiments. (129), (2017).
- Mohr, S. E., Hu, Y., Ewen-Campen, B., Housden, B. E., Viswanatha, R., Perrimon, N. CRISPR guide RNA design for research applications. The FEBS Journal. 283 (17), 3232-3238 (2016).
- Bauer, D. E., Canver, M. C., Orkin, S. H. Generation of genomic deletions in mammalian cell lines via CRISPR/Cas9. Journal of Visualized Experiments. (95), e52118 (2015).
- Hsu, P. D., Scott, D. A., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 122-123 (2014).
- Moreno-Mateos, M. A., Vejnar, C. E., et al. CRISPRscan: designing highly efficient sgRNAs for CRISPR-Cas9 targeting in vivo. Nature Methods. 12 (10), 982-988 (2015).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44, 272-276 (2016).
- Haeussler, M., Schönig, K., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148 (2016).
- Lo, T. -W., Pickle, C. S., et al. Precise and heritable genome editing in evolutionarily diverse nematodes using TALENs and CRISPR/Cas9 to engineer insertions and deletions. Genetics. 195 (2), 331-348 (2013).
- Bassett, A., Liu, J. -L. CRISPR/Cas9 mediated genome engineering in Drosophila. Methods. 69 (2), 128-136 (2014).
- Prior, H., Jawad, A. K., MacConnachie, L., Beg, A. A. Highly efficient, rapid and co-CRISPR independent genome editing in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. , Bethesda, MD. (2017).
- Hirsh, A. Cas9 expression and purification protocol. protocols.io. , (2017).
- DeWitt, M. A., Wong, J. In vitro transcription of guide RNAs. protocols.io. , (2017).
- Yang, L., Guell, M., et al. Optimization of scarless human stem cell genome editing. Nucleic Acids Research. 41 (19), 9049-9061 (2013).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnology. 34 (3), 339-344 (2016).
- Paix, A., Folkmann, A., Seydoux, G. Precision genome editing using CRISPR-Cas9 and linear repair templates in C. elegans. Methods. 121-122, 86-93 (2017).
- Mello, C., Fire, A. DNA transformation. Methods in Cell Biology. 48, 451-482 (1995).
- Sutter Pipette Cookbook. , Available from: https://www.sutter.com/PDFs/pipette_cookbook.pdf (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook: the online review of C. elegans biology. , (2006).
- Evans, T. C. Transformation and microinjection. WormBook: the online review of C. elegans biology. , (2006).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. Journal of Visualized Experiments. (18), (2008).
- Kim, H., Ishidate, T., et al. A co-CRISPR strategy for efficient genome editing in Caenorhabditis elegans. Genetics. 197 (4), 1069-1080 (2014).
- Arribere, J. A., Bell, R. T., Fu, B. X. H., Artiles, K. L., Hartman, P. S., Fire, A. Z. Efficient marker-free recovery of custom genetic modifications with CRISPR/Cas9 in Caenorhabditis elegans. Genetics. 198 (3), 837-846 (2014).
- Ward, J. D. Rapid and precise engineering of the Caenorhabditis elegans genome with lethal mutation co-conversion and inactivation of NHEJ repair. Genetics. 199 (2), 363-377 (2015).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Wood, A. J., Lo, T. -W., et al. Targeted genome editing across species using ZFNs and TALENs. Science. 333 (6040), 307 (2011).
- Friedland, A. E., Tzur, Y. B., Esvelt, K. M., Colaiácovo, M. P., Church, G. M., Calarco, J. A. Heritable genome editing in C. elegans via a CRISPR-Cas9 system. Nature Methods. 10 (8), 741-743 (2013).
- Dickinson, D. J., Ward, J. D., Reiner, D. J., Goldstein, B. Engineering the Caenorhabditis elegans genome using Cas9-triggered homologous recombination. Nature Methods. 10 (10), 1028-1034 (2013).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. Injection of Parhyale hawaiensis blastomeres with fluorescently labeled tracers. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Gerberding, M., Browne, W. E., Patel, N. H. Cell lineage analysis of the amphipod crustacean Parhyale hawaiensis reveals an early restriction of cell fates. Development (Cambridge, England). 129 (24), 5789-5801 (2002).
- Browne, W. E., Price, A. L., Gerberding, M., Patel, N. H. Stages of embryonic development in the amphipod crustacean, Parhyale hawaiensis. Genesis. 42 (3), New York, NY. 124-149 (2005).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. Fixation and dissection of Parhyale hawaiensis embryos. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. In situ hybridization of labeled RNA probes to fixed Parhyale hawaiensis embryos. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. Antibody staining of Parhyale hawaiensis embryos. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Kontarakis, Z., Pavlopoulos, A. Transgenesis in non-model organisms: the case of Parhyale. Methods in Molecular Biology. 1196, Clifton, NJ. 145-181 (2014).
- Kim, H. J., Lee, H. J., Kim, H., Cho, S. W., Kim, J. -S. Targeted genome editing in human cells with zinc finger nucleases constructed via modular assembly. Genome Research. 19 (7), 1279-1288 (2009).
- Qiu, P., Shandilya, H., D'Alessio, J. M., O'Connor, K., Durocher, J., Gerard, G. F. Mutation detection using Surveyor nuclease. BioTechniques. 36 (4), 702-707 (2004).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Tsai, S. Q., Zheng, Z., et al. GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nature Biotechnology. 33 (2), 187-197 (2015).
- Frock, R. L., Hu, J., Meyers, R. M., Ho, Y. -J., Kii, E., Alt, F. W. Genome-wide detection of DNA double-stranded breaks induced by engineered nucleases. Nature Biotechnology. 33 (2), 179-186 (2015).
- Smith, C., Gore, A., et al. Whole-genome sequencing analysis reveals high specificity of CRISPR/Cas9 and TALEN-based genome editing in human iPSCs. Cell Stem Cell. 15 (1), 12-13 (2014).
- Veres, A., Gosis, B. S., et al. Low incidence of off-target mutations in individual CRISPR-Cas9 and TALEN targeted human stem cell clones detected by whole-genome sequencing. Cell Stem Cell. 15 (1), 27-30 (2014).
- Kim, D., Bae, S., et al. Digenome-seq: genome-wide profiling of CRISPR-Cas9 off-target effects in human cells. Nature Methods. 12 (3), 237-243 (2015).
- Hendel, A., Fine, E. J., Bao, G., Porteus, M. H. Quantifying on- and off-target genome editing. Trends in Biotechnology. 33 (2), 132-140 (2015).
- O'Geen, H., Yu, A. S., Segal, D. J. How specific is CRISPR/Cas9 really. Current Opinion in Chemical Biology. 29, 72-78 (2015).
- Tsai, S. Q., Joung, J. K. Defining and improving the genome-wide specificities of CRISPR-Cas9 nucleases. Nature Reviews Genetics. 17 (5), 300-312 (2016).
- Hoban, M. D., Cost, G. J., et al. Correction of the sickle cell disease mutation in human hematopoietic stem/progenitor cells. Blood. 125 (17), 2597-2604 (2015).
- Simeonov, D. R., Gowen, B. G., et al. Discovery of stimulation-responsive immune enhancers with CRISPR activation. Nature. , (2017).
- Hultquist, J. F., Schumann, K., et al. A Cas9 ribonucleoprotein platform for functional genetic studies of HIV-host interactions in primary human T cells. Cell Reports. 17 (5), 1438-1452 (2016).
- Paix, A., Wang, Y., et al. Scalable and versatile genome editing using linear DNAs with microhomology to Cas9 sites in Caenorhabditis elegans. Genetics. 198 (4), 1347-1356 (2014).
- Lee, K., Mackley, V. A., et al. Synthetically modified guide RNA and donor DNA are a versatile platform for CRISPR-Cas9 engineering. eLife. 6, (2017).
- Minkenberg, B., Wheatley, M., Yang, Y. CRISPR/Cas9-enabled multiplex genome editing and its application. Progress in Molecular Biology and Translational Science. 149, 111-132 (2017).
- Doench, J. G., Fusi, N., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature Biotechnology. 34 (2), 184-191 (2016).
- Doench, J. G., Hartenian, E., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. , 1-8 (2014).
- Liu, H., Wei, Z., Dominguez, A., Li, Y., Wang, X., Qi, L. S. CRISPR-ERA: a comprehensive design tool for CRISPR-mediated gene editing, repression and activation. Bioinformatics (Oxford, England). 31 (22), 3676-3678 (2015).
- Wu, X., Scott, D. A., et al. Genome-wide binding of the CRISPR endonuclease Cas9 in mammalian cells. Nature Biotechnology. 32 (7), 670-676 (2014).
- Bogenhagen, D. F., Brown, D. D. Nucleotide sequences in Xenopus 5S DNA required for transcription termination. Cell. 24 (1), 261-270 (1981).
- Cozzarelli, N. R., Gerrard, S. P., Schlissel, M., Brown, D. D., Bogenhagen, D. F. Purified RNA polymerase III accurately and efficiently terminates transcription of 5S RNA genes. Cell. 34 (3), 829-835 (1983).
- Chen, B., Gilbert, L. A., et al. Dynamic imaging of genomic loci in living human cells by an optimized CRISPR/Cas system. Cell. 155 (7), 1479-1491 (2013).
- Gagnon, J. A., Valen, E., et al. Efficient mutagenesis by Cas9 protein-mediated oligonucleotide insertion and large-scale assessment of single-guide RNAs. PLoS ONE. 9 (5), 98186 (2014).
- Ren, X., Yang, Z., et al. Enhanced specificity and efficiency of the CRISPR/Cas9 system with optimized sgRNA parameters in Drosophila. Cell Reports. 9 (3), 1151-1162 (2014).
- Ran, F. A., Hsu, P. D., Wright, J., Agarwala, V., Scott, D. A., Zhang, F. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Serano, J. M., Martin, A., et al. Comprehensive analysis of Hox gene expression in the amphipod crustacean Parhyale hawaiensis. Developmental Biology. 409 (1), 297-309 (2016).
- Sternberg, S. H., Redding, S., Jinek, M., Greene, E. C., Doudna, J. A. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature. , 1-17 (2014).
- Lee, K., Conboy, M., et al. Nanoparticle delivery of Cas9 ribonucleoprotein and donor DNA in vivo induces homology-directed DNA repair. Nature Biomedical Engineering. 1 (11), 889-901 (2017).



