Summary
ラット網膜血管ペリサイト、すなわち、低温セクション、全体-マウント、および血管ネットワークの低張性分離の免疫組織化学的可視化のための 3 つの異なったティッシュ準備テクニックを紹介します。
Abstract
網膜血管は目の多くの疾患で重要な役割を果たします。免疫組織化学的染色技術網膜血管と血管ペリサイト眼科研究の中心であります。微小血管を可視化する適切な方法を選ぶことが大切です。網膜血管周皮細胞免疫組織化学的染色クライオ セクション、全体-マウント、および血小板由来増殖因子受容体 β (PDGFRβ) と 2 (NG2) 神経・ グリア抗原抗体を用いた分離の低張性の血管について述べる。これは利点と網膜の微小血管の可視化の 3 つのティッシュの準備のそれぞれの欠点を強調する私たちことができます。低温セクションすべての網膜の層の transsectional 可視化がだけいくつか時折横のカット、血管を含みます。全体マウント全体の網膜血管の概要を説明しますが、血管の可視化は面倒なことができます。低張性の分離は、神経細胞の除去による全体の網膜血管を可視化するメソッドを提供しますが、これは非常に壊れやすい組織になります。
Introduction
網膜の血管は、これらの細胞は、血管系の整合性に大きな役割を果たす多くの研究所の焦点です。糖尿病網膜症1、虚血2緑内障3など病態ペリサイトの関数を含む血管の特徴であります。ペリサイトは内側の網膜毛細血管叢で発見されます。毛細血管叢の 2 つの層に内部の網膜を供給する網膜中心動脈の枝.内側の血管床が神経節細胞と内部の核層の間に位置しています。深い層はより濃厚で複雑と内側と外側核層4,5間ローカライズされます。さらに、網膜の一部には、放射状の脈絡毛細血管と呼ばれる 3 番目のネットワークも含まれています。これらの長い、そして稀に神経線維間でうそをつくストレート毛細血管が別の 1 つまたは他の 2 つの叢6と吻合します。毛細血管の壁内ペリサイトは基底膜に埋め込まれているし、血管内皮細胞の abluminal 側のラインします。
これまで、他の血管の細胞と区別することができますこれらのペリサイトのユニークな生物学的マーカーはありません。血小板由来増殖因子受容体 β (PDGFRβ) 神経・ グリア抗原 2 (NG2) は、また他の血管細胞ですが血管に存在する一般的に使用されるマーカー。ペリサイトの同定は、形態および蛋白質の表現7で異なる周皮細胞サブセットの存在によってさらに複雑です。現在、最高の識別は、蛋白質のマーカーの組み合わせと血管壁の周皮細胞の特徴的な位置に依存します。免疫 PDGFRβ/NG2 ラット網膜血管ペリサイト、すなわち、低温セクション、全体-マウント、および血管ネットワークの低張性分離の汚損のための 3 つの異なる組織準備テクニックをここで紹介します。
低温セクション、網膜と強膜は視神経を通ってカットされます。ニューロンのすべて層状構造の可視化が可能になります。網膜の異なる 10 層ヘマトキシリン ・ エオシンや蛍光核 4', 6-diamidino-2-phenylindole (DAPI)8などの汚れを視覚化できる核や軸索・樹状突起の構造を交換として明らかにされます。層9と代謝の要件とは異なる特定の層の厚さまたは合計の不在を決定するメソッドを提供します (例えば、網膜神経節細胞の損失は網膜虚血10、認刻極印の 1 つ 11)。横を通り過ぎるそれぞれ網膜層12,13内毛細血管叢を個別に研究することが可能となって、網膜血管は明らか。
従来より、網膜血管ネットワークの調査は、網膜全体のマウントで実行されます。このティッシュの準備と網膜はカットして花状の構造として平ら。メソッドは、全体的なアーキテクチャの網膜血管を強調表示することができます比較的高速な組織の準備法としたがってしばしばマウス網膜血管新生の調査で適用。全体に取り付けられた網膜の血管の正常な可視化は発展途上の新生児マウスとラット網膜14,15,16,17,18,で報告も19. これらの研究は新生児網膜14に比べて大人に大きいキャピラリー自由な区域でより多くの定義 pericytic 活動を明らかにします。
可視化する別の方法は、低張性分離後網膜血管です。この組織作製手法で網膜血管と神経細胞の解放されて毛細血管。孤立した網膜血管ネットワークの二次元画像のこのタイプは通常網膜のトリプシン消化20後に実行、糖尿病性網膜症の周皮細胞の損失、毛細血管などの血管異常を評価するために使用変性20,21,22。低張性分離法は、彼らは、RT-PCR および西部のしみが付く23,24,25で行われている網膜血管遺伝子やタンパク質規制対応の調査を提供しています。我々 はここで微小血管を調べるトリプシンの消化力の代替として低張性孤立した網膜血管系の浮動免疫組織化学染色プロトコルを提供します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
プロトコルは、最適化され、男性大人の白子のラットで示されます。すべての実験手順で動物は ARVO ステートメントで眼科と視覚に関する研究における動物の使用のための規則に従って扱われました。動物を二酸化炭素とそれに続く頚部転位によって安楽死させ。
1. ラット網膜のティッシュの準備
-
低温セクション
- メスのラットの眼瞼の後部と前部 ~0.5 cm のスリットを作る。
- オプション: ジアテルミー バーナーを使用して、埋め込み中に一貫した方式で目をオリエンテーションと視神経を通って垂直クライオスタット切片では、内部の角度で目をマークします。
- 目を鉗子でつかんで慎重に周囲の組織を公開する側に傾けてください。結合と筋肉組織の解剖はさみでカットすることによって眼を摘出します。
注意: 目も強く引っ張らない視神経に過度の圧力は網膜剥離を引き起こす可能性があります。 - リン酸緩衝生理食塩水 (PBS) メスの先端で光の圧力を適用することによって角膜の角膜輪部に最初の穴を作る前に安定させるために、4% のホルムアルデヒドで簡潔に目を入れ。
- 顕微鏡、解剖ハサミ鉗子で 4% のホルムアルデヒドを PBS で 2-4 時間で水没する前にレンズを削除し角膜角膜の縁に沿ってカットします。
- デニスソレンセンの 10% ショ糖と 25% ショ糖リン酸バッファーに順番にすすぐ。
- 鶏の卵の白身からブタ皮膚と 30% アルブミンから 3% のゼラチンで調製した Yazulla 培地に埋め込みます。
注: プロトコルを一時停止できるここ組織預かり-20 ° C で
- メスのラットの眼瞼の後部と前部 ~0.5 cm のスリットを作る。
-
全体マウント
- メスのラットの眼瞼の後部と前部 ~0.5 cm スリットを作る。
- 目を鉗子でつかんで慎重に周囲の組織を公開する側に傾けてください。結合と筋肉組織の解剖はさみでカットすることによって眼を摘出します。
注意: 目も強く引っ張らない視神経に過度の圧力は網膜剥離を引き起こす可能性があります。 - メスの先端で光の圧力を適用することによって角膜の角膜輪部に最初の穴を作る前に安定させるために PBS で 4% ホルムアルデヒドに簡単に目を置きます。
- 顕微鏡、解剖ハサミ鉗子で角膜を外し、レンズを角膜の縁に沿ってカットします。
- 主要なテアリングを回避する小さな開口部の動きを使用して鉗子に向かって視神経網膜色素上皮細胞から網膜を区切ります。
- 解剖はさみで無料の視神経、網膜、視神経の頭に向かって網膜周辺部から数ミリメートルの長さの 4 つのスリットを作る。
- スライド ガラスに網膜を広がり、5-10 分間乾燥させます。
- 網膜上にホルムアルデヒドを滴下して 20-30 分のための 4% のホルムアルデヒドを修正します。
注意: は、ガラスから切り離すことがありますそれと網膜に直接適用されません。 - PBS で洗い。最適な結果を得る、洗浄直後後の免疫染色。
-
低張性の分離
- メスのラットの眼瞼の後部と前部 ~0.5 cm スリットを作る。
- 目を鉗子でつかんで慎重に周囲の組織を公開する側に傾けてください。結合と筋肉組織の解剖はさみでカットすることによって眼を摘出します。
注意: 目も強く引っ張らない視神経に過度の圧力は網膜剥離を引き起こす可能性があります。 - メスの先端で光の圧力を適用することによって角膜の角膜輪部に最初の穴を作る。
- 顕微鏡、解剖ハサミ鉗子で角膜を外し、レンズを角膜の縁に沿ってカットします。
- 主要なテアリングを回避する小さな開口部の動きを使用して鉗子で視神経の頭に向かって網膜色素上皮細胞から網膜を区切ります。
- 解剖はさみで視神経網膜を無料、24 ウェル プレートの脱イオン水 1 mL に網膜を配置、200 rpm 室温で 1 時間 1.5 mm 振動軌道で振る。
注: 以下、網膜が表示されます小さいエッジで定義されています。 - 網膜の血管から分離細胞の残骸を切り離して考えると、室温で 30 分間別振る 200 U DNAse 1 を追加します。
注: 破片は井戸の形成が開始可能性があります。 - 最低でも 3 回神経細胞の残骸を削除する 150-300 rpm で振とうしながら 5 分間脱イオン水ですすいでください。網膜は神経細胞残屑の除去を示すそれぞれのリンスと透明になります。
- 明らかに透けて見える孤立した網膜血管を見る 24 ウェル プレートに見て暗い背景を使用します。
- (省略可能): 血管系が表示されない場合神経層 (半透明) の無料この時点で追加するか、すすぎやすく、振動速度を増加または血管に液体を吸引、ピペットを使用します。
注意: 血管系に損傷を与える可能性がありますオプションの手順のいずれか。
- 室温で PBS で 4% パラホルムアルデヒドと PBS で 3 回すすぎの 1 mL の 10 分を修正します。
注: プロトコルを一時停止できるここで 4 ° C で組織預かり
2. 免疫組織化学
-
低温セクションの染色
- 視神経を通って垂直断面としてゼラチン埋め込まれた網膜の 10 μ m 低温セクションを切り取り、スライド ガラスと乾燥させます (最低 1 時間) に低温セクション。
- PBS で 0.25% のガラス スライドを水没トリトン X-100 (PBS-T) 15 分。
- PDGFRβ 1: 100、1: 500 の NG2 一次抗体 PBS T + 低温セクションに 1 %bsa で希釈した点滴し、4 ° C で培養室で一晩インキュベートします。
- 15 分 PBS T に 2 回スライド ガラスが水没し、1: 100 抗マウス Alexa Fluor 594 リンクと 1: 100 反うさぎ FITC リンク二次抗体と低温セクションに 3% BSA PBS T で希釈したを滴下します。
- スライド ガラスの暗闇の中で室温で 1 時間インキュベートします。
- PBS T 2 × 15 分のスライド ガラスを洗います。
注: オプション: ダブル、トリプル蛍光染色、連続染色可能 2, 3 回それぞれ 2.1.6 2.1.3 から手順を繰り返すことによって。 - 取付中含む DAPI と観察フェージング染色の低温電子顕微鏡セクションをマウントします。
-
全取り付ける染色
- 全体マウントに PBS T を滴下し、15 分間室温でインキュベートします。
- 離れて注ぎ、PDGFRβ 1: 100、1: 500 の NG2 一次抗体 PBS T + 1 %bsa で希釈した点滴し、4 ° C で湿った部屋で一晩インキュベートします。
- 注ぎ、PBS-T 2 × 15 分のスライド ガラスを洗うことで点滴します。
- 注ぐし、1: 100 反うさぎ Cy2 と 1: 100 抗マウス Cy3 リンク二次抗体と暗闇の中で室温湿室に 1 h をインキュベートする 3% BSA PBS T で希釈した上に滴下します。
- 注ぎ、暗闇の中で 2 x 15 分で洗浄する PBS T 上に滴下します。
注: オプション: ダブル、トリプル蛍光染色、連続染色が実行できるそれぞれ 2, 3 回 2.2.2 から 2.2.5 までの手順を繰り返します。 - 取付中含む DAPI と観察フェージング染色全体マウントをマウントします。
-
低張性の隔離された血管の染色
- 1 h で 100 rpm と PBS で希釈した 10% ロバ血清 500 μ L/ウェルと部屋の温度振動低張性分離血管をブロックします。
- 室温で一晩インキュベート、600 μ L/ウェル PDGFRβ 1: 100、1: 500 の NG2 一次抗体 PBS で 10% ロバ血清希釈の 100 rpm で振る。
- リンス、網膜ネットワーク PBS で 5 分の x 3 と 1: 100 抗マウス Alexa Fluor 594 リンクと 1: 100 反うさぎ FITC リンク二次抗体 PBS 揺れで 100 rpm と暗闇の中で 1 時間室温で 10% ロバ血清の希釈で孵化させなさい。
- PBS T 5 分リンス、暗闇の中で PBS T で 3 x 5 分すすぎに続いて 15 分 0.2 ng/mL PBS T の DAPI で孵化させなさい。
- プラスチックのパスツール ピペットの先端を切り取って PBS T で湿らす 4 よくガラス チェンバー スライドに網膜神経回路網を転送する使用します。
注: 湿潤のステップは、パスツール ピペットの内側に付着する網膜血管を避けるために重要です。 - 網膜の血管を展開します。これは昆布に血管を引き起こす可能性がある、鉗子で網膜の血管を触れないでください。
注: 展開することができるチェンバー スライド、前後の傾きによってまたは網膜の血管に液体の滴吸引します。 - 井戸からメディアを削除します。液体の表面張力は、スライドの下部に血管を平坦化されます。
- チェンバー スライドから井戸のプラスチックを削除する前に、顕微鏡下で正しい展開を確認します。
- 耐フェード取付中観察とステンド グラスの血管をマウントします。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
成功したプロトコルは、微小血管を可視化する 3 つの異なる網膜準備を提供します。これらの各メソッドは、PDGFRβ と NG2 陽性の共局在と血管内皮の区分の周りを包むペリサイトの固有の位置を使用します。
低温セクション、DAPI ラベル核と内側の蛍光の密度によって神経細胞の層を識別できるし、深い毛細血管叢が含まれて PDGFRβ、NG2 陽性 (図 1) を表示するペリサイトにはです。(図 1の矢印) の血管の周囲に円形または馬蹄形の陽性として血管壁内のペリサイトのユニークな位置を見ることができるまたは時折縦カット血管 (図 1の矢印)。
成体ラットのホール マウント標本で微小血管の正常な可視化は、14,20挑戦できます。全体載アダルト網膜 PDGFRβ 陽性結果のみ非常に弱い信号 (表示されていません)。NG2 染色 abluminal ペリサイト (図 2) に強い染色性と内部の血管網を概説しました。
ラット網膜の血管ネットワークの概要を得るためには、低張性ラット網膜血管ネットワークの免疫組織化学は、全体マウントする代替メソッドを提供します。正常に実行されると、この組織の作製手法は内部と深い毛細血管叢を含む全体の網膜血管の概要を示します。Pericytic マーカーによる免疫染色結果特定の血管細胞 (図 3) で強烈な応答と NG2 陽性を示す全体の微小血管のネットワーク。これらの細胞のいくつかはまた PDGFRβ 免疫反応性 (図 3) を表示します。
組織の慎重な展開は、網膜血管のよい概観を得ることが重要です。不十分な展開は困難である (図 4) をイメージング蛍光になるフォーカスの複数のレイヤーに配置されている血管で起因できます。展開は、穏やかな揺れ、チェンバー スライド前後を傾斜または網膜の血管に液体の滴を吸引によって促進することができます。それは、網膜毛細血管叢の解剖学は血管のベッドのいくつかのオーバーレイになります注意してください。したがって、スライド グラス上に展開時より深い毛細血管叢から内側を区別する問題です。
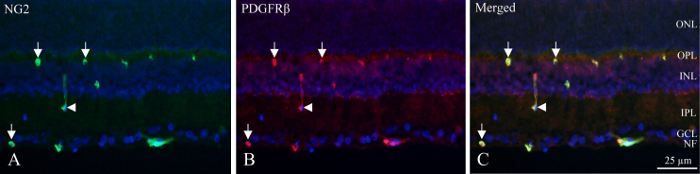
図 1: 低温部内側ラット網膜の周皮細胞染色をダブルクリックします。(A) NG2 (緑) の免疫組織化学は網膜の内側の部分の内で血管を明らかにします。矢印は、血管内の円形、馬蹄形の陽性を示します。矢印は縦カット容器に指摘します。(B) PDGFRβ (レッド) 免疫組織化学は、NG2 陽性のような反応を表示します。矢印と矢印 NG2 染色に関しては同じ構造体をポイントします。(C) 画像は、3 つの異なるフィルターを重ね (青) NG2、PDGFRβ、DAPI の結合を示しています。2 つの抗体は共局在を明らかにした (赤 + 緑 = 黄色)。NF: 神経線維層、GCL: 神経節細胞層、IPL: INL 網状層内部: 内部の核層、OPL: 外網状層、ONL: 核外層。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 全体載ラット網膜の周皮細胞染色します。(赤) NG2 陽性、染色 abluminal ペリサイト強烈な表在血管ネットワークに沿って表示されます。画像は、(青) 結合の NG2 および DAPI を見せます。神経細胞は NG2 染色血管間核を DAPI 青として表示されます。PDGFRβ 免疫全体載アダルト網膜非常に弱い信号でのみ、この数字には含まれません。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 低張性ラット網膜血管周皮細胞染色をダブルクリックします。(A). イメージ低張性ラット網膜血管網免疫組織化学的 NG2 (緑) と PDGFRβ ステンド グラス (赤) を示しています。完全なネットワークは、NG2 陽性を示した。ただし、PDGFRβ の免疫活性は細胞細胞体で発見されました。A の挿入 (青) DAPI 染色網膜血管ネットワークの概要であります。(B) イメージは、別の場所で高倍率 (A) として同じ標本を示しています。周皮細胞の免疫活性を示す血管ネットワークの細胞細胞体の PDGFRβ 染色を表示だけは明らかです。B の挿入、血管の高倍率を示す画像 NG2 (緑)、PDGFRβ (赤) 染色 DAPI を吸収合併します。DAPI 染色 NG2 および PDGFRβ を含む 3 つペリサイト (PDGFRβ プラス) および 2 つの不審船壁細胞を明らかにします。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 不十分な展開低張性孤立した網膜血管系の例。低張性の隔離された血管の慎重な展開は、積層されて血管につながる不十分な展開として重要です。写真は、別のフォーカス層が同じサイトで網膜血管の DAPI 染色を表示.(A)、DAPI 染色性細胞 1 つの焦点の層は、網膜血管の約 25 μ m の太い血管を表示します。フォーカス 2 層目 (B) の DAPI 染色性細胞は、(A) に表示される大きな血管に積み上げられている同じサイトに細い分岐毛細血管を解明します。この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
微小血管網膜血管の研究に適用できる 3 つの網膜の調製技術を提案します。以下、それぞれの方法を比較し、プロトコルで重要な手順を強調表示。
網膜は矢状セクションのカットを用いて、電子顕微鏡で、したがって、同じ網膜から多数の標本を得ることが可能です。このメソッドから生じる数字のセクションでは、抗体の特異性と滴定試験動物の不必要な犠牲を防ぐための理想的な選択。準備作業は、良い結果のために決定的です。目を引くではなく目の周りのすべての筋肉をカットする目を解剖しながら、それは重要です。力が使用される場合、網膜剥離の危険性があります。アイカップが薄いので、あまりにも長い 1 つ修正しないでください。4% のパラホルムアルデヒドを PBS で 2-4 時間で浸漬は組織を修正します。もはや固定、興味の抗原を破壊の危険性があります。最高の可能な immunostainings を生成するためにガラスに対して可能な限り平坦にする各セクションにとって重要です。セクションにはのみ、いくつか時折横のカット、血管が含まれて、ためこの組織の準備方法は、血管の断続的な可視化のみを提供しています。したがって、このメソッドは、全体的な血管構築のペリサイトの定量的研究に適してではありません。
全体的な血管は、血管系の概要を提供する全体取り付け後汚すことができます。この手法をマスターすると、比較的小さな負荷を必要とする高速ティッシュ準備手順をできます。ただし、特に注意すべきいくつかのポイントがあります。網膜は壊れやすい、注意してそれらを処理し、リッピングやカットを避けるために重要です。さらに、網膜を慎重に処理しながらひだを避けるために重要な鍵だし、後に免疫組織化学的イメージングをマウント実行時に他のクレバスに影響を与えます。マウントされた網膜が 250-300 μ m の厚さと神経層の抗体の浸透は、問題が発生する可能性があります。周皮細胞の可視化に関して全体マウント プロトコルの NG2 染色だけと達成できる Cy3 リンクの二次抗体と全体載アダルト網膜 PDGFRβ 陽性結果このような非常に弱い信号で示されていないが図。したがって、全取り付ける染色法の有用性は強く成功染色次第で主に使用される特定の第一次および二次抗体によって妨げられます。ラット網膜の血管叢を可視化するためのプロトコルを最適化するためにそれ以上の提案は、培養による一次抗体インキュベーション温度26を変更する時間の長い期間。
全体マウントの厚さによる網膜の毛細血管を含む内部の網膜と偶発的な実装を避けるために視神経の頭に向かって網膜周辺部から 4 つの切開を行った後の方向を認識することが重要です。ダウン向き。それでも、深い血管叢と、ペリサイトの詳細な可視化はこのメソッド14,20と面倒なことができます。大人の網膜の全取り付ける染色は難しい深い血管叢で、網膜の無血管であるいくつかの部分に表示される可能性があります。ペリサイト ライニング、したがって、このメソッドを表在性毛細血管の血管と血管の断片化の概要のみが偽否定的な結果につながることができます提供しています全体載アダルト網膜の免疫組織化学的染色、ラット網膜血管の可視化。
トリプシンの消化力は隔離と20網膜血管の可視化のためのゴールド スタンダード技術は長く考慮されました。低張性分離全体の複雑な立体血管ネットワークの可視化のための別の方法を提供し、同じの多くを処理することは困難である非常に壊れやすい組織での作業の課題に直面します。ために 2 つの方法の間の網膜血管製品の類似性、低張性の分離を避けることによって主要な涙や慎重な取り扱いを防ぐためにトリプシン消化20慎重な郭清を含むと同じ課題の多くに直面します。ピペッティングし、鉗子で触れます。方法の重要な違いは、固定です。トリプシンの消化力は通常固定後に行われる、いくつかの年20の固定にされている保存状態の網膜に正常に適用することができます。低張性の分離は固定の前に実行でき、文学23,24,25で説明したとおりさまざまな他のアッセイでの実装です。トリプシンの消化力は、低張性の分離は時間内に完了できるに対し、2 日間20以上実行されます。さらに、低張性の隔離のプロトコル オーバー消化のリスクは含まれません、周皮細胞認識、例えばPDGFRβ と NG2、後続のために好ましいこのメソッドを作るに必要な酵素膜マーカーの胸の谷間免疫組織化学的微小染色。
最後に、この原稿の即時の範囲から網膜27齧歯動物から大規模なそのまま血管プレキシを隔離するためのより少なく広く知られているが、非常に便利な技術があります。網膜は、特殊なガラス容器、coverslip で配置されます。カバーガラス、完全に生きているを作成する coverslip に血管装着の除去時に印刷 (細胞の ≈ 98%) 組織。この方法の最大の利点は、船と免疫染色の後固定の生理学研究できます。メソッドの明白な限界は、網膜フラット マウントとして全体の血管ネットワークの可視化/分離は提供されません低張性の準備を行うことです。それでも、この方法の27のアプリケーションによってペリサイトを視覚化できます。
ここで説明した 3 つの組織調製技術は各メソッドに利点と欠点微小血管の可視化が装備されているという意味で補完されます。各メソッドの電位と弱点の評価は、特定の病理学の条件の下で微小血管を調査するための最適な方法を選択することが重要です。実証済みの方法は、周皮細胞マーカーのみならず微小血管の構造の可視化を一般的に染色に拡張できます。最終的には、問題の研究仮説に基づく適切な視覚化の方法を選択する個々 の研究者です。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
デンマーク ルンドベック財団によって資金が供給された研究。
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



