Summary
쥐 망막 microvascular pericytes, 즉, cryo 섹션, 전체 마운트 및 혈관 네트워크의 침투성 절연의 immunohistochemical 시각화를 위한 3 개의 다른 조직 준비 기술을 설명합니다.
Abstract
망막 pericytes 눈의 많은 질병에 중요 한 역할을 한다. 얼룩 기법 및 microvascular 망막 혈관의 Immunohistochemical pericytes는 안 과학 연구의 중심. Microvascular pericytes를 시각화 하는 적절 한 방법을 선택 하는 것이 생명 이다. 곳을 알아내는-섹션, 전체 마운트, 그리고 혈소판 유래 성장 인자 수용 체 β (PDGFRβ)와 신경/glial 원 2 (NG2)에 대 한 항 체를 사용 하 여 소형 고립 된 맥 관 구조에 얼룩 망막 microvascular pericyte immunohistochemical을 설명 합니다. 장점과 망막 microvascular pericytes의 시각화에 대 한 세 가지 조직 준비의 각각의 단점을 강조 하기 위해 수 있습니다. 곳을 알아내는-섹션 모든 망막 층의 transsectional 시각화를 제공 하지만 단지 몇 가끔 가로의 상처는 microvasculature 포함. 전체-마운트 전체 망막 맥 관 구조에 대 한 개요를 제공 하지만 시각화는 microvasculature의 곤란 하실 수 있습니다. 침투성 격리 신경 세포의 제거로 전체 망막 맥 관 구조를 시각화 하는 방법을 제공 하지만이 조직 매우 깨지기 쉬운.
Introduction
이 세포는 맥 관 구조의 무결성에 중요 한 역할으로 망막 pericytes 많은 연구 실험실의 초점입니다. 당뇨병 성 망막 증1, 허 혈2, 녹 내장3 등 병 적인 조건 pericytes의 기능을 포함 하는 혈관 특성이 있다. Pericytes는 내부 망막 모 세관 plexuses에서 발견 된다. 중앙 망막 동맥 내부 망막을 공급 하는 모 세관 plexuses의 2 개의 층으로 분기 한다. 내부 관 침대는 신경 절 세포와 안 핵 층 사이 위치 해 있습니다. 깊은 계층 더 조밀 하 고 복잡 한 이며 내부 및 외부 핵 층4,5사이 지역화 됩니다. 또한, 망막의 일부는 또한 광선 parapapillary 모세 나 세 번째 네트워크를 포함 합니다. 이들은 긴, 신경 섬유 중 고 거의 직선 모 세관 다른 하나 또는 다른 두 plexuses6anastomose. 모 세관 벽에서 pericytes 지하실 멤브레인에 포함 하 고 혈관 내 피 세포의 abluminal 사이드 라인.
이 날짜에, 다른 혈관 세포에서 그들을 차별화 수 있는 이러한 pericytes의 독특한 생물 학적 마커 없는 있다. 혈소판 파생 된 성장 인자 수용 체 β (PDGFRβ)와 신경/glial 원 2 (NG2)는 일반적으로 사용 되 마커는 모두 다른 혈관 세포도 하지만 pericytes에 선물. Pericytes의 더 다양 한 형태 및 단백질 식7에서 pericyte 하위 집합의 존재에 의해 복잡 합니다. 현재, 최고의 식별 마커 단백질의 조합 및 혈관 벽에서 pericyte의 독특한 위치에 의존 합니다. 여기 쥐 망막 microvascular pericytes, 즉, cryo-섹션, 전체 마운트, 당뇨의 및 절연 혈관 네트워크의 immunohistochemical PDGFRβ/NG2 얼룩에 대 한 세 가지 다른 조직 준비 기술 설명 합니다.
곳을 알아내는-섹션, 망막과 공 막 시 신경을 통해 잘립니다. 신경의 모든 계층 구조의 시각화 수 있습니다. 망막의 고유 10 층 등 되며/오신 형광 핵 4', 6-diamidino-2-phenylindole (DAPI)8얼룩으로 구상 될 수 있다 핵 및 axonal/돌기 구조를 교환으로 명백 하다. 레이어9 와 그것은 신진 대사 요구 사항을 다 특정 층의 두께 또는 총 휴무를 결정 하는 방법을 제공 한다 (예를 들어, 망막 신경 절 세포의 손실 이다 망막 허 혈10의 특징 중 하나 11). 맥 관 구조 가로 각각 망막 층12,13내의 모 세관 plexuses를 별도로 공부 하는 게 가능 하 망막을 통해 삭감으로 분명 하다.
더 전통적으로, 망막 맥 관 구조 네트워크의 조사는 망막 전체-마운트에 수행 됩니다. 이 조직 준비, 망막은 잘라내어 꽃 모양의 구조로 결합. 메서드는 전체 아키텍처 망막 맥 관 구조를 강조 표시할 수 있습니다 상대적으로 빠른 조직 준비 기술 이며 따라서 neovascularization murine 망막에서의 조사에 적용 종종. 전체 장착 망막에 microvasculature의 성공적인 시각화 또한 개발 신생아 마우스와 쥐 망막14,15,,1617,18, 에서 보고 19.이 연구는 신생아 망막14에 비해 성인에서 더 큰 모 세관 자유로운 지역으로 더 정의 된 pericytic 활동을 공개.
시각화의 또 다른 방법은 소형 격리 후 망막 microvasculature입니다. 이 조직 준비 기술 망막 혈관과 신경 세포의 해제 되 고 모세 혈관에서 발생 합니다. 격리 망막 혈관 네트워크의 2 차원 이미지의이 유형은 일반적으로 망막 트립 신 소화20 후 수행 하 고 pericyte 손실 및 모 세관을 포함 하 여 당뇨병 성 망막 증의 혈관 이상이 평가 하는 데 사용 변성20,,2122. 침투성 격리 방법 그들은 RT-PCR와 서쪽 더 럽 히23,,2425완료 되었습니다 망막 혈관 유전자와 단백질 규제 응답의 조사를 제공 합니다. 여기 검사 microvascular pericytes 트립 신 소화 하는 대신 소형 고립 된 망막 맥 관 구조의 무료-플 로트 immunohistochemical 얼룩에 대 한 프로토콜을 제공 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
프로토콜 최적화 하 고 성인 남성 알 비 노 쥐에 설명 했다. 모든 실험 절차, 동물 ARVO 문에서 규정 안과 및 비전 연구에 있는 동물의 사용에 대 한 치료 했다. 동물은 이산화탄소와 이후 자 궁 경부 전위에 의해 안락사 되었다.
1. 쥐 망막 조직 준비
-
곳을 알아내는-섹션
- 메스로 쥐 눈 꺼 풀에 후부 및 이전 ~0.5 cm의 가늘고 길게 찢어진 곳을 확인 합니다.
- 선택 사항: 투 열 버너를 사용 하 고 포함 하는 동안 제복 패션에 눈을 찾으시는 시 신경을 통해 수직 cryostat 단면에 대 한 내부 각도에 눈을 표시 합니다.
- 집게와 눈을 신중 하 게 주변 조직이 노출 측면 기울기. 연결 및 근육 조직에 해 부가 위 컷 하 여 눈을 enucleate.
주의: 당기지 마십시오 눈 너무 열심히 시 신경에 과도 한 압력 망막 손상이 발생할 수 있습니다. - 넣어 눈 짧게 4% 포름알데히드에 인산 염 버퍼 식 염 수 (PBS) 메스의 팁과 가벼운 압력을 적용 하 여 각 막 limbus에서 초기 구멍을 만들기 전에 안정.
- 현미경으로 각 막 제거 하 고 2-4 h에 대 한 PBS에 4% 포름알데히드에 잠수 하기 전에 집게를 가진 렌즈를 제거 해 부가 위 각 막 limbus 따라 자릅니다.
- 자당 10%와 25% 자당 Sörensen의 인산 염 버퍼에 순차적으로 헹 구 십시오.
- Yazulla 매체 돼지 피부와 30% 알 부 민 닭고기 달걀 흰색에서에서 3% 젤라틴 준비에 포함 합니다.
참고: 프로토콜 일시 중지할 수 있습니다 여기-20 ° c.에 조직 스토리지
- 메스로 쥐 눈 꺼 풀에 후부 및 이전 ~0.5 cm의 가늘고 길게 찢어진 곳을 확인 합니다.
-
전체-마운트
- 메스로 쥐 눈 꺼 풀에 후부 및 이전 ~0.5 cm 가늘고 길게 찢어진 곳을 확인 합니다.
- 집게와 눈을 신중 하 게 주변 조직이 노출 측면 기울기. 연결 및 근육 조직에 해 부가 위 컷 하 여 눈을 enucleate.
주의: 당기지 마십시오 눈 너무 열심히 시 신경에 과도 한 압력 망막 손상이 발생할 수 있습니다. - 짧게 메스의 팁과 가벼운 압력을 적용 하 여 각 막 limbus에서 초기 구멍을 만들기 전에 안정화를 PBS에서 4% 포름알데히드에 눈을 넣어.
- 현미경으로 각 막 제거 하 고 집게로 렌즈를 제거 해 부가 위 각 막 limbus 따라 자릅니다.
- 망막 시 신경으로 망막 색소 상피에서 집게 주요 찢는 피하기 위해 작은 개방 움직임을 사용 하 여 구분 합니다.
- 해 부가 위 시 신경에서 망막 및 시 신경 머리 쪽으로 망막 주변에서 몇 밀리미터 길이의 4 개의 가늘고 길게 찢어진 곳을 확인 합니다.
- 유리 슬라이드에 망막을 확산 하 고 5-10 분 동안 건조 허용 합니다.
- 포름알데히드는 망막에 떨어지는 여 20-30 분 동안 4% 포름알데히드를 수정 했다.
주의: 유리에서 분리 수 있습니다으로 망막에 직접 적용 되지 않습니다. - PBS와 린스. 최적의 결과 rinsing 후 직접 면역-얼룩
-
침투성 절연
- 메스로 쥐 눈 꺼 풀에 후부 및 이전 ~0.5 cm 가늘고 길게 찢어진 곳을 확인 합니다.
- 집게와 눈을 신중 하 게 주변 조직이 노출 측면 기울기. 연결 및 근육 조직에 해 부가 위 컷 하 여 눈을 enucleate.
주의: 당기지 마십시오 눈 너무 열심히 시 신경에 과도 한 압력 망막 손상이 발생할 수 있습니다. - 메스의 팁과 가벼운 압력을 적용 하 여 각 막 limbus에서 초기 구멍을 확인 합니다.
- 현미경으로 각 막 제거 하 고 집게로 렌즈를 제거 해 부가 위 각 막 limbus 따라 자릅니다.
- 망막 시 신경 머리 쪽으로 망막 색소 상피에서 집게 주요 찢는 피하기 위해 작은 개방 움직임을 사용 하 여 구분 합니다.
- 망막 시 신경에 해 부가 위 무료, 망막 24-잘 접시에 이온된 수 1 mL에 놓고 실 온에서 1 시간에 1.5 m m 진동 궤도와 200 rpm에 흔들.
참고:이 하, 망막 표시 됩니다 덜 가장자리에서 정의 된. - 1 망막 맥 관 구조에서 lysed 세포 파편을 분리 하 여 실 온에서 또 다른 30 분 동안 흔들어 200 U DNAse를 추가 합니다.
참고: 파편 우물에서 폼을 시작할 수 있습니다. - 최소 3 번 신경 세포 파편을 제거 하려면 150-300 rpm에서 떨고와 5 분 동안 이온된 물에에서 린스. 망막 신경 세포 파편의 제거를 나타내는 각 린스 더 투명 하 게 될 것입니다.
- 어두운 백그라운드를 사용 하 여 투명 한 절연된 망막 맥 관 구조를 명확 하 게 볼을 24-잘 접시로 봐야.
- (선택 사항): 진동 속도 맥 관 구조 나타나지 않으면 무료 신경 레이어 (반투명)의 시점에서 더 린스 단계를 추가 하거나, 또는 피펫으로 액체는 맥 관 구조에 발음을 사용 하 여.
주의: 선택적 단계 중 하나는 맥 관 구조를 손상 수 있습니다.
- 실 온에서 PBS에 4 %paraformaldehyde 린스 PBS에 3 번의 1 mL에 10 분을 수정.
참고: 프로토콜 일시 중지할 수 있습니다 여기 4 ° c.에 조직 스토리지
2입니다. Immunohistochemistry
-
곳을 알아내는-섹션의 얼룩
- 10 µ m cryo-섹션 젤라틴 포함 망막 시 신경 통해 수직 단면으로 잘라내어 유리 슬라이드에 게 건조 (최소 1 시간) 곳을 알아내는-섹션을 두고.
- 0.25%와 PBS에서 유리 슬라이드 잠수함 트라이 톤 X-100 (PBS-T) 15 분.
- 1: 100 PDGFRβ, PBS-T + 1% BSA cryo-섹션에 희석 1: 500 NG2 기본 항 체를 drip 하 고 하룻밤 4 ° C에서 보육 실에서 품 어.
- PBS-T 15 분에 2 번 유리 슬라이드 잠수함 그리고 1: 100 반대로 마우스 알 렉 사 Fluor 594 연결 하 고 1: 100 반 토끼 FITC 연결 보조 항 체 PBS-T cryo-섹션에 3 %BSA에서 희석을 똑.
- 유리 슬라이드는 어둠 속에서 실 온에서 1 h를 품 어.
- PBS-T 2 x 15 분에에서 유리 슬라이드를 씻어.
참고: 옵션: 더블, 트리플 immunofluorescent 얼룩이 지기에 대 한 순차적 얼룩 수행할 수 있습니다 2, 3 번 각각 2.1.6 2.1.3에서 절차를 반복 하 여. - 안티-페이딩 마운팅 중간 포함 DAPI는 coverslip로 얼룩진된 곳을 알아내는-섹션을 탑재 합니다.
-
전체-마운트의 얼룩
- PBS-T 전체 마운트에 똑 하 고 15 분 동안 실 온에서 품 어.
- 부 어 하 고 1: 100 PDGFRβ, PBS-T + 1 %BSA 희석 1: 500 NG2 기본 항 체 물방울 4 ° C에서 촉촉한 실에서 밤새 품 어.
- 부 어 하 고 PBS-T를 2 x 15 분에 유리 슬라이드를 씻어에 똑.
- 부 어 하 고 1: 100 반 토끼 Cy2-고 1: 100 반대로 마우스 Cy3 연결 이차 항 체 품 어 어둠 속에서 실 온에서 습 한 약 실에 1 시간에 3 %BSA PBS-T에 희석에 똑.
- 부 어 하 고 어둠 속에서 2 x 15 분에 린스를 PBS-T에 똑.
참고: 옵션: 더블, 트리플 immunofluorescent 얼룩이 지기에 대 한 순차적 얼룩 수행할 수 있습니다 2, 3 번 각각 2.2.5 2.2.2에서 절차를 반복 하 여. - 안티-페이딩 마운팅 중간 포함 DAPI는 coverslip로 얼룩진된 전체 마운트를 탑재 합니다.
-
소형 고립 된 맥 관 구조의 얼룩
- 소형 고립 된 맥 관 구조 100 rpm 및 실내 온도 10% 당나귀 혈 청 PBS에 희석의 500 µ L/잘 떨고와 1 시간을 차단 합니다.
- 하룻밤 실 온에서 품 어와 1: 100 PDGFRβ 및 1: 500 NG2 1 차 항 체에 PBS에 10% 당나귀 혈 청 희석의 600 µ L/잘 100 rpm 동요.
- 행 구 기는 망막 5 분에 대 한 PBS에 3 x 네트워크와 1: 100 반대로 마우스 알 렉 사 Fluor 594 연결 하 고 1: 100 반 토끼 FITC 연결 보조 항 체에 PBS 떨고 100 rpm 및 어둠 속에서 1 시간 실 온에 10% 당나귀 혈 청 희석에 품 어
- 5 분에 대 한 PBS-T에서 헹 구 고 어둠 속에서 PBS-T에서 3 x 5 분 린스 다음 15 분 동안 0.2 ng/mL PBS T에 DAPI에서에서 품 어.
- 플라스틱 파스퇴르 피펫으로의 끝을 잘라, PBS-T와 함께 그것을 축 축 하 고 4-잘 유리 챔버 슬라이드를 망막 네트워크를 전송 하는 데 사용할.
참고: moistening 단계는 파스퇴르 피펫으로의 내부에 집착 하는 망막 맥 관 구조를 방지 해야 합니다. - 망막 맥 관 구조를 전개. 이 엉 킴을 맥 관 구조를 발생할 수 있습니다 집게와 망막 맥 관 구조를 만지지 마십시오.
참고: 전개 할 수 챔버 슬라이드를 앞뒤로 기울이기 또는 망막 맥 관 구조에 액체의 방울 발음. - 우물에서 매체를 제거 합니다. 액체의 표면 장력은 슬라이드의 아래쪽에 맥 관 구조를 평평 것입니다.
- 현미경으로 올바른 전개 챔버 슬라이드에서 우물 플라스틱을 제거 하기 전에 확인 합니다.
- 안티-페이딩 장착 매체와는 coverslip 스테인드 맥 관 구조를 탑재 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
성공적인 프로토콜 microvascular pericytes를 시각화에 대 한 세 가지 다른 망막 준비를 제공 합니다. 이러한 각 메서드 PDGFRβ 및 NG2 immunoreactivity 공동 지역화와 모 세관 내 피 foridentification 주위에 포장 하는 pericytes의 독특한 위치를 사용 합니다.
곳을 알아내는-섹션, 신경 레이어 DAPI 셔 서 핵과 내부 형광 밀도 의해 확인 될 수 있다와 깊은 모 세관 plexuses 포함 PDGFRβ 그리고 NG2 immunoreactivity (그림 1)를 표시 하는 pericytes. 선박 (그림 1, 화살표)의 주변에 원형 또는 말굽 모양의 immunoreactivity로 혈관 벽에 pericytes의 독특한 위치를 볼 수 있습니다 또는 가끔 경도 컷 혈관을 (그림 1, 화살촉).
성인 쥐의 전체 마운트 준비에서 microvascular pericytes의 성공적인 시각화14,20도전적 될 수 있다. 전체 장착 성인 망막에서 PDGFRβ immunoreactivity (표시 되지 않음) 매우 약한 신호에만 결과. Abluminal pericytes (그림 2)에서 강렬한 얼룩과 내부 혈관 네트워크 설명 NG2 얼룩.
성인 쥐 망막의 혈관 네트워크에 대 한 개요를, immunohistochemistry 소형 고립 된 쥐 망막 혈관 네트워크의 전체 마운트 하는 다른 방법을 제공 합니다. 성공적으로 수행 될 때이 조직 준비 기술은 안쪽과 깊은 모 세관 plexuses를 포함 한 전체 망막 microvasculature에 대 한 개요를 제공 합니다. Pericytic 마커 얼룩 Immunohistochemical 특정 혈관 세포 (그림 3)에 강렬한 응답 NG2 immunoreactivity를 보여주는 전체 microvascular 네트워크에서 발생 합니다. 이 세포의 일부는 또한 PDGFRβ immunoreactivity (그림 3)를 표시합니다.
조직의 주의 전개 하는 것은 망막 맥 관 구조에 대 한 좋은 개요를 얻을 중요 합니다. 부족 한 전개는 맥 관 구조 여러 초점 층에서 배열 되 고 형광 이미징 어려운 (그림 4) 하 게 될 수 있습니다. 펼쳐진 부드러운 떨고, 챔버 슬라이드를 앞뒤로 기울이기 또는 망막 맥 관 구조에 액체의 방울을 발음에 의해 촉진 수 있습니다. 그것은 망막 모 세관 plexuses의 해부학 혈관 침대의 일부 오버레이 발생 합니다 주목 해야한다. 따라서, 그것은 깊은 모 세관 plexuses 유리 슬라이드에 병합 하는 경우 내부 구별 문제입니다.
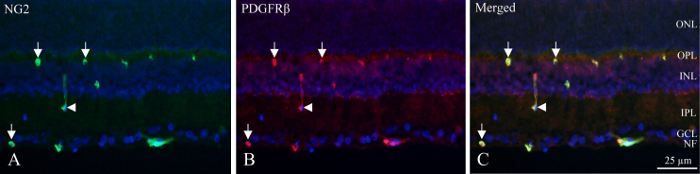
그림 1: 내부 쥐 망막의 cryo-섹션의 immunohistochemical pericyte 얼룩 더블. (A) NG2 (녹색) immunohistochemistry 망막의 안쪽 부분에서 긍정적인 혈관을 보여준다. 화살표는 혈관에 순환 및 말굽 모양의 immunoreactivity를 나타냅니다. 화살촉은 경도 컷된 배 지적 한다. (B) PDGFRβ (레드) immunohistochemistry NG2 immunoreactivity와 유사한 반응성을 보여줍니다. 화살표와 화살촉 NG2 얼룩에 관해서는 동일한 구조를 가리키면 됩니다. (C) 이미지 3 다른 필터도 랑에 의해 (파란색) NG2, PDGFRβ 및 DAPI 병합을 보여 줍니다. 그것 두 항 체는 공동 화 된 것으로 드러났습니다 (녹색 + 빨강 = 노란색). NF: 신경 섬유 층, GCL: 신경 절 세포 층, IPL: 내부 plexiform 레이어, INL: 안 핵 층, OPL: 외부 plexiform 레이어, ONL: 외부 핵 층. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 전체 탑재 쥐 망막의 Immunohistochemical pericyte 얼룩. (빨간색) NG2 immunoreactivity 표면 혈관 networkwith abluminal pericytes에 얼룩 강렬한 따라 표시 됩니다. 이미지 표시 병합 NG2 DAPI (파란색). 신경 세포 NG2 스테인드 microvasculature 사이 DAPI 블루 핵으로 볼 수 있습니다. PDGFRβ immunoreactivity 전체 탑재 성인 망막에 매우 약한 신호에만 발생 하 고이 수치에 포함 되지. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 소형 고립 된 쥐 망막 맥 관 구조의 immunohistochemical pericyte 얼룩 더블. (A). 이미지 표시 소형 고립 된 쥐 망막 혈관 네트워크 immunohistochemical 스테인드 NG2 (녹색)와 PDGFRβ (빨간색). 완전 한 네트워크 NG2 immunoreactivity로를 나타났다. 그러나, PDGFRβ immunoreactivity 셀 somas에서 발견 되었다. A의 삽입 (파란색) DAPI로 얼룩진 망막 맥 관 구조 네트워크의 개요입니다. (B)는 이미지 더 높은 확대 및 다른 위치에서 (A)로 동일한 견본을 보여 줍니다. PDGFRβ 얼룩 pericyte immunoreactivity을 나타내는 혈관 네트워크에서 셀 somas에 표시만 분명 하다. B의 삽입 이며 높은 확대의 맥 관 구조를 보여 주는 이미지 NG2 (녹색), PDGFRβ (레드) 물 DAPI와 합병. DAPI 얼룩 NG2 및 PDGFRβ를 포함 하 여 3 개의 pericytes (PDGFRβ-양성)와 2 개의 정체 불명된 혈관 벽 세포 보여준다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 한 불 충 분 한 펼친된 소형 고립 된 망막 맥 관 구조의 예. 소형 고립 된 맥 관 구조의 주의 전개 누적 되 고 맥 관 구조에 발생할 수 있습니다 부족 한 전개로 중요 하다. 그림은 DAPI 스테인드 망막 맥 관 구조 다른 초점 층에서 찍은 하지만 동일한 사이트에 보여준다. (A)는 DAPI 스테인드 셀 하나의 초점 레이어 표시는 약 25 µ m 두께 혈관 망막 맥 관 구조. 두 번째 초점에에서는 DAPI 스테인드 셀 (B) (A)에 표시 되는 더 큰 혈관에 누적 되어 같은 사이트에서 얇은 분기 모 세관 명료. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
선물이 microvascular 망막 pericytes의 연구에 적용 될 수 있는 3 개의 망막 준비 기술. 아래, 우리 각 메서드 사이 비교를 제공 하 고 프로토콜에서 중요 한 단계를 강조.
곳을 알아내는-단면, 망막은 잘라 화살 섹션에 따라서, 그것은 동일한 망막에서 수많은 견본을 얻을 수. 이 방법에서 결과 숫자 섹션 항 체 특이성 및 적정 테스트로 불필요 한 동물 희생을 방지 하기 위한 이상적인 선택 하기가. 예비 일은 좋은 결과 위해 결정적 이다. 그것은 눈을 안 하지만 눈 주위의 모든 근육을 잘라 눈 해 부 동안 중요 합니다. 힘을 사용 하는 경우 망막의 위험이 있다. 눈 컵은 얇은, 때문에 하나 하지 너무 오래 수정 해야 합니다. 2-4 h에 대 한 PBS에 4 %paraformaldehyde 침수 조직을 해결 됩니다. 더 이상 고정, 관심사의 항 원을 파괴의 위험이 있다. 최고의 가능한 immunostainings를 생성 하기 위해 그것은 유리에 대 한 가능한 플랫 되도록 각 섹션에 대 한 중요. 단원만 몇 가끔 가로의 상처는 microvasculature, 때문에이 조직을 준비 기술은 microvasculature의만 간헐적으로 시각화를 제공 합니다. 따라서,이 메서드는 전체 관 건축과 pericytes의 정량 측정의 연구에 적합 하지.
전반적인 맥 관 구조는 맥 관 구조에 대 한 개요를 제공 하기 위해 전체-장착 후 얼룩이 질 수 있다. 이 기술을 마스터링, 상대적으로 작은 작업을 요구 하는 빠른 조직 준비 절차를 수 있습니다. 그러나, 특히 인식 하는 몇 가지 포인트가 있다. 망막은 깨지기 쉬운 이며, 주의 그들을 처리 하 고 입술 및 커트에 최고. 또한, 망막을 신중 하 게 처리 하는 동안 주름을 피하기 위해 주요 중요성의 고를 설치 하는 동안 다른 크 레바 스는 immunohistochemical 이미징 나중에 영향을 미칠 수 있습니다. 탑재 된 망막은 250-300 µ m 두께 그리고 신경 층의 항 체 침투 문제가 될 수 있습니다. Pericyte 시각화에 관한 전체 마운트 프로토콜에서 NG2 얼룩만 달성 될 수 있는 Cy3 연결 2 차 항 체로, 그리고 전체 탑재 성인 망막에 PDGFRβ immunoreactivity 같은 매우 약한 결과에 표시 되지 않습니다은 신호 그림입니다. 따라서, 전체 마운트 착 기술의 유용성 성공적인 얼룩 사용 특정 차 및 2 차 항 체에 따라 강력 하 게 방해 된다. 성인 쥐 망막의 시각된 microvascular plexuses 위한 프로토콜 최적화를 더 제안 시간 변경 부 화 온도26의 더 긴 기간에 대 한 1 차적인 항 체는 외피에 의해입니다.
전체 장착의 두께 때문 실수로 장착 내부 망막 모세 혈관을 포함와 함께 피하기 위해 시 신경 머리 쪽으로 망막 주변에서 4 개의 절 개 후 망막의 방향을 인식 하는 것이 중요 하다 아래로 직면입니다. 아직도, 깊은 microvascular plexuses와는 pericytes의 상세한 시각화가 방법14,20성가신 될 수 있습니다. 전체 산 성인 망막의 얼룩은 깊은 모 세관 신경 총에,이 avascular 일부 부분에 나타나는 망막에 발생할 수 있습니다. Pericytes 표면 모 세관 신경 총에 따라서,이 방법은 혈관 안 대기와 맥 관 구조만 조각난된 개요에 틀린 부정적인 결과 이어질 수 있습니다 제공 성인 망막 전체 실장의 immunohistochemical 얼룩이 지는 쥐 망막 맥 관 구조의 시각화입니다.
트립 신 소화 오래 격리 및 망막 맥 관 구조20의 시각화를 위한 표준 기술을 고려 하고있다. 침투성 격리 전체 복잡 한 3 차원 혈관 네트워크의 시각화를 위한 다른 방법을 제공 하 고 같은 많은 작업을 처리 하기 어려운 매우 연약한 조직,도 전에 직면해. 때문에 망막 혈관 제품에는 두 가지 방법 사이 유사, 당뇨 절연 피 함으로써 주요 눈물과 신중한 처리를 방지 하기 위해 트립 신 소화20 주의 해 부를 포함 하 여 동일한 도전의 많은 얼굴 pipetting 고 집게와 감동입니다. 방법 사이의 중요 한 차이점은 고정. 트립 신 소화 일반적으로 고정 후 수행 하 고 몇 년20정착 액에 보존 된 망막에 성공적으로 적용 될 수 있다. 침투성 절연 고정 하기 전에 수행 되 고 따라서 이전 문학23,,2425에 설명 된 대로 다양 한 다른 분석 실험에 구현할 수 있습니다. 트립 신 소화 당뇨 격리 시간 안에서 마무리 될 수 있는 반면 2 일20을 통해 수행 됩니다. 또한, 당뇨 격리 프로토콜-소화의 위험을 포함 하지 않는다 막 마커의 효소 분열에 필요한 / pericyte 인식, 예를 들면 PDGFRβ NG2,이 방법에 대 한 선호를 후속 만들기 immunohistochemical microvascular 얼룩입니다.
마지막으로,이 원고의 즉각적인 범위에서 비록 망막27에서 설치류에서 큰, 그대로 microvascular plexi 격리 하기 위한 적은 널리 알려진 하지만 매우 유용한 기술이입니다. 망막은 coverslip 특수 유리 챔버에 배치 됩니다. Coverslip, 완전히 살아 만들려고 coverslip에 연결 된 microvasculature 남아의 제거에 따라 인쇄 (≈ 98% 셀) 조직. 이 방법의 가장 큰 장점은 용기 및 immunostaining에 대 한 후속 정착의 생리 적 연구에 대 한 수 것입니다. 방법의 분명 한 한계는 망막 평면 마운트로 전체 microvascular 네트워크의 시각화/절연을 제공 하지는 않습니다 소형 준비 할. 아직도, pericytes27이 방법 응용 프로그램에 의해 구상 될 수 있다.
여기에 설명 된 세 가지 조직 준비 기술 장점 및 단점 microvascular pericytes의 시각화를 위한 구성 하는 각 방법 의미에서 무료입니다. 각 방법 잠재력과 약점의 평가 특정 병 적인 조건 microvascular pericytes 조사에 대 한 최적의 방법을 선택 해야 합니다. 시연된 방법 pericyte 마커 뿐만 아니라 microvascular 구조의 시각화를 일반적으로 얼룩을 확장할 수 있습니다. 결국, 그것은 개별 연구원에 연구 가설에 따라 적절 한 시각화 방법을 선택 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 없다.
Acknowledgments
연구는 Lundbeck 재단, 덴마크에 의해 투자 되었다.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



