Summary
נדגים שלוש טכניקות להכנת רקמות שונות להמחשת immunohistochemical של pericytes microvascular ברשתית עכברוש, קרי, הקפאה-סעיפים, שלם-טעינות בידוד היפוטוניק של רשת כלי הדם.
Abstract
Pericytes ברשתית תפקיד חשוב למחלות רבות של העין. Immunohistochemical מכתים טכניקות של כלי רשתית microvascular pericytes הן גורם מרכזי מחקר ophthalmological. זה חיוני כדי לבחור שיטה המתאימה להמחיש את pericytes microvascular. אנו מתארים רשתית pericyte microvascular immunohistochemical מכתים הקפאה-סעיפים, שלם-mounts ו היפוטוניק להערכת מבודדים באמצעות נוגדנים עבור β קולטן גורם גידול נגזר טסית דם (PDGFRβ) ועצב/גליה אנטיגן 2 (NG2). זה מאפשר לנו להדגיש את היתרונות ואת החסרונות של כל אחד שלוש רקמות ההכנות החזיית pericytes microvascular ברשתית. הקפאה-סעיפים לספק transsectional ויזואליזציה של כל השכבות ברשתית אך מכיל רק כמה ומדי פעם רוחבי שמכינים microvasculature. כולה-הר מספק סקירה של להערכת ברשתית כולו, אבל ויזואליזציה של microvasculature יכול להיות בעייתי. בידוד היפוטוניק מספק שיטה כדי להמחיש את להערכת ברשתית כולו על ידי הסרת תאים עצביים, אבל זה הופך את הרקמה שברירי.
Introduction
Pericytes ברשתית הם המוקד של מעבדות מחקר רבים כמו תאים אלה ממלאים תפקיד מרכזי באינטגריטי של להערכת. מצבים פתולוגיים כגון רטינופתיה סוכרתית1, איסכמיה2וגלאוקומה3 יש מאפייני וסקולרית המערבות את הפונקציה של pericytes. Pericytes ניתן למצוא את plexuses הפנימית נימי ברשתית. עורק רשתית מרכזי המספק הרשתית פנימי מסתעף שתי שכבות של plexuses נימי. המיטה כלי הדם הפנימיים ממוקם בין שכבות הגרעין הפנימי תא גנגליון. לרובד העמוק יותר צפוף ומורכב, הוא מקומי בין השכבות הפנימיות והחיצוניות גרעיני4,5. בנוסף, חלקים מסוימים של הרשתית מכילים גם לרשת השלישית כינה הנימים parapapillary רדיאלי. אלו הם ארוכים, נימים ישר שנמצאים בין סיבי העצב ולעיתים רחוקות anastomose עם אחד לשני או אחרים plexuses שני6. בתוך הקיר נימי, pericytes נעוצים קרום המרתף, קו הצד abluminal של תאי אנדותל כלי הדם.
מועד זה, יש אין סמן ביולוגי ייחודי של אלה pericytes יכול להבדיל אותם מתאי דם אחרים. Β קולטן גורם גידול נגזר טסית דם (PDGFRβ) עצב/גליה אנטיגן 2 (NG2) נפוץ סמנים אשר שניהם מציגים על pericytes אבל גם אחרים בתאי הדם בקרב אנשי עסקים ותיירים כאחד. זיהוי של pericytes מסובך עוד יותר בקיומן של קבוצות משנה pericyte נבדלים ביטוי חלבון ומורפולוגיה7. כיום, הזיהוי הטוב ביותר מתבססת על שילוב של סמני חלבונים, את מיקום אופייני pericyte בדופן כלי הדם. נדגים כאן שלוש טכניקות להכנת רקמות שונות עבור נוגדן PDGFRβ/NG2 pericytes microvascular ברשתית עכברוש, קרי, הקפאה-סעיפים, שלם-טעינות, ו בידוד היפוטוניק של רשת כלי הדם.
עם הקפאה-חלקים, הרשתית ואת בסקלרה נחתכים דרך עצב הראייה. דבר זה מאפשר הפריט החזותי של כל מבני שכבות של נוירונים. הרבדים עשר ברורים של הרשתית נראים לעין כמו מתחלפות מבנים גרעינית, עצב/דנדריטים, ניתן לאבחן עם כתמים כגון hematoxylin/אאוזין או פלורסנט גרעיני 4', 6-diamidino-2-phenylindole (דאפי)8. הדרישות מטבוליים שונים בין שכבות9 וזה מספק שיטה לקביעת העדר עובי או סך של שכבה מסוימת (למשל, אובדן תאי גנגליון נמנה עם גולת הכותרת של איסכמיה ברשתית10, 11). להערכת מתבטא כפי רוחבי חתכים דרך הרשתית, כך שניתן ללמוד בנפרד את plexuses נימי בתוך שכבות הרשתית בהתאמה12,13.
באופן מסורתי יותר, החקירות של הרשת להערכת ברשתית מבוצעות בכל רשתית-טעינות. עם הכנת הרקמה, הרשתית לחתוך, משוטחים כמבנה בצורת פרח. השיטה היא טכניקה הכנה רקמות מהיר יחסית ניתן לסמן להערכת ברשתית הכוללת את אדריכלות והיא ולכן לעיתים קרובות חלה לגבי חקירת כורוידאלית ברשתית מאתר. ויזואליזציה מוצלח של microvasculature ב רשתית רכוב כל הוא דיווח גם העכבר neonatal המתפתח, עכברוש רשתית14,15,16,17,18, 19. מחקרים אלה לחשוף את פעילות pericytic מוגדרים יותר עם אזורים גדולים יותר ללא נימי במבוגר בהשוואה רשתית neonatal14.
דרך נוספת של ויזואליזציה של היא microvasculature ברשתית לאחר בידוד היפוטוניק. טכניקה זו הכנה רקמות התוצאה כלי הדם ברשתית נימים להיות משוחררים של תאים עצביים. סוג זה של הדמיה דו מימדי של רשת כלי הדם ברשתית מבודד הוא בדרך כלל לאחר עיכול טריפסין ברשתית20 ואין להשתמש כדי להעריך את חריגות בכלי הדם של רטינופתיה סוכרתית כולל אובדן pericyte נימי ניוון20,21,22. שיטת בידוד היפוטוניק מציעה החקירות של ג'ין כלי הדם ברשתית ותגובות חלבון רגולטורי הם סיים עם RT-PCR והמערבי סופג23,24,25. אנו מספקים כאן פרוטוקול עבור החזקות חינם נוגדן של להערכת ברשתית מבודדים היפוטוניק כחלופה טריפסין לעיכול כדי לבחון את pericytes microvascular.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
הפרוטוקול היה ממוטב, הפגינו על חולדות לבקן זכרים בוגרים. בכל ההליכים ניסיוני, חיות טופלו בתקנות המשפט ארוו שימוש בבעלי חיים של לרפואת עיניים ומחקר חזון. בעלי חיים היו מורדמים על ידי פחמן דו-חמצני ו עוקבות נקע בצוואר הרחם.
1. עכברוש רקמת רשתית ההכנות
-
הקפאה-סעיף
- להפוך ~0.5 האחורי ו הקדמי ס"מ חרכי העפעף עכברוש עם אזמל.
- אופציונלי: באמצעות צורב diathermy, לסמן את העין-הזווית הפנימית להתמצא העין בצורה אחידה במהלך הטבעה ולאפשר cryostat אנכי חלוקתה דרך עצב הראייה.
- לתפוס את העין עם מלקחיים, להטות בקפידה לצד כדי לחשוף את הרקמה שמסביב. Enucleate העין על ידי ביצוע חתכים במספריים לנתיחה ברקמת חיבור ושרירי.
התראה: לא למשוך את העין קשה מדי כמו יתר לחץ על עצב הראייה עלול לגרום הרשתיות. - את העין בקצרה בשורה 4% פורמלדהיד, באגירה פוספט תמיסת מלח (PBS) להתייצב לפני ביצוע חור הראשונית ב לימבוס הקרנית על ידי הפעלת לחץ קל עם קצה אזמל.
- תחת מיקרוסקופ, גזור לאורך לימבוס הקרנית במספריים ניתוח כדי להסיר את הקרנית ולהסיר את העדשה עם מלקחיים לפני השוקע בפורמלין 4% ב- PBS עבור h 2 – 4.
- לשטוף ברצף במאגר פוספט של Sörensen עם 10% סוכרוז ו 25% סוכרוז.
- להטביע בינוני Yazulla מוכן עם ג'לטין 3% מחזירי אלבומין העור, 30% מתרנגולת חלבון ביצה.
הערה: הפרוטוקול ניתן להשהות כאן עם רקמת אחסון ב-20 ° C.
- להפוך ~0.5 האחורי ו הקדמי ס"מ חרכי העפעף עכברוש עם אזמל.
-
כולה-הר
- להפוך ~0.5 האחורי ו הקדמי ס"מ חרכי העפעף עכברוש עם אזמל.
- לתפוס את העין עם מלקחיים, להטות בקפידה לצד כדי לחשוף את הרקמה שמסביב. Enucleate העין על ידי ביצוע חתכים במספריים לנתיחה ברקמת חיבור ושרירי.
התראה: לא למשוך את העין קשה מדי כמו יתר לחץ על עצב הראייה עלול לגרום הרשתיות. - לשים את העין לזמן קצר 4% פורמלדהיד ב- PBS להתייצב לפני ביצוע חור הראשונית ב לימבוס הקרנית על ידי הפעלת לחץ קל עם קצה אזמל.
- תחת מיקרוסקופ, גזור לאורך לימבוס הקרנית במספריים ניתוח כדי להסיר את הקרנית ולהסיר את העדשה עם מלקחיים.
- להפריד הרשתית אפיתל הפיגמנט ברשתית לכיוון עצב הראייה עם מלקחיים בתנועות פתח קטן כדי למנוע קריעה גדולה.
- חינם הרשתית על עצב הראייה במספריים לנתיחה ולעשות ארבעה חריצים של כמה מילימטרים אורך מהפריפריה ברשתית לכיוון ראש עצב הראייה.
- להפיץ את הרשתית על זכוכית ולאפשר ייבוש למשך 5 – 10 דקות.
- תקן בפורמלין 4% למשך 20-30 דקות על-ידי מטפטף פורמלין על הרשתית.
התראה: אין להחיל ישירות על הרשתית כמו זה עלול לנתק מהזכוכית. - לשטוף עם PBS. לקבלת תוצאות מיטביות, חיסונית-כתם ישירות לאחר השטיפה.
-
בידוד היפוטוניק
- להפוך ~0.5 האחורי ו הקדמי ס"מ חרכי העפעף עכברוש עם אזמל.
- לתפוס את העין עם מלקחיים, להטות בקפידה לצד כדי לחשוף את הרקמה שמסביב. Enucleate העין על ידי ביצוע חתכים במספריים לנתיחה ברקמת חיבור ושרירי.
התראה: לא למשוך את העין קשה מדי כמו יתר לחץ על עצב הראייה עלול לגרום הרשתיות. - לעשות חור הראשונית ב לימבוס הקרנית על ידי הפעלת לחץ קל עם קצה אזמל.
- תחת מיקרוסקופ, גזור לאורך לימבוס הקרנית במספריים ניתוח כדי להסיר את הקרנית ולהסיר את העדשה עם מלקחיים.
- להפריד הרשתית אפיתל הפיגמנט ברשתית לכיוון ראש עצב הראייה עם מלקחיים בתנועות פתח קטן כדי למנוע קריעה גדולה.
- חופשי הרשתית על עצב הראייה במספריים לנתיחה, למקם את הרשתית 1 מ"ל מים יונים צלחת 24-ובכן, לנער-200 סל ד עם אורביט רטט 1.5 מ מ לשעה בטמפרטורת החדר.
הערה: בעתיד, הרשתית יופיעו שפחות מוגדר בקצוות. - להוסיף 200 DNAse U 1 מביצועם lysed תא פסולת להערכת ברשתית וללחוץ על עוד 30 דקות בטמפרטורת החדר.
הערה: פסולת עלולה להתחיל בצורת הבארות. - לשטוף מינימום 3 פעמים במים יונים למשך חמש דקות עם רועדת במהירות של 150-300 סל ד כדי להסיר שאריות תאים עצביים. הרשתית צריך להיות שקוף יותר עם כל שטיפה מעידה על סילוק פסולת הסלולר עצביים.
- השתמש רקע כהה כדי לבדוק הצלחת 24-. טוב לראות בבירור להערכת ברשתית מבודד תתאים.
- (אופציונלי): אם להערכת אינו מופיע חינם (שקוף למחצה) העצבית שכבות בשלב זה גם להוסיף עוד שלבים שטיפה, להגדיל את מהירות חזק או להשתמש pipet לרוקן נוזל אל להערכת.
התראה: מהם השלבים האופציונליים עלול לגרום נזק להערכת.
- תקן 10 דקות ב- 1 מ"ל של 4% paraformaldehyde ב- PBS בטמפרטורת החדר ולאחר מכן לשטוף 3 פעמים ב- PBS.
הערה: הפרוטוקול ניתן להשהות כאן עם רקמת אחסון ב 4 º C.
2. אימונוהיסטוכימיה
-
צביעת סעיפים-הקפאה
- לחתוך 10 מיקרומטר הקפאה-סעיפים של הרשתית ג'לטין-מוטבע כמו חלוקתה אנכי דרך העצב האופטי והנח הסעיפים הקפאה על שקופיות זכוכית ולתת יבש (מינימום 1 h).
- להטביע את השקופית זכוכית ב- PBS עם 0.25% טריטון X-100 (PBS-T) למשך 15 דקות.
- לטפטף מטריים PDGFRβ, שבערך NG2 נוגדנים העיקרי מדולל ב- PBS-T + 1% BSA לתוך הקפאה-המקטע, דגירה בתאי הדגירה ב 4 מעלות צלזיוס למשך הלילה.
- להטביע את השקופית זכוכית 2 פעמים ב- PBS-T למשך 15 דקות ולשפוך מטריים העכבר נגד מקושרים-594 עבור חיל הים אלקסה, בטחונות ארנב נגד מקושרים FITC משני נוגדנים מדולל ב- PBS-T עם 3% BSA על הסעיפים הקפאה.
- דגירה השקופית זכוכית h 1 בטמפרטורת החדר בחושך.
- יש לשטוף את השקופית זכוכית ב- PBS-T 2 x 15 דקות.
הערה: אופציונלי: עבור כפולים ומשולשים immunofluorescent מכתים, צביעת רציפים יכול להתבצע על ידי חוזר ההליך מן 2.1.3 2.1.6 שתיים ושלוש פעמים, בהתאמה. - הר הסעיפים-הקפאה מוכתם מתפוגג אנטי-הרכבה דאפי המכילות בינוני ו- coverslip.
-
צביעה של כל-הר
- לטפטף PBS-T כולה-הר, דגירה בטמפרטורת החדר למשך 15 דקות.
- יוצקים את לטפטף מטריים PDGFRβ, שבערך NG2 נוגדנים העיקרי מדולל ב- PBS-T + 1% BSA, דגירה בתאי לח ב 4 מעלות צלזיוס למשך הלילה.
- יוצקים את ולשפוך על PBS-T לשטוף את השקופית זכוכית 2 x 15 דקות.
- יוצקים את ולשפוך על בטחונות ארנב אנטי Cy2, בטחונות העכבר נגד מקושרים Cy3 משני נוגדן מדולל ב- PBS-T עם 3% BSA כדי דגירה h 1 בחדר לחים בטמפרטורת החדר בחושך.
- יוצקים את ולשפוך על PBS-T לשטוף 2 x 15 דקות בחושך.
הערה: אופציונלי: עבור כפולים ומשולשים immunofluorescent מכתים, צביעת רציפים יכול להתבצע על ידי חוזר ההליך מן 2.2.2 2.2.5 שתיים ושלוש פעמים, בהתאמה. - הר ההר-כל המוכתמים מתפוגג אנטי-הרכבה דאפי המכילות בינוני ו- coverslip.
-
צביעה של היפוטוניק להערכת מבודד
- לחסום את להערכת מבודד היפוטוניק h 1 ברעידות-100 סל"ד ובטמפרטורת החדר עם 500 µL/טוב של 10% חמור סרום מדולל ב- PBS.
- דגירה ללילה בטמפרטורת החדר ומנערים ב 100 סל"ד עם 600 µL טוב של בטחונות PDGFRβ, שבערך NG2 הראשית נוגדנים מדולל בנסיוב חמור 10% ב- PBS.
- יש לשטוף הרשתית רשת 3 x ב- PBS במשך 5 דקות, דגירה שבו מטריים העכבר אנטי מקושרים-594 עבור חיל הים אלקסה, בטחונות ארנב נגד מקושרים FITC משני נוגדנים רבים מעורבבת עם 10% סרום חמור PBS לוחצים על 100 סל"ד וטמפרטורת החדר עבור h 1 בחושך.
- לשטוף ב- PBS-T במשך 5 דקות, דגירה ב 0.2 ננוגרם למ"ל דאפי ב- PBS-T למשך 15 דקות ולאחריו 3 x 5 דקות שטיפות ב- PBS-T בחושך.
- חותכים את קצה pipet פסטר פלסטיק, להרטיב אותה עם PBS-T ולהשתמש בו כדי להעביר את הרשת ברשתית לשקופית קאמרית זכוכית 4-. טוב.
הערה: השלב הרטבה הוא חשוב למנוע את להערכת ברשתית נדבקות הפנימי של pipet פסטר. - לגולל את להערכת ברשתית. להימנע מלגעת את להערכת ברשתית עם מלקחיים, כמו זה יכול לגרום את להערכת להסתבך.
הערה: התגלגלות יכול להיעשות על ידי הטיית השקופית קאמרית הלוך או כ רפה בעברית טיפות של נוזל על גבי להערכת ברשתית. - הסר את המדיום הבארות. מתח הפנים של הנוזל לשטח את להערכת אל החלק התחתון של השקופית.
- ודא התגלגלות הנכונה תחת מיקרוסקופ לפני הסרת הפלסטיק בארות משקופית קאמרית.
- לטעון את להערכת ויטראז'ים עם נגד דהייה הרכבה בינונית, עם coverslip.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
הפרוטוקולים מצליח לספק שלושה תכשירים רשתית שונות להמחשת microvascular pericytes. כל השיטות האלה משתמש PDGFRβ, NG2 immunoreactivity שיתוף הלוקליזציה של המיקום הייחודי של pericytes זה לעטוף foridentification אנדותל נימי.
עם הקפאה-מקטעים, הרבדים עצביים יכול להיות מזוהה על ידי צפיפות פלורסנט גרעינים מתויג דאפי, הפנימי, plexuses עמוק נימי מכילים pericytes המציגים immunoreactivity PDGFRβ ו- NG2 (איור 1). המיקום הייחודי של pericytes בדופן כלי הדם ניתן לראות immunoreactivity עגולה או בצורת פרסה בפריפריה של כלי (איור 1, חצים) או longitudinally מדי פעם לחתוך כלי (איור 1, ראש חץ).
ויזואליזציה מוצלח של pericytes microvascular בהכנה כולה-הר של עכברים בוגרים עשויה להיות מאתגרת14,20. PDGFRβ immunoreactivity ברשתית למבוגרים רכוב כולו הביא רק אות חלש מאוד (לא מוצג). NG2 מכתים המתוארים הרשת כלי הדם הפנימיים עם צביעת אינטנסיבי ב abluminal pericytes (איור 2).
כדי לקבל סקירה של רשת כלי הדם של הרשתית עכברים בוגרים, אימונוהיסטוכימיה של רשת כלי הדם ברשתית עכברוש מבודד היפוטוניק מספק שיטה חלופית כדי כולה-הר. כאשר מבוצעת בהצלחה, טכניקה זו הכנה רקמות מספק סקירה של microvasculature ברשתית כולו כולל plexuses הפנימית והחיצונית נימי עמוק. Immunohistochemical מכתים עם סמנים pericytic תוצאות הרשת microvascular מראה NG2 immunoreactivity עם מענה אינטנסיבי תאים מסוימים בכלי הדם (איור 3). חלק תאים אלה גם להציג PDGFRβ immunoreactivity (איור 3).
התגלגלות זהיר של הרקמה חשוב לקבל תמונה כללית של להערכת ברשתית. התגלגלות לא מספיקות יכול לגרום להערכת להיות מסודרים בשכבות פוקוס מרובים שהופך פלורסנט הדמיה קשים (איור 4). התגלגלות ניתן להקל על ידי עדין רועדות, הטיית השקופית קאמרית הלוך או כ רפה בעברית טיפות של נוזל על גבי להערכת ברשתית. יצוין, כי האנטומיה של plexuses נימי ברשתית וכתוצאה מכך כמה שכבת-על המיטות כלי הדם. מכאן, זה בעייתי לבידול הפנימי plexuses נימי עמוק לאחר השיטוח על גבי השקופית זכוכית.
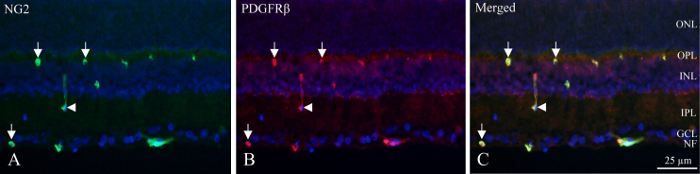
איור 1: כפול pericyte נוגדן הקפאה-סעיף של הרשתית עכברוש הפנימי. (א) NG2 אימונוהיסטוכימיה (ירוק) מגלה כלי חיובי בתוך החלק הפנימי של הרשתית. חיצים מציינים מעגלית, בצורת פרסה immunoreactivity בכלי. החץ מצביע על ספינת longitudinally חתוכים. אימונוהיסטוכימיה (B) PDGFRβ (אדום) מראים תגובתיות דומה NG2 immunoreactivity. חצים וראש חץ הצבע על מבנים אותה באשר NG2 מכתים. (ג) התמונה מראה ממיזוג של NG2, PDGFRβ ודאפי (כחול) על ידי superimposing של שלושה מסננים שונים. הוא גילה כי שני נוגדנים הם שותף מקומי (ירוק + אדום = צהוב). NF: סיבי עצב שכבה, שזכתה: שכבת תאים גנגליון, IPL: השכבה הפנימית plexiform, להיכנס: השכבה הפנימית גרעינית, OPL: השכבה החיצונית plexiform, גרת: השכבה החיצונית גרעינית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: נוגדן pericyte של הרשתית רכוב כל עכברוש. Immunoreactivity NG2 (אדום) מוצגת לאורך networkwith כלי דם שטחיים אינטנסיבי מכתים ב- abluminal pericytes. התמונות להראות הממוזג NG2 דאפי (כחול). תאים עצביים גלויים כמו גרעינים דאפי-כחול בין microvasculature שהוכתמו NG2. PDGFRβ immunoreactivity ברשתית למבוגרים רכוב כל הביא רק אות חלש מאוד, ולכן אינה כלולה דמות זו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: כפול pericyte נוגדן של להערכת ברשתית עכברוש מבודד היפוטוניק. (א). התמונה מציגה רשת כלי הדם ברשתית עכברוש מבודד היפוטוניק immunohistochemical צבעונית עם NG2 (ירוק), PDGFRβ (אדום). הרשת מלאה הראה NG2 immunoreactivity. עם זאת, נמצא PDGFRβ immunoreactivity תא somas. תותב של A הוא סקירה של רשת להערכת ברשתית צבעונית עם דאפי (כחול). (B) התמונה מראה את הדגימה זהה כמו (א) למיקום אחר, הגדלה גבוהה יותר. ברור כי PDGFRβ מכתים מוצגת רק ב- somas תא המציינת pericyte immunoreactivity ברשת כלי הדם. תותב של B היא התמונה שמראה בהגדלה של להערכת מוכתם, NG2 (ירוק) PDGFRβ (אדום) התמזגה עם דאפי. כולל דאפי מכתים יחד עם NG2, PDGFRβ מגלה שלושה pericytes (PDGFRβ-חיוביים) ותאים קיר שני כלי לא מזוהה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: דוגמה לקוי פרש היפוטוניק מבודדים ברשתית להערכת. התגלגלות זהיר של להערכת מבודדים היפוטוניק חשוב כמו התגלגלות לא מספיקות עלולה להביא להערכת להיות מוערמים. התמונות מציגות שהוכתמו דאפי להערכת ברשתית באותו אתר אבל לקח בשכבות מיקוד שונה. (א) שהוכתמו דאפי תאים בשכבה אחת המוקד להציג כלי דם עבה מיקרומטר כ 25 להערכת ברשתית. (B) שהוכתמו דאפי תאים בשכבה השנייה המוקד להסבר נימים דקים מסעף באותו אתר זה יש כבר מוערמים זה על כלי הדם גדול המוצגת (א). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
אנו מציגים שלוש טכניקות הכנה רשתית שניתן להחיל במחקר של microvascular pericytes ברשתית. להלן, אנו לספק השוואה בין כל אחת מהשיטות, לסמן את השלבים הקריטיים של הפרוטוקולים.
עם חלוקתה הקפאה, הרשתית נחתך בסעיפים הווריד, לכן, זה אפשרי להשיג דגימות רבות של הרשתית אותו. הסעיפים ספרתיות הנובע בשיטה זו להגיע לבחירה האידיאלית עבור ירידה לפרטים נוגדנים ובדיקות טיטור כמו זה מונע להקריב חיה מיותרת עבודת הכנה הוא מכריע עבור תוצאות טובות. חשוב בעת שנקלטה לא למשוך את העין, אבל לחתוך כל השרירים סביב העין. יש סיכון של הרשתיות אם שימוש בכוח. מכיוון בגביע העין הוא דק, אחד לא צריך לתקן זמן רב מדי. טבילה עם paraformaldehyde 4% ב- PBS עבור 2-4 h תתקן את הרקמה. אם קבוע יותר, יש סיכון של השמדת אנטיגן של עניין. על מנת להפיק את הטוב ביותר immunostainings אפשרי, זה קריטי עבור כל מקטע להיות שטוח ככל האפשר נגד הזכוכית. כי הסעיפים מכילים רק כמה ומדי פעם רוחבי שמכינים. microvasculature, טכניקה זו ההכנות רקמות מציע רק לסירוגין ויזואליזציה של microvasculature. לכן, בשיטה זו אינו מתאים המחקרים של אדריכלות בסך הכל כלי הדם ושל אמצעים לכימות של pericytes.
יכול להיות מוכתם להערכת הכוללת לאחר כל-הרכבה כדי לספק מבט כולל להערכת. כאשר מאסטרינג טכניקה זו, זה יכול להיות הליך הכנת רקמות מהיר שדורש יחסית מעט עומס העבודה. עם זאת, ישנן כמה נקודות להיות מודעים במיוחד. רשתית העין היא שברירית והוא בעל חשיבות עליונה כדי לטפל בהם ולמנוע קרעים וחתכים. יתר על כן, בזהירות לטיפול ברשתית, זה חשיבות מרכזית כדי למנוע קיפולים, אחרים ועיצוב במהלך הרכבה זה עשוי להשפיע על immunohistochemical הדמיה בהמשך. הרשתית הנטען יש עובי של 250-300 מיקרומטר, נוגדן חדירה של השכבות העצבית עלול להיות בעייתי. לגבי pericyte ויזואליזציה, ההכתמה NG2 בפרוטוקול כולה-הר יכולה להיות מושגת רק עם נוגדן משנית מקושרת Cy3, וכתוצאה PDGFRβ immunoreactivity ברשתית למבוגרים רכוב שלם כזה חלש מאוד אות זה לא ששודר ב הדמות. לכן, התועלת של טכניקת צביעת כולה-הר היא חריפה הקשו על ידי בהתאם מכתימים מוצלח בעיקר על נוגדנים והמשניים ספציפיים השתמשו. הצעות נוספות כדי למטב את פרוטוקול מטמיעים plexuses microvascular של הרשתית עכברים בוגרים היא על ידי הדגירה של נוגדן ראשוני לתקופה ארוכה יותר של זמן ו/או שינוי בטמפרטורת דגירה26.
בשל עובי רכוב כולו, חשוב להיות מודעים הכיוון של הרשתית לאחר ביצוע חתכים ארבע מהפריפריה ברשתית לכיוון ראש עצב הראייה כדי להימנע הרכבה מקרית עם הרשתית הפנימית המכילה את נימי הדם הפונה למטה. עדיין, ויזואליזציה מפורטת של plexuses את microvascular עמוק יותר, את pericytes יכול להיות בעייתי עם השיטה14,20. כמו כל-הר מכתים של הרשתית למבוגרים קשה מקלעת נימי עמוק יותר, התוצאה עלולה להיות ברשתית המופיעים avascular בחלקים מסוימים. נוגדן של הרשתית למבוגרים רכוב כל מספק רק סקירה מפוצלים של להערכת עם pericytes רירית בכלי הדם של מקלעת נימי שטחית, לכן שיטה זו עשוי להוביל לתוצאות שליליות שווא ב ויזואליזציה של להערכת ברשתית החולדה.
טריפסין העיכול כבר מזמן נחשב הטכניקה תקן זהב עבור בידוד והדמיה של הרשתית להערכת20. בידוד היפוטוניק מספק שיטה חלופית עבור הפריט החזותי של מורכבות תלת מימדי וסקולרית הרשת ופונה רבים של אותו עובד עם רקמה שברירית מאוד שקשה להתמודד עם אתגרים. בשל הדמיון במוצר כלי הדם ברשתית בין שתי השיטות, הבידוד היפוטוניק פונה מרבית האתגרים אותו כמו טריפסין העיכול20 כולל ניתוח זהיר כדי למנוע הדמעות הגדולות וטיפול זהירה על ידי הימנעות pipetting ונוגע עם מלקחיים. הבדל חשוב בין השיטות הוא הקיבעון. טריפסין לעיכול נעשית בדרך כלל לאחר קיבוע, יכול להיות מיושם בהצלחה על הרשתיות משומר זה היה לשבועיים במשך שנים מספר20. בידוד היפוטוניק מתבצעות לפני קיבוע, ובכך מאפשרת ליישום ב שונים מבחני אחרים כפי שתואר קודם לכן הספרות23,24,25. העיכול טריפסין מתבצע מעל יומיים20, ואילו הבידוד היפוטוניק יכולה להסתיים תוך שעות. יתר על כן, פרוטוקול בידוד היפוטוניק אינו כולל את הסיכון של עיכול יתר ו המחשוף אנזימטי של קרום סמני נדרש pericyte הכרה, למשל PDGFRβ ו- NG2, הופך שיטה זו המועדפת עבור הבאים microvascular נוגדן.
לבסוף, למרות מתוך הטווח המיידי של כתב יד זה, ישנה טכניקה פחות ידוע, אבל מאוד שימושי עבור בידוד plexi microvascular גדול, ללא פגע מן מכרסם הרשתית27. הרשתית ממוקם תא זכוכית מיוחד, coverslip. עם הסרת coverslip, שרידים microvasculature המצורפת את coverslip כדי ליצור דבר חי (≈ 98% של תאים) רקמת ההדפסה. היתרון הגדול של שיטה זו הוא שהיא מאפשרת מחקר פיזיולוגי של ספינות, קיבוע עוקבות עבור immunostaining. מגבלה ברור של השיטה היא כי הוא אינו מספק הבידוד/ויזואליזציה של הרשת microvascular כמו הר שטוח רשתית ולעשות הכנות היפוטוניק. עדיין, ניתן לאבחן pericytes על-ידי יישום שיטה זו27.
הכנה רקמות שלוש טכניקות המתוארים כאן הם משלימים במובן כי כל שיטה כוללת יתרונות, חסרונות עבור ויזואליזציה של pericytes microvascular. ההערכה של כל שיטות פוטנציאל וחולשות חשוב לבחור את השיטה אופטימלית עבור חוקרים את pericytes microvascular בתנאים ספציפי פתולוגי. ניתן להרחיב את השיטות הפגינו כדי להכתים לא רק עבור סמנים pericyte, אלא גם עבור הפריט החזותי של מבנים microvascular באופן כללי. בסופו של דבר, זה החוקר בודדים לבחור את שיטת הדמיה המתאימה בהתבסס על ההנחה המחקר הנדון.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים אין לחשוף.
Acknowledgments
המחקר מומן על ידי קרן לונדבק, דנמרק.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



