Summary
我们展示了三种不同的组织制备技术的免疫组化显示大鼠视网膜微血管毛细血管,即低温切片, 全支架, 和低渗的隔离血管网络。
Abstract
视网膜毛细血管在许多眼部疾病中起着重要作用。视网膜血管和微血管毛细血管的免疫组化染色技术是眼科研究的中心。选择合适的方法来可视化微血管毛细血管是至关重要的。我们用血小板衍生生长因子受体β (PDGFRβ) 和神经/胶质抗原 2 (NG2) 的抗体描述了低温切片、全支架和低渗隔离血管的视网膜微血管周细胞免疫组化染色。这使我们可以突出的优点和缺点, 三组织准备的可视化视网膜微血管毛细血管。冷冻切片提供 transsectional 可视化所有视网膜层, 但只包含少数偶尔的横向削减微血管。全芒提供了整个视网膜血管的概述, 但可视化的微循环可能是麻烦的。低渗隔离提供了一种通过去除神经细胞来可视化整个视网膜血管的方法, 但这使得组织非常脆弱。
Introduction
视网膜毛细血管是许多研究实验室的重点, 因为这些细胞在血管的完整性中起着重要的作用。病理条件如糖尿病视网膜病变1, 缺血2, 青光眼3有血管特征, 涉及毛细血管的功能。毛细血管见于内视网膜毛细血管丛。视网膜中央动脉提供内视网膜分支成两层毛细血管丛。内血管床位于神经节细胞和内核层之间。更深层是更加密集和复杂的, 并且在内部和外部核层数之间被本地化4,5。此外, 视网膜的某些部分还包含第三个称为径向 parapapillary 毛细血管的网络。这些是长, 直毛细血管在神经纤维之间和很少吻合互相或其他二丛6。在毛细管壁内, 毛细血管嵌在基底膜内, 线 abluminal 侧血管内皮细胞。
到目前为止, 没有这些毛细血管的唯一生物标记, 可以区分它们与其他血管细胞。血小板衍生生长因子受体β (PDGFRβ) 和神经/胶质抗原 2 (NG2) 是常用的标记, 既存在于毛细血管, 也包括其他血管细胞。毛细血管的识别由于形态学和蛋白质表达式的周细胞子集的存在而进一步复杂化.目前, 最佳的鉴定依赖于蛋白质标记的组合和周细胞在血管壁的特征定位。我们在这里演示了三种不同的组织制备技术的免疫组化 PDGFRβ/NG2 染色的大鼠视网膜微血管毛细血管,即低温切片, 全支架, 和低渗的隔离血管网络。
随着低温切片, 视网膜和巩膜被切断通过视神经。这使得神经元的所有层状结构可视化。不同的十层视网膜是明显的交换核和轴突/树突结构, 可以可视化的污点, 如苏木精/红/红或荧光核 4 ', 6-diamidino 2-苯基吲哚 (DAPI)8。代谢要求不同的层9 , 它提供了一种方法来确定厚度或总缺乏的特定层 (例如, 视网膜神经节细胞的损失是视网膜缺血10的标志之一, 11)。血管是明显的横向切开通过视网膜, 使成为可能分开地研究毛细血管丛在各自视网膜层数12,13。
传统上, 视网膜血管网的研究是在全支架上进行的。随着这种组织的准备, 视网膜被切割和扁平的花状结构。该方法是一种相对较快的组织制备技术, 能突出整体结构的视网膜血管, 因此经常被应用于小鼠视网膜新生血管的研究中。在新生小鼠和大鼠视网膜14、15、16、17、18中, 还报道了全装视网膜微血管的成功可视化19. 这些研究显示, 与新生儿视网膜14相比, 成年人的无毛细血管面积更明确的 pericytic 活动。
另一种可视化的方法是在低渗隔离后的视网膜微血管。这种组织制备技术导致视网膜血管和毛细血管被释放的神经细胞。这种类型的孤立视网膜血管网络的二维成像通常是在视网膜胰蛋白酶消化20后进行的, 用于评估糖尿病视网膜病变的血管异常, 包括周细胞丢失和毛细血管退化20,21,22。低渗隔离法提供了对视网膜血管基因和蛋白质调控反应的研究, 因为它们已经做了 rt-pcr 和西方印迹23,24,25。我们提供了一个协议, 以自由浮动的免疫组化染色的低渗隔离视网膜血管作为胰蛋白酶消化的替代品, 以检查微血管毛细血管。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
对成年雄性白化大鼠进行了优化和验证。在所有实验程序中, 动物在眼科和视力研究的 ARVO 声明中都按照《动物》的规定进行治疗。动物被二氧化碳和随后的颈椎脱位安乐死。
1. 大鼠视网膜组织制剂
-
低温切片
- 用手术刀使大鼠眼睑的后、前0.5 厘米狭缝。
- 可选: 使用透热法燃烧器, 在嵌入时将眼睛标记在内角以统一的方式定位眼睛, 并允许垂直恒温器切片通过视神经。
- 用镊子抓住眼睛, 小心地倾斜到侧面, 露出周围的组织。在结缔组织和肌肉组织中用解剖剪刀剪 Enucleate 眼睛。
注意: 不要太用力拉眼睛, 因为视神经过度的压力会导致视网膜脱离。 - 把眼睛简单地放在磷酸盐缓冲盐水 (PBS) 中的4% 甲醛, 以稳定之前, 使一个初步的孔在角膜缘通过施加轻压力与尖端的手术刀。
- 显微镜下, 用解剖剪刀沿角膜缘切开切除角膜, 在 PBS 中 2–4 4% 甲醛前取出晶状体。
- 在 Sörensen 的磷酸盐缓冲液中依次冲洗10% 蔗糖和25% 蔗糖。
- 在 Yazulla 培养基中嵌入3% 明胶, 从猪皮肤和30% 白蛋白的鸡肉蛋清。
注意: 该协议可以暂停与组织存储在-20 °c。
- 用手术刀使大鼠眼睑的后、前0.5 厘米狭缝。
-
全装
- 用手术刀使大鼠眼睑后、前0.5 厘米狭缝。
- 用镊子抓住眼睛, 小心地倾斜到侧面, 露出周围的组织。在结缔组织和肌肉组织中用解剖剪刀剪 Enucleate 眼睛。
注意: 不要太用力拉眼睛, 因为视神经过度的压力会导致视网膜脱离。 - 把眼睛简单地放在 PBS 中的4% 甲醛, 以稳定之前, 使一个初始孔在角膜缘通过施加轻压力与尖端的手术刀。
- 显微镜下, 用解剖剪刀沿角膜缘切开, 取出角膜, 用镊子摘除晶状体。
- 用小开口运动将视网膜从视网膜色素上皮分离到视神经, 避免大撕裂。
- 在视神经上用解剖剪刀释放视网膜, 从视网膜外围向视神经头发出四个毫米长的狭缝。
- 将视网膜传播到玻璃滑梯上, 并允许干燥5–10分钟。
- 通过将甲醛滴入视网膜, 固定在4% 甲醛中20–30分钟。
注意: 不要直接在视网膜上应用, 因为它可能与玻璃分离。 - 用 PBS 冲洗。为达到最佳效果, 冲洗后直接进行免疫染色。
-
低渗隔离
- 用手术刀使大鼠眼睑后、前0.5 厘米狭缝。
- 用镊子抓住眼睛, 小心地倾斜到侧面, 露出周围的组织。在结缔组织和肌肉组织中用解剖剪刀剪 Enucleate 眼睛。
注意: 不要太用力拉眼睛, 因为视神经过度的压力会导致视网膜脱离。 - 用手术刀尖端在角膜缘处做一个初始孔。
- 显微镜下, 用解剖剪刀沿角膜缘切开, 取出角膜, 用镊子摘除晶状体。
- 用镊子将视网膜色素上皮与视神经头分开, 用小开口运动来避免大撕裂。
- 在视神经上用解剖剪刀释放视网膜, 在24井板中将视网膜放置在1毫升的去离子水中, 在室温下用1.5 毫米振动轨道在 200 rpm 处摇动1小时。
注: 此后, 视网膜将出现较少定义的边缘。 - 添加 200 U DNAse 1 将裂解细胞碎片从视网膜血管中分离出来, 在室温下再摇动30分钟。
注: 残骸可能开始在水井中形成。 - 在去离子水中至少冲洗3次, 在 150–300 rpm 上摇动5分钟以去除神经细胞碎片。视网膜应该变得更加透明, 每次冲洗表明神经元细胞碎片的清除。
- 用深色的背景观察24井板, 清楚地看到透明的隔离视网膜血管。
- (可选): 如果血管在此时没有出现神经元层 (半透明), 则可以添加更多的冲洗步骤, 增加震动速度或使用吸管将液体吸到血管。
注意: 任一可选步骤都可能损坏血管。
- 在室温下固定10分钟1毫升4% 多聚甲醛, 在 pbs 中冲洗3次。
注意: 该协议可以暂停与组织存储在4°c。
2. 免疫组化
-
低温切片染色
- 将10µm 低温切片的明胶嵌入的视网膜作为垂直切片通过视神经和放置在玻璃滑动的冰冻切片, 让干燥 (至少1小时)。
- 用0.25% 海卫 X-100 (pbs t) 将玻璃滑梯浸入 pbs, 15 分钟。
- 滴 1:100 PDGFRβ和 1:500 NG2 主要抗体稀释在 PBS t + 1% BSA 到冷冻切片和孵化在孵化室4°c 过夜。
- 将玻璃滑梯浸入2倍于 pbs t 为15分钟和滴水1:100 抗鼠 Alexa 氟594联和1:100 抗兔 FITC 链二次抗体稀释在 pbs t 与 3% BSA 到冷冻切片。
- 在黑暗中在室温下孵化1小时的玻璃滑梯。
- 在 PBS-T 2x 15 分钟内冲洗玻璃滑梯。
注: 可选: 对于双重和三重免疫荧光染色, 顺序染色可以通过重复的过程, 从2.1.3 到2.1.6 三次, 分别进行。 - 安装带有 DAPI 和盖玻片的防褪色安装介质的染色冷冻切片。
-
全装染色
- 滴入全芒, 室温孵育15分钟。
- 倒入 1:100 PDGFRβ和 1:500 NG2 主要抗体稀释在 PBS t + 1% BSA 和孵化在潮湿的房间在4°c 过夜。
- 倒入和滴水在 PBS T, 以冲洗玻璃幻灯片在 2x 15 分钟。
- 1:100 抗兔 Cy2 和1:100 抗小鼠 Cy3-linked 二次抗体稀释在 PBS T 与 3% BSA 在室温下在潮湿的房间里孵化1小时在黑暗中。
- 在 2x 15 分钟的黑暗中, 倒入并滴在 PBS 上以冲洗。
注: 可选: 对于双重和三重免疫荧光染色, 顺序染色可以通过重复的过程, 从2.2.2 到2.2.5 三次, 分别进行。 - 安装含有 DAPI 和盖玻片的防褪色安装介质的染色全装。
-
低渗隔离血管的染色
- 用 100 rpm 和室温与500µL/井10% 驴血清稀释的 PBS 阻断低渗隔离脉管1小时。
- 在室温下孵化一夜, 在 100 rpm 与600µL/井 1:100 PDGFRβ和 1:500 NG2 主要抗体稀释在 PBS 10% 驴血清中。
- 在 pbs 中冲洗5分钟的视网膜网络 3x, 在1:100 个抗小鼠 Alexa 氟594联和1:100 个抗兔 FITC 链的二级抗体稀释在公共广播系统中, 在 10% rpm 和室温100小时内, 在黑暗中。
- 在 pbs 中冲洗5分钟, 在 0.2 DAPI 中孵育15分钟, 然后在黑暗中用 3x 5 分钟冲洗。
- 切断塑料巴斯德吸管的尖端, 用 PBS 滋润它, 并用它将视网膜网络转移到4井的玻璃室滑梯上。
注: 保湿步骤对避免视网膜血管粘附在巴斯德吸管内是很重要的。 - 展开视网膜血管。避免用镊子接触视网膜血管, 因为这会导致血管纠结。
注意: 展开可以通过倾斜的房间来回滑动或吸液滴到视网膜血管。 - 从水井中取出介质。液体的表面张力将把血管压扁到滑梯的底部。
- 确保正确的在显微镜下展开, 然后从燃烧室中取出塑料井。
- 安装有防褪色安装介质和盖玻片的染色血管。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
成功的协议提供三种不同的视网膜准备可视化微血管毛细血管。每种方法都使用 PDGFRβ和 NG2 免疫联合定位和毛细血管的独特位置环绕毛细血管内皮 foridentification。
随着低温切片, 神经元层可由 DAPI 标记核的荧光密度来识别, 内、深毛细血管丛含有毛细血管, 显示 PDGFRβ和 NG2 免疫反应 (图 1)。毛细血管在血管壁的独特位置可以被视为圆形或马蹄状的免疫反应在血管的外围 (图 1, 箭头) 或偶尔纵向切割船只 (图 1, 箭头)。
成功的可视化微血管毛细血管在成年大鼠全装制剂可以挑战14,20。PDGFRβ免疫反应在全装成人视网膜只导致一个非常微弱的信号 (没有显示)。NG2 染色概述了 abluminal 毛细血管强烈染色的内血管网络 (图 2)。
为获得成人大鼠视网膜血管网络的研究概况, 低渗离体大鼠视网膜血管网的免疫组化提供了一种可供选择的全支架方法。当成功地执行, 这种组织制备技术提供了整个视网膜微血管包括内和深毛细血管丛的概述。免疫组化染色的 pericytic 标记导致整个微血管网络显示 NG2 免疫反应在特定的血管细胞强烈响应 (图 3)。其中一些细胞也显示 PDGFRβ免疫反应 (图 3)。
仔细地展开组织是很重要的, 以获得良好的视网膜血管的概述。未充分展开可能导致在多个焦点层中设置血管, 使荧光成像变得困难 (图 4)。展开可以通过柔和的震动促进, 倾斜的房间来回滑动或吸液滴到视网膜血管。应注意的是, 视网膜毛细血管丛的解剖将导致血管床的一些覆盖。因此, 当扁平化到玻璃滑梯上时, 区分内部与更深的毛细管丛是有问题的。
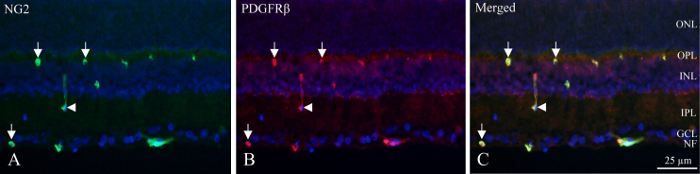
图 1: 双免疫组化周细胞染色的内鼠视网膜冷冻切片.(A) NG2 (绿色) 免疫组化揭示视网膜内部的阳性血管。箭头表示血管中的圆形和马蹄状的免疫反应。箭头指出了纵向切割的容器。(B) PDGFRβ (红色) 免疫组织化学表现出类似于 NG2 的反应性。箭头和箭头点在相同的结构 NG2 染色。(C) 图像通过叠加三个不同的过滤器, 显示了 NG2、PDGFRβ和 DAPI (蓝色) 的合并。结果表明, 这两种抗体是协同局部的 (绿色 + 红色 = 黄色)。NF: 神经纤维层, 协鑫: 神经节细胞层, 光子: 内网状层, INL: 内核层, OPL: 外层网状层, 一: 外层核层。请单击此处查看此图的较大版本.

图 2: 全装大鼠视网膜的免疫组化周细胞染色.NG2 (红色) 免疫反应是可见的沿表面血管 networkwith 强烈染色 abluminal 毛细血管。图像显示合并的 NG2 和 DAPI (蓝色)。神经元细胞可见于 NG2-stained 微血管间的 DAPI 蓝核。PDGFRβ免疫反应在全安装成人视网膜只导致一个非常微弱的信号, 因此不包括在这个数字。请单击此处查看此图的较大版本.

图 3: 双免疫组化周细胞染色的低渗大鼠视网膜血管.(A). 图像显示了低渗隔离大鼠视网膜血管网免疫组织化学染色的 NG2 (绿色) 和 PDGFRβ (红色)。完整的网络显示 NG2 免疫反应。然而, 在细胞 somas 中发现了 PDGFRβ免疫反应。A 的插入是对 DAPI (蓝色) 染色的视网膜血管网的概述。(B) 图像显示与 (a) 在不同位置的相同标本和更高的放大倍数。显然, PDGFRβ染色只显示在细胞 somas 的血管网络表明周细胞免疫。B 的插入是显示 NG2 (绿色)、PDGFRβ (红色) 和与 DAPI 合并的血管的高放大倍数的图像。包括 DAPI 染色与 NG2 和 PDGFRβ显示三毛细血管 (PDGFRβ阳性) 和两个不明血管壁细胞。请单击此处查看此图的较大版本.

图 4: 不充分展开的低渗隔离视网膜血管的例子.由于不充分的展开可能导致血管被堆积, 因此对低渗隔离血管的仔细展开是重要的。这些图片显示 DAPI 的视网膜血管在同一地点, 但采取了不同的焦点层。(A) 一个焦点层 DAPI 染色的细胞在视网膜血管中显示大约25µm 厚的血管。(B) 第二个聚焦层中的 DAPI 染色细胞阐明了在 (a) 所显示的较大血管上堆积的同一部位的细分支毛细血管。请单击此处查看此图的较大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
我们提出三种视网膜制备技术, 可用于微血管性视网膜毛细血管的研究。下面, 我们提供了两种方法之间的比较, 并突出显示了协议中的关键步骤。
随着低温切片, 视网膜被切割成矢状切片, 因此, 有可能获得来自同一视网膜的大量标本。这个方法产生的数字部分使它成为抗体特异性和滴定测试的理想选择, 因为它可以防止不必要的动物牺牲。筹备工作对取得好成绩是决定性的。这是至关重要的, 而解剖眼睛不要拉眼睛, 但削减所有的眼睛周围的肌肉。如果使用武力, 就有视网膜脱离的危险。因为眼杯很薄, 所以不应该太长。浸泡4% 多聚甲醛在 PBS 为 2–4 h 将修复组织。如果固定时间较长, 则有可能破坏感兴趣的抗原。为了产生最佳的 immunostainings, 它是关键的每一个部分是尽可能平坦的玻璃。因为这些部分只包含少量偶尔的横向裁减微血管, 这种组织准备技术只提供间歇性的微血管的可视化。因此, 该方法不适于对毛细血管的整体血管结构和量化指标进行研究。
整体的血管可以在整个安装后染色, 以提供血管的概述。当掌握这种技术, 它可以是一个快速的组织准备程序, 需要相对较少的工作量。不过, 有几点要特别注意。视网膜是脆弱的, 它是最重要的处理, 以照顾和避免撕裂和削减。此外, 在仔细处理视网膜时, 在安装过程中避免褶皱和其他裂缝可能会影响免疫组化成像是至关重要的。已安装的视网膜有250-300 µm 的厚度, 并且神经元层的抗体穿透可能有问题。在周细胞可视化方面, 全挂载协议中的 NG2 染色只能用 Cy3-linked 二级抗体来实现, 而在全装成人视网膜上的 PDGFRβ免疫反应导致了如此微弱的信号, 以至于没有显示在这个数字。因此, 全挂染色技术的实用性受到强烈的阻碍, 成功的染色主要取决于所使用的特定的主要和次要抗体。对成年大鼠视网膜可视化微血管丛的优化方案的进一步建议是通过在初级抗体的潜伏期长时间和/或改变潜伏期温度26。
由于整个安装的厚度, 重要的是要了解视网膜的方向后, 使四切口从视网膜外围向视神经头, 以避免意外安装与内视网膜含有毛细血管朝下。然而, 更深层次的微血管丛和毛细血管的详细可视化可能会困扰这个方法14,20。由于成人视网膜的全装染色在更深的毛细血管丛中是困难的, 这可能导致视网膜在某些部位出现缺血性。全装成人视网膜的免疫组化染色只提供了毛细血管血管在表面毛细血管丛中的微血管的概述, 因此, 这种方法可能导致假阴性结果在大鼠视网膜血管的可视化。
胰蛋白酶消化长期以来被认为是视网膜血管20的分离和可视化的金标准技术。低渗隔离为整个复杂的三维血管网络的可视化提供了一种替代方法, 并且面临着许多同样的挑战, 在非常脆弱的组织中很难处理。由于两种方法在视网膜血管产品中的相似性, 低渗隔离面临着许多与胰蛋白酶消化20相同的挑战, 包括仔细解剖, 以防止大的泪水和谨慎的处理, 避免吹打和钳接触。方法的一个重要区别是固定。胰蛋白酶消化通常是在固定后进行的, 可以成功地应用于保存在20年的固化视网膜上。低渗隔离是在固定之前进行, 从而允许在其他各种化验, 如文献23,24,25中所述的实施。胰蛋白酶消化在两天内进行20, 而低渗隔离可以在数小时内完成。此外, 低渗隔离协议不包括周细胞识别所需的膜标记过度消化和酶解裂的风险,如PDGFRβ和 NG2, 使此方法更适合以后免疫组化微血管染色。
最后, 虽然从这篇手稿的直接范围, 有一个不太广泛的已知, 但非常有用的技术, 以隔离大, 完整的微血管树脂从啮齿动物的视网膜27。视网膜位于一个特殊的玻璃室和盖玻片。切除盖玻片后, 微血管仍然附着在盖玻片上, 以创建一个完全活的 (≈98% 细胞) 组织打印。这种方法最大的优点是它允许对血管的生理研究和随后的染色固定。该方法的一个明显的局限性是, 它不提供整个微血管网络的可视化/隔离, 因为视网膜扁平安装和低渗准备。然而, 毛细血管可以通过这种方法27的应用来可视化。
这里描述的三种组织制备技术是互补的, 每一种方法都包括微血管毛细血管可视化的优点和缺点。对每种方法的电位和弱点进行评估, 对于选择特定病理条件下微血管毛细血管的最佳方法具有重要意义。该方法不仅可用于周细胞标志物的染色, 而且可以用于一般的微血管结构的可视化。最后, 对于个体研究者来说, 选择合适的可视化方法是基于研究假设的。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
这项研究由丹麦 Lundbeck 基金会资助。
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



