Summary
Viser vi tre ulike vev forberedelser teknikker for immunohistochemical visualisering av rotte retinal mikrovaskulær pericytes, dvs. cryo-partiene, hele-montere og hypotonisk isolasjon av vaskulære nettverket.
Abstract
Netthinnen pericytes spiller en viktig rolle i mange sykdommer i øyet. Immunohistochemical flekker teknikker av netthinnen fartøy og mikrovaskulær er pericytes sentrale i ophthalmological forskning. Det er viktig å velge en passende metode for å visualisere mikrovaskulær pericytes. Vi beskriver retinal mikrovaskulær pericyte immunohistochemical farging i cryo-inndelinger, hele-montere og hypotonisk isolert blodkar bruker antistoffer for blodplater-avledet vekst faktor reseptor β (PDGFRβ) og nerve/glial antigen 2 (NG2). Dette tillater oss å markere fordeler og svakheter av hver av de tre vev forberedelsene for visualisering av netthinnen mikrovaskulær pericytes. Cryo-deler gir transsectional visualisering av alle retinal lag, men inneholder bare noen sporadiske tverrgående kutt av microvasculature. Hele-mount gir en oversikt over det hele retinal blodkar, men visualisering av microvasculature kan være plagsom. Hypotonisk isolasjon gir en metode for å visualisere hele retinal blodkar ved fjerning av neuronal celler, men dette gjør vevet svært skjøre.
Introduction
Netthinnen pericytes er fokus for mange forskningslaboratorier som disse cellene spille en viktig rolle i integritet er blodkar. Patologiske tilstander som diabetisk retinopati1, iskemi2og glaukom3 har vaskulære egenskaper som involverer funksjonen til pericytes. Pericytes finnes i de indre retinal kapillært plexuses. Den sentral retinal arterien som leverer indre netthinnen hopper inn i to lag av kapillær plexuses. Indre vaskulær sengen ligger mellom ganglion celle- og indre kjernefysiske lag. De dypere lag er mer tett og komplekse og er lokalisert mellom indre og ytre kjernefysiske lag4,5. I tillegg inneholde deler av netthinnen også en tredje nettverk kalt radial parapapillary kapillærene. Disse er lange, rette kapillærene som ligger blant nervefibrene og sjelden anastomose med hverandre eller andre to plexuses6. I kapillær veggen, pericytes er innebygd i kjelleren membranen og linje abluminal siden av vaskulær endotelceller.
Til denne datoen er det ingen unik biologiske markør for disse pericytes som kan skille dem fra andre vaskulære celler. Blodplater-avledet vekst faktor reseptor β (PDGFRβ) og nerve/glial antigen 2 (NG2) er vanlige markører som begge presenterer på pericytes men også andre vaskulære celler. Identifikasjon av pericytes kompliseres ytterligere av eksistensen av pericyte delsett som varierer i morfologi og protein uttrykk7. Foreløpig bruker best identifikasjon en kombinasjon av protein markører og karakteristiske plasseringen av pericyte i vaskulære veggen. Her viser vi tre ulike vev forberedelser teknikker for immunohistochemical PDGFRβ/NG2 farging av rotte retinal mikrovaskulær pericytes, dvs., cryo-partiene, hele-montere og hypotonisk isolasjon av vaskulære nettverket.
I cryo-deler skjære netthinnen og sclera gjennom den optiske nerven. Dette gir visualisering av alle lag strukturer av neurons. De forskjellige ti lag av netthinnen er som interchanging kjernefysiske og axonal/dendrittiske strukturer som kan visualiseres med flekker som hematoxylin/eosin eller fluorescerende kjernefysiske 4', 6-diamidino-2-phenylindole (DAPI)8. Metabolsk kravene varierer mellom lag9 , og det gir en metode for å fastslå tykkelse eller totalt fravær av et bestemt lag (f.ekstap av netthinnen ganglieceller er ett av kjennetegnene på netthinnen iskemi10, 11). Er blodkar er tydelig som tverrgående skjærer gjennom netthinnen, som gjør det mulig å studere separat kapillært plexuses i de respektive retinal lag12,13.
Mer tradisjonelt utføres undersøkelser av netthinnen blodkar nettverk retinal hele-monteringer. Med dette vev preparatet, er netthinnen kuttet og flat som en blomst-formet struktur. Metoden er en relativt rask vev forberedelse teknikk som kan fremheve den generelle arkitekturen retinal blodkar og det er derfor ofte brukt i etterforskningen av neovascularization i murine netthinnen. Vellykket visualisering av microvasculature i hele montert Netthinne rapporteres også i utviklingsland neonatal musen og rotten netthinnen14,15,16,17,18, 19. disse studiene avsløre en mer definert pericytic aktivitet med større kapillær-fri områder i voksen sammenlignet med den nyfødte Netthinne14.
En annen måte å visualisere er netthinnen microvasculature etter hypotonisk isolasjon. Denne vev forberedelse teknikken resulterer i netthinnen blodårer og blodkar frigjort neuronal cellene. Denne typen todimensjonal avbilding av isolerte retinal vaskulære nettverket er vanligvis utført etter retinal trypsin fordøyelsen20 og brukes til å vurdere den vaskulære unormalt diabetisk retinopati inkludert pericyte tap og kapillær degenerasjon20,21,22. Metoden hypotonisk isolasjon tilbyr undersøkelser av netthinnen vaskulær genet og protein regulatoriske svar som de har blitt gjort med RT PCR og vestlige blotting23,24,25. Vi gir her en protokoll for fri-flyt immunohistochemical farging av er hypotonisk isolert retinal blodkar som et alternativ til trypsin fordøyelsen undersøke mikrovaskulær pericytes.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protokollen var optimalisert og demonstrert på voksne mannlige albino rotter. I alle eksperimentelle prosedyrer, ble dyrene behandlet i henhold til regelverket i ARVO erklæringen for bruk av dyr i Ophthalmic og visjon forskning. Dyrene var euthanized av karbondioksid og påfølgende cervical forvridning.
1. rotte netthinnen vev forberedelser
-
Cryo-delen
- Gjøre bakre og fremre ~0.5 cm åpninger for i rotte øyelokket med skalpell.
- Valgfritt: Bruker en diathermy brenner, merke øyet i indre vinkel å orientere øyet på en ensartet måte under innebygging og tillate loddrett kryostaten snitting gjennom den optiske nerven.
- Fange øyet med tang og tilt forsiktig til side å avsløre de omkringliggende vev. Enucleate øyet å kutt med disseksjon saks i connective og muskel vev.
FORSIKTIG: Ikke dra øyet for hardt overdreven trykk på synsnerven kan forårsake Netthinneavløsning. - Sett øyet kort i 4% formaldehyd i fosfat-bufret saltvann (PBS) å stabilisere før du gjør en første hullet på hornhinnen limbus ved å bruke lett trykk med spissen av en skalpell.
- Under et mikroskop, kutt langs den hornhinnen limbus med disseksjon saks fjerne hornhinnen og fjern linsen med tang før submerging i 4% formaldehyd i PBS for 2-4 h.
- Skyll sekvensielt i Sörensens fosfatbuffer med 10% sukrose og 25% sukrose.
- Bygge i Yazulla medium med 3% gelatin fra svin hud og 30% albumin fra kylling egg hvitt.
Merk: Protokollen kan pauses her med vev lagring på 20 ° C.
- Gjøre bakre og fremre ~0.5 cm åpninger for i rotte øyelokket med skalpell.
-
Hele-mount
- Gjøre bakre og fremre ~0.5 cm åpninger i rotte øyelokket med skalpell.
- Fange øyet med tang og tilt forsiktig til side å avsløre de omkringliggende vev. Enucleate øyet å kutt med disseksjon saks i connective og muskel vev.
FORSIKTIG: Ikke dra øyet for hardt overdreven trykk på synsnerven kan forårsake Netthinneavløsning. - Kort sagt øyet i 4% formaldehyd i PBS å stabilisere før du gjør en første hullet på hornhinnen limbus ved å bruke lett trykk med spissen av en skalpell.
- Under et mikroskop, Skjær langs den hornhinnen limbus med disseksjon saks fjerne hornhinnen og fjern linsen med tang.
- Skille netthinnen fra netthinnens pigment epitel mot synsnerven med tang bruker liten åpning bevegelser for å unngå store rive.
- Gratis netthinnen på synsnerven med disseksjon saks og fire spalter noen millimeter lengde fra netthinnen periferien mot synsnerven hodet.
- Spre netthinnen på et glass lysbilde og la tørke i 5-10 min.
- Fikse på 4% formaldehyd i 20-30 minutter av dryppende formaldehyd på netthinnen.
Advarsel: Ikke bruk direkte på netthinnen som det løsne fra glass. - Skyll med PBS. For optimale resultater, immuno-flekken rett etter skylling.
-
Hypotonisk isolasjon
- Gjøre bakre og fremre ~0.5 cm åpninger i rotte øyelokket med skalpell.
- Fange øyet med tang og tilt forsiktig til side å avsløre de omkringliggende vev. Enucleate øyet å kutt med disseksjon saks i connective og muskel vev.
FORSIKTIG: Ikke dra øyet for hardt overdreven trykk på synsnerven kan forårsake Netthinneavløsning. - Gjør en første hullet på hornhinnen limbus ved å bruke lett trykk med spissen av en skalpell.
- Under et mikroskop, Skjær langs den hornhinnen limbus med disseksjon saks fjerne hornhinnen og fjern linsen med tang.
- Skille netthinnen fra netthinnens pigment epitel mot synsnerven hodet med tang bruker liten åpning bevegelser for å unngå store rive.
- Gratis netthinnen på synsnerven med disseksjon saks, plassere netthinnen i 1 mL av deionisert vann i en 24-vel plate og riste på 200 rpm med en 1,5 mm vibrasjon bane 1t ved romtemperatur.
Merk: Heretter, netthinnen vises mindre definert på kantene. - Legge til 200 U DNAse 1 for å dissociate lysed celle rusk fra er netthinnen blodkar og riste for en annen 30 min ved romtemperatur.
Merk: Rusk kan begynne å danne i brønnene. - Skyll minst 3 ganger i deionisert vann i 5 min med skjelvende på 150-300 rpm fjerne neuronal celle rusk. Netthinnen skal bli mer gjennomsiktig med hver skylling indikativ av fjerning av neuronal mobilnettet rusk.
- Bruke en mørk bakgrunn for å se inn i 24-vel plate tydelig se den diaphanous isolert retinal blodkar.
- (Valgfritt): Hvis er blodkar ikke vises gratis neuronal lag (semi-transparent) på dette punktet Legg skyll skritt, risting fortere eller bruke en Pipetter inneholder væske inn i blodkar.
FORSIKTIG: En av de valgfrie trinnene kan skade er blodkar.
- Fikse 10 min i 1 mL av 4% paraformaldehyde i PBS ved romtemperatur og skyll 3 ganger på PBS.
Merk: Protokollen kan pauses her med vev lagring på 4 ° C.
2. Immunohistochemistry
-
Farging av cryo-deler
- Skjær 10 µm cryo-deler av gelatin-embedded netthinnen som vertikale snitting gjennom den optiske nerven og Legg cryo-delene på et glass lysbilde og la tørr (minimum 1 h).
- Dukke av objektglass i PBS med 0,25% Triton X-100 (PBS-T) i 15 min.
- Dryppe 1: 100 PDGFRβ og 1:500 NG2 primære antistoffer fortynnet i PBS-T + 1% BSA på cryo-delen og ruge i inkubasjon chambers på 4 ° C over natten.
- Dukke av objektglass 2 ganger i PBS-T i 15 min og dryppe 1: 100 anti-musen Alexa Fluor 594 knyttet og 1: 100 anti-kanin FITC-tilknyttet sekundære antistoffer fortynnet i PBS-T med 3% BSA på cryo-delene.
- Inkuber objektglass 1t ved romtemperatur i mørket.
- Skyll av objektglass i PBS-T 2 x 15 min.
Merk: Valgfritt: For dobbel og trippel immunofluorescent flekker, sekvensielle flekker kan utføres ved å gjenta prosedyren fra 2.1.3 til 2.1.6 to og tre ganger, henholdsvis. - Montere farget cryo-delene med anti-filtrert montering medium som inneholder DAPI og en dekkglassvæske.
-
Farging av hele-mount
- Dryppe PBS-T på hele-fjellet og ruge ved romtemperatur i 15 min.
- Hell av og dryppe 1: 100 PDGFRβ og 1:500 NG2 primære antistoffer fortynnet i PBS-T + 1% BSA og ruge i fuktig rom på 4 ° C over natten.
- Hell av og dryppe på PBS-T skylle av objektglass i 2 x 15 min.
- Hell av og dryppe på 1: 100 anti-kanin Cy2- og 1: 100 anti-musen Cy3 knyttet sekundære antistoff fortynnet i PBS-T med 3% BSA å ruge 1t i et fuktig kammer ved romtemperatur i mørket.
- Hell av og dryppe på PBS-T skylle i 2 x 15 min i mørket.
Merk: Valgfritt: For dobbel og trippel immunofluorescent flekker, sekvensielle flekker kan utføres ved å gjenta prosedyren fra 2.2.2 til 2.2.5 to og tre ganger, henholdsvis. - Montere farget hele-mount med anti-filtrert montering medium som inneholder DAPI og en dekkglassvæske.
-
Farging av hypotonisk isolert blodkar
- Blokkere er hypotonisk isolert blodkar 1t med skjelvende ved 100 rpm og romtemperatur med 500 µL/vel av 10% esel serum fortynnet i PBS.
- Ruge over natten i romtemperatur og riste på 100 rpm med 600 µL/godt av 1: 100 PDGFRβ og 1:500 NG2 primære antistoffer fortynnet i 10% esel serum i PBS.
- Skyll retinal nettverk 3 x i PBS i 5 min og ruge i 1: 100 anti-musen Alexa Fluor 594 knyttet og 1: 100 anti-kanin FITC-tilknyttet sekundære antistoffer fortynnet i 10% esel serum i PBS risting ved 100 rpm og romtemperatur 1t i mørket.
- Skyll i PBS-T i 5 min og ruge i 0,2 ng/mL DAPI i PBS-T i 15 min etterfulgt av 3 x 5 min skyller i PBS-T i mørket.
- Kutte spissen av en plast Pasteur Pipetter, fukte den med PBS-T og bruke den overføre retinal nettverket til en 4-vel kammer objektglass.
NOTE Det moistening trinnet er viktig å unngå er netthinnen blodkar stikker til innsiden av Pasteur pipetter. - Brette er netthinnen blodkar. Unngå å berøre er netthinnen blodkar med tang idet denne kanne anledning er blodkar å floke.
Merk: Unfolding kan gjøres ved å vippe kammer lysbildet og tilbake eller aspirating dråper flytende på netthinnen blodkar. - Fjerne mediet fra brønnene. Overflatespenning av væsken vil flat blodkar på bunnen av lysbildet.
- Sikre riktig unfolding under et mikroskop før fjerner plast brønner fra kammeret lysbildet.
- Montere er farget blodkar med anti-filtrert montering medium og en dekkglassvæske.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vellykket protokollene gir tre forskjellige retinal forberedelser for å visualisere mikrovaskulær pericytes. Hver av disse metodene bruker den PDGFRβ og NG2 immunoreactivity co lokaliseringen og den unike posisjonen i pericytes som brytes rundt kapillær endotelet foridentification.
I cryo-deler, neuronal lagene kan identifiseres av fluorescerende tettheten av DAPI-merket kjerner og indre og dypt kapillært plexuses inneholder pericytes som viser PDGFRβ og NG2 immunoreactivity (figur 1). Den unike plasseringen av pericytes i vaskulære veggen sees sirkulær eller hesteskoformede immunoreactivity i utkanten av fartøyene (figur 1, piler) eller sporadisk kutt langs fartøy (figur 1, pilspiss).
Vellykket visualisering av den mikrovaskulær pericytes hele-mount forberedelse av voksen rotte kan være utfordrende14,20. PDGFRβ immunoreactivity i hele montert voksen netthinnen resulterte i et meget svakt signal (vises ikke). NG2 flekker skissert indre vaskulære nettverket med intens farging i abluminal pericytes (figur 2).
For å få en oversikt over vaskulære nettverket av netthinnen som voksen rotten, gir immunhistokjemi av hypotonisk isolert rotte retinal vaskulære nettverket en alternativ metoden for hele-mount. Når utført, gir denne vev forberedelse teknikken en oversikt over det hele retinal microvasculature inkludert indre og dypt kapillært plexuses. Immunohistochemical flekker med pericytic indikatorer resulterer i hele mikrovaskulær nettverket viser NG2 immunoreactivity med en intens reaksjon i spesifikke vaskulære celler (Figur 3). Noen av disse cellene også vise PDGFRβ immunoreactivity (Figur 3).
En forsiktig unfolding av vev er viktig å få en god oversikt over er netthinnen blodkar. Utilstrekkelig unfolding kan resultere i blodkar blir arrangert i flere fokus lag som gjør fluorescerende imaging vanskelig (Figur 4). Unfolding kan ordnes av mild risting, vippe kammer lysbildet og tilbake eller aspirating dråper flytende på netthinnen blodkar. Det bør bemerkes at anatomi av netthinnen kapillært plexuses vil resultere i noen overlapping av vaskulær senger. Derfor er det problematisk å skille indre fra de dypere kapillært plexuses når flat på av objektglass.
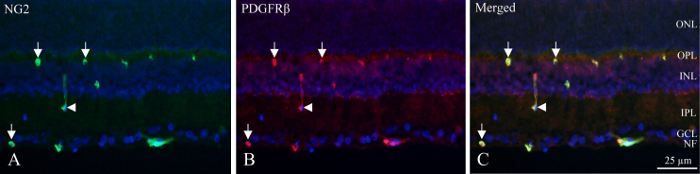
Figur 1: dobbel immunohistochemical pericyte farging av cryo-delen av netthinnen som indre rotte. (A) NG2 (grønn) immunohistochemistry avslører positiv skip i den indre delen av netthinnen. Pilene angir rundp og hesteskoformede immunoreactivity i fartøyer. Pilspissen peker en langs kutt fartøy. (B) PDGFRβ (rød) immunohistochemistry viser reaktivitet ligner på NG2 immunoreactivity. Piler og Pilspissen peker du på de samme strukturene som NG2 flekker. (C) bildet viser en sammenslåing av NG2, PDGFRβ og DAPI (blå) ved å legge til tre forskjellige filtre. Det er avslørt at to antistoffer er samlokalisert (grønn + rød = gul). NF: nerve fiber lag, GCL: ganglion celle lag, IPL: indre plexiform lag, INL: indre kjernefysiske laget, OPL: ytre plexiform lag, bare: ytre kjernefysiske lag. Klikk her for å se en større versjon av dette tallet.

Figur 2: Immunohistochemical pericyte farging av hele montert rotte netthinnen. NG2 (rød) immunoreactivity er synlige langs den overfladiske vascular networkwith intens farging i abluminal pericytes. Bildene viser flettede NG2 og DAPI (blå). Neuronal cellene vises som DAPI-blå kjerner mellom NG2-farget microvasculature. PDGFRβ immunoreactivity i hele montert voksen netthinnen resulterte i et meget svakt signal, og er derfor ikke inkludert i dette tallet. Klikk her for å se en større versjon av dette tallet.

Figur 3: dobbel immunohistochemical pericyte farging av hypotonisk isolert rotte retinal blodkar. (A). bildet viser hypotonisk isolert rotte retinal vaskulære nettverket immunohistochemical med NG2 (grønn) og PDGFRβ (rød). Komplett nettverket viste NG2 immunoreactivity. Men ble PDGFRβ immunoreactivity funnet i celle somas. Sett inn a er en oversikt over retinal blodkar nettverk farget med DAPI (blå). (B) bildet viser samme prøven som (A) til en annen plassering og høyere forstørrelse. Det er klart at PDGFRβ flekker bare vises i celle somas i vaskulære nettverket som viser pericyte immunoreactivity. Sett inn b er bildet som viser forstørring av blodkar farget med NG2 (grønn), PDGFRβ (rød) og slått sammen med DAPI. Inkludert DAPI flekker NG2 og PDGFRβ avslører tre pericytes (PDGFRβ-positive) og to uidentifisert fartøyet veggen celler. Klikk her for å se en større versjon av dette tallet.

Figur 4: eksempel på en utilstrekkelig ufalsede hypotonisk isolert retinal blodkar. Forsiktig utfoldelsen av en hypotonisk isolert blodkar er viktig som utilstrekkelig unfolding kan resultere i blodkar det stablet. Bildene viser DAPI-farget retinal blodkar på samme sted men tatt i ulike fokus lag. (A) den DAPI-farget celler i et fokus laget viser en ca. 25 µm tykt blod fartøy i er netthinnen blodkar. (B) The DAPI-farget celler i et ekstra fokus lag belyse tynn forgrening kapillærene på samme sted som har blitt stablet på større blodkaret vises i (A). Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vi presenterer tre retinal forberedelser teknikker som kan brukes i studiet av mikrovaskulær retinal pericytes. Nedenfor vi tilbyr en sammenligning mellom hver av metodene og markere avgjørende skritt i protokoller.
Med cryo-snitting netthinnen er kuttet i sagittal deler og derfor er det mulig å få mange eksemplarer fra samme netthinnen. Numeriske delene som følge av denne metoden gjør det et ideelt valg for antistoff spesifisitet og titrering testing som det forhindrer unødvendige dyr offer. Det forberedende arbeidet er avgjørende for gode resultater. Det er avgjørende mens dissekere øyet ikke å trekke øyet, men å kutte alle musklene rundt øyet. Det er en risiko for Netthinneavløsning hvis styrken brukes. Fordi øyet koppen er tynn, bør en ikke fastsette for lang. Nedsenking med 4% paraformaldehyde i PBS for 2-4 h rette vevet. Hvis fast lenger, er det en risiko for å ødelegge antigen rundt. For å generere den best mulig immunostainings, er det avgjørende for hver del å være så flat som mulig mot glasset. Fordi delene inneholder bare noen sporadiske tverrgående kutt av microvasculature, tilbyr denne vev forberedelser teknikken bare forbigående visualisering av microvasculature. Derfor, denne metoden er ikke egnet for studier av samlede vaskulære arkitektur og målbare mål for pericytes.
Den samlede blodkar kan være farget etter hele-montering å gi en oversikt over er blodkar. Når mestre denne teknikken, kan det være en rask vev forberedelse prosedyre som krever relativt liten arbeidsmengde. Men er det noen punkter å være spesielt oppmerksom på. Netthinnen er skjør, og det er avgjørende å håndtere dem forsiktig og unngå riper og kutt. Videre mens forsiktig håndtering netthinnen, er det viktig å unngå folder og andre sprekker under montering som kan påvirke immunohistochemical imaging senere. Montert netthinnen har en tykkelse på 250-300 µm og antistoff penetrasjon av neuronal lag kan være problematisk. I forhold til pericyte visualisering, den NG2 flekker i hele-mount protokollen kan bare oppnås med et Cy3-tilknyttet sekundære antistoff, og PDGFRβ immunoreactivity i hele montert voksen netthinnen resulterte i slike et meget svakt signal om at det ikke var vist i figuren. Dermed er nytten av hele-mount flekker teknikken sterkt hindret av den vellykkede flekker avhengig hovedsakelig på bestemte primære og sekundære antistoffer brukes. Ytterligere forslag å optimalisere protokollen for visualisert mikrovaskulær plexuses av en voksen rotte netthinnen er av inkubasjon i primære antistoff for en lengre periode av tid og/eller endre inkubasjon temperatur26.
På grunn av tykkelsen av det hele-montert er det viktig å være oppmerksom på retningen på netthinnen etter de fire incisions fra netthinnen periferien mot synsnerven hodet å unngå utilsiktet montering med indre netthinnen som inneholder kapillærene vender ned. Likevel, detaljert visualisering av de dypere mikrovaskulær plexuses og pericytes kan være plagsom med denne metoden14,20. Som helhet-mount farging av voksen netthinnen er vanskelig i den dypere kapillær plexus, kan dette resultere i netthinnen vises avascular i deler. Den immunohistochemical flekker av hele montert voksen netthinnen gir bare en fragmentert oversikt over blodkar med pericytes fôr fartøyene i den overfladiske kapillær plexus og derfor denne metoden kan føre til falske negative resultater i den visualisering av rotte retinal blodkar.
Trypsin fordøyelsen har lenge vært vurdert gullstandarden teknikken for isolasjon og visualisering av netthinnen blodkar20. Hypotonisk isolasjon gir en alternativ metode for visualisering av hele komplekse tredimensjonale vaskulære nettverket og møter mange av de samme utfordringene arbeider med svært skjøre vev som er vanskelig å håndtere. På grunn av likheten i netthinnen vaskulær produktet mellom de to metodene, hypotonisk isolasjon står overfor mange av de samme utfordringene som trypsin fordøyelsen20 inkludert forsiktig disseksjon å hindre store tårer og forsiktig håndtering ved å unngå pipettering og rørende med tang. En viktig forskjell mellom metodene som fiksering. Trypsin fordøyelsen er vanligvis gjort etter fiksering og kan brukes med hell på bevarte Netthinne som har vært i bindemiddel for flere år20. Hypotonisk isolasjon utføres før fiksering og dermed tillater gjennomføring i ulike andre analyser som tidligere beskrevet i litteraturen23,24,25. Trypsin fordøyelsen utføres over to dager20, mens hypotonisk isolasjon kan fullføres innen timer. Videre hypotonisk isolasjon protokollen inkluderer ikke risikoen for over fordøyelsen og enzymatiske spalting av membran markører kreves for pericyte anerkjennelse, f.eks PDGFRβ og NG2, gjør denne metoden foretrekkes for etterfølgende Immunohistochemical mikrovaskulær flekker.
Til slutt, selv ut umiddelbare omfanget av dette manuskriptet, det er en mindre kjente, men svært nyttig teknikk for å isolere store, intakt mikrovaskulær plexi fra gnager ut av netthinnen27. Netthinnen plasseres i spesielle kammer og dekkglassvæske. Ved fjerning av dekkglassvæske, microvasculature restene knyttet til dekkglassvæske til å opprette en fullt levende (≈ 98% av celler) vev ut. Den største fordelen med denne metoden er at det tillater fysiologiske studiet av fartøy og påfølgende fiksering for immunostaining. En tydelig begrensning av metoden er at det gir ikke visualisering/isolasjon av hele mikrovaskulær nettverket som netthinnen flat mount og hypotonisk forberedelser. Likevel kan pericytes visualiseres ved denne metoden27.
Tre vev forberedelser teknikker beskrevet her er komplementære i den forstand at hver metode har fordeler og mangler for visualisering av mikrovaskulær pericytes. Vurdering av hver metoder potensialer og svakheter er viktig å velge den optimale metoden for å undersøke den mikrovaskulær pericytes under bestemte patologiske forhold. Metodene demonstrert kan utvides til farging ikke bare for pericyte markører, men også for visualisering av mikrovaskulær strukturer generelt. Til slutt, er det for individuelle forskeren til Velg riktig visualisering basert på forskning hypotesen i spørsmålet.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Forskningen ble finansiert av The Lundbeck Foundation, Danmark.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



