Summary
Vi visar tre tekniker för beredning av olika vävnad för immunhistokemiska visualisering av råtta retinal mikrovaskulära pericyter, dvs cryo-avsnitt, hela-fästen och hypoton isolering av vaskulära nätverket.
Abstract
Retinal pericyter har en viktig roll vid många sjukdomar i ögat. Immunohistokemisk färgningsteknik av retinala kärl och mikrovaskulära är pericyter centrala för oftalmologisk forskning. Det är viktigt att välja en lämplig metod att visualisera de mikrovaskulära pericyter. Vi beskriver retinal mikrovaskulära pericyt immunhistokemisk färgning i cryo-avsnitt, hela-fästen och hypoton isolerade vaskulatur använder antikroppar för trombocyt-härrör tillväxtfaktor receptor β (PDGFRβ) och nerv/gliaceller antigen 2 (NG2). Detta tillåter oss att belysa fördelar och brister av varje av de tre vävnad förberedelserna för visualisering av den retinala mikrovaskulära pericyter. Cryo-avsnitten ger transsectional visualisering av alla retinala lager men innehåller endast några enstaka tvärgående nedskärningar av mikrocirkulation. Hela-mount ger en översikt över den hela retinala kärl, men visualisering av mikrocirkulation kan vara besvärande. Hypoton isolering ger en metod för att visualisera den hela retinala blodkärlen genom avlägsnande av neuronala celler, men detta gör vävnaden mycket bräcklig.
Introduction
Retinal pericyter är i fokus för många forskningslaboratorier som dessa celler spelar en viktig roll i integriteten av kärlsystemet. Sjukdomstillstånd såsom diabetesretinopati1, ischemi2och glaukom3 har vaskulära egenskaper som involverar funktionen av pericyter. Pericyter finns i de inre retinal kapillär plexuses. Den centrala retinal artär som förser inre näthinnan grenarna i två lager av kapillär plexuses. Inre vaskulär sängen ligger mellan ganglion cell och inre nukleära lager. Det djupa lagret är mer tät och komplex och är lokaliserad mellan den inre och yttre nukleära lager4,5. Dessutom innehåller vissa delar av näthinnan också ett tredje nätverk som kallas radiell parapapillary kapillärerna. Dessa är långa, raka kapillärer som ligger bland nervfibrerna och sällan anastomose med varandra eller de andra två plexuses6. Inom kapillär väggen, pericyter är inbäddade i basalmembranet och linje abluminal sidan av vaskulära endotelceller.
Till detta datum finns det ingen unik biologisk markör av dessa pericyter som kan skilja dem från andra vaskulära celler. Trombocyt-härrör tillväxtfaktor receptor β (PDGFRβ) och nerv/gliaceller antigen 2 (NG2) är vanliga markörer som båda presenterar på pericyter men också andra vaskulära celler. Identifiering av pericyter kompliceras ytterligare av förekomsten av pericyt delmängder som varierar i morfologi och protein uttryck7. För närvarande bygger bästa identifieringen på en kombination av protein markörer och karakteristiska placeringen av pericyt i kärlväggen. Här visar vi tre tekniker för beredning av olika vävnad för immunhistokemiska PDGFRβ/NG2 färgning av råtta retinal mikrovaskulära pericyter, dvs, cryo-avsnitt, hela-fästen och hypoton isolering av vaskulära nätverket.
Med kryo-sektioner skärs näthinnan och sklera genom synnerven. Detta möjliggör visualisering av alla skiktade strukturer av nervceller. De distinkta tio lagrarna av näthinnan är uppenbara som utbyta kärn- och axonal/dendritiska strukturer som kan visualiseras med fläckar såsom hematoxylin/eosin eller fluorescerande nukleära 4', 6-diamidin-2-fenylindol (DAPI)8. De metabola krav skiljer sig mellan de lager9 och det ger en metod för att bestämma tjocklek eller total avsaknad av ett visst lager (t.ex., förlusten av retinala ganglionceller är ett av kännetecknen av retinal ischemi10, 11). I kärlsystemet är uppenbart eftersom tvärgående skär genom näthinnan, vilket gör det möjligt att separat studera de kapillära plexuses inom de respektiva retinal lager12,13.
Mer traditionellt, utförs utredningarna av retinal vaskulatur nätverket i näthinnans hela-fästen. Med denna vävnad förberedelse, näthinnan skärs och tillplattad som en blomma-formad struktur. Metoden är en relativt snabb vävnad förberedelse teknik som kan belysa den övergripande arkitekturen retinala blodkärlen och det används därför ofta i utredningen av kärlnybildning i murina näthinnan. Lyckad visualisering av mikrocirkulation i hela monterade näthinnor rapporteras också i utvecklingsländer neonatal mus och råtta näthinnan14,15,16,17,18, 19. dessa studier avslöja en mer definierad pericytic aktivitet med större kapillär-fria områden i den vuxna jämfört med den neonatala näthinna14.
Ett annat sätt att visualisera är den retinala mikrocirkulation efter hypoton isolering. Denna vävnad förberedelse teknik resulterar i näthinnans blodkärl och kapillärer att vara befriad från de neuronala cellerna. Denna typ av tvådimensionell avbildning av det isolerade retinal vaskulär nätverket är vanligtvis utförs efter retinal trypsin matsmältningen20 och används för att bedöma de vaskulära avvikelserna av diabetesretinopati inklusive pericyt förlust och kapillär degeneration20,21,22. Metoden hypoton isolering erbjuder utredningarna av retinala vaskulära genen och protein reglerande svaren som de har gjorts med RT-PCR och western blotting23,24,25. Vi ger här ett protokoll för den fri-float immunhistokemisk färgning av den hypoton isolerade retinala blodkärlen som ett alternativ till trypsin matsmältningen att undersöka de mikrovaskulära pericyter.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protokollet var optimerad och visade på vuxna manliga albino råttor. I alla experimentella rutiner behandlades djur enligt reglementet i uttrycket ARVO för användning av djur i oftalmologiska och Vision forskning. Djur var euthanized av koldioxid och efterföljande cervikal dislokation.
1. råtta näthinnevävnad preparat
-
Cryo-avsnitt
- Gör bakre och främre ~0.5 cm springor i råtta ögonlocket med en skalpell.
- Valfritt: Använda en diatermi brännare, markera ögat i inre vinkel att orientera i ögat på ett enhetligt sätt under inbäddning och möjliggöra vertikala kryostaten snittningen genom synnerven.
- Ta ögat med pincett och luta försiktigt till sidan att exponera den omgivande vävnaden. Enucleate ögat genom nedskärningar med dissektion sax i bindväv och muskulatur.
FÖRSIKTIGHET: Dra inte ögat för hårt eftersom överdrivet tryck på synnerven kan orsaka näthinneavlossning. - Sätt ögat kort i 4% formaldehyd i fosfatbuffrad saltlösning (PBS) för att stabilisera innan du gör ett första hål i hornhinnan limbus av lätt tryck med spetsen på en skalpell.
- I Mikroskop, skär längs korneal limbus med dissektion sax för att ta bort hornhinnan och linsen med pincett innan dränka i 4% formaldehyd i PBS för 2-4 h.
- Skölj sekventiellt i Sörensens fosfatbuffert med 10% sackaros och 25% sackaros.
- Bädda in i Yazulla medium beredd med 3% gelatin från svin hud och 30% albumin från kyckling äggvita.
Obs: Protokollet kan pausas här med med vävnad lagring vid-20 ° C.
- Gör bakre och främre ~0.5 cm springor i råtta ögonlocket med en skalpell.
-
Hela-fäste
- Gör bakre och främre ~0.5 cm slitsar i råtta ögonlocket med en skalpell.
- Ta ögat med pincett och luta försiktigt till sidan att exponera den omgivande vävnaden. Enucleate ögat genom nedskärningar med dissektion sax i bindväv och muskulatur.
FÖRSIKTIGHET: Dra inte ögat för hårt eftersom överdrivet tryck på synnerven kan orsaka näthinneavlossning. - Sätt ögat kort i 4% formaldehyd i PBS att stabilisera innan du gör ett första hål i hornhinnan limbus av lätt tryck med spetsen på en skalpell.
- I Mikroskop, skär längs korneal limbus med dissektion sax för att ta bort hornhinnan och linsen med pincett.
- Separata näthinnan från pigmentepitelet mot synnerven med pincett med liten öppning rörelser för att undvika stora avrivning.
- Näthinnan i synnerven med dissektion sax och gör fyra slitsar av några millimeter längd från näthinnans periferi mot synnervspapillen.
- Sprida näthinnan på en glasskiva och låt torka i 5 – 10 min.
- Fixa i 4% formaldehyd i 20 – 30 min av droppande formaldehyd på näthinnan.
Varning: Inte tillämpas direkt på näthinnan som det kan lossna från glaset. - Skölj med PBS. För optimalt resultat, immuno-fläcken direkt efter sköljning.
-
Hypoton isolering
- Gör bakre och främre ~0.5 cm slitsar i råtta ögonlocket med en skalpell.
- Ta ögat med pincett och luta försiktigt till sidan att exponera den omgivande vävnaden. Enucleate ögat genom nedskärningar med dissektion sax i bindväv och muskulatur.
FÖRSIKTIGHET: Dra inte ögat för hårt eftersom överdrivet tryck på synnerven kan orsaka näthinneavlossning. - Gör en inledande hål på hornhinnan limbus av lätt tryck med spetsen på en skalpell.
- I Mikroskop, skär längs korneal limbus med dissektion sax för att ta bort hornhinnan och linsen med pincett.
- Separata näthinnan från pigmentepitelet mot synnervspapillen med pincett med liten öppning rörelser för att undvika stora avrivning.
- Gratis näthinnan i synnerven med dissektion sax, placera näthinnan i 1 mL avjoniserat vatten i ett 24-väl pläterar och skaka på 200 rpm med en 1,5 mm vibration bana för 1 h i rumstemperatur.
Obs: Nedan, näthinnan visas mindre definieras i kanterna. - Lägga till 200 U DNAS 1 för att dissociera lyserat cell skräp från den retinala blodkärlen och skaka för en annan 30 min i rumstemperatur.
Obs: Skräp kan börja form i brunnarna. - Skölj minst 3 gånger i avjoniserat vatten för 5 min med skakar på 150 – 300 rpm ta bort neuronala cellfragment. Näthinnan bör bli tydligare med varje sköljning vägledande av neuronala cellulära skräp avlägsnas.
- Använd en mörk bakgrund för att undersöka 24-väl plattan att tydligt se den vag isolerade retinala blodkärlen.
- (Valfritt): om vaskulatur inte visas gratis av neuronala lager (semi transparent) på denna punkt antingen lägga till fler skölj steg, öka skakningar hastigheten eller använda en Pipettera för att aspirera vätska på kärlsystemet.
FÖRSIKTIGHET: Antingen av valfria steg kan skada på blodkärlen.
- Fixa 10 min i 1 mL 4% PARAFORMALDEHYD i PBS i rumstemperatur och skölj 3 gånger i PBS.
Obs: Protokollet kan pausas här med med vävnad lagring vid 4 ° C.
2. immunohistokemi
-
Färgning av cryo-sektioner
- Skär 10 µm cryo-sektioner av gelatin-embedded näthinnan som vertikala snittningen genom synnerven och placera cryo-avsnitten på en glasskiva och låt torka (minst 1 h).
- Sänk glasskiva i PBS med 0,25% Triton x-100 (PBS-T) i 15 min.
- Droppa 1: 100 PDGFRβ och 1: 500 NG2 primära antikroppar utspätt i PBS-T + 1% BSA på cryo-avsnittet och inkubera i inkubation avdelningar vid 4 ° C över natten.
- Sänk glasskiva 2 gånger i PBS-T för 15 min och droppa 1: 100 antimus Alexa Fluor 594-länkade och 1: 100 anti-kanin FITC-kopplade sekundära antikroppar utspätt i PBS-T med 3% BSA på cryo-avsnitten.
- Inkubera i glas bilden 1 h i rumstemperatur i mörkret.
- Skölj glasskiva i PBS-T 2 x 15 min.
Obs: Valfritt: för dubbel- och Trebäddsrum Immunofluorescerande färgning, sekventiell färgning kan utföras genom att upprepa proceduren från 2.1.3 till 2.1.6 två och tre gånger, respektive. - Montera i betsad cryo-avsnitt med anti-fading montering medium innehållande DAPI och ett täckglas.
-
Färgning av hela-fäste
- Droppa PBS-T på hela-fästet och odla i rumstemperatur i 15 min.
- Häll av och droppa 1: 100 PDGFRβ och 1: 500 NG2 primära antikroppar utspätt i PBS-T + 1% BSA och inkubera i fuktig kammare vid 4 ° C över natten.
- Häll av och droppa på PBS-T att skölja glasskiva i 2 x 15 min.
- Häll av och droppa på 1: 100 anti-kanin Cy2- och 1: 100 antimus Cy3-kopplad sekundär antikropp utspätt i PBS-T med 3% BSA att ruva 1 h i en fuktig kammare vid rumstemperatur i mörkret.
- Häll av och droppa på PBS-T att skölja i 2 x 15 min i mörker.
Obs: Valfritt: för dubbel- och Trebäddsrum Immunofluorescerande färgning, sekventiell färgning kan utföras genom att upprepa proceduren från 2.2.2 till 2.2.5 två och tre gånger, respektive. - Montera den färgade hela-monteringen med anti-fading montering medium innehållande DAPI och ett täckglas.
-
Färgning av hypoton isolerade vaskulatur
- Blockera den hypoton isolerade vaskulatur 1 h med skakningar vid 100 rpm och rumstemperatur med 500 µL per brunn av 10% åsna serum utspätt i PBS.
- Inkubera över natten vid rumstemperatur och skaka vid 100 rpm med 600 µL per brunn av 1: 100 PDGFRβ och 1: 500 NG2 primära antikroppar utspätt i 10% åsna serum i PBS.
- Skölj retinal nätverk 3 x i PBS för 5 min och inkubera i 1: 100 antimus Alexa Fluor 594-länkade och 1: 100 anti-kanin FITC-kopplade sekundära antikroppar utspätt i 10% åsna serum i PBS skakar vid 100 rpm och rumstemperatur för 1 h i mörkret.
- Skölj i PBS-T för 5 min och inkubera i 0,2 ng/mL DAPI i PBS-T för 15 min följt av 3 x 5 min sköljningar i PBS-T i mörkret.
- Skär spetsen av en plast Pasteur Pipettera, fukta det med PBS-T och använda den för att överföra retinal nätverket till en 4-väl glasskiva-kammare.
Obs: Steget befuktningen är viktigt att undvika den retinala blodkärlen som fastnar på insidan av den Pasteur Pipettera. - Veckla den retinala blodkärlen. Undvik att vidröra den retinala blodkärlen med pincett kan orsaka att den kärlsystemet att trassla.
Obs: Utspelas kan göras genom att luta i kammaren-bilden fram och tillbaka eller aspirera droppar vätska på det retinala blodkärlen. - Ta bort mediet från brunnarna. Vätskans ytspänning kommer platta vaskulatur på undersidan av bilden.
- Säkerställa rätt utspelas under ett Mikroskop innan att ta bort plasten brunnar från kammaren bilden.
- Montera den färgade kärlsystemet med anti-fading monteringsmedium och ett täckglas.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De framgångsrika protokollen ger tre olika retinala preparat för att visualisera mikrovaskulära pericyter. Dessa metoder använder PDGFRβ och NG2 immunoreaktivitet samtidig lokaliseringen och den pericyter att linda runt den kapillära endotel foridentification unika ställning.
Med kryo-sektioner, neuronala skikten kan identifieras av fluorescerande tätheten av DAPI-märkt kärnor och inre och djupa kapillär plexuses innehålla pericyter som visar PDGFRβ och NG2 immunoreaktivitet (figur 1). Pericyter unika ställning i kärlväggen kan ses som cirkulär eller hästskoformade immunoreaktivitet i peripheryen av fartyg (figur 1, pilar) eller tillfällig skär längdriktningen fartyg (figur 1, pilspets).
Lyckad visualisering av de mikrovaskulära pericyter i hela-mount beredning av vuxen råtta kan utmanande14,20. PDGFRβ immunoreaktivitet i hela monterade vuxen näthinnan resulterade bara i en mycket svag signal (visas inte). NG2 färgning beskrivs det inre vaskulära nätverket med intensiv färgning i abluminal pericyter (figur 2).
För att få en översikt av det vaskulära nätverket av vuxen råtta näthinnan, ger immunohistokemi av hypoton isolerade råtta retinal vaskulär nätverk en alternativ metod till hela-fäste. När du framgångsrikt, ger denna vävnad förberedelse teknik en översikt över den hela retinal mikrocirkulation inklusive inre och djup kapillär plexuses. Immunhistokemisk färgning med pericytic markörer resulterar i hela mikrovaskulära nätverket visar NG2 immunoreaktivitet med en intensiv reaktion i specifika vaskulära celler (figur 3). Några av dessa celler visar också PDGFRβ immunoreaktivitet (figur 3).
En försiktig unfoldingen av vävnaden är viktigt att få en bra översikt över de retinala blodkärlen. Otillräcklig utspelas kan resultera i den vaskulatur ordnas i flera fokus lager vilket gör fluorescerande imaging svårt (figur 4). Unfolding kan underlättas genom skonsam skakar, tippning i kammaren-bilden fram och tillbaka eller aspirera droppar av vätskan på den retinala blodkärlen. Det bör noteras att de retinala kapillär plexuses anatomi kommer att resultera i vissa överlagring av kärlbäddar. Det är därför problematiskt att skilja inre från de djupare kapillär plexuses när tillplattad på en glasskiva.
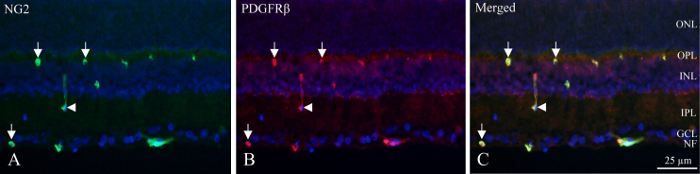
Figur 1: dubbel immunhistokemisk pericyt färgning av cryo-sektionen av inre råtta näthinnan. (A) NG2 (grön) immunohistokemi avslöjar positiva fartyg inom den inre delen av näthinnan. Pilarna anger cirkulär och hästskoformade immunoreaktivitet i kärlen. Pilspetsen pekar ut ett longitudinellt skär fartyg. (B), PDGFRβ (röd) immunohistokemi Visa reaktivitet liknar NG2 immunoreaktivitet. Pilar och pilspetsen pekar på samma strukturer när det gäller NG2 färgning. (C), bilden visar en sammanslagning av NG2, PDGFRβ och DAPI (blå) av överlagras på tre olika filter. Det avslöjas att de två antikropparna är samtidig lokaliserade (grön + röd = gul). NF: nerv fiberskiktet, GCL: ganglion celllagrar, IPL: inre plexiform lagret, INL: inre nukleära lagret, OPL: yttre plexiform lagret, ONL: yttre nukleära lagret. Klicka här för att se en större version av denna siffra.

Figur 2: immunhistokemisk pericyt färgning av hela monterade råtta näthinnan. NG2 (röd) immunoreaktivitet syns längs den ytliga kärl networkwith intensiv färgning i abluminal pericyter. Bilderna visar sammanslagna NG2 och DAPI (blå). Neuronala cellerna är synlig som DAPI-blå atomkärnor mellan den NG2-färgade mikrocirkulation. PDGFRβ immunoreaktivitet i hela monterade vuxen näthinnan resulterade bara i en mycket svag signal och ingår därför inte i denna siffra. Klicka här för att se en större version av denna siffra.

Figur 3: dubbel immunhistokemisk pericyt färgning av hypoton isolerade råtta retinal vaskulatur. (A). bilden visar hypoton isolerade råtta retinal vaskulär nätverk immunhistokemisk fläckade av NG2 (grön) och PDGFRβ (röd). Den fullständiga nätverket visade NG2 immunoreaktivitet. Dock hittades PDGFRβ immunoreaktivitet i cell somas. Insatsen av A är en översikt av retinal vaskulatur nätverk fläckade DAPI (blå). (B), bilden visar samma prov som (A) på en annan plats och högre förstoring. Det är tydligt att PDGFRβ färgning endast visas i cell somas i vaskulära nätverket som anger pericyt immunoreaktivitet. Insatsen av B är bilden som visar hög förstoring av vaskulatur fläckade av NG2 (grön), PDGFRβ (röd) och samman med DAPI. Inklusive DAPI färgning tillsammans med NG2 och PDGFRβ avslöjar tre pericyter (PDGFRβ-positiv) och två oidentifierade fartyget vägg celler. Klicka här för att se en större version av denna siffra.

Figur 4: exempel på en otillräcklig Övik hypoton isolerade retinal vaskulatur. Försiktig unfoldingen av en hypoton isolerade kärlsystemet är viktigt eftersom otillräcklig utspelas kan resultera i den vaskulatur staplas. Bilderna visar DAPI-färgade retinala blodkärlen på samma plats men som tas i olika fokus lager. (A) The DAPI-färgade celler i ett fokus lager visar ett ungefärligt 25 µm tjocka blodkärl i den retinala blodkärlen. (B) The DAPI-färgade celler i andra fokus lager belysa tunn förgrenade kapillärer på samma plats som har varit staplade på större blodkärl visas i (A). Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vi presenterar tre retinal förberedelser tekniker som kan tillämpas i studien av mikrovaskulära retinal pericyter. Nedan, vi tillhandahåller en jämförelse mellan alla metoder och markera kritiska steg i protokollen.
Med kryo-snittning, näthinnan skärs i sagittal sektioner och därför är det möjligt att få talrika exemplar från samma näthinnan. Avsnitten siffran som följer av denna metod gör det ett idealiskt val för antikropp specificitet och titrering test eftersom den förhindrar onödiga djuroffer. Det förberedande arbetet är avgörande för goda resultat. Det är avgörande medan dissekera ögat inte dra ögat utan att skära alla muskler runt ögat. Det finns en risk för näthinneavlossning om kraft används. Eftersom ögat koppen är tunn, bör man inte fixa för lång. Nedsänkning med 4% PARAFORMALDEHYD i PBS för 2 – 4 h kommer fixa vävnaden. Om fast längre, finns det en risk att förstöra antigenen av intresse. För att skapa den bästa möjliga immunostainings, är det viktigt för varje avsnitt vara lika platt som möjligt mot glaset. Eftersom avsnitten innehåller endast några enstaka tvärgående nedskärningar av mikrocirkulation, erbjuder denna vävnad preparat teknik endast intermittent visualisering av mikrocirkulation. Därför, denna metod är inte lämplig för studier av de övergripande vaskulär arkitektur och kvantifierbara åtgärder av pericyter.
Den övergripande vaskulatur kan färgas efter hela-montering att ge en översikt över kärlsystemet. När behärskar denna teknik, kan det vara en snabb vävnad förberedelse förfarande som kräver relativt liten arbetsbelastning. Det finns dock några punkter vara särskilt medvetna om. Näthinnan är bräcklig och det är av största vikt att hantera dem med omsorg och undvika revor och nedskärningar. Dessutom samtidigt noga hantering näthinnan, är det viktigt att undvika veck och andra sprickor under montering som kan påverka den immunhistokemiska imaging senare. Monterade näthinnan har en tjocklek av 250-300 µm och antikropp penetration av neuronala lager kan vara problematiskt. När det gäller pericyt visualisering, NG2 färgningen i protokollet hela-mount kan endast uppnås med en Cy3-kopplad sekundär antikropp och PDGFRβ immunoreaktivitet i hela monterade vuxen näthinnan resulterade i sådan en mycket svag signal som det inte visades i siffran. Nyttan av hela-mount färgning tekniken hämmas därför starkt av den framgångsrika färgning huvudsakligen beroende på de specifika primära och sekundära antikroppar används. Ytterligare förslag för att optimera protokollet för visualiserade mikrovaskulära plexuses av en vuxen råtta näthinnan är inkubering i primär antikropp under en längre tid och/eller ändra den inkubation temperatur26.
På grund av tjockleken av det hela-monterad är det viktigt att vara medveten om riktningen av näthinnan efter att göra de fyra snitt från näthinnans periferi mot synnerven huvudet att undvika oavsiktlig montering med inre näthinnan som innehåller kapillärer nedåt. Fortfarande, detaljerad visualisering av de djupare mikrovaskulära plexuses och pericyter kan vara besvärande med denna metod14,20. Eftersom hela-mount färgning av vuxen näthinnan är svårt i den djupa kapillär plexus, kan detta resultera i näthinnan som förekommer avaskulär i vissa delar. Den immunhistokemisk färgning av hela monterade vuxen näthinnan ger endast en fragmenterad översikt över kärlsystemet med pericyter foder fartyg i den ytliga kapillära plexus och därför denna metod kan leda till falskt negativa resultat i den visualisering av den råtta retinala blodkärlen.
Trypsin matsmältningen har länge ansetts vara guldmyntfot tekniken för isolering och visualisering av retinal vaskulatur20. Hypoton isolering ger en alternativ metod för visualisering av hela komplexa tredimensionella vaskulär nätverk och står inför många av samma utmaningar som arbetar med mycket ömtålig vävnad som är svåra att hantera. På grund av likheten i retinal vaskulär produkten mellan de två metoderna, hypoton isolering står inför många av de samma utmaningarna som trypsin matsmältningen20 inklusive noggrann dissektion att förhindra stora tårar och försiktig hantering genom att undvika pipettering och röra med pincett. En viktig skillnad mellan metoderna är fixering. Trypsin matsmältningen sker vanligtvis efter fixering och kan tillämpas framgångsrikt på bevarade näthinnor som har varit i fixativ för flera år20. Hypoton isolering utförs före fixering och således kan genomföras i olika andra analyser som tidigare beskrivits i litteraturen23,24,25. Trypsin matsmältningen utförs över två dagar20, medan hypoton isolering kan slutföras inom timmar. Dessutom hypoton isolering protokollet omfattar inte risken för alltför matsmältningen och enzymatisk klyvning av membran markörer som krävs för pericyt erkännande, e.g. PDGFRβ och NG2, vilket gör denna metod som föredras för efterföljande immunhistokemisk mikrovaskulära färgning.
Slutligen, även om ur den omedelbara omfattningen av detta manuskript, finns det en mindre kända men mycket användbar teknik för att isolera stora, intakt mikrovaskulära plexi från gnagare av näthinnan27. Näthinnan är placerad i en speciell glas kammare och täckglas. Vid avlägsnande av täckglaset, mikrocirkulation resterna bifogas täckglaset till skapa en fullt levande (≈ 98% av cellerna) vävnad ut. Den största fördelen med denna metod är att det tillåter för fysiologiska studier av de fartyg och efterföljande fixering för immunfärgning. En uppenbar begränsning för metoden är att den ger inte den visualisering/isoleringen av hela mikrovaskulära nätverket som näthinnan platt fäste och hypoton preparat göra. Pericyter kan fortfarande, kan visualiseras genom tillämpning av denna metod27.
De tekniker för beredning av tre vävnad som beskrivs här är kompletterande i den meningen att varje metod består av fördelar och brister för visualisering av de mikrovaskulära pericyter. Bedömningen av varje metoder potentialer och svagheter är viktigt att välja den optimala metoden för att undersöka de mikrovaskulära pericyter under särskilda sjukdomstillstånd. De påvisade metoderna kan utökas till färgning inte bara för pericyt markörer, men också för visualisering av mikrovaskulära strukturer i allmänhet. Så småningom, är det för den enskilda forskaren att välja den lämpliga visualisering metod baserat på forskning hypotesen i fråga.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har något att avslöja.
Acknowledgments
Forskningen har finansierats av Lundbeck Foundation, Danmark.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



