Summary
Demostrar técnicas de preparación de tres tejidos diferentes para la visualización de immunohistochemical del pericitos microvasculares retina de rata, es decir, cryo-secciones, todo-montajes e hipotónica aislamiento de la red vascular.
Abstract
Pericitos retinianos juegan un papel importante en muchas enfermedades del ojo. Immunohistochemical que manchaba técnicas de vasos retinianos y microvascular pericitos son fundamentales para la investigación oftalmológica. Es vital elegir un método apropiado de visualización del pericitos microvasculares. Describimos pericyte microvascular retiniana immunohistochemical que manchaba en cryo-secciones, todo-montajes e hipotónica vasculatura aislado usando los anticuerpos para el antígeno del nervio/glial 2 (NG2) y β del receptor de factor de crecimiento derivado de plaquetas (PDGFRβ). Esto nos permite destacar ventajas y deficiencias de cada una de las preparaciones de tres tejido para la visualización del pericitos microvasculares retinianas. Cryo-secciones proporcionan visualización de transsectional de todas las capas retinianas pero contienen sólo unos ocasionales cortes transversales de la microvascularización. Montaje en conjunto proporciona una visión general de la vasculatura retiniana completa y visualización de la microcirculación puede ser problemática. Hipotónica aislamiento proporciona un método para visualizar la vasculatura retiniana toda por la eliminación de las células neuronales, pero esto hace que el tejido muy frágil.
Introduction
Pericitos retinianos son el foco de muchos laboratorios de investigación como estas células desempeñan un papel importante en la integridad de la vasculatura. Condiciones patológicas tales como la retinopatía diabética1, isquemia2y glaucoma3 tienen características vasculares que implican la función del pericitos. Pericitos se encuentran en los plexos capilares retinianos internos. Ramas de la arteria central de la retina que suministra la retina interna en dos capas de plexos capilares. El lecho vascular interno se encuentra entre la célula del ganglio y las capas nucleares internas. La capa más profunda es más densa y compleja y se localiza entre las capas nucleares interna y externa4,5. Además, algunas partes de la retina contienen también una tercera cadena denominada los capilares parapapillary radial. Estos son largos, tubos capilares rectos que se encuentran entre las fibras nerviosas y raramente los anastomose con uno con el otro o los otros dos plexos6. Dentro de la pared capilar, pericitos están incrustadas en la membrana del sótano y la línea del lado abluminal de células endoteliales vasculares.
Hasta la fecha, no existe ningún marcador biológico único de estos pericitos que puede distinguir de otras células vasculares. Β del receptor de factor de crecimiento derivado de plaquetas (PDGFRβ) y el antígeno del nervio/glial 2 (NG2) son marcadores utilizados que presentan en pericitos pero también otras células vasculares. Identificación del pericitos se complica aún más por la existencia de pericyte subconjuntos que varían en morfología y proteína expresión7. Actualmente, la mejor identificación se basa en una combinación de marcadores de proteínas y la característica de la pericyte en la pared vascular. Aquí demostramos tres técnicas de preparación de tejidos diferentes para la coloración immunohistochemical PDGFRβ/NG2 del pericitos microvasculares retina de rata, es decir, cryo-secciones, todo-montajes y aislamiento hipotónica de la red vascular.
Con secciones de cryo, la retina y la esclerótica se cortan a través del nervio óptico. Esto permite la visualización de todas las estructuras de capas de neuronas. Las diez distintas capas de la retina son evidentes como intercambio de estructuras nucleares y axonal/dendríticas que pueden visualizarse con tinciones como hematoxilina/eosina o fluorescente nuclear 4', 6-diamidino-2-phenylindole (DAPI)8. Las necesidades metabólicas difieren entre las capas9 y ofrece un método para determinar el grueso o total ausencia de una capa específica (por ejemplo, la pérdida de células ganglionares de la retina es una de las características de la isquemia retiniana10, 11). La vasculatura es evidente como transversal atraviesa la retina, lo que es posible estudiar por separado los plexos capilares dentro de las respectivas capas retinianas12,13.
Más tradicionalmente, se realizan las investigaciones de la red de la vasculatura retiniana en retina de monturas de todo. Con esta preparación de tejido, la retina se corta y aplanada como una estructura en forma de flor. El método es una técnica de preparación de tejido relativamente rápido que se puede destacar la vasculatura retiniana de arquitectura general y por lo tanto se aplica a menudo en la investigación de neovascularización de la retina murina. Visualización exitosa de la microvascularización en retinas todo montado también se divulga en el ratón neonatal en desarrollo y14,de retina de rata15,de17,de16,18, 19. estos estudios revelan una actividad pericytic más definida con áreas libre de capilares más grandes en el adulto frente a los los neonatal retina14.
Otra forma de visualizar es la microvasculatura retiniana después aislamiento hipotónica. Esta técnica de preparación de tejido resulta en vasos sanguíneos retinianos y capilares liberados de las células neuronales. Este tipo de proyección de imagen de dos dimensiones de la red vascular retiniana aislada es generalmente realizada después de la digestión de tripsina retina20 y utilizado para evaluar las anormalidades vasculares de la retinopatía diabética como pericyte pérdida capilar degeneración20,21,22. El método de aislamiento hipotónica ofrece las investigaciones de gen vascular retiniana y proteínas reguladoras respuestas como lo ha hecho con la RT-PCR y western blot23,24,25. Aquí proporcionamos un protocolo para el flotador libre de la coloración de immunohistochemical de la vasculatura retiniana aislada hipotónica como alternativa a la digestión de la tripsina para examinar del pericitos microvasculares.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
El protocolo fue optimizado y demostrado en ratas albinas machos adultos. En todos los procedimientos experimentales, los animales fueron tratados según las disposiciones de la declaración de ARVO para el uso de animales en oftálmica y la investigación de la visión. Los animales fueron sacrificados por el dióxido de carbono y la dislocación cervical posterior.
1. rata tejido retiniano preparados
-
Cryo-sección
- Hacer posterior y anterior de ~0.5 rajas de cm de en el párpado de rata con un bisturí.
- Opcional: Con un quemador de diatermia, marque el ojo en el ángulo interno para orientar los ojos de una manera uniforme durante la incrustación y permitir criostato vertical Seccionando a través del nervio óptico.
- El ojo del gancho agarrador con el fórceps e incline cuidadosamente a un lado para exponer el tejido circundante. Enuclear el ojo haciendo cortes con las tijeras de disección en el tejido conjuntivo y muscular.
PRECAUCIÓN: No tire el ojo demasiado ya que una presión excesiva sobre el nervio óptico puede causar desprendimiento de retina. - Poner los ojos brevemente en formaldehído al 4% en tampón fosfato salino (PBS) se estabilice antes de hacer un agujero inicial en el limbus córneo aplicando ligera presión con la punta de un bisturí.
- Bajo el microscopio, corte a lo largo del limbo corneal con tijeras de disección para retirar la córnea y retirar la lente con el fórceps antes de sumergirse en formaldehído al 4% en PBS durante 2 – 4 h.
- Enjuague secuencialmente en tampón de fosfato de Sörensen con 10% de sacarosa y 25% de sacarosa.
- Incrustar en medio de Yazulla con 3% gelatina de porcino piel y 30% albúmina de clara de huevo de pollo.
Nota: El protocolo puede ser una pausa aquí con almacenamiento de tejido a-20 ° C.
- Hacer posterior y anterior de ~0.5 rajas de cm de en el párpado de rata con un bisturí.
-
Montaje en conjunto
- Hacer posterior y anterior de ~0.5 cm cortes en el párpado de rata con un bisturí.
- El ojo del gancho agarrador con el fórceps e incline cuidadosamente a un lado para exponer el tejido circundante. Enuclear el ojo haciendo cortes con las tijeras de disección en el tejido conjuntivo y muscular.
PRECAUCIÓN: No tire el ojo demasiado ya que una presión excesiva sobre el nervio óptico puede causar desprendimiento de retina. - Poner los ojos brevemente en formaldehído al 4% en PBS a estabilizar antes de hacer un agujero inicial en el limbus córneo aplicando ligera presión con la punta de un bisturí.
- Bajo el microscopio, corte a lo largo del limbo corneal con tijeras de disección para retirar la córnea y retirar la lente con el fórceps.
- Separar la retina del epitelio pigmentario de la retina hacia el nervio óptico con el fórceps con pequeña abertura movimientos para evitar desgarro importante.
- Libre de la retina en el nervio óptico con tijera de disección y hacer cuatro cortes de pocos milímetros de longitud de la periferia retiniana hacia la cabeza del nervio óptico.
- Difundir la retina en un portaobjetos de vidrio y permite secar durante 5 – 10 min.
- Fijar en formaldehído al 4% para 20-30 min por goteo de formaldehído en la retina.
PRECAUCIÓN: No aplicar directamente sobre la retina como puede separar de la Copa. - Lavar con PBS. Para obtener resultados óptimos, inmuno-tinción directamente después del enjuague.
-
Aislamiento hipotónica
- Hacer posterior y anterior de ~0.5 cm cortes en el párpado de rata con un bisturí.
- El ojo del gancho agarrador con el fórceps e incline cuidadosamente a un lado para exponer el tejido circundante. Enuclear el ojo haciendo cortes con las tijeras de disección en el tejido conjuntivo y muscular.
PRECAUCIÓN: No tire el ojo demasiado ya que una presión excesiva sobre el nervio óptico puede causar desprendimiento de retina. - Hacer un agujero inicial en el limbus córneo aplicando ligera presión con la punta de un bisturí.
- Bajo el microscopio, corte a lo largo del limbo corneal con tijeras de disección para retirar la córnea y retirar la lente con el fórceps.
- Separar la retina del epitelio pigmentario de la retina hacia la cabeza del nervio óptico con el fórceps con pequeña abertura movimientos para evitar desgarro importante.
- Sin la retina en el nervio óptico con tijeras de disección, colocar la retina en 1 mL de agua desionizada en un plato 24-well y agita a 200 rpm con una órbita de vibraciones 1,5 mm por 1 h a temperatura ambiente.
Nota: En adelante, la retina aparece que menos definida en los bordes. - Añadir 200 U DNasa 1 para disociar los restos de células sometidas a lisis de la vasculatura retiniana y agite por otros 30 minutos a temperatura ambiente.
Nota: Desechos podrían empezar a formarse en los pozos. - Enjuague mínimo 3 veces en agua desionizada durante 5 min con agitación a 150 – 300 rpm para eliminar los restos de células neuronales. La retina debe ser más transparente con cada enjuague indicativo de la eliminación de los desechos celular neuronal.
- Para ver en la placa de 24 pocillos a ver claramente la vasculatura retiniana aislada diáfana, usar un fondo oscuro.
- (Opcional): Si la vasculatura no aparece libre de capas neuronales (semi transparentes) en este punto ya sea añadir más pasos de enjuague, aumentar la velocidad de agitación o utilice una pipeta para aspirar el líquido sobre la vasculatura.
PRECAUCIÓN: Cualquiera de los pasos opcionales pueden dañar la vasculatura.
- Arreglo 10 minutos en 1 mL de paraformaldehído al 4% en PBS a temperatura ambiente y enjuagar 3 veces en PBS.
Nota: El protocolo puede pausarse aquí con almacenamiento de tejidos a 4 º C.
2. inmunohistoquímica
-
Tinción de cryo-secciones
- Corte 10 μm cryo-secciones de la retina embebido en gelatina como seccionamiento vertical a través del nervio óptico y coloque el cryo-secciones en un portaobjetos de vidrio y dejar secar (mínimo 1 h).
- Sumerja el portaobjetos de cristal en PBS con 0.25% Tritón X-100 (PBS-T) durante 15 minutos.
- Goteo 1: PDGFRβ 100 y 1: 500 NG2 anticuerpos primarios diluidos en PBS-T + 1% de BSA en la sección de crio e incubar en cámaras de incubación a 4 ° C durante la noche.
- Sumerja el portaobjetos de cristal 2 veces en PBS-T durante 15 min y 1: 100 Alexa Fluor 594-ligado y 1: 100 Anti-conejos FITC-ligado secundarios anticuerpos anti-ratón diluidos en PBS-T con el 3% de BSA en el cryo-secciones del goteo.
- Incube el portaobjetos de cristal 1 h a temperatura ambiente en la oscuridad.
- Enjuagar el portaobjetos de cristal en PBS-T 2 x 15 min.
Nota: Opcional: para dobles y triples de tinción inmunofluorescente, tinción secuencial puede realizarse repitiendo el procedimiento de 2.1.3 y 2.1.6 dos y tres veces, respectivamente. - Monte las secciones manchadas de crio con antidecoloración montaje medio DAPI que contiene y un cubreobjetos.
-
La coloración de conjunto montaje
- Gotee el montaje conjunto con PBS-T e incubar a temperatura ambiente durante 15 minutos.
- Retirar y goteo 1: PDGFRβ 100 y 1: 500 NG2 anticuerpos primarios diluidos en PBS-T + 1% de BSA e incubar en cámara húmeda a 4 ° C durante la noche.
- Retirar y goteo en PBS-T para enjuagar el portaobjetos de vidrio de 2 x 15 min.
- Retirar y gotear en el 1: 100 anti-conejo Cy2 - y 1: 100 anti-ratón Cy3-ligado anticuerpo secundario diluido en PBS-T con el 3% de BSA para incubar 1 h en cámara húmeda a temperatura ambiente en la oscuridad.
- Retirar y goteo en PBS-T a la aclaración de 2 x 15 min en la oscuridad.
Nota: Opcional: para dobles y triples de tinción inmunofluorescente, tinción secuencial puede realizarse repitiendo el procedimiento de 2.2.2 a 2.2.5 dos y tres veces, respectivamente. - Monte el soporte de toda manchado con antidecoloración montaje medio DAPI que contiene y un cubreobjetos.
-
Tinción de vasculatura aislado hipotónica
- Bloquear la vasculatura aislada hipotónica 1 h con agitación a 100 rpm y temperatura con 500 μL/pocillo de suero de burro 10% diluido en PBS.
- Incubar durante una noche a temperatura ambiente y agite a 100 rpm con 600 μL/pocillo de 1 PDGFRβ: 100 y 1: 500 NG2 anticuerpos primarios diluidos en suero de burro de 10% en PBS.
- Enjuague la retina red 3 x en PBS durante 5 minutos e incubar en 1: 100 Alexa Fluor 594-ligado y 1: 100 Anti-conejos FITC-ligado secundarios anticuerpos anti-ratón diluidos en suero de burro de 10% en PBS agitación a 100 rpm y a temperatura ambiente durante 1 h en la oscuridad.
- Lavar en PBS-T por 5 min e incubar en DAPI en PBS-T de 0,2 ng/mL durante 15 min seguido por enjuagues 3 veces, 5 minutos en PBS-T en la oscuridad.
- Cortar la punta de una pipeta Pasteur plástica, humedézcalo con PBS-T y usarlo para transferir la red retina a un portaobjeto de cámara 4-bien.
Nota: El paso de la humectación es importante evitar la vasculatura retiniana que se pega en el interior de la pipeta de Pasteur. - Despliegue de la vasculatura retiniana. Evite tocar la vasculatura retiniana con pinzas ya que esto puede causar la vasculatura a enredarse.
Nota: Despliegue puede hacerse inclinando el portaobjetos de la cámara hacia adelante y hacia atrás o aspirar las gotas de líquido sobre la vasculatura retiniana. - Retire el medio de los pozos. La tensión superficial del líquido se aplane la vasculatura en la parte inferior de la diapositiva.
- Asegurar el correcto despliegue bajo el microscopio antes de retirar el plástico de los pozos de la diapositiva de la cámara.
- Monte la vasculatura manchada con medio de montaje antidecoloración y un cubreobjetos.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Los protocolos exitosos proporcionan tres diferentes preparaciones de retinales para la visualización de pericitos microvasculares. Cada uno de estos métodos utiliza la PDGFRβ y NG2 immunoreactivity co-localización y la posición única del pericitos alrededor del foridentification del endotelio capilar.
Con secciones de crio, las capas neuronales pueden ser identificadas por la densidad fluorescente de núcleos etiquetados de DAPI y la interna y plexos profundo capilares contienen pericitos que muestran inmunoreactividad PDGFRβ y NG2 (figura 1). La posición única del pericitos en la pared vascular puede ser vista como immunoreactivity circular o en forma de herradura en la periferia de los vasos (figura 1, las flechas) u ocasional corte longitudinalmente los vasos (figura 1, flecha).
Visualización exitosa del pericitos microvasculares en todo montaje preparación de rata adulta puede ser un desafío14,20. Immunoreactivity PDGFRβ en la retina adulta montado en conjunto resultó solamente en una señal muy débil (no mostrada). NG2 la coloración indica la red vascular interna con coloración intensa en abluminal pericitos (figura 2).
Para obtener una visión general de la red vascular de la retina de la rata adulta, immunohistochemistry de la red vascular retiniana hipotónica aislado de rata proporciona un método alternativo para montaje en conjunto. Cuando se realiza correctamente, esta técnica de preparación de tejido proporciona una visión general de la microvasculatura retiniana toda incluyendo plexos internos y profundo capilares. Immunohistochemical que manchaba con marcadores pericytic resultados en toda la red microvascular que muestran inmunoreactividad NG2 con una intensa respuesta en células vasculares específicas (figura 3). Algunas de estas células también presentan inmunoreactividad PDGFRβ (figura 3).
Un desarrollo cuidadoso del tejido es importante para obtener una buena descripción de la vasculatura retiniana. Desarrollo insuficiente puede resultar en la vasculatura están dispuesta en varias capas de enfoque que hace fluorescente imagen difícil (figura 4). Puede facilitar despliegue suave agitando, inclinando el portaobjetos de la cámara hacia adelante y hacia atrás o aspirar las gotas de líquido sobre la vasculatura retiniana. Cabe señalar que la anatomía de los plexos capilares retinianos tendrá como resultado cierta superposición de los lechos vasculares. Por lo tanto, resulta problemático distinguir el interior de los plexos capilares más profundos cuando aplanado sobre el portaobjetos de cristal.
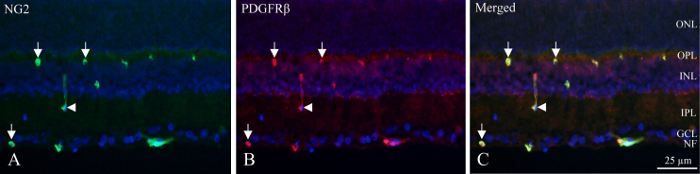
Figura 1: doble pericyte la coloración de immunohistochemical cryo-sección de la retina de la rata interior. (A) NG2 immunohistochemistry (verde) revela los vasos positivos dentro de la parte interna de la retina. Las flechas indican el immunoreactivity circular y en forma de herradura en los vasos. La flecha señala un vaso cortado longitudinalmente. (B) PDGFRβ (rojo) de inmunohistoquímica muestran reactividad similares a NG2 immunoreactivity. Flechas y flecha apuntan a las mismas estructuras en cuanto a coloración de NG2. (C) la imagen muestra una combinación de NG2, PDGFRβ y DAPI (azul) mediante la superposición de los tres filtros diferentes. Se revela que los dos anticuerpos son co localizados (verde + rojo = amarillo). NF: capa de fibras nerviosas, GCL: capa de células ganglionares, IPL: la capa plexiforme interna, INL: capa nuclear interna, OPL: capa plexiforme externa, ONL: capa nuclear externa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: la coloración Immunohistochemical pericyte de retina de rata montado entero. Immunoreactivity NG2 (rojo) es visible a lo largo de la networkwith vascular superficial intensa coloración en pericitos abluminal. Las imágenes muestran la fusión NG2 y DAPI (azul). Las células neuronales son visibles como núcleos de DAPI azul entre la microvascularización teñido de NG2. Immunoreactivity PDGFRβ en la retina adulta montado en conjunto resultó solamente en una señal muy débil y por lo tanto no está incluido en esta cifra. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: doble pericyte la coloración de immunohistochemical vasculatura retiniana hipotónica aislado de rata. (A). la imagen muestra immunohistochemical de red vascular retiniana hipotónica aislado de rata teñido con NG2 (verde) y PDGFRβ (rojo). La red demostrada el immunoreactivity de NG2. Sin embargo, immunoreactivity PDGFRβ fue encontrado en el soma de la célula. El inserto de la A es un resumen de la red de la vasculatura retiniana teñida con DAPI (azul). (B) la imagen muestra a la misma muestra como (A) en una ubicación diferente y un aumento mayor. Está claro que PDGFRβ la coloración sólo aparece en el soma celular en la red vascular indicando el immunoreactivity pericyte. El inserto de la B es la imagen que muestra el gran aumento de la vasculatura teñidos con NG2 (verde), PDGFRβ (rojo) y se fusionó con DAPI. Incluyendo la coloración de DAPI junto con NG2 y PDGFRβ revela tres pericitos (PDGFRβ-positivo) y dos células de la pared del vaso no identificados. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: ejemplo de una inadecuada desplegado hipotónica aislado vasculatura retiniana. El despliegue cuidadoso de una vasculatura aislado hipotónica es importante despliegue insuficiente puede resultar en la vasculatura están apilada. Las imágenes muestran tinción DAPI vasculatura retiniana en el mismo sitio pero en capas de diferente enfoque. (A) el DAPI-células con tinción en la capa de uno de los focos muestran un vaso sanguíneo grueso de aproximadamente 25 μm en la vasculatura retiniana. (B) el DAPI-células con tinción en una segunda capa de enfoque aclarar finos capilares ramificados en el mismo sitio que ha sido apilada en el vaso sanguíneo más grande mostrado en (A). Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Presentamos tres técnicas retiniana que pueden ser aplicadas en el estudio del pericitos retinianos microvasculares. A continuación, ofrecemos una comparación entre cada uno de los métodos y resaltar los pasos críticos en los protocolos.
Con el seccionamiento de cryo, la retina se corta en secciones sagitales y por lo tanto, es posible obtener numerosas muestras de la misma retina. Las secciones números resultantes de este método lo hacen una opción ideal para la especificidad de anticuerpos y pruebas de valoración ya que evita que el sacrificio innecesario de animales. El trabajo preparatorio es determinante para obtener buenos resultados. Es crucial durante la disección del ojo no para el ojo pero para cortar todos los músculos alrededor del ojo. Existe un riesgo de desprendimiento de retina si se usa la fuerza. Porque la taza del ojo es delgada, uno no debe arreglar demasiado. Inmersión con paraformaldehído al 4% en PBS durante 2 – 4 h va a arreglar el tejido. Si fijo ya, existe el riesgo de destruir el antígeno de interés. Para generar el mejor immunostainings posible, es fundamental en cada sección a ser tan plano como sea posible contra el vidrio. Porque las secciones contienen sólo unos ocasionales cortes transversales de la microvascularización, esta técnica de preparaciones de tejido ofrece sólo visualización intermitente de la microvascularización. Por lo tanto, este método no es adecuado para los estudios de la arquitectura vascular en general y medidas cuantificables del pericitos.
Puede mancharse la vasculatura general después del montaje de conjunto para proporcionar una visión general de la vasculatura. Al dominar esta técnica, puede ser un procedimiento de preparación de tejido rápido que requiere relativamente poca carga de trabajo. Sin embargo, hay algunos puntos a ser particularmente conscientes de. La retina es frágil y es de suma importancia para manejar con cuidado y evitar roturas y cortes. Además, durante la manipulación con cuidado de la retina, es de fundamental importancia para evitar pliegues y otras grietas durante el montaje pueden afectar la imagen de immunohistochemical más tarde. La retina montada tiene un grosor de 250-300 μm y penetración del anticuerpo de las capas neuronales podría ser problemático. En cuanto a visualización pericyte, NG2 tinción en el protocolo de montaje de conjunto sólo puede alcanzarse con un anticuerpo secundario Cy3-ligado, y immunoreactivity PDGFRβ en la retina adulta montado en conjunto dio lugar a tal muy débil señal que no se muestran en la figura. Por lo tanto, la utilidad de la técnica de tinción montaje en conjunto fuertemente se ve obstaculizada por la exitosa coloración dependiendo principalmente de los anticuerpos específicos de primarios y secundarios utilizados. Más sugerencias para optimizar el protocolo para visualizadas plexos microvasculares de la retina de una rata adulta es la incubación en anticuerpo primario durante un largo periodo de tiempo o cambio de la temperatura de incubación26.
Por el espesor del conjunto montado, es importante ser consciente de la dirección de la retina después de hacer las cuatro incisiones de la periferia retiniana hacia la cabeza del nervio óptico para evitar el montaje accidental con la retina interna que contiene los capilares orientada hacia abajo. Sin embargo, visualización detallada de los plexos microvasculares más profundo y del pericitos puede ser molesto con este método14,20. Como todo montaje de tinción de la retina adulta es difícil en el plexo capilar profundo, esto podría producir en la retina que aparecen avascular en algunas partes. La coloración de immunohistochemical de retina adultos montados en conjunto proporciona sólo una visión fragmentada de la vasculatura con pericitos que recubren los vasos del plexo capilar superficial y por lo tanto, este método puede conducir a resultados falsos negativos en la visualización de la vasculatura retiniana de la rata.
Digestión de la tripsina durante mucho tiempo se ha considerado la técnica estándar de oro para aislamiento y visualización de la vasculatura retiniana20. Aislamiento hipotónica proporciona un método alternativo para la visualización de la red vascular tridimensional complejo y muchos de los mismos enfrenta desafíos trabajando con tejido muy frágil, que es difícil de manejar. Debido a la semejanza en el producto vascular retiniano entre los dos métodos, el aislamiento hipotónico enfrenta a muchos de los mismos desafíos que la digestión de tripsina20 incluyendo disección cuidadosa para evitar grandes lágrimas y manejo prudente, evitando pipeteado y tocar con pinzas. Una diferencia importante entre los métodos es la fijación. Digestión de la tripsina se suele hacer después de la fijación y puede ser aplicada con éxito en retinas conservados en fijador para varios años20. Aislamiento hipotónica se realiza antes de la fijación y por lo tanto permite la implementación en varios otros ensayos según se describió anteriormente en la literatura23,24,25. La digestión de tripsina se lleva a cabo sobre dos días20, mientras que el aislamiento hipotónico puede completarse dentro de las horas. Además, el protocolo de aislamiento hipotónica no incluye el riesgo del exceso de la digestión y ruptura enzimática de marcadores de membrana necesaria para pericyte reconocimiento, por ejemplo, PDGFRβ y NG2, haciendo este método preferido para la posterior tinción inmunohistoquímica microvascular.
Por último, aunque fuera del alcance inmediato de este manuscrito, es una técnica menos conocida pero muy útil para aislar grandes, intacto plexi microvascular de roedores fuera de la retina27. La retina se coloca en una cámara de vidrio especial y cubreobjetos. Sobre el retiro de lo cubreobjetos, restos de microvascularización atados cubreobjetos para crear una completamente vivo (≈ 98% de las células) tejido de impresión. La mayor ventaja de este método es que permite el estudio fisiológico de los vasos y fijación posterior para la inmunotinción. Una limitación obvia del método es que no proporciona aislamiento y visualización de toda la red microvascular como montaje plano de retina y preparaciones hipotónicas. Aún así, pericitos pueden visualizarse mediante la aplicación de este método27.
Las técnicas de preparación de tres tejido aquí descritas son complementarias en el sentido de que cada método implica ventajas y deficiencias para la visualización del pericitos microvasculares. La evaluación de cada métodos potenciales y debilidades es importante seleccionar el método óptimo de investigar del pericitos microvasculares en condiciones patológicas específicas. Los métodos demostrados pueden ampliarse a las manchas para pericyte marcadores, sino también para la visualización de las estructuras microvasculares en general. Finalmente, es para que el investigador individual seleccionar el método de visualización apropiado basado en la hipótesis de la investigación en cuestión.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
La investigación fue financiada por la Fundación Lundbeck, Dinamarca.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



