Summary
علينا أن نظهر ثلاث تقنيات إعداد الأنسجة المختلفة للتصور المناعي للفئران بيريسيتيس microvascular الشبكية و أي البرد-أقسام والجامع--يتصاعد والعزلة ناقص التوتر لشبكة الأوعية الدموية.
Abstract
بيريسيتيس الشبكية دوراً هاما في العديد من أمراض العين. المناعي تلطيخ التقنيات الشبكية السفن وميكروفاسكولار بيريسيتيس المركزي لبحوث طب العيون. من المهم أن تختار طريقة مناسبة لتصور بيريسيتيس ميكروفاسكولار. يصف لنا بيريسيتي ميكروفاسكولار الشبكية المناعي تلطيخ في البرد-أقسام وكل--يتصاعد وناقص التوتر المفرج المعزولة باستخدام الأجسام المضادة لعوامل النمو المشتقة من الصفيحات مستقبلات بيتا (PDGFRβ) والأعصاب/الدبقية مستضد 2 (NG2). وهذا يسمح لنا لتسليط الضوء على مزايا وعيوب كل من الأعمال التحضيرية ثلاثة أنسجة لتصور بيريسيتيس ميكروفاسكولار الشبكية. Cryo-أقسام تقديم التصور ترانسيكشونال من جميع طبقات الشبكية لكن تحتوي على إلا عدد قليل من التخفيضات عرضية عرضية ميكروفاسكولاتوري. الجامع-جبل يوفر لمحة عامة عن المفرج الشبكية كاملة، ولكن التصور ميكروفاسكولاتوري يمكن أن تكون مزعجة. ناقص التوتر العزل يوفر طريقة لتصور المفرج الشبكية كاملة بإزالة الخلايا العصبية، ولكن هذا يجعل الأنسجة هشة للغاية.
Introduction
بيريسيتيس الشبكية هي تركيز العديد من مختبرات الأبحاث هذه الخلايا تلعب دوراً كبيرا في سلامة المفرج. الحالات المرضية مثل اعتلال الشبكية السكري1والاسكيمية2و3 من الزرق بخصائص الأوعية الدموية التي تنطوي على وظيفة بيريسيتيس. تم العثور على بيريسيتيس في بليكسوسيس الشعرية الشبكية الداخلية. وفروع الشريان الشبكية المركزية التي تزود الشبكية الداخلية في طبقتين من بليكسوسيس الشعرية. سرير الأوعية الداخلية يقع بين الخلية العقدة وطبقات النووية الداخلية. طبقة أعمق أكثر كثافة وتعقيداً وهو مترجم بين طبقات النووي الداخلي والخارجي4،5. وبالإضافة إلى ذلك، تحتوي بعض أجزاء من الشبكية أيضا على شبكة ثالثة تسمى الشعيرات الدموية بارابابيلاري شعاعي. هذه طويلة، مستقيم الشعيرات الدموية التي تقع بين الألياف العصبية ونادراً ما أناستوموسي مع بعضها البعض أو بليكسوسيس اثنين الأخرى6. داخل الجدار الشعرية، بيريسيتيس المضمنة في الغشاء الطابق السفلي وخط على الجانب أبلومينال من الخلايا البطانية في الأوعية الدموية.
وحتى الآن، هناك لا علامة بيولوجية فريدة من نوعها لهذه بيريسيتيس التي يمكن تمييزها عن غيرها من الخلايا والأوعية الدموية. عامل النمو المشتقة من الصفيحات مستقبلات بيتا (PDGFRβ) والأعصاب/الدبقية مستضد 2 (NG2) هي علامات شائعة الاستخدام الذي يقدم في بيريسيتيس ولكن أيضا غيرها من الخلايا والأوعية الدموية. تحديد بيريسيتيس تعقيداً بسبب وجود مجموعات فرعية بيريسيتي التي تختلف في التعبير مورفولوجيا والبروتين7. تعتمد حاليا، تحديد أفضل مزيج من علامات البروتين وتحديد المواقع المميزة من بيريسيتي في جدار الأوعية الدموية. علينا أن نظهر هنا ثلاث تقنيات إعداد الأنسجة المختلفة للمناعي تلطيخ PDGFRβ/NG2 بيريسيتيس microvascular الشبكية الفئران، أي، cryo-أقسام، الجامع--يتصاعد، وناقص التوتر العزلة شبكة الأوعية الدموية.
مع البرد-المقاطع، يتم قطع الشبكية والصلبة عن طريق العصب البصري. وهذا يسمح للتصور من جميع هياكل طبقات من الخلايا العصبية. طبقات الشبكية عشرة متميزة الظاهر كجانب تتبادل الهياكل النووية ومحواري/الجذعية التي يمكن تصور مع بقع مثل الهيماتوكسيلين/ويوزين أو الفلورسنت النووية 4 ', 6-دياميدينو-2-فينيليندولي (DAPI)8. تختلف متطلبات الأيض بين طبقات9 وأنه يوفر طريقة لتحديد سمك أو إجمالي غياب طبقة معينة (مثلاً، فقدان خلايا الشبكية العقدة إحدى السمات المميزة الاسكيمية الشبكية10، 11). ويتضح المفرج كما عرضية يخترق الشبكية، مما يجعل من الممكن لدراسة كل على حدة بليكسوسيس الشعرية داخل طبقات الشبكية كل منهما12،13.
أكثر تقليديا، تجري التحقيقات المتعلقة بشبكة الاتصال الشبكية المفرج في الشبكية كل--يتصاعد. مع هذا الإعداد الأنسجة، قطع شبكية العين وسويت بالأرض كبنية على شكل زهرة. الأسلوب هو أسلوب إعداد أنسجة سريعة نسبيا التي يمكن أن تسلط الضوء على المفرج الشبكية الشاملة في الهندسة المعمارية وذلك كثيرا ما تطبق في تحقيق نيوفاسكولاريزيشن في الشبكية موريني. التصور الناجح من ميكروفاسكولاتوري في الجامعة التي شنت شبكية العين يقال أيضا في وضع الماوس الولدان والفئران الشبكية14،،من1516،،من1718، 19-تكشف هذه الدراسات نشاطا بيريسيتيك أكثر تحديداً مع أكبر المناطق الخالية من شعري في الكبار مقارنة ب المواليد الشبكية14.
هو طريقة أخرى لتصور ميكروفاسكولاتوري الشبكية بعد عزلة ناقص التوتر. نتائج هذا الأسلوب إعداد الأنسجة في الأوعية الدموية الشبكية والشعيرات الدموية سراحهم من الخلايا العصبية. عادة هذا النوع من التصوير ثنائي الأبعاد لشبكة الأوعية الدموية الشبكية معزولة المنجزة بعد التربسين الشبكية الهضم20 والمستخدمة لتقييم تشوهات الأوعية الدموية اعتلال الشبكية السكري بما في ذلك فقدان بيريسيتي والشعرية تنكس20،،من2122. ويوفر طريقة العزل ناقص التوتر التحقيقات الجينات الأوعية الدموية الشبكية والاستجابات التنظيمية البروتين كما فعلوا مع RT-PCR وغرب النشاف23،،من2425. نحن نقدم هنا بروتوكولا لتلطيخ المناعي التعويم الحر للمفرج الشبكية معزولة ناقص التوتر كبديل الهضم التربسين لدراسة بيريسيتيس ميكروفاسكولار.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
البروتوكول هو الأمثل، وبرهنت على الفئران ألبينو الذكور البالغين. في جميع إجراءات تجريبية، يعاملون الحيوانات وفقا للوائح في "بيان آرفو" "استخدام الحيوانات" في أوفثالميك والرؤية للبحث. وقد euthanized الحيوانات بثاني أكسيد الكربون والتفكك عنق الرحم اللاحقة.
1-فأر نسيج الشبكية الاستعدادات
-
قسم البرد
- جعل الشقوق سم من ~0.5 الأمامي والخلفي في الجفن الفئران مع مشرط.
- اختياري: استخدام موقد النافذة، علامة العين في الزاوية الداخلية توجيه العين بطريقة موحدة خلال التضمين والسماح لتقطيع كريوستات الرأسي من خلال العصب البصري.
- الاستيلاء على العين بالملقط وآماله بعناية إلى جانب تعريض الأنسجة المحيطة بها. انوكليتي العين بإجراء تخفيضات مع مقص التشريح في النسيج الضام والعضلي.
تنبيه: لا سحب العين من الصعب جداً أن الضغط المفرط على العصب البصري قد يسبب انفصال الشبكية. - وضع العين بإيجاز في 4% فورمالدهايد في مخزنة الفوسفات المالحة (PBS) لتحقيق استقرار قبل القيام ثقب أولية في ليمبوس القرنية بتطبيق الضغط الخفيف بطرف مشرط.
- تحت مجهر، قص على طول ليمبوس القرنية مع مقص تشريح لإزالة القرنية وإزالة العدسة مع الملقط قبل غمر في 4% فورمالدهايد في برنامج تلفزيوني عن ح 2 – 4.
- أشطف بالتتابع في المخزن المؤقت للفوسفات في Sörensen مع السكروز 10% و 25% السكروز.
- تضمين في المتوسط يازولا أعد مع 3 ٪ الجيلاتين من الخنزير الزلال الجلد و 30% من البيض الدجاج.
ملاحظة: البروتوكول يمكن أن يكون مؤقتاً هنا مع تخزين الأنسجة في-20 درجة مئوية.
- جعل الشقوق سم من ~0.5 الأمامي والخلفي في الجفن الفئران مع مشرط.
-
الجامعة-جبل
- جعل ~0.5 الأمامي والخلفي سم الشقوق في الجفن الفئران مع مشرط.
- الاستيلاء على العين بالملقط وآماله بعناية إلى جانب تعريض الأنسجة المحيطة بها. انوكليتي العين بإجراء تخفيضات مع مقص التشريح في النسيج الضام والعضلي.
تنبيه: لا سحب العين من الصعب جداً أن الضغط المفرط على العصب البصري قد يسبب انفصال الشبكية. - وضع العين بإيجاز في 4% فورمالدهايد في برنامج تلفزيوني لتحقيق استقرار قبل القيام ثقب أولية في ليمبوس القرنية بتطبيق الضغط الخفيف بطرف مشرط.
- تحت مجهر، قص على طول ليمبوس القرنية مع مقص تشريح إزالة القرنية وإزالة العدسة بالملقط.
- فصل الشبكية من ظهارة صباغ الشبكية نحو العصب البصري بالملقط باستخدام حركات فتحه صغيرة لتجنب تمزيق الرئيسية.
- مجاناً شبكية العين في العصب البصري مع مقص التشريح وجعل الشقوق أربعة من بضعة مليمترات طول من محيط الشبكية نحو رأس العصب البصري.
- تنتشر الشبكية على شريحة زجاجية والسماح للتجفيف لمدة 5 – 10 دقائق.
- إصلاح في 4% فورمالدهايد لمدة 20 – 30 دقيقة قبل تتساقط فورمالدهايد على شبكية العين.
تنبيه: لا تنطبق مباشرة على الشبكية كما أنه قد فصل من الزجاج. - شطف مع برنامج تلفزيوني. لتحقيق أفضل النتائج، وصمة المناعية مباشرة بعد الشطف.
-
عزل ناقص التوتر
- جعل ~0.5 الأمامي والخلفي سم الشقوق في الجفن الفئران مع مشرط.
- الاستيلاء على العين بالملقط وآماله بعناية إلى جانب تعريض الأنسجة المحيطة بها. انوكلياتي العين بإجراء تخفيضات مع مقص التشريح في النسيج الضام والعضلي.
تنبيه: لا سحب العين من الصعب جداً أن الضغط المفرط على العصب البصري قد يسبب انفصال الشبكية. - جعل ثقب أولية في ليمبوس القرنية عن طريق تطبيق الضغط الخفيف بطرف مشرط.
- تحت مجهر، قص على طول ليمبوس القرنية مع مقص تشريح إزالة القرنية وإزالة العدسة بالملقط.
- فصل الشبكية من ظهارة صباغ الشبكية نحو رأس العصب البصري بالملقط باستخدام حركات فتحه صغيرة لتجنب تمزيق الرئيسية.
- مجاناً شبكية العين في العصب البصري مع مقص التشريح ووضع الشبكية في 1 مل مياه في صفيحة 24-جيدا ويهز 200 لفة في الدقيقة مع مدار اهتزاز 1.5 مم عن ح 1 في درجة حرارة الغرفة.
ملاحظة: الآخرة، الشبكية سوف تظهر أقل المعرفة عند الحواف. - إضافة 200 يو الدناز 1 ننأى بالحطام تفكيك خلية من المفرج الشبكية ويهز لآخر 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: قد تبدأ الحطام إلى النموذج في الآبار. - شطف الحد الأدنى 3 مرات في المياه لمدة 5 دقائق مع الهز 150 – 300 لفة في الدقيقة لإزالة الحطام الخلايا العصبية. ينبغي أن تصبح الشبكية أكثر شفافية مع كل شطف الإرشادية لإزالة الحطام الخلوية العصبية.
- استخدام خلفية داكنة لننظر إلى لوحة 24-جيدا نرى بوضوح المفرج الشبكية معزولة أرقامها.
- (اختياري): إذا كان المفرج لا تظهر خالية من طبقات الخلايا العصبية (شبه شفاف) عند هذه النقطة أما إضافة المزيد من الخطوات شطف، زيادة سرعة الهز أو استخدام بيبيت لنضح السائل على المفرج.
تنبيه: أما الخطوات الاختيارية التي قد تضر المفرج.
- إصلاح 10 دقيقة في 1 مل بارافورمالدهيد 4% في برنامج تلفزيوني في درجة حرارة الغرفة وشطف 3 مرات في برنامج تلفزيوني.
ملاحظة: البروتوكول يمكن أن يكون مؤقتاً هنا مع تخزين الأنسجة في 4 درجات مئوية.
2-إيمونوهيستوتشيميستري
-
تلوين الأقسام البرد
- قطع 10 ميكرون cryo-المقاطع الشبكية جزءا لا يتجزأ من الجيلاتين تمزيقها الرأسي من خلال العصب البصري ووضع cryo-المقاطع على الشريحة الزجاجية واسمحوا جافة (الحد الأدنى ح 1).
- غمر الشريحة الزجاجية في برنامج تلفزيوني مع 0.25% X-100 تريتون (برنامج تلفزيوني-تي) لمدة 15 دقيقة.
- التنقيط 1: 100 PDGFRβ والأجسام المضادة الأساسي 1: 500 في NG2 المخفف في برنامج تلفزيوني-T + 1% جيش صرب البوسنة على المقطع البرد واحتضان في غرف الحضانة عند 4 درجة مئوية بين عشية وضحاها.
- غمر الشريحة الزجاجية 2 مرات في برنامج تلفزيوني-T لمدة 15 دقيقة والتنقيط 1: 100 الماوس المضادة مرتبطة أليكسا فلور 594 و 1: 100 أرنب المضادة ربط فيتك الثانوية الأجسام المضادة المخفف في برنامج تلفزيوني-T مع جيش صرب البوسنة 3% على البرد-المقاطع.
- احتضان الشريحة الزجاجية ح 1 في درجة حرارة الغرفة في الظلام.
- شطف الشريحة الزجاجية في برنامج تلفزيوني-تي 2 × 15 دقيقة.
ملاحظة: اختياري: لتلطيخ مزدوجة وثلاثية إيمونوفلوريسسينت، تلطيخ متسلسلة يمكن تنفيذها بواسطة تكرار الإجراء من 2.1.3 إلى 2.1.6 اثنين وثلاثة مرات، على التوالي. - جبل cryo-المقاطع الملون مع يتلاشى لمكافحة تصاعد DAPI تحتوي على المتوسط وساترة.
-
تلوين كل-جبل
- التنقيط وبرنامج تلفزيوني-T على الجامعة-جبل واحتضان في درجة حرارة الغرفة لمدة 15 دقيقة.
- من أجل إيقاف والتنقيط 1: 100 PDGFRβ والأجسام المضادة الأساسي 1: 500 في NG2 المخفف في برنامج تلفزيوني-T + 1% جيش صرب البوسنة واحتضان في غرف رطبة في 4 درجات مئوية بين عشية وضحاها.
- من أجل إيقاف والتنقيط في برنامج تلفزيوني-T شطف الشريحة الزجاجية في 2 × 15 دقيقة.
- من أجل إيقاف والتنقيط على 1: 100 أرنب لمكافحة Cy2-و 1: 100 الماوس المضادة مرتبطة Cy3 الثانوية جسم المخفف في برنامج تلفزيوني-T مع جيش صرب البوسنة 3% لاحتضان ح 1 في غرفة رطبة في درجة حرارة الغرفة في الظلام.
- من أجل إيقاف والتنقيط في برنامج تلفزيوني-T شطف في 2 × 15 دقيقة في الظلام.
ملاحظة: اختياري: لتلطيخ مزدوجة وثلاثية إيممونوفلوريسسينت، تلطيخ متسلسلة يمكن تنفيذها بواسطة تكرار الإجراء من 2.2.2 إلى 2.2.5 اثنين وثلاثة مرات، على التوالي. - جبل الملون كلياً-جبل مع يتلاشى لمكافحة تصاعد DAPI تحتوي على المتوسط وساترة.
-
تلوين للمفرج معزولة ناقص التوتر
- كتلة المفرج معزولة ناقص التوتر ح 1 مع الهز في 100 لفة في الدقيقة ودرجة حرارة الغرفة مع 500 ميليلتر/جيدا من 10% حمار المصل المخفف في برنامج تلفزيوني.
- تبني بين عشية وضحاها في درجة حرارة الغرفة ويهز 100 لفة في الدقيقة مع 600 ميليلتر/البئر 1: 100 PDGFRβ وأجسام الأولية NG2 1: 500 المخفف في المصل حمار 10% في برنامج تلفزيوني.
- شطف الشبكية شبكة x 3 في برنامج تلفزيوني لمدة 5 دقائق واحتضان في 1: 100 الماوس المضادة ترتبط أليكسا فلور 594 و 1: 100 أرنب المضادة ربط فيتك الثانوي الأجسام المضادة المخفف في المصل حمار 10% في برنامج تلفزيوني تهتز في 100 لفة في الدقيقة ودرجة حرارة الغرفة ح 1 في الظلام.
- شطف في برنامج تلفزيوني-T لمدة 5 دقائق واحتضان 0.2 نانوغرام/مل DAPI في برنامج تلفزيوني-T لمدة 15 دقيقة تليها يشطف دقيقة 3 x 5 في برنامج تلفزيوني-تي في الظلام.
- قص طرف بيبيت باستور البلاستيك وترطيب مع برنامج تلفزيوني-تي واستخدامه لنقل شبكة الاتصال الشبكية لشريحة دائرة زجاجية 4-جيدا.
ملاحظة: الخطوة مويستينينج المهم تجنب المفرج الشبكية الخلاف إلى داخل بيبيت باستور. - تتكشف المفرج الشبكية. تجنب لمس المفرج الشبكية مع ملقط كما يمكن أن يسبب هذا المفرج متشابكة.
ملاحظة: تتكشف يمكن القيام به عن إمالة الشريحة الدائرة ذهابا وإيابا أو يسفط قطرات من السائل على المفرج الشبكية. - إزالة المتوسطة من الآبار. التوتر السطحي للسائل سوف تتسطح المفرج على الجزء السفلي من الشريحة.
- ضمان تتكشف الصحيح تحت مجهر قبل إزالة البلاستيك الآبار من الشريحة الدائرة.
- جبل المفرج الملون مع المتوسطة يتلاشى لمكافحة تصاعد وساترة.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
توفر البروتوكولات الناجحة ثلاثة استعدادات الشبكية المختلفة لتصور بيريسيتيس ميكروفاسكولار. كل من هذه الأساليب تستخدم التعريب المشارك إيمونوريكتيفيتي PDGFRβ وفي NG2 وموقف بيريسيتيس الذي يلتف حول فوريدينتيفيكيشن البطانة الشعرية الفريدة.
مع البرد-المقاطع، يمكن تحديد طبقات الخلايا العصبية الفلورسنت كثافة أنوية المسمى DAPI والداخلية وبليكسوسيس الشعرية العميقة تحتوي على بيريسيتيس التي تعرض إيممونوريكتيفيتي PDGFRβ وفي NG2 (الشكل 1). يمكن اعتبار موقف فريد من بيريسيتيس في جدار الأوعية الدموية إيمونوريكتيفيتي دائرية أو على شكل حدوة حصان في محيط هذه السفن (الشكل 1، أسهم) أو عرضية طوليا قطع السفن (الشكل 1، رأس السهم).
يمكن أن تكون صعبة التصور الناجح من بيريسيتيس ميكروفاسكولار في الجامعة-جبل إعداد الفئران الكبار14،20. وأسفرت إيمونوريكتيفيتي PDGFRβ في الشبكية الكبار مثبتة على كل فقط إشارة ضعيفة جداً (غير معروضة). تلوين في NG2 أجمل شبكة الأوعية الدموية الداخلية مع تلطيخ مكثفة في أبلومينال بيريسيتيس (الشكل 2).
للحصول على نظرة عامة لشبكة الأوعية الدموية الشبكية الفئران الكبار، immunohistochemistry شبكة الأوعية الدموية الشبكية الفئران المعزولة ناقص التوتر يوفر طريقة بديلة الجامعة-جبل. عند إجراء عملية بنجاح، هذا الأسلوب إعداد الأنسجة يوفر لمحة عامة عن ميكروفاسكولاتوري الشبكية كاملة بما في ذلك بليكسوسيس الداخلية والشعرية العميقة. النتائج المناعي تلطيخ مع علامات بيريسيتيك في الشبكة بأكملها ميكروفاسكولار عرض إيمونوريكتيفيتي في NG2 مع استجابة مكثفة في خلايا معينة الأوعية الدموية (الشكل 3). كما عرض بعض من هذه الخلايا PDGFRβ إيمونوريكتيفيتي (الشكل 3).
من المهم تتكشف حذراً من الأنسجة للحصول على نظرة عامة جيدة من المفرج الشبكية. يمكن أن ينتج عن تتكشف عدم كفاية المفرج يجري ترتيبها في طبقات متعددة من التركيز الذي يجعل الفلورسنت التصوير صعبة (الشكل 4). ويمكن تيسير تتكشف بالهز لطيف، وآماله الشريحة الدائرة ذهابا وإيابا أو يسفط قطرات سائل على المفرج الشبكية. تجدر الإشارة إلى أن تشريح بليكسوسيس الشعرية الشبكية سيؤدي إلى بعض تراكب للأسرة بالأوعية الدموية. ومن ثم فإنه مثير للجدل لتمييز الداخلية من بليكسوسيس الشعرية أعمق عندما دكت على شريحة الزجاج.
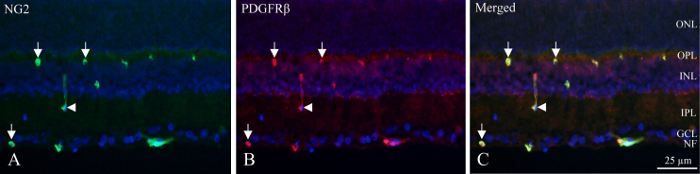
رقم 1: ضعف المناعي تلطيخ بيريسيتي البرد-قسم الشبكية الداخلية الفئران. (أ) في NG2 immunohistochemistry (الأخضر) يكشف عن السفن الإيجابية داخل الجزء الداخلي من الشبكية. تشير الأسهم إلى إيممونوريكتيفيتي دائرية وعلى شكل حدوة حصان في الأوعية الدموية. يشير رأس السهم إلى سفينة قصها طوليا. (ب) PDGFRβ (أحمر) immunohistochemistry إظهار مفاعليه مماثلة في NG2 إيمونوريكتيفيتي. الأسهم ورأس السهم نقطة في بنيات نفسه أما بالنسبة لتلطيخ في NG2. (ج) الصورة يظهر دمج في NG2، PDGFRβ و DAPI (أزرق) بفرض ثلاثة عوامل تصفية مختلفة. وكشفت أن الأجسام المضادة اثنين مترجمة شارك (الأخضر + الأحمر = أصفر). NF: طبقة الألياف العصبية، جكل: العقدة خلية طبقة، الشعيرات: طبقة بليكسيفورم الداخلية، والمكتب: الطبقة النووية الداخلية، المناضل: طبقة بليكسيفورم الخارجي، ONL: طبقة النووي الخارجي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: المناعي تلطيخ بيريسيتي الشبكية مثبتة على كل فأر. إيممونوريكتيفيتي في NG2 (أحمر) مرئياً على طول نيتووركويث الأوعية الدموية سطحية مكثفة تلطيخ في بيريسيتيس أبلومينال. وتظهر الصور المدمجة في NG2 و DAPI (أزرق). الخلايا العصبية مرئية كنواة DAPI الأزرق بين ميكروفاسكولاتوري الملون في NG2. إيمونوريكتيفيتي PDGFRβ في الشبكية الكبار شنت الجامعة أسفرت فقط عن إشارة ضعيفة جداً ولذلك لم تدرج في هذا الشكل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3: ضعف المناعي تلطيخ بيريسيتي من الفئران المعزولة ناقص التوتر المفرج الشبكية. (أ)-الصورة تظهر الفئران المعزولة ناقص التوتر شبكة الأوعية الدموية الشبكية المناعي ملطخة في NG2 (أخضر) و PDGFRβ (أحمر). وأظهرت شبكة كاملة إيمونوريكتيفيتي في NG2. ومع ذلك، تم العثور على إيممونوريكتيفيتي PDGFRβ في اتفاقات الخلية. الإدراج (أ) لمحة عامة عن شبكة المفرج الشبكية الملون مع DAPI (أزرق). (ب) الصورة تظهر العينة نفسه ك (A) في موقع مختلف وأعلى التكبير. فمن الواضح أن تلطيخ PDGFRβ يتم عرض فقط في اتفاقات خلية في شبكة الأوعية الدموية التي تشير إلى إيممونوريكتيفيتي بيريسيتي. وهو الإدراج بالصوره التي توضح تضخم عالية من المفرج ملطخة في NG2 (الأخضر)، PDGFRβ (أحمر) ودمجها مع DAPI. بما في ذلك DAPI تلطيخ جنبا إلى جنب مع NG2 و PDGFRβ يكشف عن ثلاثة بيريسيتيس (PDGFRβ-إيجابي) وخليتي الجدار سفينة مجهولة الهوية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: مثال عدم كفاية تكشفت ناقص التوتر معزولة الشبكية المفرج. تتكشف حذراً من المفرج معزولة ناقص التوتر مهم كما تتكشف غير كافية يمكن أن ينتج المفرج يجري مكدسة. وتظهر الصور الملطخة DAPI المفرج الشبكية في الموقع نفسه ولكن اتخذت في طبقات مختلفة من التركيز. إظهار الخلايا الملون DAPI (أ) في طبقة واحدة التركيز الأوعية الدموية حوالي 25 ميكرومتر سميكة في المفرج الشبكية. (ب) الملون DAPI الخلايا في طبقة تركيز ثاني توضيح رقيقة الشعيرات الدموية المتفرعة في نفس الموقع الذي قد تم مكدسة على الأوعية الدموية الكبيرة المعروضة في (أ). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Subscription Required. Please recommend JoVE to your librarian.
Discussion
نحن نقدم ثلاث تقنيات إعداد الشبكية التي يمكن تطبيقها في دراسة ميكروفاسكولار بيريسيتيس الشبكية. فيما يلي، نقدم مقارنة بين كل من الطرق وتسليط الضوء على الخطوات الحاسمة في البروتوكولات.
مع تقطيع البرد، هو قطع الشبكية في أقسام السهمي و ومن ثم فإنه من الممكن الحصول على عينات عديدة من الشبكية نفسها. المقاطع الأرقام الناتجة عن هذا الأسلوب جعله خياراً مثاليا لخصوصية جسم واختبار المعايرة كما أنه يمنع التضحية الحيوانية لا لزوم لها. الأعمال التحضيرية حاسمة بالنسبة لنتائج جيدة. من الأهمية بمكان حين تشريح العين لا لسحب العين ولكن قطع جميع العضلات حول العين. هناك خطر انفصال الشبكية في حالة استخدام القوة. نظراً لأن كأس العين رقيقة، واحدة ينبغي أن لا إصلاح طويل جداً. سيتم إصلاح الغمر مع بارافورمالدهيد 4% في برنامج تلفزيوني عن ح 2 – 4 في الأنسجة. إذا كان ثابت لم يعد، هناك خطر تدمير antigen للفائدة. من أجل توليد إيمونوستينينجس ممكن أفضل، من الأهمية بمكان لكل قسم تكون مسطحة قدر الإمكان ضد الزجاج. نظراً لأن تتضمن الفروع إلا عدد قليل من التخفيضات عرضية عرضية ميكروفاسكولاتوري، يقدم هذه الأنسجة التحضيرات التقنية فقط متقطعة التصور ميكروفاسكولاتوري. ولذلك، هذا الأسلوب غير مناسب لدراسات الهندسة المعمارية الأوعية الدموية عموما والتدابير القابلة للقياس الكمي من بيريسيتيس.
يمكن الملون المفرج عموما بعد تركيب الجامعة لتقديم نظرة عامة المفرج. عند إتقان هذا الأسلوب، فإنه يمكن إجراء إعداد أنسجة سريعة نسبيا ويتطلب قليلاً من عبء العمل. ومع ذلك، هناك عدد قليل من النقاط أن ندرك بشكل خاص. الشبكية هشة وأنه أمر بالغ الأهمية للتعامل معها بعناية وتجنب مزقت والتخفيضات. وعلاوة على ذلك، أثناء معالجة الشبكية بعناية، من الأهمية الرئيسية لتجنب الطيات والصدوع الأخرى أثناء المتصاعدة التي قد تؤثر على التصوير المناعي في وقت لاحق. شبكية العين محملة بسمك 250-300 ميكرون واختراق جسم طبقات الخلايا العصبية قد تكون إشكالية. فيما يتعلق بالتصور بيريسيتي، NG2 تلطيخ في بروتوكول الجامعة-جبل لا يمكن تحقيقه إلا بجسم ثانوية المرتبطة Cy3، وأسفر إيمونوريكتيفيتي PDGFRβ في الشبكية الكبار مثبتة على كل هذه الغاية ضعف الإشارات التي لم تبين في هذا الرقم. ومن ثم ففائدة هذه التقنية المصبوغة كلياً-جبل يعوقها بشدة اعتماداً المصبوغة الناجحة أساسا على الأجسام المضادة الأولية والثانوية المحددة المستخدمة. اقتراحات أخرى لتحسين البروتوكول المتعلق بتصور بليكسوسيس microvascular الشبكية الفئران الكبار الحضانة في جسم الأولية لفترة أطول من الوقت و/أو تغيير درجة حرارة الحضانة26.
سبب سمك محمولة أسرة، من المهم أن تكون على علم باتجاه الشبكية بعد إجراء شقوق أربعة من محيط الشبكية نحو رأس العصب البصري لتجنب تصاعد عرضي مع الشبكية الداخلية التي تحتوي على الشعيرات الدموية مواجهة لأسفل. لا يزال، التصور مفصلة بليكسوسيس ميكروفاسكولار أعمق وبيريسيتيس يمكن أن تكون مزعجة بهذا الأسلوب14،20. ككل-جبل تلطيخ الشبكية الكبار صعب في الضفيرة الشعرية أعمق، قد يؤدي هذا في الشبكية أفاسكولار التي تظهر في بعض الأجزاء. المناعي تلطيخ الشبكية الكبار شنت الجامعة يوفر فقط نظرة مجزأة للمفرج مع بيريسيتيس بطانة السفينتين في الضفيرة الشعرية سطحية، وبالتالي فهذا الأسلوب يمكن أن يؤدي إلى نتائج سلبية كاذبة في تصور المفرج الشبكية الفئران.
طالما اعتبرت الهضم التربسين تقنية معيار الذهب للعزلة والتصور في الشبكية المفرج20. يوفر طريقة بديلة لتصور شبكة الأوعية الدموية ثلاثية الأبعاد المعقدة الكامل العزلة ناقص التوتر ويواجه العديد من نفس العمل مع أنسجة هشة للغاية وصعوبة في التعامل مع التحديات. نظراً للتشابه في المنتج والأوعية الدموية الشبكية بين هاتين الطريقتين، يواجه عزلة ناقص التوتر العديد من نفس التحديات التي تواجهها التربسين هضم20 بما في ذلك تشريح دقيق لمنع الدموع الرئيسية والتعامل مع الحذر بتجنب بيبيتينج ولمس بالملقط. هو فارق هام بين الأساليب التثبيت. التربسين هضم ويتم عادة بعد التثبيت ويمكن تطبيقها بنجاح على الحفاظ على شبكية العين التي كانت في مثبت لعدة سنوات20. العزلة ناقص التوتر قبل التثبيت، ويسمح بالتالي للتنفيذ في مختلف فحوصات أخرى كما هو موضح سابقا في الأدب23،،من2425. ويتم هضم التربسين على مدى اليومين الماضيين20، حين عزل ناقص التوتر يمكن أن تنجز في غضون ساعات. وعلاوة على ذلك، البروتوكول العزلة ناقص التوتر لا تتضمن مخاطر الإفراط الهضم والانقسام الانزيمية غشاء علامات المطلوبة للاعتراف بيريسيتي، مثل PDGFRβ وفي NG2، مما يجعل هذا الأسلوب المفضل للاحقة تلوين ميكروفاسكولار المناعي.
وأخيراً، على الرغم من خارج النطاق المباشر لهذه المخطوطة، هناك تقنية معروفة على نطاق واسع أقل ولكنها مفيدة جداً لعزل plexi microvascular كبيرة، سليمة من القوارض من الشبكية27. يتم وضع الشبكية في قاعة الزجاج الخاص وساترة. عند إزالة ساترة، بقايا ميكروفاسكولاتوري تعلق على ساترة لإنشاء شكل كامل على قيد الحياة الأنسجة (≈ 98% من الخلايا) الطباعة. أكبر ميزة لهذا الأسلوب أنه يتيح للدراسة الفيزيولوجية للسفن والتثبيت لاحقاً إيمونوستينينج. حد واضح للأسلوب هو أنه لا يوفر التصور/عزل الشبكة microvascular بأكملها كجبل مسطح الشبكية والقيام بالأعمال التحضيرية ناقص التوتر. ومع ذلك، يمكن تصور بيريسيتيس بتطبيق هذا الأسلوب27.
تقنيات إعداد الأنسجة الثلاثة الموصوفة هنا متكاملة بمعنى أن كل أسلوب يشمل المزايا والعيوب لتصور بيريسيتيس ميكروفاسكولار. تقييم كل إمكانات الأساليب والضعف مهم لتحديد الأسلوب الأمثل للتحقيق في بيريسيتيس ميكروفاسكولار في ظروف مرضية محددة. يمكن توسيع الطرق الواضحة لتلطيخ ليس فقط لعلامات بيريسيتي ولكن أيضا للتصور من الهياكل ميكروفاسكولار بشكل عام. في نهاية المطاف، الباحث الفردية لتحديد أسلوب التصور المناسب استناداً إلى فرضية البحث في السؤال.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgments
الأبحاث بتمويل من مؤسسة Lundbeck، الدانمرك.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



