Summary
We tonen drie verschillende weefsel voorbereiding technieken voor immunohistochemische visualisatie van rat retinale microvasculaire pericytes, dat wil zeggen, cryo-secties, geheel-mounts en hypotone isolatie van de vasculaire netwerk.
Abstract
Netvlies pericytes spelen een belangrijke rol in vele ziektes van het oog. Immunohistochemische kleuring technieken van retinale vaartuigen en microvasculaire staan pericytes centraal in uitgevoerd oftalmologisch onderzoek. Het is belangrijk om te kiezen van een geschikte methode voor het visualiseren van de microvasculaire pericytes. We beschrijven de retinale microvasculaire pericyte immunohistochemische kleuring in cryo-secties, geheel-mounts en hypotone geïsoleerde therapieën met antilichamen voor bloedplaatjes afkomstige groei factor receptor β (PDGFRβ) en zenuw/gliale antigeen 2 (NG2). Hierdoor kunnen we voordelen en tekortkomingen van elk van de drie weefsel voorbereidingen voor de visualisatie van de retinale microvasculaire pericytes te benadrukken. Cryo-secties bieden transsectional visualisatie van alle retinale lagen maar bevatten slechts een paar occasionele dwarse bezuinigingen van de microvasculature. Geheel-mount geeft een overzicht van de gehele netvlies therapieën, maar visualisatie van de microvasculature kan worden lastig. Hypotone isolatie biedt een methode om te visualiseren de gehele netvlies therapieën door de verwijdering van neuronale cellen, maar dit maakt het weefsel erg kwetsbaar.
Introduction
Netvlies pericytes zijn de focus van vele onderzoekslaboratoria zoals deze cellen een belangrijke rol in de integriteit van de therapieën spelen. Pathologische condities zoals diabetische retinopathie1, ischemie2en glaucoom3 hebben vasculaire kenmerken die betrekking hebben op de functie van pericytes. Pericytes zijn te vinden in de innerlijke retinale capillaire pelxi. De centrale netvlies slagader die de innerlijke netvlies takken in twee lagen van capillaire pelxi levert. Het innerlijke vasculaire bed ligt tussen de ganglion cel en de binnenste nucleaire lagen. De diepere laag is meer dichte en complex en is gelokaliseerd tussen de binnenste en buitenste lagen van de nucleaire4,5. Bovendien, bevatten sommige delen van het netvlies ook een derde netwerk genoemd van de radiale parapapillary haarvaten. Dit zijn lange, rechte haarvaten, die tussen de zenuwvezels en zelden liggen anastomose met elkaar of de andere twee pelxi6. Binnen de capillaire muur, pericytes worden ingebed in het membraan van de kelder en lijn de abluminal kant van vasculaire endotheliale cellen.
Tot op heden is er geen unieke biologische marker van deze pericytes die hen van andere vasculaire cellen onderscheiden kunt. Bloedplaatjes afkomstige groei factor receptor β (PDGFRβ) en zenuw/gliale antigeen 2 (NG2) zijn veelgebruikte markeringen die beide op pericytes maar ook andere vasculaire cellen presenteren. Identificatie van de pericytes wordt verder bemoeilijkt door het bestaan van pericyte subsets kunt weergeven die in morfologie en eiwit expressie7 verschillen. Op dit moment de beste identificatie is gebaseerd op een combinatie van eiwit markers en de karakteristieke positionering van de pericyte in de vasculaire muur. Wij tonen hier drie verschillende weefsel voorbereiding technieken voor PDGFRβ/NG2 Immunohistochemie van rat retinale microvasculaire pericytes, dat wil zeggen, cryo-secties, geheel-mounts en hypotone isolatie van de vasculaire netwerk.
Met cryo-secties, worden het netvlies en de sclera gesneden door de oogzenuw. Dit zorgt voor de visualisatie van alle gelaagde structuren van neuronen. De afzonderlijke tien lagen van het netvlies zijn herkenbaar als het uitwisselen van nucleaire en axonale/dendritische structuren die kunnen worden gevisualiseerd met vlekken zoals Haematoxyline/eosine of fluorescerende nucleaire 4', 6-diamidino-2-phenylindole (DAPI)8. De metabole eisen verschillen tussen de lagen9 en het biedt een methode om te bepalen dikte of totaal gebrek aan een specifieke laag (bijvoorbeeldhet verlies van retinale peesknoopcellen is één van de kenmerken van retinale ischemie10, 11). De therapieën blijkt zoals dwarse het netvlies doorsnijdt, waardoor het kan afzonderlijk bestuderen de capillaire pelxi binnen de respectieve retinale lagen12,13.
Het onderzoek van het netvlies therapieën netwerk worden meer traditioneel, uitgevoerd in netvlies geheel-mounts. Het netvlies is met de voorbereiding van dit weefsel, knippen en afgevlakt als een bloem-vormige structuur. De methode is een relatief snel weefsel voorbereiding techniek die de algehele het platform retinale therapieën kunt markeren en het wordt daarom vaak toegepast bij het onderzoek van neovascularization in de lymfkliertest retina. Succesvolle visualisatie van het microvasculature in geheel gemonteerde netvlies wordt ook gemeld in de ontwikkelingslanden neonatale muis en rat netvlies14,15,16,17,18, 19. deze studies openbaren een meer gedefinieerde pericytic activiteit met grotere capillair-vrije gebieden in de volwassene in vergelijking met de neonatale netvlies14.
Een andere manier van het visualiseren is het netvlies microvasculature na hypotone isolatie. Dit weefsel voorbereiding techniek resulteert in netvlies bloedvaten en haarvaten wordt bevrijd van de neuronale cellen. Dit soort tweedimensionale beeldvorming van het geïsoleerde retinale vasculaire netwerk is meestal na het netvlies trypsine spijsvertering20 uitgevoerd en gebruikt om te beoordelen van de vasculaire afwijkingen van diabetische retinopathie, met inbegrip van verlies van de pericyte en capillaire degeneratie20,21,22. De methode hypotone isolatie biedt het onderzoek van het netvlies vasculaire gen- en eiwit regelgevende reacties zoals zij heeft gedaan met de RT-PCR en westelijke bevlekkende23,24,25. Wij bieden hier een protocol voor de free float immunohistochemische kleuring van de hypotone geïsoleerde retinale therapieën als alternatief voor de spijsvertering van de trypsine te onderzoeken de microvasculaire pericytes.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Het protocol werd geoptimaliseerd en bij volwassen mannelijke albino ratten laten zien. In alle experimentele procedures, werden de dieren behandeld volgens de verordeningen in de ARVO instructie voor het gebruik van dieren in Ophthalmic en visie onderzoek. Dieren werden euthanized door kooldioxide en latere cervicale dislocatie.
1. rat retinale weefsel preparaten
-
Cryo-sectie
- Maak posterieure en anterieure ~0.5 cm spleten van in het ooglid rat met een scalpel.
- Optioneel: Met een diathermie-brander, markeren het oog de binnenste hoek met het oog op een uniforme manier oriënteren tijdens het insluiten en zorgen voor verticale cryostaat segmenteren via de oogzenuw.
- Pak het oog met een tang en zorgvuldig naar de kant bloot van het omringende weefsel te kantelen. Enucleate het oog door het bezuinigen met een schaar van de dissectie in het bindweefsel en gespierd weefsel.
Let op: Trek niet aan het oog te hard zoals overmatige druk op de oogzenuw kan retinale detachement. - Het oog kort gezegd in 4% formaldehyde in een met fosfaat gebufferde zoutoplossing (PBS) te stabiliseren alvorens een eerste gat in het hoornvlies limbus door lichte druk uit met het topje van een scalpel.
- Onder een Microscoop, snijd u langs het hoornvlies limbus met een dissectie schaar aan Verwijder het hoornvlies en de lens met een tang vóór het dompelen in 4% formaldehyde in PBS voor 2 – 4 h.
- Spoel opeenvolgend in Sörensen van fosfaatbuffer met 10% sucrose en 25% sucrose.
- Insluiten in Yazulla medium bereid met 3% gelatine van varkens huid en 30% albumine van kip-ei-wit.
Opmerking: Het protocol kan worden onderbroken hier met weefsel opslag bij-20 ° C.
- Maak posterieure en anterieure ~0.5 cm spleten van in het ooglid rat met een scalpel.
-
Geheel-mount
- Maak posterieure en anterieure ~0.5 cm spleten in het ooglid rat met een scalpel.
- Pak het oog met een tang en zorgvuldig naar de kant bloot van het omringende weefsel te kantelen. Enucleate het oog door het bezuinigen met een schaar van de dissectie in het bindweefsel en gespierd weefsel.
Let op: Trek niet aan het oog te hard zoals overmatige druk op de oogzenuw kan retinale detachement. - Het oog kort gezegd in 4% formaldehyde in PBS te stabiliseren alvorens een eerste gat in het hoornvlies limbus door lichte druk uit met het topje van een scalpel.
- Onder een Microscoop, snijd u langs het hoornvlies limbus met een dissectie schaar aan Verwijder het hoornvlies en de lens met een tang.
- Het netvlies van het retinale pigment epitheel richting de oogzenuw scheiden met een tang met kleine opening bewegingen om te voorkomen dat grote scheuren.
- Het netvlies op de oogzenuw gratis met een dissectie schaar en vier spleten van een paar millimeter lengte maken vanuit de retinale periferie naar het hoofd van de oogzenuw.
- Verspreid het netvlies op een glasplaatje en laat gedurende 5-10 min. drogen.
- Oplossen in 4% formaldehyde voor 20-30 min door druipend van formaldehyde op het netvlies.
Let op: Niet rechtstreeks op het netvlies van toepassing als het van het glas loskoppelen kan. - Spoel met PBS. Voor optimale resultaten, immuno-vlek direct na het spoelen.
-
Hypotone isolatie
- Maak posterieure en anterieure ~0.5 cm spleten in het ooglid rat met een scalpel.
- Pak het oog met een tang en zorgvuldig naar de kant bloot van het omringende weefsel te kantelen. Enucleate het oog door het bezuinigen met een schaar van de dissectie in het bindweefsel en gespierd weefsel.
Let op: Trek niet aan het oog te hard zoals overmatige druk op de oogzenuw kan retinale detachement. - Maak een eerste gat op het hoornvlies limbus door lichte druk uit met het topje van een scalpel.
- Onder een Microscoop, snijd u langs het hoornvlies limbus met een dissectie schaar aan Verwijder het hoornvlies en de lens met een tang.
- Het netvlies van het retinale pigment epitheel naar de kop van de oogzenuw scheiden met een tang met kleine opening bewegingen om te voorkomen dat grote scheuren.
- Gratis het netvlies op de oogzenuw met dissectie schaar, plaats van het netvlies in 1 mL gedeïoniseerd water in een 24-well-plate en schud bij 200 omwentelingen per minuut met een 1,5 mm trillingen baan gedurende 1 uur bij kamertemperatuur.
Opmerking: Hierna, het netvlies verschijnt dat minder gedefinieerd aan de randen. - Voeg toe 200 U DNAse 1 te distantiëren van het puin lysed cellen van het retinale therapieën en schud gedurende een ander 30 minuten bij kamertemperatuur.
Opmerking: Puin zou kunnen beginnen te vormen in de putjes. - Spoel minimaal 3 keer in gedeïoniseerd water gedurende 5 minuten met schudden bij 150-300 rpm neuronale cel puin te verwijderen. Het netvlies moet transparanter worden met elk indicatief voor de verwijdering van neuronale cellulaire puin spoelen.
- Gebruik een donkere achtergrond te zoeken in de 24-well plaat om te zien duidelijk het doorschijnende geïsoleerde retinale therapieën.
- (Optioneel): als de therapieën niet vrij van neuronale lagen (semi-transparant) op dit moment hetzij meer spoelen stappen toevoegen, het schudden snelheid verhogen of een pipet kunt gecombineerd vloeistof op de therapieën.
Let op: Een van de optionele stappen kan schade aan de therapieën.
- Corrigeer 10 min in 1 mL 4% paraformaldehyde in PBS bij kamertemperatuur en spoelen 3 keer in PBS.
Opmerking: Het protocol kan worden onderbroken hier met weefsel opslag bij 4 ° C.
2. Immunohistochemistry
-
-Verkleuring van de cryo-secties
- Knip 10 µm cryo-delen van het netvlies gelatine-ingesloten als verticale segmenteren via de oogzenuw en plaats de cryo-delen op een glasplaatje en laat drogen (minimaal 1 h).
- Het glasplaatje in PBS met 0,25% dompelen Triton X-100 (PBS-T) gedurende 15 minuten.
- 1:100 PDGFRβ en 1:500 NG2 primaire antilichamen verdund in PBS-T + 1% BSA op de cryo-sectie druppelen en na een nacht bebroeden in incubatie kamers bij 4 ° C.
- Het glasplaatje 2 keer in PBS-T gedurende 15 min. onderdompelen en druppelen van 1:100 anti-muis Alexa Fluor 594-linked contracten en 1:100 anti-konijn FITC-linked secundaire antilichamen verdund in PBS-T met 3% BSA op de cryo-delen.
- Incubeer het glasplaatje 1 uur bij kamertemperatuur in het donker.
- Spoel het glasplaatje in PBS-T 2 x 15 min.
Opmerking: Optionele: voor twee- en driepersoonskamers immunefluorescentie kleuring, opeenvolgende kleuring kan worden uitgevoerd door het procédé van 2.1.3 aan 2.1.6 twee of drie keer, respectievelijk. - Monteer de gebeitst cryo-delen met anti-fading montage middellange met DAPI en een dekglaasje aan.
-
Kleuring voor geheel-mount
- PBS-T druppelen op het geheel-mount en Incubeer bij kamertemperatuur gedurende 15 minuten.
- Giet af en 1:100 PDGFRβ en 1:500 NG2 primaire antilichamen verdund in PBS-T + 1% BSA druppelen en na een nacht bebroeden in vochtige kamers bij 4 ° C.
- Giet af en druppelen op PBS-T te spoelen het glasplaatje in 2 x 15 min.
- Giet af en druppelen op 1:100 anti-konijn Cy2- en 1:100 anti-muis Cy3 alternerende secundair antilichaam verdund in PBS-T met 3% BSA naar Incubeer 1 uur in een vochtige kamer bij kamertemperatuur in het donker.
- Giet af en druppelen op PBS-T te spoelen in 2 x 15 min in het donker.
Opmerking: Optionele: voor twee- en driepersoonskamers immunefluorescentie kleuring, opeenvolgende kleuring kan worden uitgevoerd door het procédé van 2.2.2 aan 2.2.5 twee of drie keer, respectievelijk. - Monteer de gebeitst geheel-mount met anti-fading montage middellange met DAPI en een dekglaasje aan.
-
Kleuring van hypotone geïsoleerde therapieën
- Blokkeren de hypotone geïsoleerde therapieën 1 h met schudden op 100 rpm en kamertemperatuur met 500 µL per putje van 10% ezel serum verdund in PBS.
- Na een nacht bebroeden bij kamertemperatuur en schud op 100 rpm met 600 µL per putje van 1:100 PDGFRβ en 1:500 NG2 primaire antilichamen in 10% ezel serum in PBS is verdund.
- Spoel de retinale netwerk 3 x in PBS voor 5 min en broeden in 1:100 anti-muis Alexa Fluor 594-linked contracten en 1:100 anti-konijn FITC-linked secundaire antilichamen verdund in 10% serum van de ezel in PBS schudden op 100 rpm en kamertemperatuur gedurende 1 uur in het donker.
- Spoel in PBS-T voor 5 min en incubeer in 0,2 ng/mL DAPI in PBS-T gedurende 15 minuten gevolgd door 3 x 5 min gespoeld in PBS-T in het donker.
- Knip het puntje van een plastic pipet van Pasteur, het bevochtigen met PBS-T en gebruiken voor het overbrengen van het netvlies netwerk naar een kamer van 4-well glasplaatje.
Opmerking: De moistening stap is belangrijk om te voorkomen dat het netvlies therapieën vasthouden aan de binnenkant van de pipet van Pasteur. - Ontvouwen van de retinale therapieën. Raak de retinale therapieën met een tang als dit leiden de therapieën tot kan te verwarren.
Opmerking: Ontplooiing kan gedaan worden door het kantelen van de kamer dia heen en weer of zuigen druppels vloeistof op het netvlies therapieën. - Verwijder het medium van de putten. De oppervlaktespanning van de vloeistof zal de therapieën op de bodem van de dia afvlakken.
- Zorgen voor juiste ontvouwen onder een Microscoop voordat het verwijderen van het plastic wells van de dia van de kamer.
- Monteer de gebeitst therapieën met anti-fading montage medium en een dekglaasje aan.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De succesvolle protocollen bieden drie verschillende retinale preparaten voor het visualiseren van microvasculaire pericytes. Elk van deze methoden gebruikt de PDGFRβ en NG2 co lokalisatie van de immunoreactivity en de unieke positie van de pericytes die rondom de capillaire endotheel-foridentification doorloopt.
De neuronale lagen kunnen worden geïdentificeerd door de fluorescerende dichtheid van DAPI-gelabelde kernen en de binnenste met cryo-secties, en diep capillaire pelxi bevatten pericytes die weer PDGFRβ en NG2 immunoreactivity (Figuur 1). De unieke positie van pericytes in de vasculaire muur kan worden gezien als cirkelvormige of hoefijzer-vormige immunoreactivity in de periferie van de schepen (Figuur 1, pijlen) of occasionele Overlangs snijden vaartuigen (Figuur 1, pijlpunt).
Succesvolle visualisatie van de microvasculaire pericytes in geheel-mount voorbereiding van volwassen ratten kan lastig zijn14,20. PDGFRβ immunoreactivity in het geheel gemonteerde volwassen netvlies resulteerde slechts in een zeer zwak signaal (niet afgebeeld). Ng2 kleuring schetste de innerlijke vasculaire netwerk met intense kleuring in abluminal pericytes (Figuur 2).
Voor het verkrijgen van een overzicht van de vasculaire netwerk van het netvlies van volwassen ratten, biedt immunohistochemistry van hypotone geïsoleerde rat retinale vasculaire netwerk een alternatieve methode aan geheel-mount. Als met succes uitgevoerd, biedt deze weefsel voorbereiding techniek een overzicht van de gehele netvlies microvasculature met inbegrip van binnenste en diep capillaire pelxi. Immunohistochemische kleuring met pericytic markers resulteert in het gehele microvasculaire netwerk NG2 immunoreactivity met een hevige reactie in specifieke vasculaire cellen (Figuur 3) tonen. Sommige van deze cellen weergegeven ook PDGFRβ immunoreactivity (Figuur 3).
Een zorgvuldige ontplooiing van het weefsel is belangrijk om een goed overzicht van de retinale therapieën. Onvoldoende ontvouwen kan resulteren in de therapieën bedisseld in meerdere focus lagen waardoor fluorescerende imaging moeilijk (Figuur 4). Ontplooiing kan worden vergemakkelijkt door zacht schudden, kantelen van de kamer dia heen en weer of zuigen druppels vloeistof op het netvlies therapieën. Opgemerkt moet worden dat de anatomie van de retinale capillaire pelxi in een overlay van de vasculaire bedden resulteren zal. Vandaar, is het problematisch om te onderscheiden van de binnenste van de diepere capillaire pelxi wanneer afgevlakt op het glasplaatje.
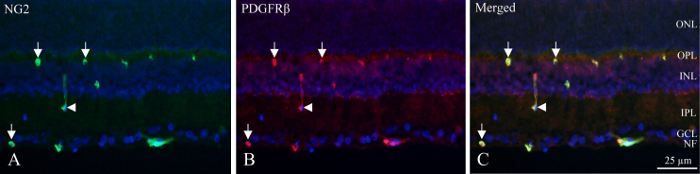
Figuur 1: dubbel pericyte Immunohistochemie van cryo-gedeelte van het netvlies innerlijke rat. (A) NG2 (groen) immunohistochemistry onthult positieve schepen binnen het binnenste deel van het netvlies. Pijlen geven aan verdienstelijke en cirkelvormige hoefijzer-vormige immunoreactivity in de bakken. De pijlpunt wijst op een lengterichting gesneden vaartuig. (B) PDGFRβ (rood) immunohistochemistry Toon reactiviteit vergelijkbaar NG2 immunoreactivity. Pijlen en pijlpunt wijst op dezelfde structuren wat betreft NG2 kleuring. (C) de afbeelding toont een samenvoeging van NG2, PDGFRβ en DAPI (blauw) door de drie verschillende filters boven elkaar plaatsen. Het is gebleken dat de twee antilichamen mede gelokaliseerde zijn (groen + rood = geel). NF: zenuw vezel laag, GCL: ganglion cellaag, IPL: Meervormige binnenlaag, l: nucleaire binnenlaag, OPL: Meervormige buitenlaag, ONL: nucleaire buitenlaag. Klik hier voor een grotere versie van dit cijfer.

Figuur 2: immunohistochemie pericyte van geheel gemonteerde rat netvlies. Ng2 (rood) immunoreactivity is zichtbaar langs de oppervlakkige vasculaire networkwith intense kleuring in abluminal pericytes. De afbeeldingen tonen samengevoegde NG2 en DAPI (blauw). De neuronale cellen zijn zichtbaar als DAPI-blauw kernen tussen de NG2 gebeitste microvasculature. PDGFRβ immunoreactivity in het geheel gemonteerde volwassen netvlies resulteerde slechts in een zeer zwak signaal en is daarom niet opgenomen in deze afbeelding. Klik hier voor een grotere versie van dit cijfer.

Figuur 3: dubbel pericyte Immunohistochemie van hypotone geïsoleerde rat retinale therapieën. (A). de afbeelding toont hypotone geïsoleerde rat retinale vasculaire netwerk immunohistochemische gekleurd met NG2 (groen) en PDGFRβ (rood). Het volledige netwerk toonde NG2 immunoreactivity. PDGFRβ immunoreactivity werd echter gevonden in cel Soma. Het invoegen van A is een overzicht van retinale therapieën netwerk gekleurd met DAPI (blauw). (B) de afbeelding toont het zelfde model als (A) op een andere locatie en hogere vergroting. Het is duidelijk dat PDGFRβ kleuring wordt alleen weergegeven in cel Soma in het vasculaire netwerk met vermelding van pericyte immunoreactivity. Het invoegen van B is het beeld waarin hoge vergroting van therapieën gekleurd met NG2 (groen), PDGFRβ (rood) en samengevoegd met de DAPI. Inclusief DAPI kleuring samen met NG2 en PDGFRβ onthult drie pericytes (PDGFRβ-positief) en twee onbekende schip muur cellen. Klik hier voor een grotere versie van dit cijfer.

Figuur 4: voorbeeld van een onvoldoende geïsoleerde ongevouwen hypotone retinale therapieën. De zorgvuldige ontplooiing van een hypotone geïsoleerde therapieën is belangrijk omdat onvoldoende ontvouwen kan resulteren in de therapieën worden gestapeld. De foto's tonen DAPI gebeitste retinale therapieën op hetzelfde terrein maar genomen in andere focus lagen. (A) de DAPI gebeitste cellen in een focus laag een ongeveer 25 µm dik bloedvat in het netvlies therapieën weergeven. (B) de DAPI gebeitste cellen in een tweede laag van de focus verhelderen dunne vertakkende haarvaten op hetzelfde terrein dat op de grotere bloedvat weergegeven in (A) heeft zijn gestapeld. Klik hier voor een grotere versie van dit cijfer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Wij presenteren drie retinale voorbereiding technieken die kunnen worden toegepast in de studie van microvasculaire retinale pericytes. Hieronder, wij bieden een vergelijking tussen elk van de methoden en markeer kritische stappen in de protocollen.
Met de cryo-segmenteren, het netvlies wordt gesneden in Sagittaal secties en vandaar, is het mogelijk om talrijke exemplaren te verkrijgen door het dezelfde netvlies. De cijfervormen secties die voortvloeien uit deze methode maken het een ideale keuze voor antilichamenspecificiteit en titratie testen zoals het voorkomt geen onnodige dierlijke offer. De voorbereidende werkzaamheden is van doorslaggevend belang is voor goede resultaten. Het is essentieel terwijl de ontrafeling van het oog niet te trekken het oog maar te snijden alle van de spieren rond het oog. Er is een risico van retinale detachement als kracht wordt gebruikt. Omdat de ogen cup dun is, moet het bevestigen dat een niet te lang. Onderdompeling met 4% paraformaldehyde in PBS voor 2 – 4 h zal het bevestigen van het weefsel. Als langer vast, is er een risico van vernietiging van het antigeen van belang. Om de best mogelijke immunostainings te genereren, is het van cruciaal belang voor elke sectie moet zo plat mogelijk tegen het glas. Omdat de secties alleen een paar occasionele dwarse bezuinigingen van de microvasculature bevatten, biedt dit weefsel preparaten techniek alleen intermitterende visualisatie van de microvasculature. Daarom is deze methode niet geschikt voor de studies van de algehele vasculaire architectuur en meetbare maatregelen van pericytes.
De algehele therapieën kan worden gekleurd na geheel-montage een overzicht gegeven van de therapieën. Wanneer deze techniek beheersen, kan het een snelle weefsel voorbereiding procedure waarvoor relatief weinig werklast. Er zijn echter een paar punten met name opletten voor. Het netvlies is kwetsbaar en het is primordiaal voorzichtig te behandelen en scheurt en bezuinigingen te vermijden. Bovendien, tijdens het zorgvuldig het verwerken van het netvlies, is het van cruciaal belang voor het voorkomen van plooien en andere gletsjerspleten tijdens montage dat kunnen gevolgen hebben voor de immunohistochemische imaging later. De gemonteerde netvlies heeft een dikte van 250-300 µm en antilichaam penetratie van de neuronale lagen wellicht problematisch. Met betrekking tot pericyte visualization, de NG2 kleuring in het geheel-koppelingsprotocol kon alleen bereikt worden met een secundair antilichaam met Cy3 alternerende en PDGFRβ immunoreactivity in het geheel gemonteerde volwassen netvlies resulteerde in deze een zeer zwak signaal dat het niet werd getoond in de figuur. Vandaar wordt het nut van de gehele-mount kleuring techniek sterk belemmerd door de succesvolle kleuring afhankelijk van vooral de specifieke primaire en secundaire antilichamen gebruikt. Verdere suggesties voor het optimaliseren van het protocol voor gevisualiseerde microvasculaire pelxi van een volwassen ratten netvlies is door de incubatie primair antilichaam voor een langere periode van tijd en/of wijzigen van de incubatie temperatuur26.
Als gevolg van de dikte van het geheel gemonteerd is het belangrijk om te beseffen van de richting van het netvlies na het maken van de vier insnijdingen vanuit de retinale periferie naar het hoofd van de oogzenuw om te voorkomen dat per ongeluk montage met de innerlijke netvlies met de haarvaten gerichte neer. Nog steeds, gedetailleerde visualisatie van de diepere microvasculaire pelxi en de pericytes kan worden lastig met deze methode14,20. Als geheel-mount kleuring van het volwassen netvlies moeilijk in de diepere capillaire plexus is, kan dit resulteren in het netvlies avasculaire verschijnen in sommige delen. De immunohistochemische kleuring van volwassen netvlies geheel gemonteerde biedt alleen een versnipperd overzicht van de therapieën met pericytes voering van de schepen in de oppervlakkige capillaire plexus en daarom deze methode kan leiden tot valse negatieve resultaten in de visualisatie van de rat retinale therapieën.
Spijsvertering van de trypsine is lang beschouwd als de gouden standaard techniek voor isolatie en visualisatie van de retinale therapieën20. Hypotone isolatie biedt een alternatieve methode voor de visualisatie van het gehele complexe driedimensionale vasculaire netwerk en uitdagingen veel van hetzelfde werken met zeer kwetsbare weefsel dat moeilijk is te behandelen. Als gevolg van de gelijkenis tussen de twee methoden in het netvlies vasculaire product, de hypotone isolatie geconfronteerd met veel van de dezelfde uitdagingen als trypsine spijsvertering20 met inbegrip van zorgvuldige dissectie om te voorkomen dat grote tranen en voorzichtige behandeling door het vermijden van pipetteren en raken met een tang. Een belangrijk verschil tussen de methoden is de fixatie. Spijsvertering van de trypsine gebeurt meestal na fixatie en met succes kan worden toegepast op bewaarde netvlies die in fixeerspray voor meerdere jaren20zijn geweest. Hypotone isolatie wordt uitgevoerd vóór de fixatie en dus kan de tenuitvoerlegging in diverse andere tests zoals eerder is beschreven in de literatuur23,24,25. De spijsvertering van de trypsine gebeurt meer dan twee dagen20, overwegende dat de hypotone isolatie binnen uur kan worden voltooid. Bovendien, het hypotone isolatie-protocol omvat niet het risico van overmatige spijsvertering en enzymatische splitsing van membraan markeringen vereist voor pericyte erkenning, bijvoorbeeld PDGFRβ en NG2, waardoor deze methode de voorkeur voor latere microvasculaire immunohistochemie.
Tot slot, hoewel buiten het directe bereik van dit manuscript, is er een minder gekende maar zeer nuttige techniek voor het isoleren van grote, intact microvasculaire plexi van knaagdier uit het netvlies27. Het netvlies is geplaatst in een speciaal glas zaal en dekglaasje aan. Na de verwijdering van het dekglaasje aan, de overblijfselen van de microvasculature gekoppeld aan het dekglaasje aan maken een volledig leven (≈ 98% van de cellen) weefsel afdrukken. Het grootste voordeel van deze methode is dat het mogelijk voor de fysiologische studie van de vaartuigen en de daaropvolgende fixatie voor immunokleuring maakt. Een duidelijke beperking van de methode is dat het voorziet niet in de visualisatie/isolatie van het gehele microvasculaire netwerk als netvlies platte mount en hypotone voorbereidingen doen. Pericytes kunnen echter worden gevisualiseerd door toepassing van deze methode27.
De hier beschreven technieken voor de voorbereiding van drie weefsel zijn complementair in de zin dat elke methode voordelen en tekortkomingen voor visualisatie van de microvasculaire pericytes omvat. De beoordeling van elke methoden potentials en zwakke punten is belangrijk om te kiezen van de optimale methode voor het onderzoeken van de microvasculaire pericytes onder specifieke pathologische condities. De bewezen methoden kunnen worden uitgebreid tot de kleuring niet alleen voor pericyte markeringen, maar ook voor de visualisatie van microvasculaire structuren in het algemeen. Uiteindelijk is het voor de individuele onderzoeker om de juiste visualisatie methode op basis van het onderzoek-hypothese in kwestie te selecteren.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Het onderzoek werd gefinancierd door het Lundbeck Foundation, Denemarken.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



