Summary
Wir führen drei verschiedene Gewebe Vorbereitung Techniken für immunhistochemische Visualisierung der Ratte retinalen mikrovaskuläre perizyten, d. h. Cryo-Abschnitte, ganze-Reittiere und hypotone Isolierung des vaskulären-Netzes.
Abstract
Netzhaut perizyten spielen eine wichtige Rolle bei vielen Erkrankungen des Auges. Immunhistochemische Färbung Techniken der Netzhautgefäße und mikrovaskuläre prägen perizyten ophthalmologischen Forschung. Es ist wichtig, eine geeignete Methode zur Visualisierung der mikrovaskulären perizyten wählen. Wir beschreiben retinalen mikrovaskuläre Pericyte immunhistochemische Färbung in Cryo-Abschnitte, ganze-Reittiere und hypotone isoliert Gefäßsystem mit Antikörpern für Platelet-derived Wachstumsfaktor-Rezeptor β (PDGFRβ) und Nerven/Glia Antigen 2 (NG2). Dies ermöglicht es uns, vor- und Nachteile jeder der drei Gewebe Vorbereitungen für die Visualisierung von der Netzhaut mikrovaskulären perizyten hervorzuheben. Cryo-Abschnitte enthalten nur ein paar gelegentliche Quere Schnitten von den Microvasculature aber Transsectional Visualisierung aller Schichten der Netzhaut. Ganz-Mount bietet eine Übersicht über die gesamte Netzhaut Gefäßsystem, aber Visualisierung von den Microvasculature kann lästig sein. Hypotone Isolierung bietet eine Methode, um die gesamte Netzhaut Gefäßsystem durch den Abbau von Nervenzellen zu visualisieren, aber das macht das Gewebe sehr zerbrechlich.
Introduction
Netzhaut perizyten stehen im Mittelpunkt von vielen Forschungslabors, wie diese Zellen eine wichtige Rolle in die Integrität des Gefäßsystems spielen. Pathologische Zuständen wie Diabetische Retinopathie1, Ischämie2und Glaukom3 haben vaskuläre Merkmale, die die Funktion der perizyten beinhalten. Perizyten befinden sich in der inneren retinalen Kapillaren Plexi. Der zentralen Netzhautarterie, die die inneren Netzhaut liefert verzweigt sich in zwei Schichten der Kapillare Plexi. Die innere vaskuläre Bett befindet sich zwischen dem Ganglion Zelle und nukleare Innenlagen. Die tiefere Schicht ist dicht und komplex und ist zwischen der inneren und äußeren nuclear Layer4,5lokalisiert. Darüber hinaus enthalten einige Teile der Netzhaut auch eine dritte Netz bezeichnet die radiale Parapapillary Kapillaren. Dies sind lange, gerade Kapillaren, die unter die Nervenfasern und selten liegen anastomosieren mit einander oder die anderen beiden Plexi-6. Innerhalb der Kapillare Wand perizyten sind eingebettet in die Basalmembran und Linie die abluminalen Seite des vaskulären endothelialen Zellen.
Zu diesem Zeitpunkt gibt es keine einzigartige biologische Marker für diese perizyten, die sie von anderen vaskulären Zellen unterscheiden kann. Platelet-derived Wachstumsfaktor-Rezeptor β (PDGFRβ) und Nerven/Glia Antigen 2 (NG2) sind häufig verwendete Markierungen die perizyten aber auch andere vaskulären Zellen zu präsentieren. Identifizierung von perizyten wird weiter erschwert durch das Vorhandensein von Pericyte Teilmengen, deren Morphologie und Protein Ausdruck7variiert. Derzeit setzt die besten Identifizierung auf eine Kombination aus Protein-Marker und die charakteristischen Positionierung des Pericyte in der Gefäßwand. Wir zeigen hier drei verschiedene Gewebe Präparationstechniken für immunhistochemische Färbung PDGFRβ/NG2 Ratte retinalen mikrovaskuläre perizyten, d. h., Cryo-Abschnitte, ganze-Halterungen und hypotone Isolierung des vaskulären-Netzes.
Mit Cryo-Abschnitten werden die Netzhaut und Sklera durch den Sehnerv geschnitten. Dies ermöglicht die Visualisierung aller geschichteten Strukturen von Neuronen. Die deutlichen zehn Schichten der Netzhaut sind offensichtlich als Vertauschung Kern- und axonalen/dendritischen Strukturen, die mit Flecken wie Hämatoxylin/Eosin oder fluoreszierende nuklearen 4', 6-Diamidino-2-Phenylindole (DAPI)8visualisiert werden können. Die metabolischen Anforderungen unterscheiden sich zwischen den Schichten9 und es bietet eine Methode, um festzustellen, das dicke oder insgesamt Fehlen einer bestimmten Ebene (z. B.der Verlust von retinalen Ganglienzellen ist eines der Markenzeichen von retinale Ischämie10, 11). Das Gefäßsystem ist klar, wie quer der Netzhaut durchschneidet, die es ermöglichen, die Kapillare Plexi innerhalb der jeweiligen Netzhaut Schichten12,13separat zu studieren.
Eher traditionell sind die Untersuchungen des retinalen Gefäßsystem Netzwerks in retinalen ganze-Halterungen durchgeführt. Gewebe vorbereitet ist die Netzhaut schneiden und flach wie eine Blume-förmige Struktur. Die Methode ist eine relativ schnelle Gewebe Präparationstechnik, die das gesamte Architektur retinalen Gefäßsystem hervorheben kann und es wird daher oft in der Untersuchung der Neovaskularisation in der murinen Netzhaut angewendet. Erfolgreiche Visualisierung von Microvasculature im gesamten montierte Netzhaut wird auch in die Entwicklung Neugeborener Maus und Ratte Netzhaut14,15,16,17,18, berichtet. 19. diese Studien zeigen eine definierte Pericytic-Aktivität mit größeren Kapillar-freie Flächen bei Erwachsenen im Vergleich zu den Neugeborenen Netzhaut14.
Eine weitere Möglichkeit der Visualisierung ist die Netzhaut Microvasculature nach hypotone Isolierung. Dieses Gewebe Präparationstechnik führt Netzhautgefäße und Kapillaren der neuronalen Zellen freigegeben wird. Diese Art von zweidimensionalen Bildgebung des retinalen Gefäße inselnetzes ist in der Regel nach retinalen Trypsin Verdauung20 durchgeführt und zur Beurteilung der vaskulären Anomalien der diabetischen Retinopathie einschließlich Pericyte Verlust und Kapillare Degeneration20,21,22. Die hypotone Isolationsmethode bietet die Untersuchungen der retinalen Gefäße gen und Protein regulatorischen Reaktionen mit RT-PCR und westlichen befleckenden23,24,25getan wurde. Wir bieten hier ein Protokoll für die free-Float-immunhistochemische Färbung des das hypotone isoliert retinalen Gefäßsystem als Alternative zu Trypsin-Verdauung, mikrovaskulären perizyten zu untersuchen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Das Protokoll wurde optimiert und an erwachsenen männlichen Albino Ratten gezeigt. In allen experimentellen Verfahren wurden Tiere gemäß den Bestimmungen in der ARVO-Anweisung für den Einsatz von Tieren in Ophthalmic und Vision Forschung behandelt. Tiere wurden durch Kohlendioxid und anschließende zervikale Dislokation eingeschläfert.
1. Rat Netzhautgewebe Vorbereitungen
-
Cryo-Abschnitt
- Machen Sie hinteren und vorderen ~0.5 cm Schlitze des in der Ratte Augenlid mit einem Skalpell.
- Kennzeichnen Sie optional: Mit einem Brenner Diathermie das Auge im inneren Winkel, um das Auge auf einheitliche Weise zu orientieren, während einbetten und ermöglichen vertikale Kryostat Schneiden durch den Sehnerv.
- Schnappen Sie sich das Auge mit der Pinzette und kippen vorsichtig zur Seite, um das umliegende Gewebe zu entlarven. Enucleate das Auge durch die Kürzungen mit Dissektion Schere im Bindegewebe und Muskulatur Gewebe.
Achtung: Ziehen Sie nicht das Auge zu hart wie übermäßiger Druck auf den Sehnerv Netzhautablösung führen kann. - Legen Sie das Auge kurz in 4 % Formaldehyd in Phosphat-gepufferte Kochsalzlösung (PBS) zu stabilisieren, bevor eine erste Bohrung an der Hornhaut Limbus durch leichten Druck mit der Spitze eines Skalpells machen.
- Unter dem Mikroskop, schneiden Sie entlang der Hornhaut Limbus mit Dissektion Schere Entfernen der Hornhaut und die Linse mit der Pinzette entfernen, bevor Eintauchen in 4 % Formaldehyd in PBS für 2 – 4 h.
- Spülen Sie nacheinander in Sörensen Phosphatpuffer mit 10 % Saccharose und 25 % Saccharose.
- Betten Sie in Yazulla Medium zubereitet mit 3 % Gelatine vom Schwein Haut und 30 % Albumin von Huhn-Ei-weiß.
Hinweis: Das Protokoll kann hier mit Gewebe Lagerung bei-20 ° c angehalten werden
- Machen Sie hinteren und vorderen ~0.5 cm Schlitze des in der Ratte Augenlid mit einem Skalpell.
-
Vollständig-hängen
- Machen Sie hinteren und vorderen ~0.5 cm Schlitze in der Ratte Augenlid mit einem Skalpell.
- Schnappen Sie sich das Auge mit der Pinzette und kippen vorsichtig zur Seite, um das umliegende Gewebe zu entlarven. Enucleate das Auge durch die Kürzungen mit Dissektion Schere im Bindegewebe und Muskulatur Gewebe.
Achtung: Ziehen Sie nicht das Auge zu hart wie übermäßiger Druck auf den Sehnerv Netzhautablösung führen kann. - Legen Sie das Auge kurz in 4 % Formaldehyd in PBS zu stabilisieren, bevor eine erste Bohrung an der Hornhaut Limbus durch leichten Druck mit der Spitze eines Skalpells machen.
- Unter dem Mikroskop Schnitt entlang der Hornhaut Limbus mit Dissektion Schere Entfernen der Hornhaut und die Linse mit einer Pinzette zu entfernen.
- Trennen der Netzhaut von das retinale Pigmentepithel in Richtung des Sehnervs mit der Pinzette mit kleinen Kopfsätze großen reißen zu vermeiden.
- Die Netzhaut bei den Sehnerv mit Dissektion Schere frei und stellen vier Schlitze von wenigen Millimetern Länge aus der netzhautperipherie in Richtung des sehnervenkopfes.
- Die Netzhaut auf einen Objektträger zu verbreiten und für 5 – 10 min trocknen lassen.
- Korrigieren Sie in 4 % Formaldehyd für 20-30 min von Formaldehyd auf die Netzhaut tropft.
Achtung: Gelten Sie nicht direkt auf der Netzhaut, wie es aus dem Glas lösen kann. - Spülen mit PBS. Für ein optimales Ergebnis, Immuno-Fleck direkt nach dem spülen.
-
Hypotone Isolierung
- Machen Sie hinteren und vorderen ~0.5 cm Schlitze in der Ratte Augenlid mit einem Skalpell.
- Schnappen Sie sich das Auge mit der Pinzette und kippen vorsichtig zur Seite, um das umliegende Gewebe zu entlarven. Enucleate das Auge durch die Kürzungen mit Dissektion Schere im Bindegewebe und Muskulatur Gewebe.
Achtung: Ziehen Sie nicht das Auge zu hart wie übermäßiger Druck auf den Sehnerv Netzhautablösung führen kann. - Machen Sie eine erste Bohrung an der Hornhaut Limbus durch leichten Druck mit der Spitze eines Skalpells.
- Unter dem Mikroskop Schnitt entlang der Hornhaut Limbus mit Dissektion Schere Entfernen der Hornhaut und die Linse mit einer Pinzette zu entfernen.
- Trennen Sie die Netzhaut von das retinale Pigmentepithel in Richtung des sehnervenkopfes mit der Pinzette mit kleinen Kopfsätze großen reißen zu vermeiden.
- Kostenlos die Netzhaut auf den Sehnerv mit Dissektion Schere, die Netzhaut in 1 mL entionisiertem Wasser in einer 24-Well-Platte und schütteln bei 200 u/min mit einem 1,5 mm Vibration Orbit für 1 h bei Raumtemperatur.
Hinweis: Im folgenden die Netzhaut erscheint weniger an den Rändern definiert. - Fügen Sie 200 U DNAse 1 um die Trümmer lysierten Zellen der Netzhaut Gefäßsystem zu distanzieren und schütteln für weitere 30 Minuten bei Raumtemperatur.
Hinweis: Trümmer könnten in den Brunnen zu bilden beginnen. - Spülen Sie mindestens 3 Mal in entionisiertem Wasser für 5 min mit schütteln bei 150 bis 300 u/min, neuronale Zelle Ablagerungen zu entfernen. Die Netzhaut sollte mit jeder Spülung bezeichnend für die Entfernung von neuronalen zelltrümmer transparenter.
- Verwenden Sie einen dunklen Hintergrund um zu prüfen, die 24-Well-Platte, die durchscheinenden isolierende retinale Gefäßsystem klar zu sehen.
- (Optional): Wenn das Gefäßsystem nicht frei von neuronalen Ebenen (semi-transparent) an dieser Stelle entweder mehr spülen Schritte hinzufügen erscheint, schütteln beschleunigen oder über eine pipettieren Aspirieren Sie Flüssigkeit auf das Gefäßsystem.
Achtung: Entweder die optionalen Schritte können das Gefäßsystem beschädigen.
- 10 min in 1 mL 4 % Paraformaldehyd in PBS bei Raumtemperatur und Spülen mit PBS-Puffer 3 Mal zu beheben.
Hinweis: Das Protokoll kann hier mit Gewebe Lagerung bei 4 ° c angehalten werden
(2) Immunhistochemie
-
Färbung der Cryo-Abschnitte
- 10 µm Cryo-Sektionen der Gelatine eingebettet Netzhaut als vertikaler Schnitt durch den Sehnerv und die Cryo-Abschnitte auf einem Objektträger und trocknen lassen (mindestens 1 h).
- Tauchen Sie den Objektträger in PBS mit 0,25 % Triton x-100 (PBS-T) für 15 Minuten.
- Drip, 1 PDGFRβ: 100 und 1: 500 NG2 Primärantikörper in PBS-T + 1 % BSA auf der Cryo-Sektion verdünnt und über Nacht in Inkubation Kammern bei 4 ° C inkubieren.
- Tauchen Sie den Objektträger 2 Mal im PBS-T für 15 min und 1: 100 Anti-Maus Alexa Fluor 594 verknüpft und 1: 100 Anti-Kaninchen FITC-linked Sekundärantikörper verdünnt in PBS-T mit 3 % BSA auf der Cryo-Abschnitte tropft.
- Inkubieren Sie die Objektträger 1 h bei Raumtemperatur im Dunkeln.
- Spülen Sie die Objektträger in PBS-T 2 x 15 min..
Hinweis: Optional: für Doppel- und Dreibettzimmer immunofluorescent Färbung, sequentielle Färbung von wiederholen den Vorgang von 2.1.3 auf 2.1.6 zwei bis dreimal bzw. durchgeführt werden kann. - Montieren Sie die gefärbten Cryo-Abschnitte mit Anti-Fading Montage mittlerer mit DAPI und einem deckgläschen.
-
Färbung des gesamten-mount
- PBS-T auf die gesamte-Mount Tropfen und bei Raumtemperatur 15 min inkubieren.
- Gießen Sie ab und Tropfen Sie 1: 100 PDGFRβ und 1: 500 NG2 Primärantikörper in PBS-T + 1 % BSA verdünnt ab und über Nacht in feuchten Kammern bei 4 ° C inkubieren.
- Abgießen und abtropfen auf PBS-T auf den Objektträger in 2 x 15 min. spülen.
- Abgießen und abtropfen auf 1: 100 Anti-Kaninchen Cy2 und 1: 100 Anti-Maus Cy3 verknüpft Sekundärantikörper verdünnt in PBS-T mit 3 % BSA 1 h in einer feuchten Kammer bei Raumtemperatur im Dunkeln inkubieren.
- Abgießen und abtropfen auf PBS-T, 2 x 15 min in der Dunkelheit zu spülen.
Hinweis: Optional: für Doppel- und Dreibettzimmer immunofluorescent Färbung, sequentielle Färbung von wiederholen die Prozedur von 2.2.2 2.2.5 bzw. zwei bis dreimal durchgeführt werden kann. - Montieren Sie die gefärbten vollständig-hängen mit Anti-Fading Montage mittlerer mit DAPI und einem deckgläschen.
-
Färbung der hypotone isoliert Gefäßsystem
- Blockieren Sie das hypotone isolierende Gefäßsystem 1 h unter Schütteln bei 100 u/min und Raumtemperatur mit 500 µL/Well 10 % Esel Serum in PBS verdünnt.
- Über Nacht bei Raumtemperatur inkubieren und schütteln bei 100 u/min mit 600 µL/Well von 1: 100 PDGFRβ und 1: 500 NG2 primären Antikörpern im Serum 10 % Esel in PBS verdünnt.
- Spülen der Netzhaut Netzwerk 3 X mit PBS-Puffer für 5 min und in 1: 100 Anti-Maus Alexa Fluor 594 verknüpft und 1: 100 Anti-Kaninchen FITC-linked Sekundärantikörper verdünnt in 10 % Esel Serum in PBS schütteln bei 100 u/min und 1 h im Dunkeln bei Raumtemperatur inkubieren.
- Für 5 min in PBS-T abspülen und in 0,2 ng/mL DAPI im PBS-T für 15 min, gefolgt von 3 x 5 min Spülungen im PBS-T im Dunkeln inkubieren.
- Schneiden Sie die Spitze des einen Kunststoff Pasteur pipettieren, Befeuchten Sie es mit PBS-T und es verwenden Sie, um das retinale Netzwerk auf einen 4-Well Kammer Objektträger übertragen.
Hinweis: Der befeuchtenden Schritt ist wichtig, die Netzhaut Gefäßsystem festhalten an der Innenseite des Pasteur pipettieren zu vermeiden. - Die Netzhaut Gefäßsystem zu entfalten. Berühren Sie das retinale Gefäßsystem mit einer Pinzette, da dadurch das Gefäßsystem zu verwirren können.
Hinweis: Entfaltung kann erfolgen durch die Kammer Folie hin und her kippen oder Absaugen von Flüssigkeit auf der Netzhaut Gefäßsystem sinkt. - Entfernen Sie das Medium aus dem Brunnen. Die Oberflächenspannung der Flüssigkeit wird das Gefäßsystem auf die Unterseite der Folie glätten.
- Stellen Sie sicher, richtig entfaltet sich unter dem Mikroskop, vor Entfernen der Plastik aus der Kammer Folie aufsteigt.
- Montieren Sie die gefärbte Gefäßsystem mit Anti-Fading Eindeckmittel und einem deckgläschen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Die erfolgreiche Protokolle bieten drei verschiedene retinalen Präparate zur Visualisierung von mikrovaskulärer perizyten. Jede dieser Methoden verwendet, die PDGFRβ und NG2 Immunoreactivity Co-Lokalisierung und die einmalige Lage der perizyten, die wrap-around der Kapillaren Endothel Foridentification.
Mit Cryo-Abschnitte die neuronalen Schichten durch die fluoreszierenden Dichte des DAPI gekennzeichnet Kernen und inneren identifiziert werden können und tief Kapillare Plexi enthalten perizyten, in denen PDGFRβ und NG2 Immunoreactivity (Abbildung 1) angezeigt. Die einzigartige Position der perizyten in der Gefäßwand kann man als Kreis- oder hufeisenförmigen Immunoreactivity in der Peripherie der Gefäße (Abbildung 1, Pfeile) oder gelegentliche längs geschnitten Gefässen (Abbildung 1, Pfeilspitze).
Erfolgreiche Visualisierung von mikrovaskulären perizyten in ganz-Mount Vorbereitung der Erwachsenen Ratte kann schwierig sein,14,20. PDGFRβ-Immunoreactivity in der gesamten montierte Erwachsenen Retina führte nur ein sehr schwaches Signal (nicht dargestellt). Ng2 Färbung skizziert die inneren Kreislauf Netzwerk mit intensiven Färbung in abluminalen perizyten (Abbildung 2).
Um eine Übersicht über die vaskuläre Netzwerk der Erwachsenen Ratte Netzhaut bietet Immunohistochemistry hypotone isoliert Ratte retinalen vaskuläre Netzwerk eine alternative Methode, vollständig-hängen. Wenn erfolgreich durchgeführt, bietet dieses Gewebe Präparationstechnik einen Überblick über die gesamte Netzhaut Microvasculature einschließlich innen- und tief Kapillare Plexi. Immunhistochemische Färbung mit Pericytic Marker führt das gesamte mikrovaskuläre Netzwerk zeigt NG2 Immunoreactivity mit einer intensiven Reaktion in bestimmten vaskuläre Zellen (Abbildung 3). Einige dieser Zellen zeigen auch PDGFRβ Immunoreactivity (Abbildung 3).
Eine sorgfältige Entfaltung des Gewebes ist wichtig, einen guten Überblick über die Netzhaut Gefäßsystem zu erhalten. Unzureichende Entfaltung führt zu das Gefäßsystem in mehrere Schwerpunkte lagen angeordnet wodurch die Fluoreszenz imaging schwierig (Abbildung 4). Entfaltung kann erleichtert werden durch sanftes schütteln, Kippen der Kammer Folie hin und her oder absaugen Tropfen der Flüssigkeit auf die Netzhaut Gefäßsystem. Es sei darauf hingewiesen, dass die Anatomie des retinalen Kapillaren Plexi einige Überlagerung der vaskulären Betten führt. Daher ist es problematisch, das Innere von tiefer Kapillaren Plexi wenn auf den Objektträger abgeflacht zu unterscheiden.
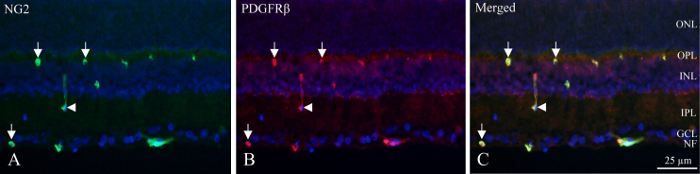
Abbildung 1: doppelte immunhistochemische Färbung Pericyte Cryo-Abschnitts der inneren Ratte Netzhaut. (A) NG2 (grün) Immunohistochemistry zeigt positive Schiffe innerhalb der innere Teil der Netzhaut. Pfeile zeigen auf kreisförmigen und hufeisenförmige Immunoreactivity in den Gefäßen. Die Pfeilspitze weist darauf hin ein längs geschnittenen Schiff. (B) PDGFRβ (rot) Immunohistochemistry zeigen Reaktivität NG2 Immunoreactivity ähnlich. Pfeile und Pfeilspitzen zeigen auf die gleichen Strukturen wie bei NG2 Färbung. (C) das Bild zeigt eine Zusammenführung von NG2, PDGFRβ und DAPI (blau) durch die Überlagerung der drei verschiedene Filter. Es stellt sich heraus, dass die beiden Antikörper Co lokalisiert sind (grün + rot = gelb). NF: nervenfaserschicht, GCL: Ganglion Zellschicht, IPL: innere plexiformer Schicht, INL: nukleare Innenschicht, OPL: äußeren plexiformen Schicht, ONL: nukleare Außenschicht. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: immunhistochemische Färbung Pericyte ganze montierte Ratte Netzhaut. Ng2 (rot) Immunoreactivity ist entlang der oberflächliche vaskuläre Networkwith intensive Färbung in abluminalen perizyten sichtbar. Die Bilder zeigen die zusammengeführten NG2 und DAPI (blau). Die neuronalen Zellen werden als DAPI-blaue Kerne zwischen die NG2-gefärbten Microvasculature angezeigt. PDGFRβ-Immunoreactivity in der gesamten montierte Erwachsenen Retina führte nur ein sehr schwaches Signal und ist daher in dieser Zahl nicht enthalten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: doppelte immunhistochemische Färbung Pericyte der hypotone isoliert Ratte retinalen Gefäßsystem. (A). das Bild zeigt die hypotone isoliert Ratte retinalen vaskuläre Netzwerk immunhistochemische gebeizt mit NG2 (grün) und PDGFRβ (rot). Das komplette Netzwerk NG2 Immunoreactivity zeigte. Jedoch wurde PDGFRβ Immunoreactivity in Zelle Somas gefunden. Der Einsatz von A finden Sie eine Übersicht der Netzhaut Gefäßsystem Netzwerk gebeizt mit DAPI (blau). (B) das Bild zeigt die gleiche Probe als (A) an einem anderen Ort und höhere Vergrößerung. Es ist klar, dass PDGFRβ Färbung nur in Zelle Somas im Kreislauf Netzwerk angibt Pericyte Immunoreactivity angezeigt wird. Der Einsatz von B ist das Bild, das zeigt hohen Vergrößerung des Gefäßsystems gebeizt mit NG2 (grün), PDGFRβ (rot) und fusionierte mit DAPI. DAPI-Färbung mit NG2 und PDGFRβ einschließlich zeigt drei perizyten (PDGFRβ-positiv) und zwei nicht identifizierte Schiff Wand Zellen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Beispiel für eine unzureichende entfaltet hypotone isoliert retinalen Gefäßsystem. Die sorgfältige Entfaltung eine hypotone isoliert Gefäßsystem ist wichtig, da nicht genügend Entfaltung in das Gefäßsystem wird gestapelt führen kann. Die Bilder zeigen DAPI-gefärbten retinalen Gefäßsystem an der gleichen Stelle, sondern in unterschiedlichen Schwerpunkten Schichten. (A) das DAPI-gefärbten Zellen in einem Fokus Ebene zeigen eine etwa 25 µm dicken Blutgefäße in der Netzhaut Gefäßsystem. (B) das DAPI-gefärbten Zellen in einem zweiten Fokus-Ebene aufzuklären dünne verzweigte Kapillaren an der gleichen Stelle, die auf die größeren Blutgefäße angezeigt (a) gestapelt wurden. Bitte klicken Sie hier für eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Wir präsentieren Ihnen drei retinalen Vorbereitung Techniken, die in der Studie von mikrovaskulären retinalen perizyten angewendet werden können. Unten, wir bieten einen Vergleich zwischen den einzelnen Methoden und wichtige Schritte in den Protokollen zu markieren.
Mit Cryo-Schnitt, die Netzhaut ist in sagittaler Abschnitte geschnitten und daher ist es möglich, zahlreiche Exemplare von der gleichen Netzhaut zu erhalten. Die Bezugszeichen Abschnitte aus dieser Methode machen es ideal für Antikörperbesonderheit und Titration zu testen, wie es verhindert, unnötige Tieropfer dass. Die vorbereitende Arbeit ist entscheidend für gute Ergebnisse. Es ist wichtig beim sezieren des Auges nicht das Auge zu ziehen, sondern die Muskeln rund um das Auge zu schneiden. Wenn Gewalt eingesetzt wird, gibt es ein Risiko für Netzhautablösung. Weil die Augenmuschel dünn ist, sollte man nicht zu lange beheben. Eintauchen mit 4 % Paraformaldehyd in PBS für 2 – 4 h repariert das Gewebe. Wenn mehr festgelegt, gibt es eine Gefahr der Zerstörung der Antigen des Interesses. Um die best mögliche Immunostainings zu erzeugen, ist es wichtig für jeden Abschnitt so flach wie möglich gegen das Glas sein. Da die Abschnitte nur ein paar gelegentliche Quere Schnitten von den Microvasculature enthalten, bietet diese Gewebe Vorbereitungen Technik nur intermittierend Visualisierung der Microvasculature. Diese Methode eignet sich daher nicht für das Studium der insgesamt gefäßarchitektur und quantifizierbare Maßnahmen der perizyten.
Das gesamte Gefäßsystem kann nach der ganzen Montage ermöglichen einen Überblick über das Gefäßsystem gebeizt werden. Wenn diese Technik beherrschen, kann es eine schnelle Gewebe Vorbereitung Verfahren sein, die relativ wenig Arbeitsaufwand erfordert. Es gibt jedoch einige Punkte besonders beachten. Die Netzhaut ist zerbrechlich und es ist äußerst wichtig, mit Vorsicht behandeln und vermeiden Risse und Schnitten. Darüber hinaus während der Behandlung sorgfältig der Netzhaut, ist es von entscheidender Bedeutung, um Falten zu vermeiden und andere Spalten bei der Montage, dass beeinträchtigen die immunhistochemische imaging später. Die montierte Netzhaut hat eine Stärke von 250-300 µm und Antikörper Durchdringung der neuronalen Ebenen problematisch sein könnte. In Bezug auf Pericyte Visualisierung, die NG2 Färbung des ganzen-Mount-Protokolls konnte nur erreicht werden mit einem Cy3 verknüpft Sekundärantikörper, und PDGFRβ Immunoreactivity in der gesamten montierte Erwachsenen Retina führte zu solch einem sehr schwachen Signal, das es nicht in gezeigt wurde die Figur. Daher ist die Nützlichkeit der gesamten-Mount Färbung Technik stark behindert durch die erfolgreiche Färbung abhängig vor allem die spezifischen primären und sekundären Antikörper verwendet. Weitere Vorschläge zur Optimierung des Protokolls für visualisierte mikrovaskuläre Plexi einen Erwachsenen Ratte Netzhaut ist durch die Inkubation in primären Antikörper für eine längere Zeit und/oder ändern die Inkubation Temperatur26.
Aufgrund der Dicke der gesamten montiert ist es wichtig, die Richtung der Netzhaut nach machen die vier Einschnitte von der netzhautperipherie in Richtung des sehnervenkopfes, versehentliche Montage mit der inneren Netzhaut enthält die Kapillaren zu vermeiden beachten Verkleidung nach unten. Dennoch kann detaillierte Visualisierung von tiefer mikrovaskuläre Plexi und die perizyten mit dieser Methode14,20lästig sein. Da ganze-Mount Färbung der Erwachsenen Netzhaut schwierig in den tieferen Kapillare Plexus, könnte dadurch in der Netzhaut avaskulären erscheinen in einigen Teilen. Die immunhistochemische Färbung der Erwachsenen Netzhaut ganz montiert bietet nur eine fragmentierte Übersicht über das Gefäßsystem mit perizyten Auskleidung der Gefäße in der oberflächlichen Kapillaren Plexus und daher diese Methode kann zu falsch-negativen Ergebnissen in der Visualisierung von der Ratte retinalen Gefäßsystem.
Trypsin-Verdauung galt lange Zeit die Gold-Standard-Technik für Isolation und Visualisierung der retinalen Gefäße20. Hypotone Isolierung bietet eine alternative Methode zur Visualisierung der komplexen dreidimensionalen vaskulären Netzwerkzustand und viele der gleichen Herausforderungen arbeiten mit sehr empfindlichen Gewebe, das schwierig zu handhaben ist. Wegen der Ähnlichkeit in der retinalen Gefäße Produkt zwischen den beiden Methoden steht die hypotone Isolation vieler denselben Herausforderungen wie Trypsin Verdauung20 einschließlich sorgfältiger Präparation, große Tränen und vorsichtige Handhabung durch die Vermeidung von zu verhindern pipettieren und berühren mit der Pinzette. Ein wichtiger Unterschied zwischen den Methoden ist die Fixierung. Trypsin-Verdauung erfolgt in der Regel nach der Fixierung und kann auf erhaltene retinae, die Fixiermittel für mehrere Jahre20wurden erfolgreich angewendet werden. Hypotone Isolierung vor Fixierung erfolgt und somit für die Umsetzung in verschiedenen anderen Tests wie zuvor beschrieben in der Literatur23,24,25. Die Trypsin-Verdauung erfolgt über zwei Tage20, während die hypotone Isolation innerhalb von Stunden abgeschlossen werden kann. Darüber hinaus das hypotone Isolierung-Protokoll beinhaltet nicht das Risiko einer übermäßigen Verdauung und enzymatische Spaltung der Membran Marker für Pericyte Anerkennung, z. B. PDGFRβ und NG2, so dass diese Methode bevorzugt für nachfolgende erforderlich immunhistochemische Färbung mikrovaskuläre.
Schließlich, obwohl aus dem unmittelbaren Anwendungsbereich dieser Handschrift, gibt es eine weniger bekannte, aber sehr nützliche Technik für das Isolieren von großen, intakten mikrovaskuläre Plexi von Nagetier aus der Netzhaut-27. Die Netzhaut befindet sich in einem speziellen Glas-Kammer und Deckglas. Nach der Entfernung der Deckglas, die Microvasculature bleibt mit Deckglas erstelle ich ein voll lebendig verbunden (≈ 98 % der Zellen) Gewebe drucken. Der größte Vorteil dieser Methode ist, dass es die physiologische Untersuchung der Gefäße und anschließende Fixierung für Immunostaining ermöglicht. Eine offensichtliche Einschränkung der Methode ist, dass es keine Visualisierung/Isolierung des gesamten mikrovaskuläre Netzwerks als Netzhaut flache Halterung und Hypotonische Vorbereitung tun. Dennoch können perizyten durch Anwendung dieser Methode27visualisiert werden.
Die hier beschriebenen drei Gewebe Vorbereitung Techniken ergänzen sich in dem Sinne, dass jede Methode vor- und Nachteile für die Visualisierung von mikrovaskulären perizyten umfasst. Die Bewertung der einzelnen Methoden Potentiale und Schwächen ist wichtig, die optimale Methode zur Untersuchung der mikrovaskulären perizyten unter bestimmten pathologischen Bedingungen auszuwählen. Die Methoden können zu Verfärbungen nicht nur für Pericyte Marker, sondern auch für die Visualisierung von mikrovaskulären Strukturen im Allgemeinen erweitert werden. Schließlich ist es für den einzelnen Forscher um die entsprechende Visualisierung Methode basierend auf der Forschung-Hypothese in Frage.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Die Forschung wurde finanziert durch die Lundbeck Foundation, Dänemark.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



