Summary
हम चूहे रेटिना microvascular pericytes के immunohistochemical दृश्य के लिए तीन अलग ऊतक तैयार करने की तकनीक का प्रदर्शन, यानी, क्रायो-वर्गों, पूरे माउंट, और संवहनी नेटवर्क के hypotonic अलगाव.
Abstract
रेटिना pericytes आंख के कई रोगों में एक महत्वपूर्ण भूमिका निभाते हैं । रेटिना वाहिकाओं और microvascular pericytes के Immunohistochemical धुंधला तकनीक नेत्र विज्ञान अनुसंधान के लिए केंद्रीय हैं । यह microvascular pericytes visualizing की एक उपयुक्त विधि का चयन करने के लिए महत्वपूर्ण है । हम रेटिना microvascular pericyte immunohistochemical क्रायो में दाग-वर्गों, पूरे-माउंट, और hypotonic अलग vasculature प्लेटलेट के लिए एंटीबॉडी का उपयोग कर वृद्धि कारक रिसेप्टर β (PDGFRβ) और तंत्रिका/glial प्रतिजन 2 (NG2) का वर्णन. यह हमें लाभ और रेटिना microvascular pericytes के दृश्य के लिए तीन ऊतक तैयार करने में से प्रत्येक की कमियों को उजागर करने की अनुमति देता है । क्रायो-वर्गों सभी रेटिना परतों के transsectional दृश्य प्रदान करते हैं, लेकिन केवल microvasculature के कुछ सामयिक अनुप्रस्थ कटौती होते हैं. पूरे-माउंट पूरे रेटिना vasculature का एक सिंहावलोकन प्रदान करता है, लेकिन microvasculature के दृश्य परेशानी हो सकती है । Hypotonic अलगाव ंयूरॉन कोशिकाओं को हटाने के द्वारा पूरे रेटिना vasculature कल्पना करने के लिए एक विधि प्रदान करता है, लेकिन यह बहुत नाजुक ऊतक बनाता है ।
Introduction
रेटिना pericytes कई अनुसंधान प्रयोगशालाओं का ध्यान केंद्रित कर रहे हैं के रूप में इन कोशिकाओं vasculature की अखंडता में एक प्रमुख भूमिका निभाते हैं. ऐसे मधुमेह रेटिनोपैथी1, ischemia2के रूप में रोग की स्थिति, और मोतियाबिंद3 संवहनी विशेषताओं है कि pericytes के समारोह में शामिल है । Pericytes भीतरी रेटिना केशिका जाल में पाए जाते हैं । केंद्रीय रेटिना धमनी कि केशिका जाल के दो परतों में भीतरी रेटिना शाखाओं की आपूर्ति. भीतरी संवहनी बिस्तर नाड़ीग्रंथि सेल और भीतरी परमाणु परतों के बीच स्थित है । गहरी परत और अधिक घने और जटिल है और भीतरी और बाहरी परमाणु परतों के बीच स्थानीयकृत है4,5। इसके अलावा, रेटिना के कुछ भागों में भी एक तिहाई नेटवर्क रेडियल parapapillary केशिकाओं का कार्यकाल शामिल है । ये लंबे, सीधे केशिकाओं कि तंत्रिका तंतुओं के बीच झूठ और शायद ही कभी एक दूसरे या अंय दो जाल6के साथ anastomose हैं । केशिका दीवार के भीतर, pericytes तहखाने झिल्ली में एंबेडेड और संवहनी endothelial कोशिकाओं के abluminal पक्ष लाइन कर रहे हैं ।
इस तिथि के लिए, इन pericytes के कोई अद्वितीय जैविक मार्कर है कि उंहें अंय संवहनी कोशिकाओं से अंतर कर सकते हैं । प्लेटलेट-व्युत्पन्न वृद्धि कारक रिसेप्टर β (PDGFRβ) और तंत्रिका/glial प्रतिजन 2 (NG2) आमतौर पर दोनों pericytes पर भी मौजूद है जो मार्करों इस्तेमाल कर रहे हैं, लेकिन अन्य संवहनी कोशिकाओं. pericytes की पहचान और pericyte उपसमुच्चय है कि आकृति विज्ञान और प्रोटीन अभिव्यक्ति7में भिंनता के अस्तित्व से आगे जटिल है । वर्तमान में, सबसे अच्छी पहचान प्रोटीन मार्करों और संवहनी दीवार में pericyte की विशेषता स्थिति का एक संयोजन पर निर्भर करता है । हम यहां immunohistochemical PDGFRβ के लिए तीन अलग ऊतक तैयार करने की तकनीक का प्रदर्शन/NG2 चूहा रेटिना microvascular pericytes, यानी, क्रायो-वर्गों, पूरे mounts के धुंधला, और संवहनी नेटवर्क के hypotonic अलगाव ।
क्रायो-वर्गों के साथ, रेटिना और श्वेतपटल ऑप्टिक तंत्रिका के माध्यम से काट रहे हैं । यह ंयूरॉंस के सभी स्तरित संरचनाओं के दृश्य के लिए अनुमति देता है । रेटिना की अलग दस परतों परमाणु और axonal/वृक्ष संरचनाओं कि hematoxylin/eosin या फ्लोरोसेंट परमाणु 4 ', 6-diamidino-2-phenylindole (DAPI)8के रूप में दाग के साथ कल्पना की जा सकती है कि बदलते के रूप में स्पष्ट कर रहे हैं । चयापचय आवश्यकताओं परतों9 के बीच अलग है और यह एक विशिष्ट परत की मोटाई या कुल अनुपस्थिति का निर्धारण करने के लिए एक विधि प्रदान करता है (उदाहरणके लिए, रेटिना नाड़ीग्रंथि कोशिकाओं का नुकसान रेटिना10ischemia की पहचान में से एक है, 11). vasculature रेटिना के माध्यम से अनुप्रस्थ कटौती के रूप में स्पष्ट है, यह अलग से संबंधित रेटिना परतों के भीतर केशिका जाल का अध्ययन करने के लिए संभव बनाने12,13.
अधिक परंपरागत रूप से, रेटिना vasculature नेटवर्क की जांच रेटिना पूरे माउंट में प्रदर्शन कर रहे हैं. इस ऊतक तैयारी के साथ, रेटिना कट और एक फूल के आकार का संरचना के रूप में समतल है । विधि एक अपेक्षाकृत तेजी से ऊतक तैयारी तकनीक है कि समग्र वास्तुकला रेटिना vasculature को उजागर कर सकते है और यह इसलिए अक्सर murine रेटिना में neovascularization की जांच में लागू किया जाता है । पूरे घुड़सवार रेटिना में microvasculature के सफल दृश्य भी विकासशील नवजात चूहे और चूहे रेटिना में सूचना दी है14,15,16,17,18, 19. ये अध्ययन नवजात रेटिना14की तुलना में वयस्क में बड़े केशिका-मुक्त क्षेत्रों के साथ एक अधिक परिभाषित pericytic गतिविधि प्रकट करते हैं ।
visualizing का एक और तरीका है hypotonic अलगाव के बाद रेटिना microvasculature है । यह ऊतक तैयारी तकनीक परिणाम में रेटिना रक्त वाहिकाओं और केशिकाओं न्यूरॉन्स कोशिकाओं से मुक्त किया जा रहा. अलग रेटिना संवहनी नेटवर्क के दो आयामी इमेजिंग के इस प्रकार आमतौर पर रेटिना trypsin पाचन20 के बाद किया जाता है और pericyte हानि और केशिका सहित मधुमेह रेटिनोपैथी के संवहनी विषमताओं का आकलन करने के लिए इस्तेमाल किया अध२०,२१,२२. hypotonic आइसोलेशन विधि रेटिना संवहनी जीन और प्रोटीन विनियामक प्रतिक्रियाओं की जांच प्रदान करता है के रूप में वे आरटी के साथ किया गया है-पीसीआर और पश्चिमी सोख्ता23,24,25। हम यहां के लिए एक प्रोटोकॉल प्रदान मुक्त फ्लोट immunohistochemical धुंधला hypotonic पृथक रेटिना vasculature के लिए एक विकल्प के रूप में trypsin पाचन microvascular pericytes की जांच करने के लिए ।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
प्रोटोकॉल अनुकूलित और वयस्क पुरुष albino चूहों पर प्रदर्शन किया गया था । सभी प्रायोगिक प्रक्रियाओं में, पशुओं नेत्र और दृष्टि अनुसंधान में पशुओं के उपयोग के लिए ARVO बयान में नियमों के अनुसार इलाज किया गया । पशु कार्बन डाइऑक्साइड और बाद में गर्भाशय ग्रीवा के विस्थापन से euthanized थे ।
1. चूहा रेटिना ऊतक की तैयारी
-
क्रायो-खंड
- पीछे और पूर्वकाल ~ ०.५ cm slits एक स्केलपेल के साथ चूहे पलक में ।
- वैकल्पिक: एक diathermy बर्नर का उपयोग करना, भीतरी कोण पर आंख को चिह्नित करने के लिए एक समान फैशन में एंबेडिंग के दौरान आंख मालूम और ऊर्ध्वाधर cryostat ऑप्टिक तंत्रिका के माध्यम से अनुभाग के लिए अनुमति देते हैं ।
- संदंश के साथ आँख पकड़ो और आसपास के ऊतकों को बेनकाब करने के लिए पक्ष को ध्यान से झुकाव. Enucleate संयोजी और मांसपेशियों के ऊतकों में विच्छेदन कैंची के साथ कटौती करने से आँख ।
चेतावनी: नहीं खींच आंख भी कठिन ऑप्टिक तंत्रिका पर अत्यधिक दबाव के रूप में रेटिना अलगाव का कारण हो सकता है । - एक स्केलपेल की नोक के साथ हल्के दबाव लागू करके corneal limbus पर एक प्रारंभिक छेद करने से पहले स्थिर करने के लिए फॉस्फेट-खारा (पंजाब) में 4% formaldehyde में आंख संक्षेप में रखो ।
- एक खुर्दबीन के नीचे, विच्छेदन कैंची के साथ corneal limbus के साथ काट कॉर्निया हटाने और 2-4 एच के लिए पंजाब में 4% formaldehyde में विलय से पहले संदंश के साथ लेंस को हटा दें ।
- Sörensen's फॉस्फेट बफर में 10% सुक्रोज और 25% सुक्रोज के साथ क्रमिक रूप से कुल्ला ।
- सुअर का त्वचा और चिकन अंडे सफेद से 30% एल्ब्युमिन से 3% जिलेटिन के साथ तैयार Yazulla माध्यम में एंबेड ।
नोट: प्रोटोकॉल यहां-20 डिग्री सेल्सियस पर ऊतक भंडारण के साथ रोका जा सकता है ।
- पीछे और पूर्वकाल ~ ०.५ cm slits एक स्केलपेल के साथ चूहे पलक में ।
-
पूरे माउंट
- एक स्केलपेल के साथ चूहे पलक में पीछे और पूर्वकाल ~ ०.५ cm slits बनाओ ।
- संदंश के साथ आँख पकड़ो और आसपास के ऊतकों को बेनकाब करने के लिए पक्ष को ध्यान से झुकाव. Enucleate संयोजी और मांसपेशियों के ऊतकों में विच्छेदन कैंची के साथ कटौती करने से आँख ।
चेतावनी: नहीं खींच आंख भी कठिन ऑप्टिक तंत्रिका पर अत्यधिक दबाव के रूप में रेटिना अलगाव का कारण हो सकता है । - पंजाब में 4% formaldehyde में आंख संक्षेप में रखो एक स्केलपेल की नोक के साथ प्रकाश दबाव लागू करके corneal limbus पर एक प्रारंभिक छेद करने से पहले स्थिर ।
- एक माइक्रोस्कोप के तहत, विच्छेदन कैंची के साथ corneal limbus के साथ काट कॉर्निया हटाने के लिए और संदंश के साथ लेंस को हटा दें ।
- संदंश के साथ ऑप्टिक तंत्रिका की ओर रेटिना वर्णक उपकला से रेटिना अलग छोटे खोलने आंदोलनों का उपयोग कर प्रमुख फाड़ से बचने के लिए.
- लकीर की कैंची के साथ ऑप्टिक तंत्रिका पर रेटिना नि: शुल्क और ऑप्टिक तंत्रिका सिर की ओर रेटिना परिधि से कुछ मिलीमीटर लंबाई के चार slits बनाते हैं ।
- एक गिलास स्लाइड पर रेटिना फैलाओ और 5 के लिए सुखाने की अनुमति-10 मिनट ।
- 20 के लिए 4% formaldehyde में फिक्स-रेटिना पर formaldehyde टपकाव का 30 मिनट ।
चेतावनी: यह शीशे से अलग कर सकते है के रूप में रेटिना पर सीधे लागू नहीं है । - पंजाबियों के साथ कुल्ला । इष्टतम परिणामों के लिए, इंयूनो-सीधे धोने के बाद दाग ।
-
Hypotonic अलगाव
- एक स्केलपेल के साथ चूहे पलक में पीछे और पूर्वकाल ~ ०.५ cm slits बनाओ ।
- संदंश के साथ आँख पकड़ो और आसपास के ऊतकों को बेनकाब करने के लिए पक्ष को ध्यान से झुकाव. Enucleate संयोजी और मांसपेशियों के ऊतकों में विच्छेदन कैंची के साथ कटौती करने से आँख ।
चेतावनी: नहीं खींच आंख भी कठिन ऑप्टिक तंत्रिका पर अत्यधिक दबाव के रूप में रेटिना अलगाव का कारण हो सकता है । - एक स्केलपेल की नोक के साथ हल्के दबाव लागू करके corneal limbus पर एक प्रारंभिक छेद बनाओ ।
- एक माइक्रोस्कोप के तहत, विच्छेदन कैंची के साथ corneal limbus के साथ काट कॉर्निया हटाने के लिए और संदंश के साथ लेंस को हटा दें ।
- संदंश के साथ ऑप्टिक तंत्रिका सिर की ओर रेटिना वर्णक उपकला से रेटिना अलग छोटे खोलने आंदोलनों का उपयोग करने के लिए प्रमुख फाड़ से बचने के.
- विच्छेदन कैंची के साथ ऑप्टिक तंत्रिका पर रेटिना नि: शुल्क, एक 24 अच्छी तरह से थाली में जल के 1 मिलीलीटर में रेटिना जगह और 1 के लिए १.५ मिमी कंपन कक्षा के साथ २०० rpm पर शेक कमरे के तापमान पर एच ।
नोट: इसके बाद, रेटिना कम किनारों पर परिभाषित दिखाई देगा । - जोड़ें २०० U DNAse 1 रेटिना vasculature से लीजड ड सेल मलबे अलग कर देना और कमरे के तापमान पर एक और 30 मिनट के लिए हिला ।
नोट: मलबे के कुओं में फार्म शुरू हो सकता है । - कम कुल्ला 5 मिनट के लिए 150 में मिलाते हुए के साथ पानी में 3 बार-300 rpm को ंयूरॉंस कोशिका मलबे को हटा दें । रेटिना प्रत्येक न्यूरॉन सेलुलर मलबे को हटाने का संकेत कुल्ला के साथ और अधिक पारदर्शी हो जाना चाहिए ।
- एक अंधेरे पृष्ठभूमि का उपयोग करने के लिए 24 अच्छी तरह से थाली में देखने के लिए स्पष्ट रूप से diaphanous पृथक रेटिना vasculature देखते हैं ।
- (वैकल्पिक): यदि vasculature इस बिंदु पर (अर्द्ध पारदर्शी) न्यूरॉनल परतों से मुक्त दिखाई नहीं देता है या तो अधिक कुल्ला कदम जोड़ने, झटकों की गति बढ़ाने या vasculature पर तरल महाप्राण के लिए एक प्लास्टिक का उपयोग करें.
चेतावनी: वैकल्पिक चरणों का या तो vasculature को नुकसान हो सकता है ।
- पंजाब में कमरे के तापमान पर 4% paraformaldehyde के 1 मिलीलीटर में 10 मिनट फिक्स और पंजाब में 3 बार कुल्ला ।
नोट: प्रोटोकॉल यहां 4 डिग्री सेल्सियस पर ऊतक भंडारण के साथ रोका जा सकता है ।
2. Immunohistochemistry
-
क्रायो के दाग-वर्गों
- कट 10 µm क्रायो-जिलेटिन की धारा-ऑप्टिक तंत्रिका के माध्यम से ऊर्ध्वाधर अनुभाग के रूप में रेटिना एंबेडेड और एक गिलास स्लाइड पर क्रायो-वर्गों जगह और दो सूखी (ंयूनतम 1 घंटे) ।
- 15 मिनट के लिए ०.२५% ट्राइटन X-१०० (पंजाबियों-टी) के साथ पंजाब में कांच स्लाइड जलमग्न ।
- ड्रिप 1:100 PDGFRβ और 1:500 NG2 प्राथमिक पंजाब में पतला एंटीबॉडी-टी + क्रायो पर 1% BSA-खंड और 4 डिग्री सेल्सियस पर रात भर में मशीन कक्ष में गर्मी ।
- 15 मिनट और ड्रिप 1:100 विरोधी माउस Alexa Fluor ५९४-जुड़ा हुआ है और 1:100 विरोधी खरगोश FITC-पंजाब में पतला माध्यमिक एंटीबॉडी-टी के लिए टी-2 में कांच स्लाइड के लिए दो बार जलमग्न-t क्रायो-वर्गों पर 3% BSA के साथ ।
- अंधेरे में कमरे के तापमान पर गिलास स्लाइड 1 ज मशीन ।
- पंजाब में कांच स्लाइड-टी 2x 15 मिनट कुल्ला ।
नोट: वैकल्पिक: डबल और ट्रिपल immunofluorescent धुंधला के लिए, अनुक्रमिक धुंधला 2.1.3 से प्रक्रिया दोहरा द्वारा किया जा सकता है 2.1.6 दो और तीन बार, क्रमशः । - DAPI और एक coverslip युक्त विरोधी लुप्त होती बढ़ते माध्यम के साथ दाग क्रायो-वर्गों माउंट ।
-
पूरे माउंट के दाग
- ड्रिप पंजाब-पूरे पर टी-माउंट और 15 मिनट के लिए कमरे के तापमान पर गर्मी ।
- बंद डालो और ड्रिप 1:100 PDGFRβ और 1:500 NG2 प्राथमिक पंजाब में पतला एंटीबॉडी-टी + 1% BSA और नम कक्षों में 4 डिग्री सेल्सियस रात भर में गर्मी ।
- बंद डालो और पंजाबियों पर ड्रिप-टी 2x 15 मिनट में गिलास स्लाइड कुल्ला करने के लिए ।
- बंद डालो और 1:100 विरोधी खरगोश Cy2 पर ड्रिप-और 1:100 विरोधी माउस Cy3-जुड़े माध्यमिक पंजाब में पतला एंटीबॉडी-3% BSA के साथ टी अंधेरे में कमरे के तापमान पर एक नम कक्ष में 1 ज मशीन ।
- बंद डालो और पंजाबियों पर ड्रिप-टी अंधेरे में 2x 15 मिनट में कुल्ला करने के लिए ।
नोट: वैकल्पिक: डबल और ट्रिपल immunofluorescent धुंधला के लिए, अनुक्रमिक धुंधला करने के लिए -8 से प्रक्रिया दोहरा द्वारा किया जा सकता है 2.2.5 दो और तीन बार, क्रमशः । - DAPI और एक coverslip युक्त विरोधी लुप्त होती बढ़ते माध्यम के साथ दाग पूरे माउंट माउंट ।
-
hypotonic पृथक vasculature के दाग
- १०० rpm और ५०० µ एल के साथ कमरे के तापमान पर मिलाते के साथ hypotonic अलग vasculature 1 एच ब्लॉक 10% गधा पंजाब में पतला के सीरम ।
- कमरे के तापमान पर रात भर गर्मी और ६०० µ एल के साथ १०० rpm पर शेक/1:100 PDGFRβ और 1:500 NG2 प्राथमिक पंजाब में 10% गधा सीरम में पतला एंटीबॉडी के साथ ।
- 5 मिनट और 1:100 विरोधी में मशीन के लिए रेटिना नेटवर्क 3x कुल्ला-माउस Alexa Fluor ५९४-जुड़े और 1:100 विरोधी खरगोश FITC-माध्यमिक एंटीबॉडी पंजाब में 10% गधा सीरम में पतला मिलाते १०० rpm और कमरे के तापमान पर 1 के लिए अंधेरे में एच ।
- पंजाब में कुल्ला-5 मिनट के लिए टी और पंजाब में ०.२ एनजी/DAPI में मशीन-15 मिनट के लिए टी के लिए 3x द्वारा पीछा किया पंजाब में 5 मिनट कुल्ला-टी अंधेरे में ।
- एक प्लास्टिक पाश्चर प्लास्टिक की नोक कट, यह पंजाबियों के साथ गीला-टी और यह एक 4-अच्छी तरह से ग्लास चैंबर स्लाइड करने के लिए रेटिना नेटवर्क हस्तांतरण करने के लिए उपयोग करें ।
नोट: गीला कदम पाश्चर प्लास्टिक के अंदर करने के लिए चिपके हुए रेटिना vasculature से बचने के लिए महत्वपूर्ण है. - रेटिना vasculature का खुलासा । संदंश के साथ रेटिना vasculature को छूने से बचें क्योंकि यह vasculature को उलझन में पैदा कर सकता है ।
नोट: खुलासा करने के लिए आगे और पीछे चैंबर स्लाइड झुका द्वारा किया जा सकता है या रेटिना vasculature पर तरल की aspirating बूँदें. - यम को कुएं से निकाल दें । तरल की सतह तनाव स्लाइड के तल पर vasculature समतल होगा ।
- चैंबर स्लाइड से प्लास्टिक के कुओं को हटाने से पहले एक खुर्दबीन के नीचे सही खुलासा सुनिश्चित करें ।
- विरोधी लुप्त होती बढ़ते मध्यम और एक coverslip के साथ सना हुआ vasculature माउंट ।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
सफल प्रोटोकॉल microvascular pericytes visualizing के लिए तीन अलग रेटिना तैयारियां प्रदान करते हैं । इन विधियों में से प्रत्येक PDGFRβ और NG2 immunoreactivity सह स्थानीयकरण और pericytes की अद्वितीय स्थिति है कि केशिका endothelium foridentification चारों ओर लपेटो का उपयोग करता है ।
क्रायो-वर्गों के साथ, ंयूरॉन परतों DAPI की फ्लोरोसेंट घनत्व से पहचाना जा सकता है-बला नाभिक और भीतरी और गहरी केशिका जाल pericytes कि प्रदर्शन PDGFRβ और NG2 immunoreactivity (चित्रा 1) होते हैं । संवहनी दीवार में pericytes की अनूठी स्थिति परिपत्र या घोड़े की नाल के आकार का immunoreactivity के रूप में जहाजों की परिधि में देखा जा सकता है (चित्रा 1, तीर) या सामयिक longitudinally कटौती जहाजों (चित्रा 1, arrowhead) ।
पूरे में microvascular pericytes के सफल दृश्य-वयस्क चूहे की तैयारी माउंट14,20चुनौतीपूर्ण हो सकता है । PDGFRβ immunoreactivity में पूरे घुड़सवार वयस्क रेटिना में केवल एक बहुत ही कमजोर संकेत (नहीं दिखाया गया) के परिणामस्वरूप । NG2 धुंधला abluminal pericytes (चित्रा 2) में तीव्र दाग के साथ भीतरी संवहनी नेटवर्क रेखांकित किया ।
वयस्क चूहे रेटिना के संवहनी नेटवर्क का अवलोकन प्राप्त करने के लिए, hypotonic पृथक चूहे रेटिना संवहनी नेटवर्क के immunohistochemistry पूरे माउंट करने के लिए एक वैकल्पिक विधि प्रदान करता है. जब सफलतापूर्वक प्रदर्शन किया, इस ऊतक तैयारी तकनीक भीतरी और गहरी केशिका जाल सहित पूरे रेटिना microvasculature का एक सिंहावलोकन प्रदान करता है । Immunohistochemical पूरे microvascular विशिष्ट संवहनी कोशिकाओं (चित्रा 3) में एक तीव्र प्रतिक्रिया के साथ NG2 immunoreactivity दिखा नेटवर्क में pericytic मार्करों परिणाम के साथ धुंधला । इनमें से कुछ कोशिकाएँ PDGFRβ immunoreactivity (चित्रा ३) का प्रदर्शन भी करतीं हैं.
ऊतक के एक सावधान खुलासा रेटिना vasculature का एक अच्छा सिंहावलोकन प्राप्त करने के लिए महत्वपूर्ण है । अपर्याप्त खुलासा vasculature में परिणाम कर सकते है कई ध्यान परतों जो फ्लोरोसेंट इमेजिंग मुश्किल (चित्रा 4) में व्यवस्था की जा रही है । खुलासा कोमल मिलाते द्वारा सुविधा हो सकता है, चैंबर स्लाइड आगे और पीछे झुकाव या रेटिना vasculature पर तरल के aspirating बूंदें । यह ध्यान दिया जाना चाहिए कि रेटिना केशिका जाल के एनाटॉमी संवहनी बिस्तरों के कुछ ओवरले में परिणाम होगा । इसलिए, यह गहरी केशिका जाल से भीतर भेद जब गिलास स्लाइड पर चपटा समस्याग्रस्त है । ।
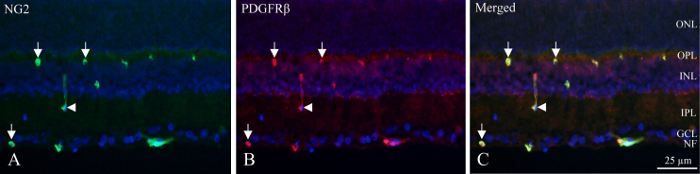
चित्रा 1: डबल immunohistochemical pericyte क्रायो के दाग-भीतरी चूहे रेटिना की धारा । (क) NG2 (हरा) immunohistochemistry से रेटिना के भीतरी भाग के भीतर सकारात्मक जहाजों का पता चलता है. तीर रक्त वाहिकाओं में परिपत्र और घोड़े की नाल के आकार का immunoreactivity से संकेत मिलता है । arrowhead एक longitudinally कट पोत बताते हैं । (ख) PDGFRβ (red) immunohistochemistry NG2 immunoreactivity के समान जेट दिखाएं । तीर और NG2 धुंधला के लिए के रूप में एक ही संरचनाओं पर arrowhead बिंदु । (ग) छवि तीन अलग फिल्टर superimposing द्वारा NG2, PDGFRβ और DAPI (नीला) की एक मर्ज दिखाता है । यह पता चला है कि दो एंटीबॉडी सह स्थानीयकृत रहे हैं (हरे + लाल = पीला). NF: तंत्रिका फाइबर परत, GCL: नाड़ीग्रंथि सेल परत, आईपीएल: इनर plexiform परत, आईएनएल: इनर परमाणु परत, OPL: बाहरी plexiform परत, केव: बाहरी परमाणु परत । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्रा 2: Immunohistochemical pericyte पूरे घुड़सवार चूहा रेटिना के दाग । NG2 (लाल) immunoreactivity सतही संवहनी networkwith abluminal pericytes में तीव्र दाग के साथ दिखाई दे रहा है । छवियाँ NG2 और DAPI (नीला) मर्ज किए गए दिखाएँ । NG2-सना microvasculature के बीच DAPI-नीला नाभिक के रूप में न्यूरॉन कोशिकाएं दिखाई देती हैं । PDGFRβ immunoreactivity में पूरे बढ़-चढ़कर व्यस्क रेटिना का परिणाम ही बहुत कमजोर संकेत में है और इसलिए इस आंकड़े में शामिल नहीं है. कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्रा 3: डबल immunohistochemical pericyte hypotonic अलग चूहे रेटिना vasculature के दाग । (क). छवि hypotonic अलग चूहे रेटिना संवहनी नेटवर्क immunohistochemical NG2 (हरा) और PDGFRβ (लाल) के साथ दाग से पता चलता है । पूरा नेटवर्क NG2 immunoreactivity दिखाया । हालांकि, PDGFRβ immunoreactivity सेल सोमास में मिली । एक के डालने के रेटिना vasculature नेटवर्क DAPI (नीला) के साथ दाग का एक सिंहावलोकन है । (ख) छवि एक अलग स्थान और उच्च आवर्धन पर (क) के रूप में एक ही नमूना से पता चलता है । यह स्पष्ट है कि PDGFRβ धुंधला केवल pericyte immunoreactivity का संकेत संवहनी नेटवर्क में सेल सोमा में प्रदर्शित किया जाता है । बी के डालने की छवि है कि NG2 (हरा), PDGFRβ (लाल) और DAPI के साथ विलय के साथ सना हुआ vasculature के उच्च इज़ाफ़ा दिखाता है । NG2 और PDGFRβ के साथ एक साथ धुंधला DAPI सहित तीन pericytes (PDGFRβ पॉजिटिव) और दो अज्ञात पोत दीवार कोशिकाओं से पता चलता है । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्रा 4: एक अपर्याप्त सामने आया hypotonic पृथक रेटिना vasculature का उदाहरण । एक hypotonic पृथक vasculature के सावधान खुलासा महत्वपूर्ण है के रूप में अपर्याप्त unfold में परिणाम कर सकते है खड़ी जा रहा है । चित्र एक ही साइट पर DAPI-सना हुआ रेटिना vasculature दिखाने लेकिन अलग ध्यान परतों में ले लिया । (क) एक फोकस परत में DAPI-सना हुआ कोशिकाओं रेटिना vasculature में एक लगभग 25 µm मोटी रक्त वाहिका दिखा । (ख) एक दूसरी फोकस परत में DAPI-सना हुआ कोशिकाओं स्पष्ट पतली शाखाओं में एक ही साइट है कि (एक) में प्रदर्शित बड़ा रक्त पोत पर खड़ी कर दी गई है । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
हम तीन रेटिना तैयार करने की तकनीक है कि microvascular रेटिना pericytes के अध्ययन में लागू किया जा सकता पेश करते हैं । नीचे, हम प्रत्येक विधि के बीच तुलना प्रदान करते हैं और प्रोटोकॉल में महत्वपूर्ण चरणों को हाइलाइट करते हैं.
क्रायो-अनुभाग के साथ, रेटिना sagittal वर्गों में काट रहा है और इसलिए, यह एक ही रेटिना से कई नमूनों को प्राप्त करने के लिए संभव है. अंक वर्गों इस विधि से जिसके परिणामस्वरूप यह एंटीबॉडी विशिष्टता और अनुमापन परीक्षण के लिए एक आदर्श विकल्प बनाने के रूप में यह अनावश्यक पशु बलि रोकता है । अच्छे परिणाम के लिए तैयारी कार्य निर्णायक है । यह महत्वपूर्ण है जबकि आँख से आँख नहीं खींचना लेकिन आँख के आसपास की सभी मांसपेशियों को काटना । वहां रेटिना टुकड़ी का खतरा अगर बल प्रयोग किया जाता है । क्योंकि आंख कप पतली है, एक बहुत लंबा नहीं तय करना चाहिए । 2-4 एच के लिए पंजाब में 4% paraformaldehyde के साथ विसर्जन ऊतक ठीक हो जाएगा । यदि अब तय समय पर ब्याज की प्रतिजन नष्ट होने का खतरा है । आदेश में सबसे अच्छा संभव immunostainings उत्पंन करने के लिए, यह प्रत्येक अनुभाग के लिए महत्वपूर्ण के रूप में कांच के खिलाफ संभव के रूप में फ्लैट है । क्योंकि वर्गों केवल microvasculature के कुछ सामयिक अनुप्रस्थ कटौती होते हैं, इस ऊतक तैयारी तकनीक microvasculature के केवल आंतरायिक दृश्य प्रदान करता है । इसलिए, यह विधि समग्र संवहनी वास्तुकला और pericytes के quantifiable उपायों के अध्ययन के लिए उपयुक्त नहीं है ।
समग्र vasculature के बाद दाग हो सकता है पूरे-बढ़ते vasculature के एक सिंहावलोकन प्रदान करने के लिए । जब इस तकनीक माहिर, यह एक तेजी से ऊतक तैयारी प्रक्रिया है कि अपेक्षाकृत कम कार्यभार की आवश्यकता हो सकती है । हालांकि, कुछ बिंदुओं के बारे में विशेष रूप से जानते हैं । रेटिना नाजुक है और यह उन्हें देखभाल के साथ संभाल और rips और कटौती से बचने के लिए सर्वोपरि है । इसके अलावा, जबकि ध्यान से रेटिना हैंडलिंग, यह महत्वपूर्ण महत्व का है कि immunohistochemical इमेजिंग पर बाद में प्रभावित हो सकता है बढ़ते के दौरान परतों और अंय crevasses से बचने के लिए । घुड़सवार रेटिना की एक मोटाई है 250-300 µm और एंटीबॉडी पैठ के ंयूरॉन परतों समस्याग्रस्त हो सकता है । pericyte विज़ुअलाइज़ेशन के संबंध में, पूरे-माउंट प्रोटोकॉल में NG2 दाग केवल एक Cy3 से जुड़े माध्यमिक एंटीबॉडी के साथ प्राप्त किया जा सकता है, और पूरे में PDGFRβ immunoreactivity घुड़सवार वयस्क रेटिना में इस तरह के एक बहुत कमजोर संकेत है कि यह नहीं दिखाया गया था में परिणाम आंकड़ा । इसलिए, पूरे-धुंधला तकनीक माउंट की उपयोगिता दृढ़ता से सफल दाग मुख्य रूप से विशिष्ट प्राथमिक और माध्यमिक एंटीबॉडी इस्तेमाल पर निर्भर करता है से प्रभावित है । इसके अलावा सुझाव एक वयस्क चूहे रेटिना की कल्पना microvascular जाल के लिए प्रोटोकॉल का अनुकूलन करने के लिए प्राथमिक एंटीबॉडी में समय की एक लंबी अवधि के लिए मशीन द्वारा है और/
पूरी मुहिम की मोटाई के कारण, ऑप्टिक तंत्रिका सिर की ओर रेटिना परिधि से चार चीरा बनाने के बाद रेटिना की दिशा के बारे में पता होना जरूरी है कि आकस्मिक केशिकाओं युक्त भीतरी रेटिना के साथ बढ़ते से बचने के लिए नीचे की दिशा में । फिर भी, गहरी microvascular जाल और pericytes के विस्तृत दृश्य इस विधि के साथ परेशानी हो सकती है14,20. पूरे-के रूप में वयस्क रेटिना के धुंधला माउंट गहरी केशिका जाल में मुश्किल है, यह कुछ भागों में रेटिना दिखने avascular में परिणाम हो सकता है । पूरी की immunohistochemical धुंधला वयस्क रेटिना घुड़सवार pericytes सतही केशिका जाल में जहाजों अस्तर के साथ vasculature का केवल एक खंडित सिंहावलोकन प्रदान करता है और इसलिए, इस विधि में झूठी नकारात्मक परिणाम के लिए नेतृत्व कर सकते है चूहे रेटिना vasculature के दृश्य ।
Trypsin पाचन लंबे अलगाव और रेटिना vasculature20के दृश्य के लिए सोने के मानक तकनीक पर विचार किया गया है । Hypotonic अलगाव पूरे जटिल तीन आयामी संवहनी नेटवर्क के दृश्य के लिए एक वैकल्पिक विधि प्रदान करता है और बहुत ही नाजुक ऊतक जो संभालना मुश्किल है के साथ काम कर रहे चुनौतियों के कई चेहरे । दो तरीकों के बीच रेटिना संवहनी उत्पाद में समानता के कारण, hypotonic अलगाव से बचने के प्रमुख आँसू और सतर्क हैंडलिंग को रोकने के लिए सावधान विच्छेदन सहित trypsin पाचन20 के रूप में एक ही चुनौतियों के कई चेहरे pipetting और संदंश के साथ छुए । तरीकों के बीच एक महत्वपूर्ण अंतर निर्धारण है । Trypsin पाचन आम तौर पर निर्धारण के बाद किया जाता है और सफलतापूर्वक कई वर्षों के लिए निर्धारण में किया गया है कि संरक्षित रेटिना पर लागू किया जा सकता है20। Hypotonic अलगाव निर्धारण से पहले किया जाता है और इस तरह विभिंन अंय परख में कार्यांवयन के लिए अनुमति देता है के रूप में पहले साहित्य23,24,25में वर्णित है । trypsin पाचन दो दिन20पर किया जाता है, जबकि hypotonic अलगाव घंटे के भीतर पूरा किया जा सकता है । इसके अलावा, hypotonic अलगाव प्रोटोकॉल के जोखिम को शामिल नहीं करता है पर पाचन और झिल्ली मार्करों के एंजाइमी दरार pericyte मांयता के लिए आवश्यक, जैसे PDGFRβ और NG2, इस विधि बनाने के बाद के लिए पसंद immunohistochemical microvascular दाग.
अंत में, हालांकि इस पांडुलिपि के तत्काल दायरे से बाहर है, वहां एक कम व्यापक रूप से जाना जाता है, लेकिन अलग से बड़े, बरकरार microvascular plexi के लिए बहुत उपयोगी तकनीक है रेटिना27से बाहर चूहे । रेटिना को एक विशेष कांच के चैंबर और coverslip में तैनात किया जाता है । coverslip के हटाने पर, microvasculature coverslip से जुड़ा रहता है एक पूरी तरह से जीवित (≈ कोशिकाओं के ९८%) ऊतक प्रिंट बनाने के लिए । इस विधि का सबसे बड़ा लाभ यह है कि यह जहाजों और immunostaining के लिए बाद में निर्धारण के शारीरिक अध्ययन के लिए अनुमति देता है । विधि की एक स्पष्ट सीमा है कि यह चित्रण प्रदान नहीं करता है/पूरे microvascular नेटवर्क के अलगाव के रूप में रेटिना फ्लैट माउंट और hypotonic तैयारी करते हैं । फिर भी, pericytes इस विधि27के अनुप्रयोग द्वारा विज़ुअलाइज़ किया जा सकता है ।
तीन ऊतक तैयार करने की तकनीक यहां वर्णित अर्थ में पूरक है कि प्रत्येक विधि microvascular pericytes के दृश्य के लिए लाभ और कमियों शामिल हैं । प्रत्येक विधियों की क्षमता और कमजोरियों का आकलन विशिष्ट रोग स्थितियों के तहत microvascular pericytes की जांच के लिए इष्टतम विधि का चयन करने के लिए महत्वपूर्ण है । प्रदर्शन विधियों न केवल pericyte मार्करों के लिए, लेकिन यह भी सामांय में microvascular संरचनाओं के दृश्य के लिए धुंधला करने के लिए विस्तारित किया जा सकता है । अंततः, यह व्यक्तिगत शोधकर्ता के लिए है के लिए उपयुक्त दृश्य प्रश्न में अनुसंधान परिकल्पना के आधार पर विधि का चयन करें ।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों का खुलासा करने के लिए कुछ नहीं है ।
Acknowledgments
अनुसंधान Lundbeck फाउंडेशन, डेनमार्क द्वारा वित्त पोषित किया गया ।
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



