Summary
Vamos demonstrar três técnicas de preparação de tecidos diferentes para visualização de imuno-histoquímica de pericitos microvascular da retina do rato, ou seja, crio-seções, todo-montagens e hipotônica isolamento da rede vascular.
Abstract
Perícitos da retina desempenham um papel importante em muitas doenças do olho. Imuno-histoquímica coloração técnicas dos vasos da retina e microvasculares pericitos são centrais para pesquisas oftalmológicas. É fundamental escolher um método apropriado de visualizar os pericitos microvasculares. Descrevemos a imuno-histoquímica da retina Pericito microvascular coloração em crio-seções, todo-montagens e hipotônica vasculatura isolada usando anticorpos para fator de crescimento derivado de plaquetas do receptor β (PDGFRβ) e nervo/gliais antígeno 2 (NG2). Isso nos permite destacar as vantagens e limitações de cada um dos preparativos para a visualização das retina pericitos microvasculares três tecido. Cryo-seções fornecem transsectional visualização de todas as camadas da retina, mas contêm apenas alguns cortes transversais ocasionais da microvasculatura. Toda a montagem fornece uma visão geral da vasculatura da retina inteira, mas visualização da microvasculatura pode ser problemática. Hipotônica isolamento fornece um método para visualizar a vasculatura da retina inteira pela remoção de células neuronais, mas isso faz com que o tecido muito frágil.
Introduction
Perícitos da retina são o foco de muitos laboratórios de pesquisa como estas células desempenham um papel importante na integridade da vasculatura. Condições patológicas como retinopatia diabética1, isquemia2e glaucoma3 têm características vasculares que envolvem a função de pericitos. Pericitos são encontrados nos interiores plexos capilares da retina. Artéria central da retina que abastece os ramos de retina interna em duas camadas de plexos capilares. A cama vascular interna situa-se entre as células ganglionares e camadas nucleares internas. A camada mais profunda é mais denso e complexo e está localizada entre o interior e exterior camadas nucleares4,5. Além disso, algumas partes da retina também contêm uma terceira rede denominada os capilares parapapillary radial. Estas são longas, retos capilares que se encontram entre as fibras nervosas e raramente se anastomosam com um outro ou os outros dois plexos6. Dentro da parede capilar, pericitos são incorporados na membrana do porão e linha do lado de abluminal das células endoteliais vasculares.
Até esta data, não há nenhum marcador biológico exclusivo destas pericitos que pode diferenciá-las das outras células vasculares. Fator de crescimento derivado de plaquetas do receptor β (PDGFRβ) e nervo/gliais antígeno 2 (NG2) são comumente utilizados marcadores que ambos apresentam em pericitos mas também outras células vasculares. Identificação de pericitos é ainda mais complicada pela existência de subconjuntos Pericito que variam em morfologia e proteínas de expressão7. Atualmente, a melhor identificação depende de uma combinação de marcadores de proteína e o posicionamento característico do Pericito na parede vascular. Demonstramos aqui três técnicas de preparação de tecidos diferentes para coloração imuno-histoquímica PDGFRβ/NG2 de pericitos microvascular da retina do rato, ou seja, crio-seções, todo-montagens e hipotônica isolamento da rede vascular.
Com cryo-seções, a retina e a esclera são cortados através do nervo óptico. Isto permite a visualização de todas as estruturas em camadas de neurônios. As distintas dez camadas da retina são aparentes como intercâmbio nucleares e axonal/dendríticas estruturas que podem ser visualizadas com manchas como hematoxilina/eosina ou nuclear fluorescente 4', 6-diamidino-2-phenylindole (DAPI)8. As exigências metabólicas diferem entre as camadas de9 e fornece um método para determinar a espessura ou a total ausência de uma camada específica (por exemplo, a perda de células ganglionares da retina é uma das marcas registradas de isquemia da retina10, 11). O sistema vascular é evidente como transversal corta através da retina, tornando possível estudar separadamente os plexos capilares dentro as respectivas camadas da retina12,13.
Mais tradicionalmente, as investigações da rede vasculatura da retina são realizadas em retinais todo-montagens. Com esta preparação do tecido, a retina é cortada e achatada como uma estrutura em forma de flor. O método é uma técnica de preparação do tecido relativamente rápida que pode realçar a vasculatura da retina de arquitetura global e, portanto, é muitas vezes aplicado na investigação da neovascularização na retina murino. Visualização bem sucedida da microvasculatura em retinas todo montado também é relatada no desenvolvimento neonatal rato e rato retina14,15,16,17,18, 19. estes estudos revelam uma atividade pericytic mais definida com áreas maiores capilar-livre no adulto em comparação com a retina neonatal14.
Outra maneira de Visualizar é a microvasculatura retiniana após isolamento hipotônica. Esta técnica de preparação do tecido resulta em embarcações de sangue retinais e capilares sendo liberados das células neuronais. Este tipo de imagem bidimensional da rede vascular retiniana isolada é geralmente realizado após a digestão de tripsina da retina20 e usado para avaliar as anormalidades vasculares da retinopatia diabética, incluindo capilar e perda de Pericito degeneração de21,20,22. O método de isolamento hipotônica oferece as investigações do gene vascular da retina e respostas regulatórias de proteína, como tem sido feito com RT-PCR e ocidental mancha23,24,25. Nós fornecemos aqui um protocolo para a coloração imuno-histoquímica livre flutuante da vasculatura da retina hipotônica isolada, como uma alternativa para a digestão do trypsin para examinar os pericitos microvasculares.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
O protocolo foi otimizado e demonstrado em ratos adultos machos albino. Em todos os procedimentos experimentais, os animais foram tratados de acordo com os regulamentos na instrução ARVO para o uso de animais em oftalmologia e Vision Research. Os animais foram sacrificados por dióxido de carbono e subsequente deslocamento cervical.
1. preparações de tecido Retinal do rato
-
Cryo-seção
- Fazer fendas cm de ~0.5 anterior e posterior na pálpebra rato com um bisturi.
- Opcional: Usar um queimador de diatermia, marca o olho no ângulo interno para orientar o olho de forma uniforme durante a incorporação e permitir criostato vertical de corte através do nervo óptico.
- Pegue o olho com fórceps e incline cuidadosamente para o lado para expor o tecido circundante. Enucleate do olho, fazendo cortes com uma tesoura de dissecação no tecido conjuntivo e muscular.
Atenção: Não puxe o olho muito difícil pois uma pressão excessiva sobre o nervo óptico pode causar descolamento de retina. - Coloque o olho brevemente em formol 4% em tampão fosfato salino (PBS) para estabilizar antes de fazer um furo inicial no limbo da córnea aplicando uma ligeira pressão com a ponta de um bisturi.
- Sob um microscópio, corte com tesoura de dissecação para remover a córnea e remover a lente com pinça antes de submergir em formol 4% em PBS para 2 – 4 h ao limbo da córnea.
- Enxágue sequencialmente em tampão de fosfato do Sörensen com 10% de sacarose e 25% de sacarose.
- Incorpore no médio Yazulla, preparado com gelatina de 3% de suínos pele e 30% albumina de ovo de galinha.
Nota: O protocolo pode ser uma pausa aqui com armazenamento de tecido a-20 ° C.
- Fazer fendas cm de ~0.5 anterior e posterior na pálpebra rato com um bisturi.
-
Toda a montagem
- Fazer ~0.5 anterior e posterior cm fendas na pálpebra rato com um bisturi.
- Pegue o olho com fórceps e incline cuidadosamente para o lado para expor o tecido circundante. Enucleate do olho, fazendo cortes com uma tesoura de dissecação no tecido conjuntivo e muscular.
Atenção: Não puxe o olho muito difícil pois uma pressão excessiva sobre o nervo óptico pode causar descolamento de retina. - Coloque o olho brevemente em formol 4% em PBS para estabilizar antes de fazer um furo inicial no limbo da córnea aplicando uma ligeira pressão com a ponta de um bisturi.
- Sob um microscópio, corte ao limbo da córnea com tesoura de dissecação para remover a córnea e remover a lente com fórceps.
- Separe a retina o epithelium retinal do pigment para o nervo óptico com fórceps, usando movimentos de pequena abertura para evitar grandes rasgando.
- Livre da retina ao nervo óptico com tesoura de dissecação e fazer quatro fendas de alguns milímetros de comprimento da periferia da retina, cabeça do nervo óptico.
- Espalhe a retina numa lâmina de vidro e permitem a secagem de 5 – 10 min.
- Corrigi em formol 4% por 20 a 30 min pingando formol na retina.
Atenção: Não aplique diretamente na retina como ele pode separar do vidro. - Enxaguar com PBS. Para obter melhores resultados, imuno-mancha diretamente após o enxágue.
-
Isolamento hipotônica
- Fazer ~0.5 anterior e posterior cm fendas na pálpebra rato com um bisturi.
- Pegue o olho com fórceps e incline cuidadosamente para o lado para expor o tecido circundante. Enucleate do olho, fazendo cortes com uma tesoura de dissecação no tecido conjuntivo e muscular.
Atenção: Não puxe o olho muito difícil pois uma pressão excessiva sobre o nervo óptico pode causar descolamento de retina. - Faça um furo inicial no limbo da córnea aplicando uma ligeira pressão com a ponta de um bisturi.
- Sob um microscópio, corte ao limbo da córnea com tesoura de dissecação para remover a córnea e remover a lente com fórceps.
- Separe a retina o epithelium retinal do pigment na direcção da cabeça do nervo óptico com fórceps, usando movimentos de pequena abertura para evitar grandes rasgando.
- Livre da retina ao nervo óptico com tesoura de dissecação, coloque a retina em 1 mL de água deionizada em uma placa de 24 e agitar a 200 rpm com uma órbita de vibração de 1,5 mm por 1h à temperatura ambiente.
Nota: Daqui em diante, a retina vai aparecer que menos definidos nas bordas. - Adicione 200 U DNAse 1 para dissociar os destroços lisados celulares da vasculatura da retina e agitar durante mais 30 min à temperatura ambiente.
Nota: Os restos podem começam a se formar em poços. - Lave o mínimo 3 vezes em água desionizada por 5 min com agitação a 150-300 rpm para remover os restos da célula neuronal. A retina deve tornar-se mais transparente com cada lavagem indicativa da remoção de restos celulares neuronais.
- Use um fundo escuro, a olhar para a placa de 24 para ver claramente a vasculatura da retina isolada diáfana.
- (Opcional): se a vasculatura não aparecer livre de camadas neuronais (semi-transparente) neste ponto também adicionar mais etapas de lavagem, aumentar a velocidade de agitação ou usar uma pipeta para aspirar o líquido sobre o sistema vascular.
Cuidado: Uma das etapas opcionais podem danificar o sistema vascular.
- Corrigi a 10 min em 1 mL de paraformaldeído 4% em PBS em temperatura ambiente e lave 3 vezes em PBS.
Nota: O protocolo pode ser uma pausa aqui com armazenamento de tecido a 4 ° C.
2. imuno-histoquímica
-
Coloração de cryo-seções
- 10 µm cryo-seções da retina gelatina-incorporado como corte vertical através do nervo óptico de corte e coloque as cryo-seções sobre uma lâmina de vidro e deixar secar (mínimo 1 h).
- Mergulhe a lâmina de vidro em PBS com 0,25% Triton X-100 (PBS-T) por 15 min.
- 1: 100, PDGFRβ e 1: 500 NG2 anticorpos primários diluídos em PBS-T + 1% de BSA para o cryo-seção de gotejamento e incubar em câmaras de incubação de 4 ° C durante a noite.
- Mergulhe a lâmina de vidro 2 vezes em PBS-T por 15 min e 1: 100 anti-rato Alexa Fluor 594-ligados e 1: 100 anti-coelho FITC-lig anticorpos secundários diluídos em PBS-T com 3% de BSA para as cryo-seções de gotejamento.
- Incube a lâmina de vidro de 1 h à temperatura ambiente no escuro.
- Enxague a lâmina de vidro em PBS-T 2 x 15 min.
Nota: Opcional: para coloração imunofluorescente duplos e triplos, coloração sequencial pode ser realizada, repetindo o procedimento de 2.1.3 2.1.6 duas e três vezes, respectivamente. - Monte as cryo-seções manchadas com antidesbotamento montagem DAPI contendo médio e uma lamela.
-
A coloração de toda a montagem
- Gotejamento PBS-T para a conjunto de montagem e incubar a temperatura ambiente por 15 min.
- Decantar e gotejamento 1: 100, PDGFRβ e 1: 500 NG2 anticorpos primários diluídos em PBS-T + 1% de BSA e incubar em câmaras úmidas a 4 ° C durante a noite.
- Decantar e gotejamento em PBS-T para enxaguar a lâmina de vidro de 2 x 15 min.
- Decantar e gotejamento no 1: 100 anti-coelho Cy2 - e 1: 100 anti-rato Cy3-lig secundário anticorpo diluído em PBS-T com 3% de BSA para incubar 1 h em uma câmara úmida à temperatura ambiente no escuro.
- Decantar e gotejamento em PBS-T para lavar em 2 x 15 min no escuro.
Nota: Opcional: para coloração imunofluorescente duplos e triplos, coloração sequencial pode ser realizada, repetindo o procedimento de 2.2.2 2.2.5 duas e três vezes, respectivamente. - Montagem a montagem toda manchada com antidesbotamento montagem DAPI contendo médio e uma lamela.
-
Coloração da vasculatura isolada hipotônica
- Bloco da vasculatura isolada hipotônica 1 h com agitação a 100 rpm e temperatura com 500 µ l/poço de 10% de soro de burro diluído em PBS.
- Incubar durante uma noite em temperatura ambiente e agite a 100 rpm com 600 µ l/poço de 1: 100, PDGFRβ e 1: 500 NG2 anticorpos primários diluídos em soro de burro de 10% em PBS.
- Enxágue o retinal rede 3 x em PBS por 5 min e incubar em 1: 100 anti-rato Alexa Fluor 594-ligados e 1: 100 anti-coelho FITC-lig anticorpos secundários diluídos em 10% de soro de burro em PBS sacudir a 100 rpm e temperatura ambiente durante 1 h no escuro.
- Enxaguar em PBS-T por 5 min e incubar em 0,2 ng/mL DAPI em PBS-T por 15 min, seguido de lavagens de 3 x 5 min em PBS-T no escuro.
- Corte a ponta de uma pipeta Pasteur plástica, umedecê-la com PBS-T e usá-lo para transferir a rede da retina para uma lâmina de vidro de 4-poço de câmara.
Nota: A etapa de umedecimento é importante evitar a vasculatura da retina degola para dentro da pipeta de Pasteur. - Desdobre a vasculatura da retina. Evite tocar a vasculatura da retina com fórceps, pois isso pode causar a vasculatura tangle.
Nota: Desdobramento pode ser feito pela inclinação do slide de câmara e para trás ou aspiração gotas de líquido sobre a vasculatura da retina. - Remova o meio dos poços. A tensão de superfície do líquido vai achatar a vasculatura na parte inferior do slide.
- Certifique-se de desdobramento correto sob um microscópio, antes de remover o plástico poços no slide de câmara de.
- Monte da vasculatura manchada com meio de montagem antidesbotamento e uma lamela.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Os bem sucedidos protocolos fornecem três diferentes preparações da retina para a visualização de pericitos microvasculares. Cada um desses métodos usa PDGFRβ e NG2 imunorreatividade co localização e posição única de pericitos que envolvem a identificação do endotélio capilar.
Com cryo-seções, as camadas neuronais podem ser identificadas pela densidade fluorescente dos núcleos DAPI-rotulados e o interior e profunda capilares plexos contêm pericitos que exibem imunorreatividade PDGFRβ e NG2 (Figura 1). A posição única de pericitos na parede vascular pode ser vista como imunorreatividade circular ou em forma de ferradura na periferia dos vasos (Figura 1, setas) ou ocasional corta longitudinalmente vasos (Figura 1, ponta de seta).
Visualização bem sucedida dos pericitos microvasculares na preparação de toda a montagem do rato adulto pode ser um desafio14,20. Imunorreatividade PDGFRβ na retina adulta todo montado resultou apenas em um sinal muito fraco (não mostrado). NG2 coloração delineou a rede vascular interna com coloração intensa em pericitos abluminal (Figura 2).
Para obter uma visão geral da rede vascular da retina rato adulto, imuno-histoquímica da rede vascular da retina de rato isolado hipotônica fornece um método alternativo para toda a montagem. Quando realizada com sucesso, esta técnica de preparação do tecido fornece uma visão geral sobre a microvasculatura retiniana inteira incluindo plexos internos e profunda capilares. Coloração com pericytic marcadores imuno-histoquímicos resulta em toda a rede microvascular mostrando imunorreatividade NG2 com uma intensa resposta em células vasculares específicas (Figura 3). Algumas dessas células também exibem imunorreatividade PDGFRβ (Figura 3).
Um cuidado desdobramento do tecido é importante para obter uma boa visão da vasculatura da retina. Desdobramento insuficiente pode resultar na vasculatura sendo disposta em várias camadas de foco que torna fluorescente de imagem difícil (Figura 4). Desdobramento pode ser facilitada pela agitação suave, inclinando o slide de câmara e para trás ou aspiração gotas de líquido sobre a vasculatura da retina. Note-se que a anatomia dos plexos capilares da retina irá resultar em uma sobreposição dos leitos vasculares. Portanto, é problemático para distinguir o interior os mais profundos plexos capilares quando aplainado a lâmina de vidro.
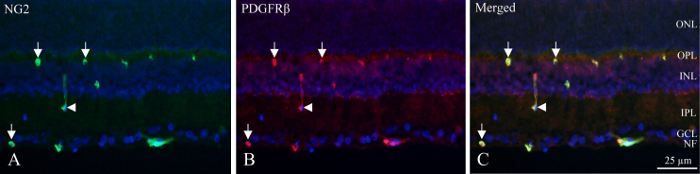
Figura 1: dupla coloração imuno-histoquímica Pericito de cryo-seção da retina interna rato. (A) NG2 (verde) imuno-histoquímica revela positivos navios dentro da parte interna da retina. As setas indicam a circular e em forma de ferradura imunorreatividade nos vasos. A seta aponta um navio cortado longitudinalmente. Imuno-histoquímica (B), PDGFRβ (vermelho) mostram reatividade semelhante a imunorreatividade NG2. Flechas e a seta apontam para as mesmas estruturas quanto à coloração de NG2. (C) a imagem mostra uma mesclagem de NG2, PDGFRβ e DAPI (azul) sobrepondo os três filtros diferentes. É revelado que os dois anticorpos são co localizados (vermelho + verde = amarelo). NF: camada de fibras nervosas, GCL: camada de células ganglionares, IPL: camada plexiforme interna, INL: camada nuclear interna, OPL: camada plexiforme externa, ONL: camada nuclear exterior. Clique aqui para ver uma versão maior desta figura.

Figura 2: coloração imuno-histoquímica Pericito da retina do rato todo montado. Imunorreatividade NG2 (vermelho) é visível ao longo do RH vascular superficial intensa coloração em pericitos abluminal. As imagens mostram mesclado NG2 e DAPI (azul). As células neuronais são visíveis como núcleos de DAPI-azul entre a microvasculatura NG2-manchado. Imunorreatividade PDGFRβ na retina adulta todo montado resultou apenas em um sinal muito fraco e, portanto, não está incluída nesta figura. Clique aqui para ver uma versão maior desta figura.

Figura 3: dupla coloração imuno-histoquímica Pericito da vasculatura da retina de rato isolado hipotônica. (A). A imagem mostra o rato isolado hipotônica rede vascular da retina immunohistochemical manchado com NG2 (verde) e PDGFRβ (vermelho). A rede completa mostrou imunorreatividade NG2. No entanto, imunorreatividade PDGFRβ foi encontrada em somas de célula. A inserção de um é uma visão geral da rede de vascularização da retina manchado com DAPI (azul). (B) a imagem mostra o mesmo espécime como (A) em um local diferente e maior ampliação. É claro que PDGFRβ coloração só é exibido em somas de célula da rede vascular indicando imunorreatividade Pericito. A inserção de B é a imagem que mostra alta ampliação da vasculatura manchado com NG2 (verde), PDGFRβ (vermelho) e fundiu-se com DAPI. Incluindo a DAPI coloração juntamente com NG2 e PDGFRβ revela três pericitos (PDGFRβ-positivo) e duas células de parede da nave não identificada. Clique aqui para ver uma versão maior desta figura.

Figura 4: exemplo de uma inadequada desdobrada hipotônica isolado da retina vasculatura. O cuidado desdobramento de uma hipotônica vasculatura isolada é importante como desdobramento insuficiente pode resultar na vasculatura sendo empilhada. As fotos mostram DAPI-manchado da vasculatura da retina no mesmo local, mas em camadas de foco diferente. (A) o DAPI-manchado de células na camada um foco mostram uma embarcação de sangue grosso aproximadamente 25 µm na vasculatura da retina. (B) o DAPI-manchado de células em uma segunda camada de foco elucidar capilares ramificação finos no mesmo local que tem sido empilhados sobre o maior vaso sanguíneo exibido em (A). Clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Apresentamos três técnicas de preparação da retina que podem ser aplicadas no estudo de pericitos da retina microvasculares. Abaixo, fornecemos uma comparação entre cada um dos métodos e destacar os passos críticos nos protocolos.
Com cryo-seccionamento, a retina é cortada em secções sagitais e, portanto, é possível obter inúmeros espécimes da retina mesma. As numerais seções resultantes deste método é fazem uma escolha ideal para a especificidade do anticorpo e testes de titulação como evita desnecessário sacrifício de animais. O trabalho preparatório é determinante para bons resultados. É crucial ao mesmo tempo dissecando o olho para não puxar o olho mas para cortar todos os músculos ao redor dos olhos. Se a força é usada, há um risco de descolamento de retina. Porque o copo do olho é fino, um não deve corrigir há muito tempo. Imersão com paraformaldeído 4% em PBS para 2 – 4 h irá corrigir o tecido. Se fixa mais, há um risco de destruir o antígeno de interesse. Para gerar o melhor possível immunostainings, é crítico para cada seção a ser tão liso quanto possível contra o vidro. Porque as seções contêm apenas alguns cortes transversais ocasionais da microvasculatura, esta técnica de preparações de tecido oferece apenas intermitente visualização da microvasculatura. Portanto, esse método não é adequado para os estudos de arquitetura em geral vascular e medidas quantificáveis de pericitos.
Vasculatura global pode ser manchada após toda a montagem para fornecer uma visão geral da vasculatura. Quando dominar essa técnica, pode ser um procedimento de preparação rápida de tecido que requer relativamente pouca carga de trabalho. No entanto, existem alguns pontos a estar particularmente atento. A retina é frágil e é fundamental para lidar com eles com cuidado e evite rasgos e cortes. Além disso, quando manusear com cuidado a retina, é de fundamental importância para evitar dobras e outras fendas durante a montagem que podem afetar a imuno-histoquímica de imagens mais tarde. A retina montada tem uma espessura de 250-300 µm e penetração de anticorpo das camadas neuronais pode ser problemática. Em relação à visualização do Pericito, a coloração de NG2 no protocolo toda a montagem só será possível com um anticorpo secundário Cy3-lig, e imunorreatividade PDGFRβ na retina adulta todo montado resultou em tal um fraco sinal que não foi demonstrado em a figura. Portanto, a utilidade da técnica de coloração de toda a montagem fortemente é dificultada pelo sucesso coloração depende principalmente aos anticorpos primários e secundários específicos usados. Mais sugestões para otimizar o protocolo para visualizado plexos microvasculares da retina rato adulto é pela incubação no anticorpo primário por um longo período de tempo e/ou mudar a temperatura de incubação26.
Devido a espessura do conjunto montado, é importante estar ciente da direção da retina depois de fazer as quatro incisões da periferia da retina, cabeça do nervo óptico para evitar montagem acidental com a retina interna que contém os capilares virados para baixo. Ainda, a visualização detalhada dos plexos microvasculares mais profundos e os pericitos pode ser problemática com este método de14,20. Como toda a montagem de coloração da retina adulta é difícil no plexo capilar mais profundo, isso pode resultar na retina avascular constam algumas partes. A coloração imuno-histoquímica de retina adulto todo montado fornece apenas uma visão fragmentada da vasculatura com pericitos forro os vasos no plexo capilar superficial e, portanto, esse método pode levar a resultados falsos negativos na visualização da vasculatura da retina de ratos.
Digestão do trypsin tem sido considerado a técnica padrão-ouro para isolamento e visualização da vasculatura da retina20. Isolamento hipotônica fornece um método alternativo para a visualização de toda rede vascular tridimensional complexo e muitos da mesma enfrenta desafios de trabalhar com tecido muito frágil, que é difícil de lidar. Devido a semelhança no produto vascular da retina, entre os dois métodos, o isolamento hipotônica enfrenta muitos dos mesmos desafios como tripsina digestão20 incluindo dissecção cuidadosa para evitar grandes lágrimas e manipulação cautelosa, evitando pipetagem e tocando com fórceps. Uma diferença importante entre os métodos é a fixação. Digestão do trypsin normalmente é feito após a fixação e pode ser aplicado com sucesso na retina preservada que foram no fixador durante vários anos20. Isolamento hipotônica é executado antes de fixação e, portanto, permite a aplicação em vários outros ensaios como descrito anteriormente na literatura23,24,25. A digestão do trypsin é realizada ao longo de dois dias20, Considerando que o isolamento hipotônica pode ser concluído dentro de horas. Além disso, o protocolo de isolamento hipotônica não inclui o risco de excesso de digestão e clivagem enzimática de marcadores de membrana necessários para reconhecimento de Pericito, por exemplo, PDGFRβ e NG2, tornando este método preferido para subsequentes microvascular coloração imuno-histoquímica.
Finalmente, embora fora do escopo imediato este manuscrito, há uma técnica menos amplamente conhecida, mas muito útil para isolar grande, intacto plexi microvascular do roedor a retina27. A retina é posicionada em uma câmara de vidro especial e lamela. Após a remoção da lamela, os restos da microvasculatura anexados a lamela para criar um totalmente vivo (≈ 98% das células) tecido impressão. A maior vantagem deste método é que permite o estudo fisiológico dos vasos e fixação posterior para immunostaining. Uma óbvia limitação do método é que ele não fornece o visualização/isolamento de toda a rede microvascular como montagem plana de retina e preparações hipotônicas. Ainda, pericitos podem ser visualizados pela aplicação do presente método27.
As técnicas de preparação de três tecido descritas aqui são complementares no sentido de que cada método compreende vantagens e deficiências para visualização de pericitos a microvascular. A avaliação de cada métodos potenciais e fraquezas é importante selecionar o método ideal para investigar os pericitos microvasculares em condições patológicas específicas. Os métodos demonstrados podem ser expandidos para coloração não só para os marcadores Pericito, mas também para a visualização de estruturas microvasculares em geral. Eventualmente, é para o pesquisador individual selecionar o método de visualização apropriada com base na hipótese de investigação em questão.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
A pesquisa foi financiada pela Fundação Lundbeck, Dinamarca.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



