Summary
एक 1, 2-dithiolane संशोधित पेप्टाइड के संश्लेषण के लिए एक प्रोटोकॉल और supramolecular पेप्टाइड स्व-विधानसभा से उत्पन्न संरचनाओं के लक्षण वर्णन.
Abstract
इस रिपोर्ट के संश्लेषण पर केंद्रित एक N-टर्मिनस 1, 2-dithiolane संशोधित स्व-कोडांतरण पेप्टाइड और जिसके परिणामस्वरूप स्वयं इकट्ठे supramolecular संरचनाओं के लक्षण वर्णन. सिंथेटिक मार्ग dithiolane अग्रदूत अणु, 3-(acetylthio)-2-(acetylthiomethyl) propanoic एसिड की पर राल युग्मन के साथ ठोस चरण पेप्टाइड संश्लेषण का लाभ लेता है, और माइक्रोवेव की सहायता से thioacetate के संरक्षण पेप्टाइड N-से पहले अंतिम दरार राल से टर्मिनस 1, 2-dithiolane संशोधित पेप्टाइड उपज । 1, 2-dithiolane पेप्टाइड के उच्च प्रदर्शन तरल क्रोमैटोग्राफी (HPLC) शुद्धि के बाद, अल्जाइमर रोग के साथ जुड़े Aβ पेप्टाइड के nucleating कोर से व्युत्पंन, पेप्टाइड को पार-β amyloid फाइबर में स्वयं इकट्ठा करने के लिए दिखाया गया है. चलत amyloid तंतुओं की विशेषता का रूपान्तर-रूपांतर इन्फ्रारेड स्पेक्ट्रोस्कोपी (एफटी-IR), परिपत्र dichroism स्पेक्ट्रोस्कोपी (सीडी) और ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी (उनि) प्रस्तुत कर रहे हैं. एक 1, 2-dithiolane moiety के साथ एन टर्मिनल संशोधन के तरीके अच्छी तरह से विशेषता स्व-कोडांतरण पेप्टाइड्स अब मॉडल सिस्टम के बाद विधानसभा संशोधन रणनीतियों और गतिशील आबंध रसायन विज्ञान का पता लगाने के विकास के रूप में पता लगाया जा सकता है supramolecular पेप्टाइड nanofiber सतहों ।
Introduction
मजबूत पेप्टाइड बांड बनाने में शामिल रसायन विज्ञान ठोस चरण पेप्टाइड संश्लेषण और अनुक्रम लंबाई और संरचना को नियंत्रित करने की क्षमता बनाने पेप्टाइड्स कि स्वयं supramolecular संरचनाओं में इकट्ठा एक भारी शोध क्षेत्र. पहलू है कि नियंत्रण और स्थिर पेप्टाइड स्व-इकट्ठे संरचनाओं, साइड चेन steric और इलेक्ट्रोस्टैटिक बातचीत, हाइड्रोजन बांड सहित, और hydrophobic प्रभाव1, डिजाइन नियमों का एक सेट के रूप में सेवा । के रूप में इन मौलिक डिजाइन नियमों में अनुसंधान के लिए जारी है प्रगति, तार्किक अगले पेप्टाइड स्व-विधानसभा में कदम पेप्टाइड की विविधता के विस्तार-संरचनाओं और कार्यों पर आधारित शामिल है । स्व-कोडांतरण पेप्टाइड्स एक बहुमुखी जैव सामग्री है कि कई बायोमेडिकल अनुप्रयोगों के लिए पेप्टाइड अनुक्रम या विधानसभा की स्थिति2,3,4, के लिए रणनीतियों के विकास ट्यूनिंग द्वारा इस्तेमाल किया गया है रहे हैं बाद विधानसभा संशोधनों के लिए पेप्टाइड nanofibers5,6,7,8,9 एक अपेक्षाकृत बेरोज़गार क्षेत्र रहता है ।
गतिशील डाइसल्फ़ाइड एक्सचेंज और supramolecular संरचनाओं की सतह पर thiol रसायन विज्ञान एक क्षेत्र है कि नए और कार्यात्मक जैव सामग्री उपज की क्षमता है । 1, 2 के शामिल-dithiolane moieties (आमतौर पर एक व्युत्पंन लाइपो एसिड (ला) या asparagusic एसिड (एए)) liposome सिस्टम में सूचित किया गया है10,11, ब्लॉक copolymers12,13, और के रूप में सतहों पर लंगर का आयोजन14,15। साथ ही, हम संश्लेषण और एक स्व-संयोजन पेप्टाइड के nucleating कोर से व्युत्पंन Aβ पेप्टाइड अल्जाइमर रोग है कि N-टर्मिनस में संशोधित किया गया है के साथ जुड़े के लक्षण वर्णन रिपोर्ट एक 1, 2-dithiolane कार्यात्मक समूह16के साथ, 17. शी. परिणामस्वरूप supramolecular फाइबर अब amyloid फाइबर18के supramolecular सतह पर डाइसल्फ़ाइड-विनिमय और thiol जेट का अध्ययन करने के लिए एक प्रयोगात्मक मंच के रूप में सेवा करते हैं ।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. संश्लेषण और 1, 2-Dithiolane संशोधित पेप्टाइड का शुद्धिकरण
- dithiolane प्रणेता, ३-(acetylthio)-२-(acetylthiomethyl) propanoic एसिड१९का संश्लेषण.
- 3 के 1 जी जोड़ें-ब्रोमो-2-(bromomethyl) propionic एसिड (1 equiv.) 1 एम NaOH की ंयूनतम राशि में भंग (लगभग 4 मिलीलीटर) के लिए एक 25 मिलीलीटर गोल नीचे प्रतिक्रिया कुप्पी ५५ डिग्री सेल्सियस पर सरगर्मी के साथ । एक सेपता और नाइट्रोजन वातावरण के तहत जगह के साथ प्रतिक्रिया कुप्पी सील ।
- एक समाधान तैयार करें जिसमें पोटेशियम thioacetate के १.४९ ग्राम (३.२ equiv.) में 4 मिलीलीटर पानी और 2 एम सल्फर एसिड (एच2इतना4) के 3 मिलीलीटर में thioacetic एसिड बनाने के लिए सीटू।
- एक प्लास्टिक डिस्पोजेबल 10 मिलीलीटर सिरिंज में thioacetic एसिड समाधान खींचो और सिरिंज पर एक सुई जगह है । सुई के साथ सेपता के माध्यम से भेदी द्वारा प्रतिक्रिया कुप्पी करने के लिए मिश्रण dropwise जोड़ें । ५५ ° c पर रात भर प्रतिक्रिया जारी रखें ।
- सिलिका जेल ६० एफ२५४ प्लेटों पर पतली परत क्रोमैटोग्राफी (टीएलसी) द्वारा प्रतिक्रिया की निगरानी मेथनॉल और dichloromethane (1:9) के मिश्रण का उपयोग कर । bromocresol हरी दाग द्वारा प्रतिक्रिया प्रगति कल्पना । उत्पाद एक Rf = ०.५७ है ।
- के बाद प्रतिक्रिया पूर्ण और कमरे के तापमान को ठंडा है, मिश्रण acidify 2 एम एच2के साथ पीएच 1 तो4। एक पीला तेल समाधान से बाहर अलग ।
- कोल्ड क्लोरोफॉर्म (४० एमएल एक्स 3) के साथ उत्पाद निकालें । कार्बनिक परतों का मिश्रण है और मैग्नीशियम सल्फेट पर सूखी । कम दबाव के तहत क्लोरोफॉर्म निकालें ।
- पृथक उत्पाद की पहचान की पुष्टि करें, 1, परमाणु चुंबकीय अनुनाद द्वारा (एनएमआर) स्पेक्ट्रोस्कोपी के रूप में आंकड़े 1b और सीमें दिखाया गया है । निम्नलिखित परिणामों की अपेक्षा: 1h एनएमआर, CDCl3, ३०० MHz: d = १०.१ (b, 1 h), ३.२ (m, 4 h), २.९ (एम, 1 एच), २.४ (एस, 6 एच); 13 c एनएमआर, CDCl3, ७५ MHz: d = १९५.१ (CH3cOS-), १७७.६ (-cऊह), ४५.१ (-सीएच2एस-), ३०.५ (सीएच), २९.२ (-एससीओसीएच3).
नोट: उत्पाद एक पीला तेल है और ८३% की एक समग्र उपज है । आगे की शुद्धि के बिना उत्पाद का उपयोग करें ।
- SPPS और पर राल युग्मन Dithiolane के प्रणेता
नोट: ठोस चरण पेप्टाइड संश्लेषण नीचे वर्णित एक स्वचालित पेप्टाइड सिंथेसाइज़र पर आयोजित किया गया था, अनुशंसित निर्माता के प्रोटोकॉल का पालन. सेटिंग्स और एजेंट अंय वाणिज्यिक उपकरणों के लिए अनुकूलित किया जा सकता है या जब विशेष अमीनो एसिड का उपयोग कर ।- 4-methylbenzhydrylamine (मभा) राल (०.१ mmol) और एक प्रतिक्रिया पोत में जगह के बीच रिंक के ०.१५६ जी बाहर वजन । dimethylformamide में राल प्रफुल्लित करना (DMF) संश्लेषण की शुरुआत करने के लिए पहले से कम 15 मिनट के लिए.
- प्रत्येक fluorenylmethyloxycarbonyl के 4 समकक्ष बाहर वजन (Fmoc) परिक्रमा में संरक्षित अमीनो अम्ल (०.४ mmol) और एन, एन,एन के ०.१५२ g, n ', n '-tetramethyl-O-(1एच-benotriazol-1-yl) यूरेनियम hexafluorophosphate (०.४ mmol, HBTU) के लिए अनुक्रम में प्रत्येक एमिनो एसिड । प्रत्येक कारतूस Fmoc-संरक्षित एमिनो एसिड और HBTU दोनों शामिल हैं ।
- सिंथेसाइज़र पर सभी पूर्व संश्लेषण की जाँच चल रहा है के बाद (रिएजेंट फिर से भरना, flushed एजेंट लाइनों और सभी एजेंट बोतलों दबाव), हिंडोला में ' सी ' एन में अमीनो एसिड कारतूस जगह टर्मिनस दिशा । अंतिम एन के लिए अंतिम एमिनो एसिड की स्थिति के बाद एक खाली कारतूस प्लेस-टर्मिनल Fmoc संरक्षण कदम ।
- मानक की सिफारिश की सेटिंग्स का उपयोग पेप्टाइड संश्लेषित ।
- DMF में 20% piperidine की 5 मिलीलीटर (5 मिनट x 2) के साथ राल से Fmoc समूह को बचाना ।
- DMF के साथ राल धो (6 एक्स 5 एमएल) युग्मन कदम से पहले ।
- एक एकल युग्मन कदम के लिए, DMF में ०.४ एम एन-methylmorpholine के 4 मिलीलीटर Fmoc-संरक्षित एमिनो एसिड और HBTU के लिए जोड़ें । प्रतिक्रिया पोत के समाधान के हस्तांतरण से पहले 30 एस के लिए Fmoc-संरक्षित एमिनो एसिड समाधान सक्रिय करें ।
नोट: स्वचालित पेप्टाइड सिंथेसाइज़र bubbling N2 गैस हर 30 एस 20 मिनट के लिए द्वारा राल और समाधान घोला जा सकता है जबकि युग्मन प्रतिक्रिया स्थानों लेता है । मैनुअल पेप्टाइड संश्लेषण के लिए, युग्मन कदम की अवधि के लिए कम गति पर एक कक्षीय शेखर पर प्रतिक्रिया पोत जगह है । - समाधान नाली और DMF (3 एक्स 5 एमएल) के साथ राल धो लो ।
- ' C ' में प्रत्येक Fmoc-रक्षित अमीनो अम्ल के लिए 1.2.4.4 के माध्यम से 1.2.4.1 चरणों को दोहराएँ-ब्याज की पेप्टाइड को संश्लेषित करने के लिए N'-टर्मिनस दिशा.
- अंतिम एन टर्मिनल संरक्षण कदम के बाद, एक डिस्पोजेबल fritted सिरिंज में राल हस्तांतरण. DMF (3 x 5 एमएल) और dichloromethane (डीसीएम, 3 एक्स 5 एमएल) के साथ राल धो लो ।
नोट: एक वैक्यूम desiccator में डीसीएम धोने के बाद राल को संग्रहित किया जा सकता है । यदि राल युग्मन के लिए पिछले संग्रहीत किया गया था, युग्मन प्रतिक्रिया से पहले DMF में राल प्रफुल्लित करने के लिए सुनिश्चित करें । - दंपति ने dithiolane के प्रणेता (1) को एन-टर्मिनस को 1, DMF के 5 मिलीलीटर, HBTU के 4 समकक्ष और एन के 10 समकक्ष, एन-diisopropylethylamine (DIPEA) के 4 समकक्ष जोड़कर ऑन-राल पेप्टाइड का दर्जा । पूर्व fritted सिरिंज युक्त राल को जोड़ने से पहले 10 मिनट के लिए युग्मन मिश्रण को सक्रिय करें.
- 2 एच के लिए युग्मन प्रतिक्रिया हिला । 2 घंटे के बाद, DMF (3 एक्स 5 एमएल) के साथ राल धो और रात भर मिलाने के साथ युग्मन प्रतिक्रिया दोहराना ।
- दूसरा युग्मन के बाद, DMF (3 एक्स 5 एमएल) और डीसीएम (3 एक्स 5 एमएल) के साथ राल धो लो ।
नोट: राल दरार तक शूंय के तहत इस बिंदु पर संग्रहीत किया जा सकता है ।
- Thioacetate संरक्षण और पेप्टाइड दरार से राल
- N-टर्मिनस dithiolane प्रणेता से thioacetate समूह को बचाने के लिए, एक 10 मिलीलीटर माइक्रोवेव प्रतिक्रिया ट्यूब करने के लिए सूखे राल हस्तांतरण और DMF के 2 मिलीलीटर जोड़ें । प्रफुल्लित करने के लिए राल की अनुमति दें, पोत को एक छोटे चुंबकीय हलचल बार जोड़ने के लिए, और फिर से 15 मिनट के लिए चुंबकीय सरगर्मी की एक कम गति के साथ निलंबित ।
- केंद्रित अमोनियम हीड्राकसीड के 2 मिलीलीटर जोड़ें, सिलिकॉन सेपता के साथ रिएक्शन पोत टोपी, और एक माइक्रोवेव रिएक्टर में प्रतिक्रिया पोत ७५ डिग्री सेल्सियस की माइक्रोवेव सेटिंग्स का उपयोग करने के लिए सरगर्मी के साथ ४५ मिनट के लिए जगह है ।
- माइक्रोवेव प्रतिक्रिया के बाद पूरा हो गया है, एक साफ डिस्पोजेबल fritted सिरिंज में राल हस्तांतरण । DMF (2 x 5 एमएल) और मेथनॉल (MeOH, 2 x 5 एमएल) के साथ धो लें ।
- 5 मिलीलीटर की कुल मात्रा के लिए मेथनॉल (1:4) में केंद्रित अमोनियम हीड्राकसीड का एक समाधान जोड़ें । dithiolane रिंग में डाइसल्फ़ाइड बॉन्ड के intramolecular ऑक्सीकरण को बढ़ाने के लिए रात भर शेक छोड़ें ।
- MeOH (2 x 5 एमएल) और डीसीएम (3 x 5 एमएल) के साथ राल धो लो ।
नोट: सूखे राल इस बिंदु पर एक वैक्यूम desiccator में संग्रहीत किया जा सकता है । - धीरे १.५ एच के लिए मिलाने के साथ सिरिंज युक्त राल के लिए दरार कॉकटेल जोड़ें इस क्लीवेज कॉकटेल का इस्तेमाल ९५% trifluoroacetic एसिड (TFA), २.५% triisopropylsilane (TIPS), और २.५% पानी की कुल मात्रा में 5 एमएल का होता है ।
चेतावनी: केवल रासायनिक धुएं हुड के तहत काम करते हैं । TFA अस्थिर और संक्षारक है ।
नोट: पेप्टाइड अनुक्रम और एमिनो एसिड sidechain की रक्षा समूहों के बहुमत के लिए, ऊपर दरार कॉकटेल समाधान पर्याप्त है; हालांकि, वैकल्पिक दरार कॉकटेल कुछ एमिनो एसिड पक्ष श्रृंखला (विशेष Cys युक्त पेप्टाइड्स में, मिले, टीआरपी और Arg) या अंय राल रसायन विज्ञान20की रक्षा के लिए आवश्यक हो सकता है । - fritted सिरिंज से dropwise अलावा द्वारा एक ५० मिलीलीटर शंकु ट्यूब में ठंड diethyl ईथर के 25 मिलीलीटर में क्रूड पेप्टाइड हाला । पेप्टाइड के रूप में एक सफेद ठोस हाला । 10 मिनट के लिए १३०० x g पर केंद्रापसारक द्वारा पेप्टाइड गोली. ध्यान से अपशिष्ट संग्रह के लिए एक अलग कंटेनर में diethyl ईथर की खिचड़ी भाषा ।
- शंकु ट्यूब करने के लिए diethyl ईथर के एक और 25 मिलीलीटर जोड़ें और भंवर द्वारा फिर से वेग से निलंबित । 10 मिनट के लिए १३०० x g पर केंद्रापसारक को दोहराने और diethyl ईथर फिर से खिचड़ी भाषा । वैक्यूम के तहत गोली सूखी ।
- 1, 2-Dithiolane संशोधित पेप्टाइड का शुद्धिकरण
नोट: रिवर्स चरण-HPLC द्वारा कच्चे पेप्टाइड शुद्ध । लीजिए और पेप्टाइड चोटियों गठबंधन और मालदी द्वारा जन की पुष्टि-तोफ मास स्पेक्ट्रोमेट्री.- ०.१% TFA के साथ acetonitrile की ंयूनतम राशि में कच्चे पेप्टाइड गोली भंग । पेप्टाइड की hydrophobicity और एकत्रीकरण प्रवृत्ति के कारण, धीरे घुलनशीलता में सहायता करने के लिए ४० डिग्री सेल्सियस पर नमूना गर्मी.
नोट: उच्च तापमान और sonication के क्रम में संभावित डाइसल्फ़ाइड विनिमय प्रतिक्रियाओं को रोकने के लिए से बचें21,22,23। - HPLC शुद्धि के लिए क्रूड पेप्टाइड की 1 मिलीलीटर तैयार करने के लिए, acetonitrile में केंद्रित पेप्टाइड स्टॉक के ४०० μL जोड़ें ०.१% TFA के साथ एच2ओ के ६०० μL और एक HPLC शीशी में एक 22 माइक्रोन सिरिंज फिल्टर के माध्यम से फिल्टर. एक अतिरिक्त 5% isopropanol पेप्टाइड एकत्रीकरण और वर्षा को रोकने के लिए जोड़ा जा सकता है ।
- 3 मिलीलीटर की एक प्रवाह दर के साथ सी-18 अर्द्ध preparative कॉलम का उपयोग कर पेप्टाइड शुद्ध/20 मिनट में 15-55% acetonitrile का एक रैखिक ढाल पर यूवी डिटेक्टरों सेट २२२ एनएम (रीढ़ के बीच) और ३३० एनएम (डाइसल्फ़ाइड बांड) के लिए । लीजिए और ब्याज की चोटियों (चित्रा 2a) गठबंधन ।
- reflectron मोड (चित्रा बी) में मालदी-तोफ मास स्पेक्ट्रोमीटर द्वारा पेप्टाइड उत्पाद द्रव्यमान की पुष्टि करें । विश्लेषण के लिए, मालदी प्लेट पर एकत्र पीक के ०.५ μL को ०.५ μL के साथ 2, 5-dihydroxybenzoic एसिड (DHB) मैट्रिक्स (10 mg/एमएल DHB में ५०% acetonitrile, ०.१% TFA) के साथ मिलाएं ।
नोट: मालदी-तोफ मास स्पेक्ट्रोमेट्री में आम adducts सोडियम और पोटेशियम नमक adduct ([एम + ना]+ और [एम + कश्मीर]+) चोटियों शामिल हैं । नमूना विश्लेषण करने से पहले लवण की सिफारिश की है, तो नमक adduct चोटियों मुख्य [एम + एच] के संकेत को दबाने+ पीक । इसके अतिरिक्त, [एम + ओ]+ का एक ऑक्सीकरण पीक भी 1, 2-dithiolane संशोधित पेप्टाइड में पाया जाता है । लेजर पर एक रिपोर्ट मालदी ionization से प्रेरित ऑक्सीकरण DHB मैट्रिक्स का उपयोग कर पता चलता है कि नमूना एकाग्रता, विलायक सहित कारकों, और लेजर तीव्रता के लिए मालदी प्रेरित ऑक्सीकरण विरूपण साक्ष्य24सीमा संशोधित किया जा सकता है । - सही द्रव्यमान की मालदी-तोफ पुष्टिकरण करने के बाद, lyophilize को फ्लैश जमने के बाद पेप्टाइड का यूज करें । lyophilized पेप्टाइड पाउडर वैक्यूम के तहत विधानसभा तक रखें ।
- ०.१% TFA के साथ acetonitrile की ंयूनतम राशि में कच्चे पेप्टाइड गोली भंग । पेप्टाइड की hydrophobicity और एकत्रीकरण प्रवृत्ति के कारण, धीरे घुलनशीलता में सहायता करने के लिए ४० डिग्री सेल्सियस पर नमूना गर्मी.
2. Supramolecular स्व-विधानसभा संरचनाओं के लक्षण वर्णन
-
Amyloid फाइबर का गठन
- आत्म-विधानसभा समाधान तैयार करने के लिए, एक विश्लेषणात्मक संतुलन का उपयोग कर 1 मिलीग्राम पेप्टाइड पाउडर का वजन । एक मिश्रण में भंग (पीएच ७.५) 20% acetonitrile और 10 मिमी (4-(2-hydroxyethyl) -1-piperazineethanesulfonic एसिड (HEPES) एक १.५ मिलीलीटर microcentrifuge ट्यूब में, 1 मिलीग्राम/एमएल पेप्टाइड विधानसभा मिश्रण की एक अंतिम एकाग्रता के लिए । भंवर विधानसभा समाधान और कमरे के तापमान पर इकट्ठा करने के लिए छोड़ दें ।
-
Amyloid फाइबर का स्पेक्ट्रोस्कोपी लक्षण वर्णन
- रूपान्तर के माध्यम से पेप्टाइड विधानसभा प्रक्रिया का पालन करें-बदलना इंफ्रारेड (स्विचेज) स्पेक्ट्रोस्कोपी हर कुछ दिनों । १६७० cm-1 के आसपास केंद्रित एक व्यापक पीक नमूना17में जुदा पेप्टाइड्स से उत्पन्न होने वाली IR हस्ताक्षर है । पेप्टाइड विधानसभा नमूने आमतौर पर व्यापक जुदा पीक के लिए एक से दो सप्ताह के लिए गायब हो जाते हैं और परिपक्वता तक पहुँचने ।
- सूखी एक aliquot के 8-10 μL के विधानसभा समाधान एटीआर डायमंड क्रिस्टल पर एक पतली फिल्म के रूप में । सूखी फिल्म रूपों के रूप में १६४० से १६३० सेमी-1 से एक बड़े और व्यापक जल पीक के गायब होने की निगरानी ।
- एक 2 सेमी-1 संकल्प के साथ 1500-1800 सेमी-1 औसत ५० स्कैन से आईआर स्पेक्ट्रा प्राप्त । प्रत्येक नमूना स्कैन करने से पहले पृष्ठभूमि स्कैन प्राप्त करें और घटाएं । β-पत्रक असेंबली के लिए IR हस्ताक्षर १६२५ और १६३५ cm-1 (चित्रा 3ए)25,26के बीच एक तेज चोटी है ।
- dichroism (सीडी) द्वारा β-पत्रक रिच supramolecular संरचनाओं में पेप्टाइड असेंबली की विशेषता है । एक Peltier तापमान नियंत्रण प्रणाली के साथ एक सीडी spectropolarimeter का उपयोग कर स्पेक्ट्रा रिकॉर्ड.
- पिपेट ०.१ मिमी पथ लंबाई microcuvette में विधानसभा समाधान के 30 μL ।
नोट: एक सेल धारक को दबाना और साधन में छोटे पथ लंबाई सेल की स्थिति की जरूरत है । - प्रत्येक स्पेक्ट्रम के लिए, निम्नलिखित मापदंडों के लिए सीडी साधन सेट: १८० एनएम के लिए ३०० एनएम के तरंग दैर्ध्य स्कैनिंग, 100/मिनट, 1 एनएम, 25 डिग्री सेल्सियस, तीन स्कैन के औसत के बैंड की चौड़ाई की दर स्कैनिंग ।
- बफर (20% acetonitrile/10 मिमी HEPES, पीएच ७.५) की एक स्पेक्ट्रम ले लीजिए और एक नियंत्रण के रूप में प्रत्येक नमूना स्कैन से घटाना. β-पत्रकों के लिए CD हस्ताक्षर एक ellipticity न्यूनतम २२० एनएम (चित्र बी)27के आसपास केंद्रित है ।
- पिपेट ०.१ मिमी पथ लंबाई microcuvette में विधानसभा समाधान के 30 μL ।
- रूपान्तर के माध्यम से पेप्टाइड विधानसभा प्रक्रिया का पालन करें-बदलना इंफ्रारेड (स्विचेज) स्पेक्ट्रोस्कोपी हर कुछ दिनों । १६७० cm-1 के आसपास केंद्रित एक व्यापक पीक नमूना17में जुदा पेप्टाइड्स से उत्पन्न होने वाली IR हस्ताक्षर है । पेप्टाइड विधानसभा नमूने आमतौर पर व्यापक जुदा पीक के लिए एक से दो सप्ताह के लिए गायब हो जाते हैं और परिपक्वता तक पहुँचने ।
-
Amyloid फाइबर की माइक्रोस्कोपी
- दो से तीन सप्ताह की अनुमति के लिए पेप्टाइड नमूने β-शीट रिच supramolecular संरचनाओं में परिपक्व करने के लिए ।
नोट: असेंबली असेंबली प्रक्रिया के पहले चरण में ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी (उनि) का उपयोग कर के रूप में अच्छी तरह से imaged किया जा सकता है ।- पिपेट 10 μL की सतह पर पेप्टाइड विधानसभा समाधान के उनि कार्बन ग्रिड ।
नोट: ध्यान रखना ग्रिड की सतह के लिए पिपेट टिप को छूने के लिए नहीं । तैयारी के दौरान उनि ग्रिड को पकड़ने के लिए उच्च परिशुद्धता, आत्म-समापन चिमटी का प्रयोग किया जाता है । - 1-2 मिनट प्रतीक्षा करें असेंबली ग्रिड सतह पर adsorb करने के लिए अनुमति दें करने के लिए । ग्रिड के किनारे पर फ़िल्टर काग़ज़ को स्पर्श करके अतिरिक्त नमूना निकालें ।
- एक 2% uranyl एसीटेट दाग को व्यावसायिक रूप से उपलब्ध 4% uranyl एसीटेट समाधान के लिए १०० μL को जोड़कर तैयार करें । पिपेट 2% uranyl एसीटेट के 10 μL ग्रिड सतह और 2-3 मिनट के लिए मशीन पर दाग । मशीन के बाद, ग्रिड के किनारे करने के लिए फिल्टर कागज को छूने से अतिरिक्त दाग हटा दें ।
- एक वैक्यूम desiccator में रात भर उनि ग्रिड प्लेस । इमेजिंग जब तक वैक्यूम के तहत स्टोर ।
- उनि (चित्रा 3सी) के साथ तैयार नमूनों छवि. माइक्रोस्कोपी के लिए विशिष्ट मापदंडों के रूप में इस प्रकार हैं: 9, 300X से 23, 000X, १२० केवी के एक त्वरित वोल्टेज के साथ टंगस्टन रेशा से लेकर आवर्धन पर छवियां ।
नोट: ImageJ का अधिग्रहण किया उनि छवियों के supramolecular संरचनाओं के औसत फाइबर चौड़ाई को मापने के लिए इस्तेमाल किया जा सकता28.
सावधानी: उपयोग से पहले सभी प्रासंगिक सुरक्षा डेटा पत्रक (एसडीएस) से परामर्श करें । संश्लेषण में प्रयुक्त कई रसायनों, शुद्धि, और वर्णन 1, 2-dithiolane संशोधित स्व-कोडांतरण पेप्टाइड्स संक्षारक या विषाक्त और केवल एक रासायनिक धुएं हुड के तहत इस्तेमाल किया जाना चाहिए के लक्षण वर्णन । प्रयोगशाला में काम करते समय हमेशा उचित व्यक्तिगत सुरक्षात्मक उपकरणों (सुरक्षा चश्मे, लैब कोट, पूर्ण लंबाई पैंट, बंद पैर के जूते सहित) का उपयोग करें ।
- पिपेट 10 μL की सतह पर पेप्टाइड विधानसभा समाधान के उनि कार्बन ग्रिड ।
- दो से तीन सप्ताह की अनुमति के लिए पेप्टाइड नमूने β-शीट रिच supramolecular संरचनाओं में परिपक्व करने के लिए ।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
dithiolane अग्रदूत अणु के प्रारंभिक एक कदम संश्लेषण के अलावा, 1, 2-dithiolane संशोधित पेप्टाइड संश्लेषण के बाकी ठोस समर्थन (चित्र 1a) पर होता है । 3-ब्रोमो-2-(bromomethyl) propionic एसिड से 3-(acetylthio)-2-(acetylthiomethyl) propanoic एसिड के रूपांतरण, dithiolane प्रणेता, 1एच और 13सी एनएमआर (चित्रा 1b और सी) से पहले यह मुक्त करने के लिए युग्मित है की पुष्टि की है N-एक पेप्टाइड के अभी भी पर राल-टर्मिनस अमीन । अमोनियम हीड्राकसीड के साथ thiols करने के लिए thioacetate के संरक्षण एक माइक्रोवेव रिएक्टर का उपयोग किया जाता है और 1, 2 dithiolane मेथनॉल में रातोंरात ऑक्सीकरण हो जाता है 1, 2-dithiolane संशोधित पेप्टाइड राल से सट गया है । कच्चे पेप्टाइड रिवर्स चरण HPLC द्वारा शुद्ध है (चित्रा 2a) और उत्पाद के द्रव्यमान मालदी द्वारा पुष्टि की है-तोफ मास स्पेक्ट्रोमेट्री (चित्रा बीए) ।
1 शुद्ध, 2-dithiolane पेप्टाइड स्वयं एक 2-3 सप्ताह की अवधि में परिपक्व amyloid फाइबर में इकट्ठे । FT-IR (चित्रा 3ए) और सीडी स्पेक्ट्रोस्कोपी (चित्र बी) के लिए विधानसभा की प्रक्रिया का पालन करें और विस्तारित β-पत्र अनुरूप की विशेषता के लिए उपयोग किया जाता है । तंतुओं (चित्रा 3सी) उनि द्वारा imaged कर रहे हैं ।
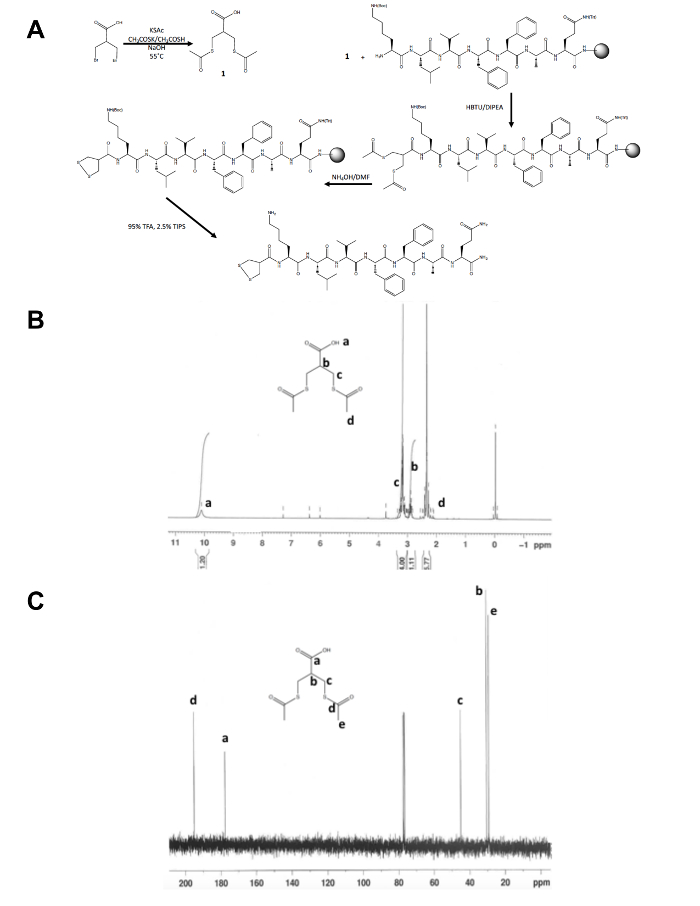
चित्र 1. 1, 2-dithiolane अग्रदूत अणु के लक्षण वर्णन के लिए सिंथेटिक योजना । (क) अंतिम १ की सिंथेटिक योजना, २-dithiolane संशोधित पेप्टाइड, १, २-dithiolane-KLVFFAQ-एनएच२. (ख) १ज-एनएमआर ३-(acetylthio)-२-(acetylthiomethyl) propanoic एसिड CDCl३ में ३०० मेगाहर्ट्ज. (ग)१३सी-एनएमआर ३-(acetylthio)-२-(acetylthiomethyl) propanoic एसिड में CDCl३ बजे ७५ mhz. कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण देखने के लिए ।

चित्र 2. 1, 2 के संश्लेषण-dithiolane संशोधित पेप्टाइड. (क) HPLC वर्णलेख की शुद्धि से १, २-dithiolane-KLVFFAQ-एनएच२. (ख) मालदी-HPLC शुद्धि से मुख्य शिखर की तोफ जन स्पेक्ट्रम (~ १७.५ मिनट का अवधारण समय) DHB मैट्रिक्स का उपयोग reflectron मोड में 1, 2-dithiolane-KLVFFAQ-NH2की गणना द्रव्यमान की पुष्टि करता है. आम adducts भी पहचाने जाते हैं । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्र 3. Supramolecular 1, 2 के लक्षण वर्णन-dithiolane संशोधित पेप्टाइड । (A) FT-IR के 1 मिलीग्राम/एमएल 1, 2-dithiolane-KLVFFAQ-NH2 10 मिमी HEPES में इकट्ठे फाइबर, पीएच ७.५ 20% CH3CN में । १६२७ सेमी-1 पर चोटी एक β-पत्रक अनुरूप में इकट्ठे पेप्टाइड्स के साथ संगत है । (ख) की सीडी 1 मिलीग्राम/एमएल 1, 2-dithiolane-KLVFFAQ-NH2 फाइबर में इकट्ठे 10 मिमी HEPES, पीएच ७.५ में 20% CH3CN. २१८ एनएम पर ellipticity ंयूनतम एक β-पत्रक अनुरूप में इकट्ठे पेप्टाइड्स के अनुरूप है । (ग) की छवि 1, 2-dithiolane-KLVFFAQ-एनएच2 amyloid फाइबर (2% uranyl एसीटेट के नकारात्मक दाग) उनि द्वारा । स्केल बार १०० एनएम है । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
यह आलेख दोनों संश्लेषण और एक एन के शुद्धि-टर्मिनल 1, 2-dithiolane संशोधित आत्म कोडांतरण पेप्टाइड और परिणामी supramolecular संरचनाओं के लक्षण वर्णन के विवरण पर चर्चा की । 1, 2-dithiolane पेप्टाइड के संश्लेषण यहां की रिपोर्ट dithiolane अग्रदूत, 3-(acetylthio)-2-(acetylthiomethyl) propanoic एसिड का उत्पादन करने के लिए एक कदम संश्लेषण सहित फायदे हैं, और पर-राल माइक्रोवेव के संरक्षण की प्रतिक्रिया अग्रदूत thioacetate की रक्षा समूह ऑक्सीकरण 1, 2-dithiolane moiety विषाक्त hydrazine संरक्षण के लिए एक सुरक्षित विकल्प के रूप में अमोनियम हीड्राकसीड का उपयोग उपज के लिए पहले29की सूचना दी । समग्र ठोस चरण पेप्टाइड का संश्लेषण 1, 2-dithiolane पेप्टाइड (आंकड़ा 1a) आसानी से अनुक्रम लंबाई और संरचना को बदलने के द्वारा संशोधित किया जा सकता, Fmoc-संरक्षित अप्राकृतिक अमीनो एसिड का उपयोग कर सहित, और सी टर्मिनल राल रसायन सूट करने के लिए कई विभिंन अनुसंधान अनुप्रयोगों ।
आदेश में से अवांछित पेप्टाइड को रोकने के लिए-उत्पादों जब nucleophilic पक्ष चेन या समूहों की रक्षा के साथ एमिनो एसिड के साथ एमिनो एसिड प्रतिक्रियाशील दरार उत्पादों है, अतिरिक्त मेहतरों दरार कॉकटेल20में जोड़ा जाना चाहिए । एक छोटे से भाग के एक परीक्षण दरार (कुल राल का कम 10% से) से पहले प्रदर्शन किया जा सकता है पर राल माइक्रोवेव संरक्षण कदम युग्मन प्रतिक्रिया की एक उच्च उपज सुनिश्चित करने के लिए । रिपोर्ट में वर्णित कॉलम और HPLC स्थितियों का उपयोग करते हुए, thioacetate संरक्षित 1, 2-dithiolane के प्रणेता पेप्टाइड पीक elutes 5 मिनट के बाद युगल मुक्त अमीन पेप्टाइड. यदि मुक्त अमीन पेप्टाइड की एक महत्वपूर्ण राशि रहती है, 3 के साथ एक और युग्मन कदम-(acetylthio)-2-(acetylthiomethyl) propanoic एसिड की सिफारिश की है । ३३० एनएम पर कमजोर डाइसल्फ़ाइड बॉन्ड सोखने की मॉनीटरिंग करके intramolecular 1, 2-dithiolane डाइसल्फ़ाइड बॉन्ड का HPLC पर पता लगाया है । HPLC चोटी के ऑक्सीकरण 1, 2-dithiolane के लिए इसी १०० mM tris (2-carboxyethyl) phosphine (TCEP) के १०० एल जोड़ने के द्वारा पुष्टि की है एक पेप्टाइड नमूना एक अलग HPLC चलाने में । पेप्टाइड युक्त TCEP कम thiol ऑक्सीकरण डाइसल्फ़ाइड पेप्टाइड की तुलना में एक अलग अवधारण समय होगा । thiol युक्त पेप्टाइड elutes लगभग 1 मिनट बाद में कॉलम और रिपोर्ट में वर्णित शर्तों का उपयोग कर डाइसल्फ़ाइड पेप्टाइड से । पेप्टाइड्स के लिए एक उपयुक्त वैकल्पिक मालदी मैट्रिक्स α-cyano-4-hydroxycinnamic एसिड (CHCA) है और acetonitrile के 5 मिलीग्राम के लिए ०.१% TFA के साथ ५०% CHCA की 1 मिलीलीटर जोड़कर तैयार किया जाता है । नमूनों को एक C18 ज़िप-टिप का उपयोग कर मालदी-तोफ मास विश्लेषण से पहले किया जा सकता है यदि नमक adduct (Na+ और K+) चोटियों काफी [M + H]+ पीक को दबा ।
पेप्टाइड अनुक्रम इन अध्ययनों के लिए चुना Aβ के डच उत्परिवर्ती से व्युत्पंन है अल्जाइमर रोग के साथ जुड़े पेप्टाइड30, और पहले स्वयं को दिखाया गया है-समानांतर β के amyloid फाइबर में इकट्ठा-चादरें16,17 . के रूप में प्रतिनिधि परिणामों में दिखाया गया है, चित्र 3ए-सी, 1, 2-dithiolane-KLVFFAQ-NH2 पेप्टाइड भी amyloid फाइबर में इकट्ठे । स्विचेज के बीच मैं 1627cm पर केंद्रित खिंचाव-1 और सीडी ellipticity ंयूनतम पर २१८ एनएम स्पेक्ट्रोस्कोपी हस्ताक्षर कर रहे है β-पत्र विधानसभाओं25,26,27, और carbonyl सह खिंचाव पर १६७६ cm-1 आदेश दिया glutamine पक्ष श्रृंखला बातचीत करने के लिए संगत सुझाव है कि पेप्टाइड्स समानांतर में आयोजित कर रहे हैं β-किस्में16,31,३२.
संचरण इलेक्ट्रॉन माइक्रोस्कोपी छवियों, 2% uranyl एसीटेट नकारात्मक दाग का उपयोग कर, शो विस्तारित और घुमा supramolecular फाइबर कि लगभग 10 एनएम चौड़ाई में हैं । एन टर्मिनल acetylated पेप्टाइड, एसी-KLVFFAQ-एनएच2के तंतुओं, चिकनी और सीधे कर रहे हैं, लगभग 12 एनएम16की एक थोड़ी बड़ी चौड़ाई के साथ । के बाद से उनि ग्रिड की तैयारी और छवियों को प्राप्त करने के एक समय गहन प्रक्रिया है, यह सबसे अच्छा है एक ही विधानसभा नमूना से कई उनि ग्रिड तैयार करने के लिए अलग पेप्टाइड सांद्रता के एक बार । मूल असेंबली समाधान नमूना के साथ उनि (1:50 या 1:100) के लिए एक पतला नमूना तैयार करें । उच्च सांद्रता पर amyloid तंतुओं का झुरमुट या पैच में ग्रिड का पालन कर सकते हैं और व्यक्तिगत तंतुओं की छवियों को प्राप्त करना मुश्किल हो सकता है. यह चौड़ाई माप और फाइबर helicity के दृश्य के लिए व्यक्तिगत तंतुओं के किनारों अक्सर भीड़ के नमूनों से छिप जाता है देखने के लिए महत्वपूर्ण है ।
के रूप में और अधिक अनुप्रयोगों का उपयोग supramolecular का पता लगाया जा रहा है, वहां के लिए संभावित प्रतिक्रियाशील कार्यात्मक समूहों है कि स्वयं में विधानसभा प्रक्रिया को ओर्थोगोनल रहे है एकीकृत मोनोमर कोडांतरण की जरूरत है । इस रिपोर्ट में वर्णित विधियों में से एक 1, 2-dithiolane संशोधित आत्म संयोजन पेप्टाइड और supramolecular संरचनाओं के स्पेक्ट्रोस्कोपी लक्षण वर्णन के संश्लेषण के लिए एक पर राल दृष्टिकोण पर प्रकाश डाला ।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों का खुलासा करने के लिए कुछ नहीं है ।
Acknowledgments
लेखक उसे तकनीकी प्रशिक्षण के लिए Dr. B. एलेन Scanley शुक्रिया अदा करना चाहूंगा और कनेक्टिकट राज्य के कॉलेजों और विश्वविद्यालय (CSCU) नैनो के लिए केंद्र और डॉ इशिता Mukerji Wesleyan विश्वविद्यालय में उसकी सीडी का उपयोग करने के लिए में उनि का उपयोग करने में मदद spectrophotometer । काम की रिपोर्ट Fairfield विश्वविद्यालय में विज्ञान संस्थान द्वारा समर्थित भाग में था, नासा कनेक्टिकट स्पेस ग्रांट कंसोर्टियम, और राष्ट्रीय विज्ञान फाउंडेशन द्वारा अनुदान नंबर चे-१६२४७७४ के तहत ।
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



