Summary
Протокол для синтеза 1,2-dithiolane изменение пептида и характеристика супрамолекулярные структуры пептида в результате самостоятельной сборки.
Abstract
Этот доклад фокусируется на синтез N-конечная 1,2-dithiolane изменение самостоятельной сборки пептида и характеристика в результате самостоятельного собрал супрамолекулярные структуры. Синтетические маршрут использует твердофазный пептидного синтеза с муфтой на смолы dithiolane прекурсоров молекулы, 3-(acetylthio) -2-(acetylthiomethyl) Пропионовая кислота и при содействии микроволновой thioacetate deprotection пептида N-конечная остановка перед окончательной расщепления из смолы приносить 1,2-dithiolane изменение пептид. После очистки высокой производительности жидкостной хроматографии (ВЭЖХ) 1,2-dithiolane пептид, производные от затравок ядро пептид значения, связанные с болезнью Альцгеймера пептид показано самостоятельно собрать кросс β волокон амилоида. Представлены протоколы характеризовать волокон амилоида Фурье ИК-спектроскопии (FT-IR), циркуляр дихроизма спектроскопии (CD) и просвечивающей электронной микроскопии (ТЕА). Методы изменения N-терминала с 1,2-dithiolane группу хорошо изученных самостоятельной сборки пептиды теперь могут быть изучены как модель системы для разработки стратегий пост Ассамблеи модификации и изучения динамических ковалентных химии на супрамолекулярная пептид нановолокно поверхности.
Introduction
Надежные пептид Бонд, образуя химии участвует в пептидной Твердофазный синтез и способность контролировать длину последовательности и сделать пептидов, которые самостоятельно собрать в супрамолекулярные структуры сильно исследуемой области. Факторы, которые контролируют и стабилизировать пептид собственн-собранные структур, включая боковой цепи их пространственной и электростатических взаимодействий, спекание водородом и гидрофобных эффекты1, служить набор правил проектирования. Исследования в этих фундаментальных Дизайн правила продолжает прогрессировать, следующий логический шаг в пептидной самостоятельной сборки включает расширение разнообразия на основе пептида структур и функций. При самостоятельной сборке пептиды являются универсальным биоматериал, были использованы для многих биомедицинских приложений тюнинг пептида последовательности или Ассамблеи условия2,3,4, разработка стратегий для изменения после Ассамблеи пептид nanofibers5,6,7,8,9 остается относительно неисследованные области.
Динамических дисульфида обмен и тиоловых химии на поверхности супрамолекулярных структур является одной из областей, которая имеет потенциал, чтобы принести новые и функциональные биоматериалы. Включение 1,2-dithiolane постановление (обычно производное липоевой кислоты (ла) или asparagusic кислоты (aa)) были зарегистрированы в липосомы систем10,11, блок сополимеры12,13, а Организация якоря на поверхности14,15. Здесь мы приводим синтеза и характеристика самостоятельной сборки пептид, производный от затравок ядро пептид значения, связанные с болезнью Альцгеймера, измененный в N-terminus с 1,2-dithiolane функциональные группы16, 17. Результате супрамолекулярные волокна теперь служат экспериментальной платформы для изучения дисульфида обмен и тиоловых реактивности в супрамолекулярные поверхности волокон амилоида18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Синтез и очистки 1,2-Dithiolane изменение пептида
- Синтез dithiolane прекурсоров, 3-(acetylthio) -2-(acetylthiomethyl) Пропионовая кислота19.
- Добавить 1 g 3-бром - 2-(bromomethyl) пропионовой кислоты (1 экв.) растворяют в минимальное количество 1 M NaOH (примерно 4 мл) до 25 мл круглым дном реакции колбу с перемешиванием на 55 ° C. Уплотнение реакции колбу с перегородками и место в атмосфере азота.
- Подготовить раствор, содержащий 1,49 г калия thioacetate (3.2 экв.) в 4 мл деионизированной воды и 3 мл серной кислоты, 2 M (H2так4) для создания thioacetic кислоты, в situ.
- Вытяните кислоты раствор thioacetic в пластиковые одноразовые 10 мл шприц и поместите иглу на шприц. Добавьте смесь каплям в колбу реакции, пирсинг через перегородками с иглой. Продолжать реакции на ночь при 55 ° C.
- Контролировать реакцию методом хроматографии (ТСХ) тонким слоем на силикагеле 60 F254 пластины с помощью смеси метанола и Дихлорметан (1:9). Визуализируйте ход реакции, бромкрезоловый зеленый краситель. Продукт имеет Rf = 0,57.
- После реакции и охлаждения до комнатной температуры, так подкисляет смесь до pH 1 с 2 М H24. Желтая масло отделяется из раствора.
- Извлекает продукт с холодной хлороформ (40 мл x 3). Сочетать органические слои и сушат над сульфат магния. Удаление хлороформе при пониженном давлении.
- Подтвердите личность изолированных продукта, 1, методом спектроскопии ядерного магнитного резонанса (ЯМР), как показано в цифры 1B и C. Ожидать следующие результаты: 1H ЯМР, CDCl3, 300 МГц: d = 10.1 (b, 1 H), 3.2 (m, 4 Ч), 2.9 (m, 1 H), 2.4 (s, 6 H); 13 C ЯМР, CDCl3, 75 МГц: d = 195,1 (CH3COS-), 177.6 (-COOH), 45,1 (-CH2S-), 30,5 (CH), 29,2 (-ШОСCH3).
Примечание: Продукт желтого масла и имеет общую доходность 83%. Используйте продукт без дальнейшей очистки.
- ППУ и муфт на смолы Dithiolane прекурсоров
Примечание: Пептид Твердофазный синтез описанные ниже было проведено на автоматизированной пептид синтезатор, следующие рекомендованные производителем протоколы. Параметры и реагенты могут быть адаптированы для других коммерческих инструментов или при использовании специализированных аминокислоты.- Весят вне 0,156 г каток Амида 4-methylbenzhydrylamine (MBHA) смолы (0,1 ммоль) и место в сосуде. Зыбь смолы в диметилформамиде (DMF) для по крайней мере 15 минут до начала синтеза.
- Взвешивание, 4 эквиваленты каждого fluorenylmethyloxycarbonyl (Fmoc) защищены аминокислоты (0.4 ммоль) в последовательности и 0,152 г N, N, N', N'- тетраметилсвинца-O-(1H- benotriazol-1-ил) уран Гексафторофосфат (0.4 ммоль, HBTU) для Каждый аминокислоты в последовательности. Каждый картридж содержит защищенные Fmoc аминокислоты и HBTU.
- После выполнения всех предварительных синтеза проверяет на синтезаторе (пополнить реагентов, покраснел реагент линии и под давлением все бутылки реагент), установите картриджи аминокислоты в Карусель в C' для N' конечной направлении. Место пустого картриджа после окончательного аминокислоты позиции для последнего шага deprotection N-терминала Fmoc.
- Синтез пептида, с использованием стандартных рекомендуемых параметров.
- Deprotect Fmoc группы из смолы с 5 мл 20% пиперидина в DMF (5 min x 2).
- Вымойте смолы с DMF (6 x 5 мл) перед шагом сцепного устройства.
- Для сцепления одного шага добавьте 4 мл 0,4 М N-methylmorpholine в DMF Fmoc защищенный amino acid и HBTU. Активировать Fmoc защищенный аминокислоты решение для 30 s перед передачей решение реакционный сосуд.
Примечание: Автоматизированная пептид синтезатор смешивает смолы и решение восходящей N2 газ каждые 30 s 20 минут во время реакции муфта занимает места. Для ручной пептидного синтеза место реакционный сосуд на орбитальный шейкер на низкой скорости для Длительность шага сцепного устройства. - Слейте раствор и мыть смолы с DMF (3 x 5 мл).
- Повторите шаги 1.2.4.1 через 1.2.4.4 для каждого Fmoc защищенный амино кислоты в C' п '-конечная руководство для синтеза пептида интерес.
- После последнего шага deprotection N-стержня передачи смолы в одноразовых фриттированных шприц. Вымойте смолы с DMF (3 x 5 мл) и Дихлорметан (DCM, 3 х 5 мл).
Примечание: Смола может быть сохранена после DCM, промывание в вакуумный сушильный шкаф. Если смола хранилась до сцепления, обеспечить набухать смолы в DMF перед муфта реакции. - Пара dithiolane прекурсоров (1) N-го пептид-смолы, добавив 4 эквиваленты 1, 5 мл ДМФ, 4 эквиваленты HBTU и 10 эквиваленты n, N-diisopropylethylamine (DIPEA). Предварительно активируйте муфта смесь 10 минут перед добавлением смолы, содержащие фриттированных шприц.
- Встряхните реакции сцепления 2 h. Через 2 ч мыть смолы с DMF (3 x 5 мл) и повторить муфта реакции с встряхивания на ночь.
- После второго сцепления, вымойте смолы с DMF (3 x 5 мл) и DCM (3 x 5 мл).
Примечание: Смола может храниться в этой точке под вакуумом до расщепления.
- Thioacetate Deprotection и расщепления пептидов из смолы
- Deprotect группа thioacetate из N-конечная dithiolane прекурсоров, передать трубку реакции Микроволновая печь 10 мл сушеные смолы и добавить 2 мл ДМФ. Разрешить смолы набухают, добавить небольшой переполох магнитный бар на судно, и вновь приостановить с низкой скоростью магнитных помешивании 15 мин.
- Добавить 2 мл концентрированной Гидроксид аммония, крышка реакционный сосуд с силиконовой септы и место реакционный сосуд в микроволновой реактор, используя параметры микроволновой 75 ° C для 45 мин с перемешиванием.
- После завершения реакции микроволновой передачи смолы в чистые одноразовые фриттированных шприц. Промойте DMF (2 x 5 мл) и метанола (метанола, 2 х 5 мл).
- Добавляют раствор концентрированный Гидроксид аммония в метаноле (1:4), общий объем 5 мл. Оставьте, чтобы пожать на ночь, чтобы увеличить внутримолекулярной окисления Скрепления дисульфида в dithiolane кольце.
- Вымойте смолы с метанола (2 x 5 мл) и DCM (3 x 5 мл).
Примечание: Сушеные смола может храниться в вакуумный сушильный шкаф на данный момент. - Добавьте декольте коктейль для смол, содержащих шприц с нежно встряхивания в течение 1,5 ч. Декольте коктейль используется — 95% trifluoroacetic кислоты (ТФК), triisopropylsilane (советы) 2,5% и 2,5% воды в общем объеме 5 мл.
Предупреждение: Работа под химических зонта. TFA-летучих и коррозию.
Примечание: Для большинства пептид последовательностей и аминокислоты sidechain защиты групп, выше декольте коктейль решение является достаточным; Однако альтернативные расщепления коктейли могут быть необходимы для определенных аминокислот боковой цепи защиты групп (в частности пептиды, содержащие Cys, Met, ГТО и Arg) или других смол химии20. - Осадок сырой пептида в 25 мл холодного диэтиловый эфир в 50 мл Конические трубки по каплям дополнение от фриттированных шприц. Пептида осаждается в виде белого твердого. Пелле пептид центрифугированием в 1300 x g 10 мин тщательно сцеживаться диэтиловый эфир в отдельный контейнер для сбора отходов.
- Добавьте еще один 25 мл диэтиловым эфиром Конические трубки и вновь приостановить осадок, vortexing. Повторите центрифугирования в 1300 x g 10 мин и сцеживаться диэтиловом эфире снова. Сухие гранулы под вакуумом.
- Очистка 1,2-Dithiolane изменение пептида
Примечание: Очищайте сырой пептид, обратная фаза ВЭЖХ. Собрать и объединить вершины пептид и подтвердите массы на MALDI-TOF масс-спектрометрии.- Растворяют гранулы сырой пептида в минимальное количество ацетонитриле с 0.1% TFA. Благодаря пептида гидрофобность и агрегации склонность аккуратно тепла образца при 40 ° C для помощи в растворимости.
Примечание: Избегайте более высоких температур и sonication пептида с целью предотвращения потенциальных дисульфида обмен реакции21,22,23. - Подготовить 1 мл сырой пептид для очистки ВЭЖХ, добавьте 400 мкл концентрированного пептид акций в ацетонитриле 600 мкл H2O с 0,1% TFA и фильтра через фильтр шприц 22 мкм в ампулу ВЭЖХ. Для предотвращения агрегации пептида и осадков могут быть добавлены дополнительные 5% изопропиловый спирт.
- Очищения пептида, используя C-18 полу препаративные столбца с расходом 3 мл/мин через линейный градиент 15-55% Ацетонитрил в 20 мин набор УФ-детекторы 222 Нм (Амида позвоночника) и 330 Нм (дисульфидными облигаций). Собирать и объединять пики интерес (рисунок 2A).
- Подтвердите массы продукта пептид, MALDI-TOF масс-спектрометр в reflectron режиме (рис. 2B). Для анализа, 0.5 мкл собранных пик на пластину MALDI смешать с 0,5 мкл 2,5-dihydroxybenzoic кислота (DHB) матрицы (10 мг/мл DHB в 50% ацетонитриле, 0.1% TFA).
Примечание: Общий аддукты в MALDI-TOF масс-спектрометрии включают натрия и калия соли аддукт ([M + Na]+ и [M + K]+) пики. Обессоливания образца до анализа рекомендуется если соль adduct пики подавления сигнала основной пик [M + H]+ . Кроме того, окисленного пик [M + O]+ также обнаружен в 1,2-dithiolane изменение пептид. Доклад о лазерной индуцированной оксидация от MALDI ионизации, с использованием матрицы DHB свидетельствует о том, что факторы, включая образец концентрации, растворитель и интенсивности лазера могут быть изменены для ограничивает MALDI индуцированных артефакт окисления24. - После подтверждения MALDI-TOF правильной массы lyophilize пептида после вспышки замораживания. Держите Порошок лиофилизированный пептидов под вакуумом до Ассамблеи.
- Растворяют гранулы сырой пептида в минимальное количество ацетонитриле с 0.1% TFA. Благодаря пептида гидрофобность и агрегации склонность аккуратно тепла образца при 40 ° C для помощи в растворимости.
2. характеристика супрамолекулярной самосборки структуры
-
Формирование амилоида волокон
- Для самостоятельной сборки приготовляют раствор, весят, 1 мг порошка пептид, используя аналитический баланс. Растворяются в смесь (рН 7,5) 20% ацетонитриле и 10 мм (4-(2-hydroxyethyl)-1-piperazineethanesulfonic кислота (HEPES) в пробки microcentrifuge 1,5 мл, до конечной концентрации 1 мг/мл пептид Ассамблеи смеси. Вихревой решения Ассамблеи и оставить собрать при комнатной температуре.
-
Спектральные характеристики волокон амилоида
- Следить за процессом сборки пептид через Фурье ИК спектроскопии (FTIR) каждые несколько дней. Широкий пик вокруг 1670 см-1 является подпись ИК, вытекающих из разобранном виде пептидов в образце17. Образцы Ассамблеи пептида обычно принимают одну-две недели для широкого разобранном виде пик исчезают и достигают созревания.
- Сухой Алиготе 8-10 мкл раствора Ассамблея, как тонкая пленка на Алмазный кристалл ATR. Следить за исчезновение большой и широкий воды пик с 1640-1630 см-1 как сухой пленки формы.
- Приобрести ИК спектров от 1500-1800 см-1 в среднем 50 сканирование с разрешением 2 см-1 . Приобретать и вычитание фона сканирования до каждого образца сканирования. IR подпись для β-лист Ассамблеи является острый пик между 1625 и 1635 см-1 (рис. 3A)25,26.
- Характеризуют пептид Ассамблея в богатых супрамолекулярные структуры β-лист по круговой дихроизма (CD). Запишите спектры с использованием CD спектрополяриметра Пельтье системой контроля температуры.
- Пипетка 30 мкл раствора Ассамблея в microcuvette длина пути 0,1 мм.
Примечание: Держатель ячейки требуется зажим и расположите короткий путь длина ячейки в документе. - Для каждого спектра, инструмент CD установить следующие параметры: сканирование длин волн 300 Нм до 180 Нм, скорость сканирования 100/мин, ширина ремешка 1 Нм, 25 ° C, в среднем три сканирования.
- Собирать спектр буфера (20% Ацетонитрил/10 мм HEPES, рН 7,5) и вычесть из каждого образца проверки как элемент управления. Подпись CD для β-листы является эллиптичность минимальный сосредоточено около 220 Нм (рис. 3B)27.
- Пипетка 30 мкл раствора Ассамблея в microcuvette длина пути 0,1 мм.
- Следить за процессом сборки пептид через Фурье ИК спектроскопии (FTIR) каждые несколько дней. Широкий пик вокруг 1670 см-1 является подпись ИК, вытекающих из разобранном виде пептидов в образце17. Образцы Ассамблеи пептида обычно принимают одну-две недели для широкого разобранном виде пик исчезают и достигают созревания.
-
Микроскопия амилоида волокон
- Разрешить две-три недели для образцов пептид перерастет в β-лист богатые супрамолекулярные структуры.
Примечание: Сборки можно образы с помощью просвечивающей электронной микроскопии (ТЕА) на ранних стадиях процесса сборки, а также.- Пипетка 10 мкл пептид Ассамблеи раствора на поверхность сетку углеродные ТЕА.
Примечание: не заботиться сенсорный наконечник пипетки на поверхность сетки. Высокая точность, самозакрывающиеся пинцеты используются для хранения сетке ТЕА во время подготовки. - Подождите 1-2 мин, чтобы разрешить сборкам адсорбируются на поверхность сетки. Удалите избыток образец прикоснувшись фильтровальной бумаги до края сетки.
- Подготовьте пятно ацетат уранила 2%, добавив 100 мкл обессоленной воды для коммерчески доступных ацетата раствор уранилнитрата 4%. Пипетка 10 мкл 2% уранила ацетат пятно на поверхность сетки и инкубировать в течение 2-3 мин. После инкубации удалите избыток пятно, прикоснувшись фильтровальной бумаги до края сетки.
- Место сетки ТЕА в вакуумный сушильный шкаф на ночь. Хранят под вакуумом до изображений.
- Изображения подготовлены образцы с ТЕА (рис. 3 c). Типичные параметры для микроскопии заключаются в следующем: изображения в увеличениях, начиная от 9300 X 23, X, накаливания вольфрама с ускоряющего напряжения 120 000 кв.
Примечание: ImageJ может использоваться для измерения средней волокна ширина супрамолекулярных структур приобретенных ТЕА изображения28.
Предупреждение: Обратитесь все соответствующие листы данным по безопасности (ПБ) перед использованием. Несколько химических веществ, используемых в синтезе, очистки, и характеристика описанных 1,2-dithiolane изменение самостоятельной сборки пептиды являются коррозионными или токсичных и должны использоваться только под химических зонта. Всегда использовать соответствующие средства индивидуальной защиты (включая защитные очки, лаборатории пальто, брюки полной длины, закрыты носок обуви) при работе в лаборатории.
- Пипетка 10 мкл пептид Ассамблеи раствора на поверхность сетку углеродные ТЕА.
- Разрешить две-три недели для образцов пептид перерастет в β-лист богатые супрамолекулярные структуры.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Помимо первоначальные одношаговым синтез dithiolane прекурсоров молекулы остальная часть 1,2-dithiolane изменение пептидного синтеза происходит на твердой поддержки (рис. 1A). Преобразование 3-бром - 2-(bromomethyl) пропионовой кислоты 3-(acetylthio) -2-(acetylthiomethyl) Пропионовая кислота, предшественник dithiolane, подтверждается 1H и 13C ЯМР (рис. 1B и C) перед она совмещена с бесплатно N-конечная Амин пептид еще смолы. Deprotection thioacetate для тиолов с Гидроксид аммония осуществляется с помощью микроволновой реактора и 1,2-dithiolane окисляется на ночь в метаноле, прежде чем изменения 1,2-dithiolane пептид расщепляется из смолы. Сырой пептид очищенная методом обратной фазы ВЭЖХ (рисунок 2A) и массы продукта подтверждается MALDI-TOF масс-спектрометрия (рис. 2B).
Очищенный 1,2-dithiolane пептид самостоятельно собирает в зрелые волокон амилоида в течение 2-3 недели. Следить за процессом сборки и характеризовать расширенный конформации β-лист используются FT-IR (Рисунок 3А) и CD спектроскопии (рис. 3B). Волокна отражаются по ТЕА (рис. 3 c).
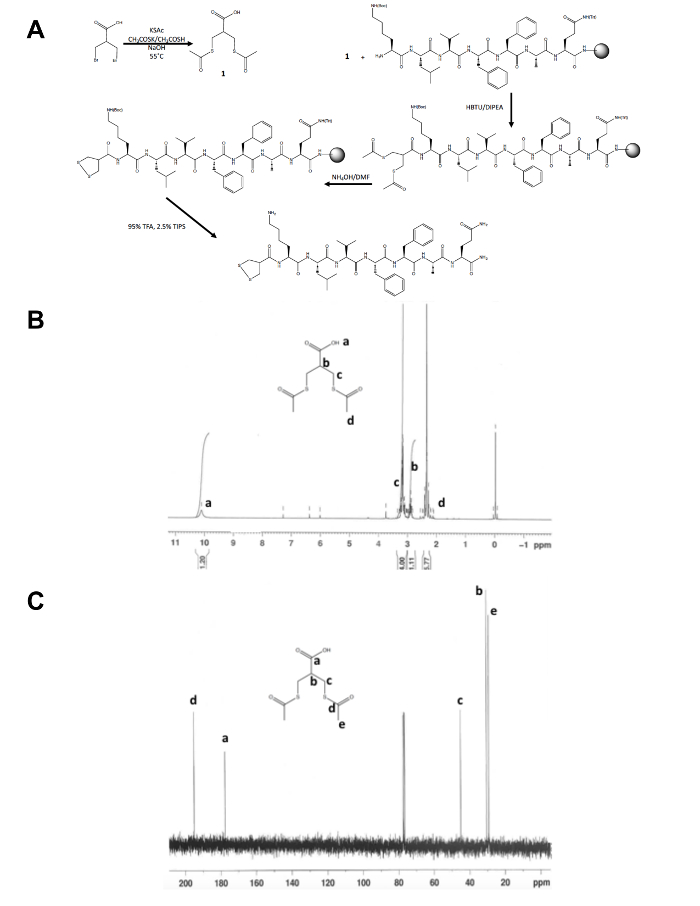
Рисунок 1. Синтетическая схема для характеризации прекурсоров молекулы 1,2-dithiolane. (A) синтетические схема окончательного 1,2-dithiolane изменение пептида, 1,2-dithiolane-KLVFFAQ-NH2. (B) 1H ЯМР-3 (acetylthio) -2-(acetylthiomethyl) Пропионовая кислота в CDCl3 на 300 МГц (C)13C-ЯМР-3 (acetylthio) -2-(acetylthiomethyl) Пропионовая кислота в CDCl3 75 МГц в. , пожалуйста, нажмите здесь чтобы посмотреть большую версию этой фигуры.

Рисунок 2. Синтез 1,2-dithiolane изменение пептид. (A) ВЭЖХ Хроматограмма от очистки 1,2-dithiolane - KLVFFAQ-NH2. (B) MALDI-TOF массовых спектр основной пик от очистки ВЭЖХ (время хранения ~17.5 мин) в reflectron режиме с использованием матрицы DHB подтверждает расчетная масса 1,2-dithiolane-KLVFFAQ-NH2. Общие аддукты также определены. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3. Супрамолекулярная характеристика 1,2-dithiolane изменение пептид. (A) FT-IR-1 мг/мл 1,2-dithiolane-KLVFFAQ-NH2 волокон собрались в 10 мм HEPES, pH 7.5 в 20% CH CN3. Пик в 1627 см-1 согласуется с пептидами, собраны в конформации β-лист. (B) CD 1 мг/мл 1,2-dithiolane-KLVFFAQ-NH2 волокон собрались в 10 мм HEPES, рН 7,5 в 20% CH3CN. Эллиптичность минимум на 218 Нм согласуется с пептидами, собраны в конформации β-лист. (C) изображение 1,2-dithiolane-KLVFFAQ-NH2 амилоида волокна (отрицательный пятно 2% уранила ацетат) по ТЕА. Линейки-100 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Эта статья обсуждает детали как синтеза и очистки 1,2-dithiolane изменение N-терминальный самостоятельной сборки пептида и характеристики полученных супрамолекулярных структур. Синтез пептида 1,2-dithiolane, сообщили здесь имеет преимущества, включая одношаговый синтеза для производства прекурсоров dithiolane, 3-(acetylthio) -2-(acetylthiomethyl) Пропионовая кислота и на смолы СВЧ deprotection реакция предшественник thioacetate защиты группы приносить окисленных 1,2-dithiolane группу, используя Гидроксид аммония, как безопасной альтернативы токсичных гидразина deprotection сообщалось ранее29. Пептида в целом Твердофазный синтез пептида 1,2-dithiolane (Рисунок 1A) могут быть легко изменены, изменив длину последовательности и композиции, в том числе с помощью Fmoc защищенный неестественные аминокислоты и C-терминал смолы химии в соответствии много различных исследовательских приложениях.
Для того, чтобы предотвратить нежелательные пептиды побочных продуктов, когда аминокислоты с нуклеофильного боковых цепей или аминокислоты с защита групп имеют реактивной расщепления продуктов, следует добавить дополнительные падальщики декольте коктейль20. Расщеплении теста небольшой части (менее 10% от общего смолы) может быть выполнено перед на смолу Микроволновая печь deprotection шаг, чтобы обеспечить высокую доходность сцепления реакции. С помощью столбцов и ВЭЖХ условий, описанных в докладе, пик пептид прекурсоров охраняемых 1,2-dithiolane thioacetate elutes 5 мин после центровку бесплатно Амин пептида. Если остается значительное количество свободного Амин пептид, еще один шаг муфта с 3-(acetylthio) -2-(acetylthiomethyl) Пропионовая кислота рекомендуется. Внутримолекулярная 1,2-dithiolane дисульфидными облигаций обнаруживается на ВЭЖХ путем наблюдения за слабых дисульфидными облигаций поглощения на 330 Нм. ВЭЖХ пика, соответствующего окисленных 1,2-dithiolane подтверждается путем добавления 100 Л 100 мм tris(2-carboxyethyl)phosphine(TCEP) образец пептида в отдельном ВЭЖХ запуска. Тиоловых TCEP уменьшена, содержащие пептид будет иметь разные удержания время чем окисленных дисульфида пептид. Тиоловых, содержащие пептидные elutes примерно 1 мин позднее дисульфида пептид, с помощью столбца и условий, описанных в докладе. Подходящих альтернативных матрицы MALDI для пептидов α-циано-4-Гидроксикоричная кислота (CHCA) и готовится путем добавления 1 мл 50% ацетонитриле с 0,1% TFA до 5 мг CHCA. Образцы могут быть обессоленной с помощью zip кончик с18 до MALDI-TOF массового анализа, если вершины соли adduct (Na+ и K+) значительно подавить пик [M + H]+ .
Пептид последовательность, выбранные для этих исследований является производным от голландского мутант значения-пептида, связанные с болезнью Альцгеймера30и ранее было показано, что самостоятельно собрать в амилоидные белки параллельных β-листы16,17 . Как показано в результатах представительных, Рисунок 3A-C, 1,2-dithiolane-KLVFFAQ-NH2 пептида также собирает в волокон амилоида. FTIR Амида я растянуть по центру в 1627 см-1 и CD эллиптичность минимум на 218 Нм, спектроскопические подписи сборки β-лист25,26,27, и карбонильных CO стрейч в 1676 см-1 соответствующий приказ, глютамин боковой цепи взаимодействия предположить, что пептиды организованы в параллельных β-стренги16,,3132.
Передача электронной микроскопии изображений, используя 2% уранила ацетат негативные пятно, Показать расширенный и скручивания супрамолекулярные волокна, которые являются около 10 Нм в ширину. Волокна N-терминальный ацетилированные пептид, Ac-KLVFFAQ-NH2, гладкие и прямые, с немного больше ширина почти 12 Нм16. Поскольку подготовка сетей ТЕА и получения изображений время интенсивного процесса, лучше подготовить несколько ТЕА сетки из той же Ассамблея выборке сразу различной концентрации пептида. Подготовьте образец разбавленный ТЕА (1:50 или 1: 100) наряду с исходным образцом решения Ассамблеи. Волокон амилоида при высоких концентрациях могут присоединиться к сетке в кусты или патчи и получения изображений отдельных волокон может быть трудным. Важно увидеть края отдельных волокон для измерения ширины и визуализация Спиральность волокна часто закрывались переполнены образцами.
Как больше приложений с помощью супрамолекулярные биоматериалов в настоящее время изучаются, существует необходимость в интеграции потенциально реактивной функциональных групп, которые являются ортогональными для самостоятельной сборки процесс в самостоятельной сборки мономеров. Методы, описанные в настоящем докладе освещены на смолы подход к синтез 1,2-dithiolane изменение самостоятельной сборки пептида и спектральные характеристики супрамолекулярных структур.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
Авторы хотели бы поблагодарить д-р B. Эллен Scanley за ее техническую подготовку и помочь с помощью ТЕА в Коннектикут государственных колледжей и университетов (CSCU) центр нанотехнологий и доктор Ишита Мукерджи в Уэслианском университете для доступа к ее CD Спектрофотометр. Работе в части было поддержано институтом наук в университете Фэрфилд, Коннектикут НАСА космический Грант консорциум и Национальный научный фонд под Грант номер ЧЕ-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



