Summary
En protokol til syntese af en 1,2-dithiolane ændrede peptid og karakterisering af Supramolekylær strukturer som følge af peptid samlesæt.
Abstract
Denne rapport fokuserer på syntesen af en N-terminus 1,2-dithiolane ændret selvsamlende peptid og karakterisering af den deraf følgende samlet selvstændige Supramolekylær strukturer. Den syntesevejen udnytter faststadie syntese med den på harpiks kobling af dithiolane forløber molekyle, 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre, og mikrobølgeovn-assisteret thioacetate deprotection af peptid N-terminus før endelige kavalergang fra harpiks til at give 1,2-dithiolane ændrede peptid. Efter en high-performance væskekromatografi (HPLC) rensning af 1,2-dithiolane peptid, stammer fra den kernedannende kerne af Aβ peptid forbundet med Alzheimers sygdom, er peptid vist at selv samle til cross-β amyloid fibre. Protokoller til at karakterisere den amyloid fibre ved Fouriertransformation infrarød spektroskopi (FT-IR), cirkulære dichroism spektroskopi (CD) og transmissions elektronmikroskopi (TEM) er præsenteret. Metoder til ændring af N-terminal med en 1,2-dithiolane gruppe godt karakteriseret selvsamlende peptider kan nu undersøges som modelsystemer at udvikle strategier, efter montering modifikation og udforske dynamisk kovalente kemi på Supramolekylær kemi peptid nanofiber overflader.
Introduction
Den robuste peptidbinding danner kemi involveret faststadie peptidsyntese og evnen til at kontrollere rækkefølgen længde og sammensætning gør de peptider, der selv samler til Supramolekylær strukturer et stærkt undersøgte felt. De faktorer, der styrer og stabilisere peptid selvsamlede strukturer, herunder sidekæde sterisk og elektrostatiske interaktion, hydrogenbindende og hydrofobe virkninger1, tjene som et sæt af designregler. Som forskningen i disse grundlæggende designregler fortsat at gøre fremskridt, indebærer det logiske næste skridt i peptid samlesæt udvide mangfoldighed af peptid-baserede strukturer og funktioner. Mens du selv samle peptider er en alsidig biomateriale, som har været brugt i mange biomedicinske anvendelser af tuning peptid sekvens eller forsamling betingelser2,3,4, udviklingen af strategier for efter samling ændringer til peptid nanofibers5,6,7,8,9 er fortsat et relativt uudforsket område.
Dynamisk disulfid exchange og thiol kemi på overfladen af Supramolekylær strukturer er et område, der har potentiale til at give nye og funktionelle biomaterialer. Indarbejdelse af 1,2-dithiolane fraspaltning (almindeligvis et derivat af lipoinsyre (la) eller asparagusic syre (aa)) er blevet rapporteret i Liposom systemer10,11, blok copolymerer af12,13, og som organisere ankre på overflader14,15. Heri, rapporterer vi syntese og karakterisering af en selvsamlende peptid stammer fra den kernedannende kerne af Aβ peptid forbundet med Alzheimers sygdom, er ændret på N-terminus med en 1,2-dithiolane funktionelle gruppe16, 17. De resulterende Supramolekylær fibre nu fungere som en eksperimenterende platform til at studere disulfid-udveksling og thiol reaktiviteten på Supramolekylær overfladen af amyloid fibre18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Sammenfatning og rensning af 1,2-Dithiolane ændret peptid
- Syntese af dithiolane forløber, 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre19.
- Tilføje 1 g 3-bromo - 2-(bromomethyl) propionsyre (1 ækvivalent) opløst i minimum 1 M NaOH (ca. 4 mL) til en 25-mL rund bund reaktionskolben under omrøring til 55 ° C. Forsegle reaktionskolben med en septa og sted under atmosfære af nitrogen.
- Der fremstilles en opløsning indeholdende 1,49 g kalium thioacetate (3.2 ækvivalent) i 4 mL deioniseret vand og 3 mL 2 M svovlsyre (H2SO4) til at oprette thioacetic syre i situ.
- Trække thioacetic syre til en plast engangs 10 mL sprøjte og placere en nål på sprøjten. Tilføj blandingen dråbevis reaktion kolben ved piercing gennem septa med nålen. Fortsætte reaktionen natten over ved 55 ° C.
- Overvåge reaktionen ved tyndtlagskromatografi (TLC) på silica gel 60 F254 plader ved hjælp af en blanding af metanol og dichlormethan (1:9). Visualisere reaktion fremskridt af bromkresol grønne plet. Produktet har en Rf = 0,57.
- Efter at reaktionen er komplet og afkølet til stuetemperatur, surt blandingen til pH 1 med 2 M H2så4. En gul olie adskiller ud af løsningen.
- Ekstrakt produkt med kolde chloroform (40 mL x 3). Kombinere de organiske lag og tør over magnesium sulfat. Fjerne chloroform under reduceret tryk.
- Bekræfte identiteten af den isolerede produkt, 1, ved Kernemagnetisk resonans (NMR) spektroskopi, som vist i tal 1B og C. Forvente følgende resultater: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H), 3.2 (m, 4 H), 2.9 (m, 1 H), 2.4 (s, 6 H); 13 C NMR, CDCl3, 75 MHz: d = 195.1 (CH3COS-), 177.6 (-COOH), 45,1 (-CH2S-), 30,5 (CHansen), 29.2 (-SCOCH3).
Bemærk: Produktet er en gul olie og har et samlet udbytte på 83%. Bruge produktet uden yderligere rensning.
- SPP'ER og på harpiks kobling af Dithiolane forløber
Bemærk: Solid faststadie peptidsyntese beskrevet nedenfor blev gennemført på en automatiseret peptid synthesizer, efter fabrikantens anbefalede protokoller. Indstillinger og reagenser, der kan tilpasses til andre kommercielle instrumenter eller når du bruger specialiserede aminosyrer.- Afvejes 0.156 g af Rink akrylamid 4-methylbenzhydrylamine (MBHA) harpiks (0,1 mmol) og placere i en reaktion fartøj. Kvældning harpiks i dimethylformamid (DMF) i mindst 15 min før starten af syntesen.
- Vejer ud 4 ækvivalenter af hver fluorenylmethyloxycarbonyl (Fmoc) beskyttet aminosyre (0.4 mmol) i den rækkefølge og 0.152 g af N, N, N', N'- tetramethyl-O-(1H- benotriazol-1-yl) uran hexafluorophosphate (0,4 mmol, HBTU) for hver aminosyre i sekvensen. Hver patron indeholder både Fmoc-beskyttet aminosyre og HBTU.
- Efter at have kørt alle pre syntese kontrol på synthesizeren (refill reagenser, skyllet reagens linjer og tryk alle reagensflasker), placere aminosyre patroner i karrusellen i C' n ' endestation retning. Placer en tom blækpatron efter den endelige aminosyre holdning til den endelige N-terminale Fmoc deprotection trin.
- Syntetisere peptid ved hjælp af de anbefalede standardindstillinger.
- Deprotect gruppen Fmoc fra harpiks med 5 mL af 20% Piperidin i DMF (5 min x 2).
- Vask harpiks med DMF (6 x 5 mL) før trinnet kobling.
- For et enkelt kobling skridt, tilføje 4 mL 0,4 M N-methylmorpholine i DMF til Fmoc-beskyttet aminosyre og HBTU. Aktivere Fmoc-beskyttet aminosyre-løsning til 30 s før du overfører løsningen til reaktion fartøj.
Bemærk: Den automatiserede peptid synthesizer blander resinen og løsningen af boblende N2 gas hver 30 s i 20 min. mens kobling reaktion finder sted. Manuel faststadie peptidsyntese, placere reaktion fartøj på en orbitalryster ved lav hastighed for varigheden af trinnet kobling. - Dræn løsningen og vaske harpiks med DMF (3 x 5 mL).
- Gentag trin 1.2.4.1 gennem 1.2.4.4 for hver Fmoc-beskyttet aminosyre i C' n '-terminus retning at syntetisere peptid af interesse.
- Efter det sidste N-terminale deprotection trin, Ionbyttermaterialet overføres til en engangs fritted sprøjte. Vask harpiks med DMF (3 x 5 mL) og dichlormethan (DCM, 3 x 5 mL).
Bemærk: Harpiks kan opbevares efter DCM vask i et vakuum ekssikkator. Hvis resinen blev gemt før kobling, sikre for at svulme harpiks i DMF før kobling reaktion. - Par dithiolane forløber (1) til N-terminus af på harpiks peptid ved at tilføje 4 ækvivalenter af 1, 5 mL DMF, 4 ækvivalenter af HBTU og 10 ækvivalenter af N, N-diisopropylethylamine (DIPEA). Pre-aktivere koblingen blandingen i 10 min før du tilføjer til harpiks, der indeholder fritted sprøjte.
- Ryste kobling reaktionen for 2 h. Efter 2 h, vaske harpiks med DMF (3 x 5 mL) og Gentag kobling reaktion med ryster natten over.
- Efter den anden kobling, vaske harpiks med DMF (3 x 5 mL) og DCM (3 x 5 mL).
Bemærk: Harpiks kan opbevares ved dette punkt under vakuum indtil kavalergang.
- Thioacetate Deprotection og peptid kavalergang fra harpiks
- For at deprotect thioacetate gruppen fra N-terminus dithiolane forløber, overføre det tørrede harpiks til en 10 mL mikrobølgeovn reaktion tube og der tilsættes 2 mL DMF. Ionbytteren henstår til svulme, tilføje en lille magnetiske rør bar til fartøjet og genopslæmmes med en lav hastighed af magnetiske omrøring i 15 min.
- Der tilsættes 2 mL koncentreret ammoniumhydroxid, cap reaktion fartøj med silikone septa og placere reaktion fartøj i en mikrobølgeovn reaktor med indstillingerne mikrobølgeovn 75 ° c i 45 min. under omrøring.
- Efter mikrobølgeovnen reaktion er færdig, Ionbyttermaterialet overføres til en ren engangs fritted sprøjte. Vask med DMF (2 x 5 mL) og methanol (MeOH, 2 x 5 mL).
- Tilføje en opløsning af koncentreret ammoniumhydroxid i methanol (1:4), for en samlet maengde paa 5 mL. Forlade for at ryste overnight at øge intramolekylære oxidation af disulfid obligation i dithiolane ring.
- Vask harpiks med MeOH (2 x 5 mL) og DCM (3 x 5 mL).
Bemærk: Det tørrede harpiks kan opbevares i et vakuum ekssikkator på dette punkt. - Tilføje kavalergang cocktail til harpiks, der indeholder sprøjte med forsigtigt ryste for 1,5 h. Kløvningen cocktail bruges er 95% trifluoreddikesyre (TFA), 2,5% triisopropylsilane (TIPS) og 2,5% vand i en samlet maengde paa 5 mL.
Forsigtig: Arbejde under kemiske stinkskab kun. TFA er flygtige og ætsende.
Bemærk: For fleste af peptid sekvenser og aminosyre sidechain beskytte grupper, ovenstående kavalergang cocktail løsning er tilstrækkelig; Men alternative kavalergang cocktails kan være behov for visse aminosyre sidekæde beskytter grupper (i bestemt peptider der indeholder Cys, Met, Trp og Arg) eller andre harpiks kemi20. - Udfælde den rå peptid i 25 mL koldt dietylaeter i en 50 mL konisk slange af dråbevis ud fra den fritted sprøjte. Peptid udfældes som en hvid solid. Pellet peptid ved centrifugering ved 1300 x g i 10 min. dekanteres omhyggeligt dietylaeter i en separat beholder til indsamling af affald.
- Tilføje en anden 25 mL dietylaeter til den koniske rør og genopslæmmes bundfaldet af vortexing. Gentag centrifugering ved 1300 x g i 10 min. og dekanteres dietylaeter igen. Tørre pellet under vakuum.
- Rensning af 1,2-Dithiolane ændret peptid
Bemærk: Rense den rå peptid ved omvendt fase-HPLC. Indsamle og kombinere peptid toppe og bekræfte massen af MALDI-TOF-massespektrometri.- Opløse rå peptid pelleten i minimal mængde af acetonitril med 0,1% TFA. På grund af peptids hydrophobicity og sammenlægning tilbøjelighed, varme forsigtigt prøve ved 40 ° C til støtte i opløselighed.
Bemærk: Undgå højere temperaturer og ultralydbehandling af peptid for at forhindre potentielle disulfid exchange reaktioner21,22,23. - For at forberede HPLC rensning 1 mL rå peptid, Tilføj 400 μL af koncentreret peptid bestand i acetonitril til 600 μl af H2O med 0,1% TFA og filter gennem en 22 μm sprøjte filter i en HPLC hætteglas. En yderligere 5% isopropanol kan være tilføjet for at forhindre peptid sammenlægning og nedbør.
- Rense peptid ved hjælp af C-18 semi-forberedende kolonne med en gennemstrømningshastighed på 3 mL/min. over en lineær gradient af 15-55% acetonitril i 20 min. sæt UV detektorer til 222 nm (AMID rygraden) og 330 nm (disulfid obligation). Saml og Kombiner toppene af interesse (figur 2A).
- Bekræfte peptid produkt massen af MALDI-TOF massespektrometer i reflectron tilstand (figur 2B). For analyse, bland 0,5 μl af indsamlede peak på MALDI plade med 0,5 μL af 2,5-dihydroxybenzoic syre (DHB) matrix (10 mg/mL DHB i 50% acetonitril, 0,1% TFA).
Bemærk: Fælles adukter i MALDI-TOF massespektrometri omfatte natrium og kaliumsalt addukt ([M + Na]+ og [M + K]+) toppe. Afsaltning prøve før analysen anbefales hvis salt adduct toppe undertrykke signalet fra de vigtigste [M + H]+ peak. Derudover en oxideret peak af [M + O]+ også fundet i 1,2-dithiolane ændret peptid. En rapport om laser induceret oxidation fra MALDI ionisering ved hjælp af DHB matrix tyder på, at faktorer, herunder prøve koncentration, opløsningsmiddel og laser intensitet kan ændres for at begrænse MALDI induceret oxidation artefakt24. - Efter MALDI-TOF bekræftelse af den korrekte masse, lyophilize peptid efter flash frysning. Holde den frysetørrede peptid pulver under vakuum indtil forsamling.
- Opløse rå peptid pelleten i minimal mængde af acetonitril med 0,1% TFA. På grund af peptids hydrophobicity og sammenlægning tilbøjelighed, varme forsigtigt prøve ved 40 ° C til støtte i opløselighed.
2. karakterisering af Supramolekylær strukturer samlesæt
-
Dannelsen af Amyloid fibre
- For at forberede samlesæt løsning, der afvejes 1 mg af peptid pulver ved hjælp af en Analysevægt. Opløses i en blanding (pH 7,5) 20% acetonitril og 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic syre (HEPES) i 1,5 mL microcentrifuge rør, til en endelig koncentration på 1 mg/mL peptid forsamling blanding. Vortex forsamling løsning og orlov til at samle ved stuetemperatur.
-
Spektroskopiske karakterisering af Amyloid fibre
- Følg peptid forsamling proces via Fouriertransformation infrarød (FTIR) spektroskopi hver par dage. En bred peak centreret omkring 1670 cm-1 er den IR signatur skyldes usamlet peptider i stikprøven17. Peptid forsamling prøver tager normalt en til to uger for den brede usamlet peak til at forsvinde og nå modning.
- Tør en alikvot af 8-10 μl af opløsningen forsamling som en tynd film på ATR diamant krystal. Overvåge forsvinden af en stor og bred vand peak fra 1640 til 1630 cm-1 som tør film former.
- Erhverve IR spektre fra 1500-1800 cm-1 gennemsnit 50 scanninger med en 2 cm-1 opløsning. Erhverve og fratræk baggrundsscanninger før hver prøve scanning. IR signatur for β-plade samling er en skarp peak mellem 1625 og 1635 cm-1 (figur 3A)25,26.
- Karakterisere peptid forsamlingen i β-plade rige Supramolekylær strukturer af cirkulære dichroism (CD). Optage spektrene benytter en CD spectropolarimeter med en Peltier temperatur kontrolsystem.
- Tilsæt 30 μl af forsamling løsningen i en 0.1 mm sti længde microcuvette.
Bemærk: En celle indehaveren er nødvendig for at klemme og Placer kort sti længde celle i instrumentet. - For hvert spektrum, indstille CD instrument til følgende parametre: scanning bølgelængder af 300 nm til 180 nm, scanning hastighed på 100/min, band bredde 1 nm, 25 ° C, gennemsnitligt tre scanninger.
- Indsamle et spektrum af buffer (20% acetonitril/10 mM HEPES, pH 7,5) og trække fra hver prøve scanning som et kontrolelement. CD signatur for β-sheets er en minimum ellipticity centreret omkring 220 nm (figur 3B)27.
- Tilsæt 30 μl af forsamling løsningen i en 0.1 mm sti længde microcuvette.
- Følg peptid forsamling proces via Fouriertransformation infrarød (FTIR) spektroskopi hver par dage. En bred peak centreret omkring 1670 cm-1 er den IR signatur skyldes usamlet peptider i stikprøven17. Peptid forsamling prøver tager normalt en til to uger for den brede usamlet peak til at forsvinde og nå modning.
-
Mikroskopi af Amyloid fibre
- Tillade to til tre uger for peptid prøver til at modnes i β-plade rige Supramolekylær strukturer.
Bemærk: Forsamlingerne kan være afbildet ved hjælp af transmissions elektronmikroskopi (TEM) på tidligere stadier af montage-processen.- Tilsæt 10 μl af peptid forsamling løsning på overfladen af TEM carbon gitter.
Bemærk: Sørg for ikke for at røre pipette tip til gitter overflade. Høj præcision, selvlukkende pincet bruges til at holde gitteret TEM under forberedelse. - Vente 1-2 min til at tillade forsamlinger til adsorberes på gitteret overflade. Fjerne overskydende prøve ved at røre ved filtrerpapir til kanten af gitteret.
- Forbered en 2% uranyl acetat plet ved at tilføje 100 μL ionbyttet vand til kommercielt tilgængelige 4% uranyl acetat løsning. Tilsæt 10 μl af 2% uranyl acetat pletten overfladen, grid og inkuberes i 2-3 min. Efter inkubation, fjerne overskydende pletten ved rørende filtrerpapir til kanten af gitteret.
- Anbringe TEM gitre i et vakuum ekssikkator natten over. Opbevares under vakuum indtil billeddannelse.
- Billede de forberedte prøver med TEM (figur 3 c). Typiske parametre for mikroskopi er som følger: billeder i forstørrelser spænder fra 9,300 X 23, 000 X, wolfram glødelampe med en accelererende spænding på 120 kV.
Bemærk: ImageJ kan bruges til at måle gennemsnitlige fiber bredde ved erhvervede TEM billeder28Supramolekylær strukturer.
Forsigtig: Kontakt venligst alle relevante sikkerhedsdatablade (SDS) før brug. Flere kemikalier anvendt i syntese, rensning, og karakterisering af de beskrevne 1,2-dithiolane ændret selvsamlende peptider er ætsende eller giftigt og bør kun anvendes under en kemisk stinkskab. Altid bruge relevante personlige værnemidler (herunder sikkerhed briller, laboratoriekittel, fuld længde bukser, lukket tå sko) når du arbejder i laboratoriet.
- Tilsæt 10 μl af peptid forsamling løsning på overfladen af TEM carbon gitter.
- Tillade to til tre uger for peptid prøver til at modnes i β-plade rige Supramolekylær strukturer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Bortset fra den indledende one-step syntese af dithiolane forløber molekyle opstår resten af 1,2-dithiolane ændret faststadie peptidsyntese på solid støtte (figur 1A). Konvertering af 3-bromo - 2-(bromomethyl) propionsyre til 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre, dithiolane forløber, bekræftes af 1H og 13C NMR (figur 1B og C) før det er koblet til den frie N-terminus Amin af et peptid stadig på-harpiks. Deprotection af thioacetate til dithioler med ammoniumhydroxid udføres ved hjælp af en mikrobølgeovn reaktor og 1,2-dithiolane oxideres natten over i methanol før 1,2-dithiolane ændret peptid er kløvet fra harpiks. Den rå peptid er renset ved omvendt fase HPLC (figur 2A) og produktets masse bekræftes af MALDI-TOF-massespektrometri (figur 2B).
Renset 1,2-dithiolane peptid samler selv i modne amyloid fibre over en periode på 2-3 uger. FT-IR (figur 3A) og CD spektroskopi (figur 3B) bruges til at følge forsamling processen og at karakterisere den udvidede β-plade kropsbygning. Fibrene er afbildet af TEM (figur 3 c).
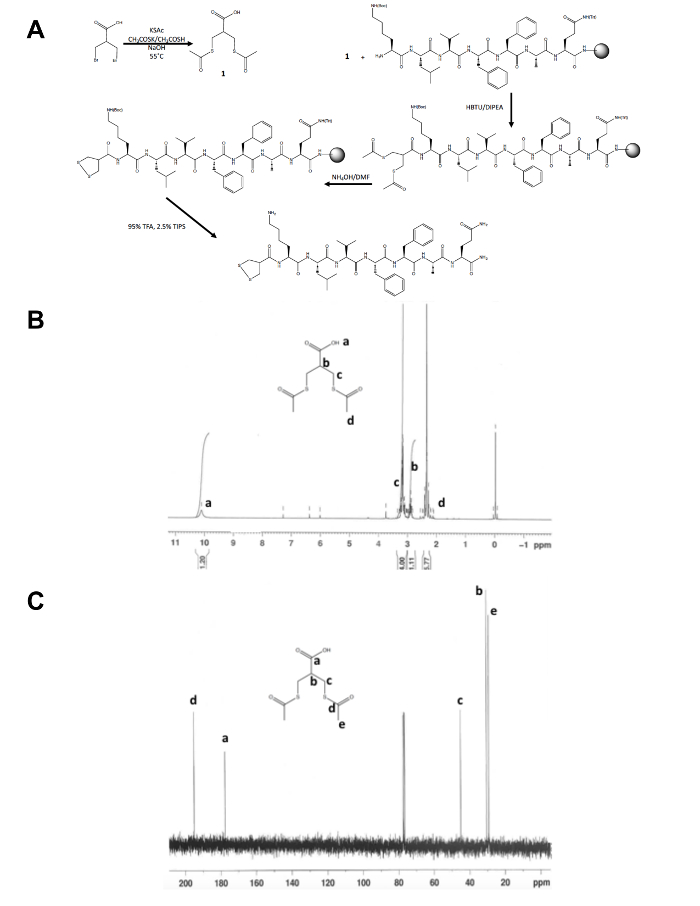
Figur 1. Syntetisk ordningen for karakterisering af 1,2-dithiolane forløber molekyle. (A) syntetiske ordningen af den endelige 1,2-dithiolane ændret peptid, 1,2-dithiolane-KLVFFAQ-NH2. (B) 1H-NMR af 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre i CDCl3 på 300 MHz. (C)13C-NMR af 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre i CDCl3 på 75 MHz. Klik her at se en større version af dette tal.

Figur 2. Syntese af 1,2-dithiolane ændrede peptid. (A) HPLC kromatogrammet fra rensning af 1,2-dithiolane - KLVFFAQ-NH2. (B) MALDI-TOF masse spektrum af de vigtigste peak fra HPLC rensning (retentionstiden for ~17.5 min) i reflectron tilstand ved hjælp af DHB matrix bekræfter den beregnede masse af 1,2-dithiolane-KLVFFAQ-NH2. Fælles adukter identificeres også. Venligst klik her for at se en større version af dette tal.

Figur 3. Supramolekylær kemi karakterisering af 1,2-dithiolane ændrede peptid. (A) FT-IR af 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 fibre samlet i 10 mM HEPES, pH 7,5 i 20% CH3CN. Peak på 1627 cm-1 er i overensstemmelse med peptider samlet i en β-plade kropsbygning. (B) CD af 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 fibre samlet i 10 mM HEPES, pH 7,5 i 20% CH3CN. Ellipticity minimum på 218 nm er i overensstemmelse med peptider samlet i en β-plade kropsbygning. (C) Image af 1,2-dithiolane-KLVFFAQ-NH2 amyloid fiber (negative pletten af 2% uranyl acetat) af TEM. Skalalinjen er 100 nm. Venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne artikel omhandler detaljerne i både syntesen og rensning af en N-terminale 1,2-dithiolane ændret selvsamlende peptid og karakterisering af de resulterende Supramolekylær strukturer. Syntesen af 1,2-dithiolane peptid rapporteret her har fordele, herunder en et-trins syntese for at producere dithiolane forløber, 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre, og harpiksen mikroovn deprotection reaktion af de forløber thioacetate beskytte gruppe for at give den oxiderede 1,2-dithiolane gruppe udnytter ammoniumhydroxid som et sikrere alternativ til giftige hydrazin deprotection rapporteret tidligere29. Den samlede faststadie syntese af 1,2-dithiolane peptid (figur 1A), der let kan ændres ved at ændre rækkefølgen længde og sammensætning, herunder ved hjælp af Fmoc-beskyttet unaturlige aminosyrer, og C-terminale harpiks kemi passer til mange forskellige forskning applikationer.
For at forhindre uønskede peptid biprodukter, når aminosyrerne med nukleofil sidekæder eller aminosyrer med beskytte grupper har reaktiv spaltningsprodukter, skal yderligere skraldemanden føjes til kavalergang cocktail20. En test spaltning af en lille del (mindre end 10% af total harpiks) kan udføres før på harpiks mikroovn deprotection skridt til at sikre et højt udbytte af kobling reaktion. Ved hjælp af kolonnen og HPLC betingelser beskrevet i rapporten, eluerer thioacetate beskyttede 1,2-dithiolane forløber peptid peak 5 min efter afkoblede gratis Amin peptid. Hvis en betydelig mængde af gratis Amin peptid forbliver, en anden kobling skridt med 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre kan anbefales. Intramolekylære 1,2-dithiolane disulfid obligation er fundet på HPLC ved at overvåge de svage disulfid obligation absorbans på 330 nm. HPLC peak svarende til den oxiderede 1,2-dithiolane bekræftes ved at tilføje 100 L af 100 mM tris(2-carboxyethyl)phosphine(TCEP) til et peptid udsnit i et separat HPLC køre. TCEP reduceret thiol indeholdende peptid vil have en anden retentionstid end oxideret disulfid peptid. Thiol indeholdende peptid eluerer ca 1 min senere end disulfid peptid ved hjælp af kolonnen og betingelserne beskrevet i rapporten. En egnet alternativ MALDI matrix for peptider er α-cyano-4-hydroxycinnamic syre (CHCA) og er fremstillet ved tilsætning af 1 mL af 50% acetonitril med 0,1% TFA til 5 mg CHCA. Prøverne kan være afsaltes ved hjælp af en C18 zip-tip før MALDI-TOF masse analyse, hvis salt adduct (Na+ og K+) toppe betydeligt undertrykke [M + H]+ peak.
Peptid sekvensen valgt for disse undersøgelser er afledt af hollandske mutant af Aβ-peptid forbundet med Alzheimers sygdom30, og har tidligere vist at selv samle til amyloid fibre af parallelle β-sheets16,17 . Som vist i de repræsentative resultater, fig. 3A-C, samler 1,2-dithiolane-KLVFFAQ-NH2 peptid også i amyloid fibre. FTIR akrylamid jeg strække centreret på 1627cm-1 og CD ellipticity minimum på 218 nm er spektroskopiske underskrifter af β-plade forsamlinger25,26,27, og strækningen carbonyl CO 1676 cm-1 svarer til bestilte glutamin sidekæde interaktioner tyder på, at peptider er organiseret i parallelle β-tråde16,31,32.
Transmissions Elektron Mikroskopi billeder, ved hjælp af 2% uranyl acetat negative pletten, vise udvidede og vride Supramolekylær fibre, der er ca. 10 nm i bredden. Fibrene af den N-terminale acetyleret peptid, Ac-KLVFFAQ-NH2, er glat og lige, med en lidt større bredde af næsten 12 nm16. Da forberede TEM gitre og hentning af billeder er en intensiv proces, tid, er det bedst at forberede flere TEM gitre fra den samme forsamling prøve på én gang med varierende peptid koncentrationer. Forberede en fortyndet prøve til TEM (1:50 eller 1: 100) sammen med den oprindelige samling løsning prøve. Den amyloid fibre i høje koncentrationer kan tiltræde gitteret i klumper eller patches og hentning af billeder af enkelte fibre kan være vanskelig. Det er vigtigt at se kanterne af enkelte fibre for bredde målinger og visualisering af fiber helicity er ofte skjult af overfyldte prøver.
Som flere programmer ved hjælp af Supramolekylær biomaterialer udforskes, er der behov for at integrere potentielt reaktive funktionelle grupper, der er ortogonale i forhold til den samlesæt proces i de selvsamlende monomerer. Metoderne beskrevet i denne rapport fremhæver en på harpiks tilgang til syntese af en 1,2-dithiolane ændret selvsamlende peptid og spektroskopiske karakterisering af Supramolekylær strukturer.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Forfatterne vil gerne takke Dr. B. Ellen Scanley for hendes teknisk uddannelse og hjælp ved hjælp af TEM på Connecticut State Colleges og Universitet (CSCU) Center for nanoteknologi og Dr. Ishita Mukerji på Wesleyan University for adgang til hendes CD Spektrofotometer. Arbejdet rapporteret blev delvis støttet af Science Institute på Fairfield Universitet, NASA Connecticut plads Grant Consortium, og National Science Foundation under tilskud antal CHE-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



