Summary
1, 2-ジチオランの合成のためのプロトコルは、ペプチドやペプチドの自己集合結果超分子構造の評価に変更されました。
Abstract
本報告では N 末端の 1, 2-ジチオランの合成に焦点を当てて自己組織化ペプチドとその結果の評価を変更された自己組織化超分子構造。合成経路は、ジチオラン前駆体分子 3-(acetylthio)-2 の樹脂の結合の固相ペプチド合成の活用-(acetylthiomethyl) プロパン酸、およびマイクロ波を用いた thioacetate ペプチドの deprotection1, 2-ジチオランに屈する前に、ガレージから最終的な胸の谷間 N 末端ペプチドを変更しました。アルツハイマー病に関連付けられている a β ペプチドの核のコアから派生した、1, 2-ジチオラン ペプチドの高速液体クロマトグラフィー (HPLC) 精製後、ペプチドはクロス β アミロイド線維に自己組み立てるに表示されます。フーリエ変換赤外分光法 (FT-IR)、円二色性分光法 (CD) と透過型電子顕微鏡 (TEM) によるアミロイド繊維を特徴付けるためのプロトコルが表示されます。組立後変更戦略を開発し、動的共有結合化学を探索するモデル系として、よ特徴付けられた自己組織化ペプチドを 1, 2-ジチオラン構造 N 末端修飾の方法を検討今することができます。超分子のペプチド ナノファイバーの表面。
Introduction
固相ペプチド合成に関与する堅牢なペプチド結合の化学を形成し、シーケンスの長さと構成を制御する機能、超分子構造に重く研究フィールドをまとめる自己ペプチド。制御し、側鎖の立体を含むペプチドの自己組織化構造と静電相互作用、水素結合、疎水性効果1、安定の要因はデザイン ルールのセットとして機能します。これらの基本的な設計ルールに研究が進み、ペプチドの論理の次の手順では自己ペプチド ベースの構造と機能の多様性を拡大して含まれます。自己組織化ペプチドがペプチド シーケンスまたはアセンブリ条件2,3,4のための戦略の開発をチューニングすることによって多くの医用に使用されている汎用性の高い生体材料ペプチド ナノファイバー5,6,7,8,9組立後変更のまま比較的未踏の領域です。
動的ジスルフィド交換とチオール化学超分子構造体の表面では、機能的な新しい生体材料をもたらす可能性がある 1 つの領域です。1, 2-ジチオラン鎖 (一般的リポ酸 (la) やアスパラガス酸 (aa) の派生物) の設立がリポソーム システム10、11ブロック共重合体12,13と報告されています。表面14,15でアンカーを整理します。ここで、合成と 1, 2-ジチオラン機能グループ16、N 末端修飾アルツハイマー病に関連付けられている a β ペプチドの核のコアから派生した自己組織化ペプチドの特性を報告します。 17。結果として得られる分子繊維は今アミロイド繊維18の超分子表面にチオール、ジスルフィド交換反応性を研究する実験的プラットフォームとして機能します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 1, 2-ジチオランの合成・精製ペプチドを変更
- ジチオラン前駆体、3-(acetylthio)-2 の合成-(acetylthiomethyl) プロパン酸19。
- 3 の 1 グラムを追加-ブロモ - 2-(ブロモメチル) プロピオン酸 (1 当量) 最小限の 55 ° C で攪拌しながら 25 mL 丸底反応フラスコに 1 M 水酸化ナトリウム (約 4 mL) に溶解隔壁を有する反応フラスコを密封し、窒素雰囲気下で配置します。
- 1.49 カリウム thioacetate g を含むソリューションを準備 (3.2 当量) 4 ml の脱イオン水と 2 M 硫酸 3 mL (H2SO4) 酸場チオを作成します。
- プラスチック製の使い捨て 10 mL 注射器にチオ酢酸溶液を引き、注射器に針を配置します。セプテムを針で突き刺すことにより、反応フラスコに滴下し混合物を追加します。55 ° C で一晩反応を続ける
- メタノール及びジクロロ メタン (1:9) の混合物を用いたシリカゲル 60 F254板の薄層クロマトグラフィー (TLC) による反応を監視します。ブロモ クレゾール グリーン染色で反応の進行を視覚化します。製品は Rf = 0.57。
- 反応が完了したら部屋の温度に冷却後、だから 2 M H2pH 1 に混合物を酸性化4。黄色の油をソリューションから分離します。
- 冷たいクロロホルム (40 mL x 3) 製品を抽出します。有機層を結合し、硫酸マグネシウムで乾燥します。減圧下でクロロホルムを削除します。
- 図 1 bとCに示すように、核磁気共鳴 (NMR) 分光法による分離製品 ( 1) の id を確認します。次の結果を期待する: 1H NMR、CDCl3, 300 MHz: d = (s、6 H) 2.4 2.9 (m, 1 H)、3.2 (m, 4 H) 10.1 (b、1 H)13C NMR、CDCl3、75 MHz: d = 195.1 (CH3COS-)、177.6 (-COOH)、45.1 (CH2S-)、30.5 (CH)、29.2 (-SCOCH3)。
注: 製品は黄色の油、83% の全体的な利回り。さらに精製することがなく製品を使用します。
- SPP とジチオラン前駆体の樹脂に結合
注: 自動化されたペプチッド シンセサイザー、推奨メーカーのプロトコルを次に下記固相ペプチド合成を行った。設定と試薬は、特殊なアミノ酸を使用する場合またはその他の商業器械のため適応かもしれません。- 0.156 g リンク アミド 4-methylbenzhydrylamine (MBHA) 樹脂 (0.1 モル) の重量を量り、反応容器の場所します。合成の開始前に少なくとも 15 分のジメチルホルムアミド (DMF) に樹脂をうねり。
- 各 fluorenylmethyloxycarbonyl (fmoc 保護) の 4 の同等物を重量を量る保護アミノ酸 (0.4 モル) シーケンスと 0.152 g N、N、N'、N'- テトラメチル-O-(1H- benotriazol-1-イル) ウラン ヘキサフルオロリン酸 (0.4 モル、HBTU) のシーケンスの各アミノ酸。各カートリッジには、fmoc 保護保護アミノ酸と HBTU の両方が含まれています。
- すべて事前合成シンセサイザーのチェックを実行した後 (補充試薬、試薬の行をフラッシュされ、すべての試薬瓶を加圧)、C のカルーセルにアミノ酸カートリッジを配置 'n' 末端方向。N 末端 fmoc 保護脱保護の最後の手順の最終的なアミノ酸位置の後、空のカートリッジを配置します。
- 標準の推奨設定を使用するペプチドを合成します。
- DMF (5 分 × 2) で 20% ピペリジンの樹脂 5 mL を fmoc 保護グループを deprotect します。
- カップリング ステップの前に DMF (6 x 5 mL) と樹脂を洗浄します。
- 単一ステップの fmoc 保護保護アミノ酸と HBTU DMF で 0.4 M N-メチルモルホリン 4 mL を追加します。30 アミノ酸 fmoc 保護で保護されたソリューションをアクティブ ソリューションを反応容器に転送する前に s。
注: 自動ペプチド合成装置ミックス樹脂とソリューション N2ガスをバブリングによってあらゆる 30 のカップリング反応しながら 20 分間は場所を取ります。手動ペプチッド統合、低速で軌道シェーカーでカップリング段階の間反応容器を配置します。 - ソリューションをドレインし、DMF (3 x 5 mL) と樹脂を洗浄します。
- 1.2.4.4 を通じて 1.2.4.1 手順各 fmoc 保護保護アミノ酸の c 'n'-末端方向興味のペプチドを合成します。
- 最後の N ターミナル脱保護手順後ガラスフリット シリンジに樹脂を転送します。DMF (3 x 5 mL)、ジクロロ メタン (DCM、3 x 5 mL) に樹脂を洗浄します。
メモ: 樹脂は DCM 真空デシケータで洗浄後保存可能性があります。樹脂は、結合前に保存されていた、DMF でカップリング反応前に、の樹脂を膨張するを確認します。 - HBTU 4 相当 10 及び n, N-diisopropylethylamine (DIPEA) 1、dmf、5 mL の 4 の同等物を追加することによって樹脂のペプチドの N 末端にジチオラン前駆体 (1) のカップルします。ガラスフリットの注射器を含む樹脂を追加する前に 10 分間結合混合物を前活動化させます。
- 2 h のカップリング反応を振る。2 時間後に DMF (3 x 5 mL) 樹脂を洗浄し、一晩振動カップリング反応を繰り返します。
- 2 番目の結合後 DMF (3 x 5 mL)、DCM (3 x 5 mL) に樹脂を洗浄します。
注: 樹脂は真空下でこの時点で胸の谷間まで格納できます。
- Thioacetate および樹脂からペプチド胸の谷間
- N 末端ジチオラン前駆体から thioacetate グループを deprotect、乾燥した樹脂を 10 mL マイクロ波反応管に転送し、DMF の 2 mL を追加します。樹脂を膨潤する容器に小さな電磁攪拌棒を追加して、15 分間電磁攪拌の低速で再停止を許可します。
- 濃アンモニア水 2 mL を加えてシリコーン隔壁を有する反応容器のキャップ 45 分攪拌の 75 ° C の電子レンジ設定を使用してマイクロ波リアクター反応容器に配置。
- マイクロ波反応の完了後は、ガラスフリットきれいなシリンジに樹脂を転送します。DMF (2 x 5 mL)、メタノール (メタノール、2 x 5 mL) で洗浄します。
- 量 5 mL のメタノール (1:4)、濃水酸化アンモニウムのソリューションを追加します。ジチオラン環ジスルフィド結合の分子内酸化を増加するために一晩を振ることを残します。
- メタノール (2 x 5 mL)、DCM (3 x 5 mL) に樹脂を洗浄します。
注意: 乾燥した樹脂が格納する真空デシケータでこの時点で。 - 胸の谷間のカクテルを優しく 1.5 時間振とうしながら注射器を含む樹脂に追加します。95% トリフルオロ酢酸 (TFA)、2.5 %triisopropylsilane (ヒント)、2.5% 水 5 mL の容量であり、使用されるカクテルの谷間。
注意: にのみ化学発煙のフードの下で動作します。TFA は、揮発性および腐食性です。
注記: ペプチド配列とアミノ酸側鎖の保護基の大半は、上記の胸の谷間カクテル ソリューションは十分です。ただし、代替胸の谷間のカクテルは、特定のアミノ酸の側鎖 (システイン、メチオニン、Trp、Arg を含む特定のペプチド) のグループまたは他の樹脂化学20の保護のため必要かもしれない。 - ガラスフリットの注射器から滴下することで 50 mL の円錐管に冷たいジエチル エーテル 25 mL に原油のペプチドを沈殿させます。ペプチドは、白色固体として析出します。ペレットで 1300 x g で 10 分間の遠心分離によってペプチドは慎重に廃棄物収集のための別の容器にジエチル エーテルをデカントします。
- 円錐管にジエチル エーテルの別の 25 mL を追加し、再ボルテックスで沈殿を中断します。10 分間 1300 × g で遠心分離を繰り返し、ジエチル エーテルを再度デカントします。真空下でペレットを乾燥させます。
- 1, 2-ジチオランの精製は、ペプチドを変更
注: は、逆相高速液体クロマトグラフィーによる原油のペプチドを浄化します。収集しペプチド ピーク、MALDI-TOF 質量分析法による質量を確認します。- 0.1% アセトニ トリルの最小限の量で粗ペプチド ペレットを溶解 TFA。ペプチドの疎水性と集約傾向のため優しく溶解度を支援する 40 の ° C のサンプルを加熱します。
注: は、潜在的なジスルフィド交換反応21,22,23を防ぐために高い温度およびペプチドの超音波処理を避けてください。 - HPLC 精製の粗ペプチドの 1 mL を準備をするには、400 μ L を追加集中ペプチド株式のアセトニ トリルで 600 μ L H2O 0.1 %tfa とフィルターに 22 μ m シリンジ フィルターを通して HPLC バイアルに。追加の 5% イソプロパノールは、ペプチドの凝集を防ぐために追加できます。
- 浄化の 20 分セット 15-55% アセトニ トリルの線形グラデーションを 3 mL/min の流速で C-18 セミ分取カラムを用いたペプチド 222 に UV 検出器 nm (アミド バックボーン) と 330 nm (ジスルフィド結合)。収集し、(図 2 a) の関心のピークを組み合わせます。
- リフレクトロン モード (図 2 b) で MALDI-TOF 質量分析計でペプチド製品質量を確認します。0.5 μ L 2, 5-ジヒドロキシ安息香酸 (DHB) 行列の解析、ミックス MALDI プレートに収集されたピークの 0.5 μ L (10 mg/mL DHB アセトニ トリル 50%、0.1 %tfa)。
注: 一般的な MALDI-TOF における付加体の質量分析法は、ナトリウムとカリウム塩の付加物 ([M+na]+ [M + k]+) のピーク。推奨は、分析の前にサンプルの脱塩塩付加ピーク [M + H]+主峰の信号を抑制する場合。さらに、[M + O]+の酸化ピークも 1, 2-ジチオラン変更ペプチドの検出します。DHB 行列を用いた MALDI イオンからのレーザー誘起酸化に関する報告書では、MALDI 誘起酸化アーティファクト24を制限するため、サンプル濃度、溶媒、レーザー強度などの要因を変更できることを示唆しています。 - MALDI-TOF 正しい質量の確認の後に、フラッシュの凍結後ペプチドを凍結乾燥します。アセンブリまで真空下で凍結乾燥させたペプチド粉末を保ちます。
- 0.1% アセトニ トリルの最小限の量で粗ペプチド ペレットを溶解 TFA。ペプチドの疎水性と集約傾向のため優しく溶解度を支援する 40 の ° C のサンプルを加熱します。
2 分子の特性は自己組織化構造します。
-
アミロイド線維の形成
- 自己集合ソリューションを準備するには、分析用天秤を用いたペプチド粉末の 1 mg を重量を量る。20% アセトニ トリルと 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic 酸 (HEPES) 1 mg/mL ペプチド アセンブリ混合物の最終的な集中に、1.5 mL 遠心チューブの混合物 (pH 7.5) に溶解します。渦アセンブリ ソリューションと室温でアセンブルする残す。
-
アミロイド線維の分光学的キャラクタリゼーション
- 数日おきフーリエ変換の赤外線 (FTIR) 分光法によるペプチド アセンブリ プロセスに従います。1670 cm-1を中心とした広範なピークは、サンプル17の組み立てのペプチドから生じる IR 署名です。ペプチド アセンブリ サンプルは通常消えて、成熟に達する広い組み立てピークの 1 〜 2 週間を取る。
- ATR のダイヤモンド結晶の薄膜としてアセンブリ ソリューションの 8-10 μ L の因数を乾燥します。ドライ フィルム フォームとして 1630 cm-1に 1640 年から大きく、広い水のピークの消失を監視します。
- 1500-1800 cm-1 2 cm-1解像度 50 のスキャンの平均から IR スペクトルを取得します。取得し、各サンプル スキャン前にバック グラウンド ・ スキャンを減算します。Β シート アセンブリの赤外線署名は、1625 と 1635 cm-1 (図 3 a)25,26の間鋭いピークです。
- 円二色性 (CD) による β シート豊富な超分子構造にペプチド組み立てを特徴付けます。ペルチェ温度コントロール システムで CD 性分光を使用してスペクトルを記録します。
- 0.1 mm のパス長さ microcuvette でアセンブリ ソリューションの 30 μ L をピペットします。
注: 電池ホルダーはクランプし、楽器の短いパスの長さセルを配置する必要です。 - 各スペクトル CD 楽器を次のパラメーターに設定: 300 の波長をスキャン nm、180 nm、100/分のスキャン率 1 海里、25 ° C、3 つのスキャンの平均帯域幅。
- バッファー (20% アセトニ トリル/10 mM HEPES、pH 7.5) のスペクトルを収集し、コントロールとして各サンプル スキャンから減算します。Β シートの CD 署名は、楕円率、最小中心約 220 nm (図 3 b)27です。
- 0.1 mm のパス長さ microcuvette でアセンブリ ソリューションの 30 μ L をピペットします。
- 数日おきフーリエ変換の赤外線 (FTIR) 分光法によるペプチド アセンブリ プロセスに従います。1670 cm-1を中心とした広範なピークは、サンプル17の組み立てのペプチドから生じる IR 署名です。ペプチド アセンブリ サンプルは通常消えて、成熟に達する広い組み立てピークの 1 〜 2 週間を取る。
-
アミロイド繊維の顕微鏡観察
- Β シート豊富な超分子構造に成熟するペプチド試料の 2 〜 3 週間かかります。
注: アセンブリは、同様のアセンブリ プロセスの初期の段階で透過型電子顕微鏡 (TEM) を使用してイメージすることができます。- カーボンの TEM グリッドの表面上にペプチド アセンブリ ソリューションの 10 μ L をピペットします。
注: グリッド表面にピペット チップに触れないように注意してください。高精度、自動閉鎖準備中に TEM グリッドを保持するためにピンセットを使用します。 - 1-2 分グリッド表面に吸着するアセンブリを許可するを待ちます。余分なサンプルを削除するには、グリッドの端にフィルター ペーパーに触れます。
- 市販のウラニル 4% 酢酸溶液を 100 μ L の脱イオン水を追加することによって 2% ウラニル アセテート染色を準備します。グリッド サーフェス上に 2% ウラニル アセテート染色の 10 μ L をピペットし、2-3 分間インキュベートします。、孵化後、グリッドの端にろ紙を触れることにより、余分な汚れを削除します。
- 一晩真空デシケータに TEM グリッドを配置します。イメージングまで真空下で保存します。
- TEM (図 3) で作製した試料をイメージします。顕微鏡検査のための一般的なパラメーターは次のとおりです: に至る 9,300 X 23、倍率で画像 000 X 120 の加速電圧を持つタングステン フィラメント kV。
注: 取得した TEM 画像28の超分子構造体の平均繊維の幅を測定する ImageJ を使用できます。
注意: 使用する前にすべての関連する安全性データ シート (SDS) を参照してください。いくつかの化学物質は、合成、精製で使用されると説明 1, 2-ジチオラン修正の自己組織化ペプチドの解析、腐食性や毒性と化学の発煙のフードの下でのみ使用する必要があります。常に適切な個人用保護具 (安全眼鏡、白衣、フルの長さのズボン、閉じてつま先の靴を含む) を使用して、研究室で作業するとき。
- カーボンの TEM グリッドの表面上にペプチド アセンブリ ソリューションの 10 μ L をピペットします。
- Β シート豊富な超分子構造に成熟するペプチド試料の 2 〜 3 週間かかります。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ジチオラン前駆体分子の初期段階合成、脇から 1, 2-ジチオラン変更ペプチド合成の残りの部分は、固体支持体 (図 1 a) で発生します。3 の変換-ブロモ - 2-(ブロモメチル) プロピオン酸 3-(acetylthio)-2- 1H (acetylthiomethyl) プロパン酸、ジチオラン前駆体を確認し、 13C の NMR (図 1 bとC) それの前に自由に結合まだガレージにペプチドの N 末端アミン。マイクロ波リアクターを用いた水酸化アンモニウムとチオールに thioacetate の脱保護を実行し、1, 2-ジチオラン変更ペプチドは樹脂から切断前に 1, 2-ジチオランはメタノールの酸化一晩。逆相高速液体クロマトグラフィー (図 2 a) による原油のペプチドを精製し、MALDI-TOF 質量分析法 (図 2 b) による製品の質量を確認します。
自己精製 1, 2-ジチオラン ペプチドを 2-3 週間の期間で成熟したアミロイド線維に組み立てます。FT-IR (図 3 a) と CD スペクトル (図 3 b) を使用するには、アセンブリ プロセスに従うことと拡張の β シート構造を特徴付けます。繊維は、TEM (図 3) によって作成されます。
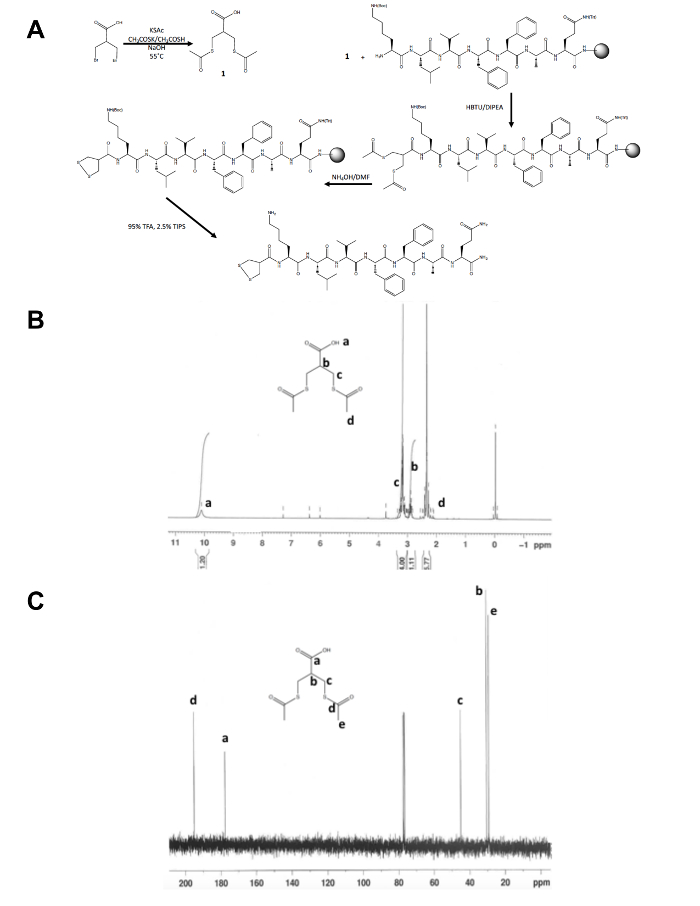
図 1。1, 2-ジチオラン前駆体分子の合成スキーム。(A) 1, 2-ジチオラン-KLVFFAQ-NH2最終的な 1, 2-ジチオラン変更ペプチドの合成方式です。(B) 1H NMR の 3-(acetylthio)-2-(acetylthiomethyl) プロパン酸 CDCl3 300 MHz (C)13C NMR の 3-(acetylthio)-2-(acetylthiomethyl) プロパン酸 CDCl3で 75 MHz。はこちらをご覧ください。この図の拡大版を表示します。

図 2。1, 2-ジチオランの合成ペプチドに変更。1, 2-ジチオラン-KLVFFAQ-NH2の浄化から(A)の HPLC クロマト グラム。(B) DHB 行列を用いたリフレクトロン モード HPLC 精製 (~17.5 分の保持時間) から主要なピークの MALDI-TOF 質量スペクトルは、1, 2-ジチオラン-KLVFFAQ-NH2計算される質量を確認します。一般的な付加体の識別されます。この図の拡大版を表示するのにはここをクリックしてください。

図 3。超分子の 1, 2-ジチオラン改変ペプチド。(A) 1 mg/mL 1, 2-ジチオラン-KLVFFAQ-NH2繊維の FT-IR は CH3CN 10 mM HEPES、pH 7.5 で 20% で組み立て。1627 cm-1にピークは β シート構造で組み立てられるペプチドと一貫性が。(B) 1 mg/mL 1, 2-ジチオラン-KLVFFAQ-NH2繊維の CD は 10 mM HEPES、pH 7.5 に 20% CH3CN で組み立てください。楕円率の最小値には 218 nm は β シート構造で組み立てられるペプチドと一貫性のあります。TEM による 1, 2-ジチオラン-KLVFFAQ-NH2アミロイド繊維 (2% 酢酸ウランの負染色) の(C)の画像。スケール バーは 100 nm。この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
この記事では、両方の合成の詳細は、N ターミナル 1, 2-ジチオラン修正の自己組織化ペプチドの精製と結果の超分子構造の性質をについて説明します。ここで報告される 1, 2-ジチオラン ペプチドの合成ジチオラン前駆体、3-(acetylthio)-2 を生成するワンステップ合成を含む利点があります-(acetylthiomethyl) プロパン酸と樹脂の電子レンジの脱保護反応、有毒なヒドラジンの脱保護する安全な代替案は既報29水酸化アンモニウムを利用しながら酸化 1, 2-ジチオラン構造を生成するためのグループを保護する前駆体 thioacetate。シーケンスの長さと合わせて fmoc 保護で保護された不自然なアミノ酸および C ターミナル樹脂化学を使用するなど、組成を変更することによって (図 1 a) 1, 2-ジチオラン ペプチドの全体的な固相ペプチド合成を簡単に変更することができます。多くの異なる研究アプリケーション。
求側鎖を有するアミノ酸またはグループを保護するとアミノ酸が反応性胸の谷間製品、不要なペプチド副産物を防止するため胸の谷間カクテル20に追加スカベン ジャーを追加する必要があります。小さな部分 (総樹脂 10% 未満) のテスト胸の谷間は、カップリング反応の高収量を確保するため樹脂にマイクロ波脱保護手順の前に実行されるかもしれません。カラムを用いる高速液体クロマトグラフィー条件レポートに記載されている、thioacetate 保護された 1, 2-ジチオラン前駆体ペプチド ピークは共役遊離アミン ペプチド後 5 分をた。大量遊離アミン ペプチドのまま、別のカップリング ステップ 3-(acetylthio)-2-(acetylthiomethyl) プロパン酸をお勧めします。330 弱い二硫化物結束吸光度を監視することによって、高速液体クロマトグラフィーで分子内の 1, 2-ジチオラン ジスルフィド結合が検出される nm。100 mM tris(2-carboxyethyl)phosphine(TCEP) の 100 L を実行別の HPLC におけるペプチドのサンプルに追加することによって酸化の 1, 2-ジチオランに対応する高速液体クロマトグラフィーのピークを確認しました。ペプチドを含む削減 TCEP チオール二硫化物酸化ペプチドよりも異なる保持時間があります。ペプチドを含むチオールた列およびレポートに記載されている条件を使用してジスルフィド結合ペプチドよりも後で約 1 分です。ペプチドの適切な代替 MALDI マトリックス α-シアノ-4-ヒドロキシケイ皮酸 (CHCA) で、0.1% と 50% アセトニ トリル 1 mL を追加することによって準備される TFA CHCA 5 mg。サンプルは、塩の付加 (Na+と K+) ピーク大幅抑制 [M + H]+ピーク MALDI-TOF 質量分析の前に zip チップ C18 を使用して脱塩することができます。
これらの研究のために選択されたペプチド シーケンス アルツハイマー病30に関連付けられている a β ペプチドのオランダの突然変異体から派生したし、以前平行 β シート16,17のアミロイド線維に自己組み立てるに示されています。.代表の結果、図 3 a・ Cに示すように、1, 2-ジチオラン-KLVFFAQ-NH2ペプチドはまたアミロイド線維にアセンブルします。1627 cm-1 218 最低 CD 楕円を中心としたストレッチ私 FTIR アミド nm が β シート ・ アセンブリ25,26,27, と 1676 cm-1 カルボニル CO ストレッチの分光署名グルタミン側鎖の相互作用はペプチド、平行 β ストランド16,31,32で編成されている示唆している注文に対応します。
ウラニルの 2% 酢酸否定的な汚れを使用して、透過電子顕微鏡画像表示拡張とねじれの超分子ファイバーを約 10 nm 幅の。Ac KLVFFAQ NH2、N 末端のアセチル化ペプチドの繊維は滑らかで、まっすぐ、ほぼ 12 nm16幅がわずかに大きい。TEM グリッドを準備し、画像を取得時間の集中的なプロセスであるために、一度に様々 なペプチド濃度の同じアセンブリ サンプルからいくつかの TEM グリッドを準備することをお勧めします。元のアセンブリ ソリューション サンプルと一緒に TEM (1:50 または 1: 100) を希釈したサンプルを準備します。高濃度におけるアミロイド線維が塊またはパッチのグリッドに準拠し、個々 の繊維の画像を取得することは、難しいかもしれません。幅測定のため個々 の繊維の端を見ることが重要で、繊維ヘリシティの可視化が過密のサンプルでよく隠されています。
超分子の生体材料を使用してより多くのアプリケーションを検討されているが、自己組織化モノマーに自己組織化プロセスは潜在的反応性の官能基を統合する必要があります。このレポートで説明する方法は、1, 2-ジチオラン修正の自己組織化ペプチドの合成と分子構造の分光学的キャラクタリゼーションへの樹脂のアプローチを強調表示します。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
著者博士 B. エレン Scanley をありがとう彼女の技術的なトレーニングと彼女の CD にアクセスするためのナノテク ・ ウェスリアン大学で博士中川ムカージについてコネチカット州立大学および大学 (CSCU) センターで TEM を使用してヘルプをしたいです。分光光度計。報告される作業は、フェア フィールド大学、NASA コネチカット宇宙グラント コンソーシアムの科学研究所、国立科学財団助成番号チェ-1624774 の下に一部サポートされていました。
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



