Summary
Un protocole pour la synthèse d’un 1, 2-dithiolane modifiée peptide et la caractérisation des structures supramoléculaires résultant de la peptide auto-assemblage.
Abstract
Ce rapport met l’accent sur la synthèse d’un N-terminal 1, 2-dithiolane modifiée auto-assemblage de peptide et la caractérisation du résultant self-assembled structures supramoléculaires. La voie de synthèse profite de la synthèse de peptide de phase solide avec l’accouplement sur résine de la molécule précurseur dithiolane, 3-(acetylthio) -2-acide propanoïque (acetylthiomethyl) et le thioacétate assistée par micro-ondes deprotection du peptide N-terminale avant dernier clivage de la résine pour donner le 1, 2-dithiolane modifiée peptide. Après la purification de la chromatographie en phase liquide à haute performance (HPLC) du peptide 1, 2-dithiolane, dérivé de la nucléation core du peptide Aβ associée à la maladie d’Alzheimer, le peptide est avéré s’auto-assembler en fibres amyloïdes Croix-β. Protocoles pour caractériser les fibres amyloïdes par spectroscopie infrarouge à transformée de Fourier (FT-IR), spectroscopie de dichroïsme circulaire (CD) et microscopie électronique à transmission (TEM) sont présentés. Les méthodes de modification de la N-terminale avec une portion de 1, 2-dithiolane aux peptides auto-assemblage bien caractérisés peuvent maintenant être explorées comme systèmes modèles pour élaborer des stratégies de modification après montage et Explorer chimie covalente dynamique sur surfaces de peptide supramoléculaire de nanofibres.
Introduction
La liaison peptidique robuste formant chimie impliquée dans la synthèse de peptide de phase solide et la possibilité de contrôler la composition et la durée d’une séquence font les peptides qui s’auto-assembler en structures supramoléculaires un champ largement documenté. Les facteurs qui contrôlent et stabilisent les structures auto-assemblées peptide, y compris la chaîne latérale stérique et interactions électrostatiques, des liaisons hydrogènes et effets hydrophobes1, constituent un ensemble de règles de conception. Comme des recherches menées sur ces règles de conception fondamentale continuent de progresser, l’étape logique suivante en peptide auto-assemblage consiste à élargir la diversité des fonctions et des structures à base de peptides. Lors de l’assemblage des peptides sont un biomatériau polyvalent qui ont été utilisés pour de nombreuses applications biomédicales en syntonisant le peptide séquence ou montage conditions2,3,4, l’élaboration de stratégies pour modifications après montage peptide nanofibres5,6,7,8,9 reste un domaine relativement inexploré.
Disulfure dynamique échange thiol chimie et à la surface des structures supramoléculaires est un secteur qui a le potentiel d’engendrer des biomatériaux nouveaux et fonctionnels. L’incorporation des portions de 1, 2-dithiolane (généralement un dérivé de l’acide lipoïque (la) ou l’acide asparagusique (aa)) ont été signalés dans un liposome systèmes10,11, copolymères de bloc12,13et en tant que ancres à surfaces14,15de l’organisation. Ici, nous rapportons la synthèse et la caractérisation d’un auto-assemblage peptide dérivé de la nucléation core du peptide Aβ associée à la maladie d’Alzheimer qui est modifiée à l’extrémité N-terminale avec un 1, 2-dithiolane groupe fonctionnel16, 17. Les fibres qui en résulte supramoléculaires servent désormais une plateforme expérimentale pour étudier la réactivité disulfure intracirconscriptions et thiols en surface des fibres amyloïdes18supramoléculaire.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. synthèse et Purification de 1, 2-Dithiolane modifiés Peptide
- Synthèse d’un précurseur dithiolane, 3-(acetylthio) -2-(acetylthiomethyl) acide propanoïque19.
- Ajouter 1 g 3-bromo - 2-(bromométhyl) l’acide propionique (1 équiv.) dissous dans une quantité minimale de 1 NaOH M (environ 4 mL) pour un ballon à fond rond 25 mL réaction en agitant à 55 ° C. Sceller le ballon à réaction avec un septum et placer sous atmosphère d’azote.
- Préparer une solution contenant 1,49 g de potassium thioacétate (3.2 équiv.) dans 4 mL d’eau désionisée et 3 mL d’acide sulfurique 2 M (H2SO4) pour créer thioacétique acid in situ.
- Tirez la solution acide thioacétique dans une seringue en plastique jetable 10 mL et placer une aiguille sur la seringue. Ajouter le mélange goutte à goutte le ballon à réaction en perçant à travers le septum avec l’aiguille. Continuer la réaction du jour au lendemain à 55 ° C.
- Surveiller la réaction par chromatographie sur couche mince (TLC) sur gel de silice 60 F254 plaques à l’aide d’un mélange de méthanol et de dichlorométhane (1:9). Visualiser la progression de la réaction de tache de vert de bromocrésol. Le produit a un Rf = 0,57.
- Après la réaction est complète et refroidi à la température ambiante, acidifier le mélange à pH 1 avec 2 M H2SO4. Une huile jaune sépare hors de la solution.
- Extrait le produit avec du chloroforme froid (40 mL x 3). Combiner les couches organiques et sécher sur sulfate de magnésium. Retirez le chloroforme sous pression réduite.
- Confirmer l’identité du produit isolé, 1, par spectroscopie de résonance magnétique nucléaire (RMN), comme illustré dans les Figures 1 b et C. Attendons les résultats suivants : 1H RMN, CDCl3, 300 MHz : d = 10,1 (b, 1 H), 3.2 (m, 4 H), 2,9 (m, 1 H) 2.4 (s, 6 H) ; 13 RMN du 13C, CDCl3, 75 MHz : d = 195.1 (CH3COS-), 177,6 (-OOHC), 45,1 (-CH2S), 30.5(Caba), 29.2 (-SCOCH3).
Remarque : Le produit est une huile jaune et a un rendement global de 83 %. Utiliser le produit sans davantage de purification.
- RCR et le couplage sur la résine de Dithiolane précurseur
Note : La synthèse de peptide de phase solide décrite ci-dessous a été effectuée sur un synthétiseur de peptide automatisé, suivant les protocoles du fabricant recommandée. Réactifs et des paramètres peuvent être adaptés pour d’autres instruments commerciaux ou lors de l’utilisation spécialisée des acides aminés.- Peser de 0,156 g de résine de 4-methylbenzhydrylamine (MBHA) patinoire amide (0,1 mmol) et les placer dans un réacteur. Gonfler la résine dans le diméthylformamide (DMF) pendant au moins 15 minutes avant le début de la synthèse.
- Peser 4 équivalents de chaque fluorenylmethyloxycarbonyl (Fmoc) protégé des acides aminés (0,4 mmol) dans la séquence et 0,152 g de N, N, N', N'- tétraméthyl-O-(1H- benotriazol-1-yl) uranium hexafluorophosphate (0,4 mmol, HBTU) pour chaque acide aminé dans la séquence. Chaque cartouche contient le Fmoc-protégé des acides aminés et HBTU.
- Après l’exécution de synthèse avant tous les contrôles sur le synthétiseur (remplir les réactifs, vidées lignes réactif et pressurisé tous les flacons de réactifs), placer les cartouches acides aminés dans le carrousel au C' n ' direction terminus. Placez une cartouche vide après la position finale en acide aminé pour la dernière étape de déprotection Fmoc N-terminale.
- Synthétiser le peptide avec les paramètres recommandés standards.
- Déprotéger le groupe Fmoc de la résine avec 5 mL de pipéridine de 20 % dans le DMF (5 min x 2).
- Laver la résine avec DMF (6 x 5 mL) avant l’étape de l’accouplement.
- Pour une couplage unique étape, ajouter 4 mL de 0,4 M N-méthylmorpholine dans le DMF à l’aminoacide Fmoc-protégés et HBTU. Activer la solution Fmoc-protégé des acides aminés pendant 30 s avant de les transvaser la solution dans la cuve de réaction.
Remarque : Le synthétiseur de peptide automatisé mêle la résine et la solution de propagation N2 gaz toutes les 30 s pendant 20 min alors que la réaction de couplage a lieu. Pour la synthèse peptidique manuelle, placer la cuve de réaction dans un agitateur orbital à basse vitesse pendant la durée de l’étape de l’accouplement. - Egoutter la solution et laver la résine avec DMF (3 x 5 mL).
- Répétez les étapes 1.2.4.1 par 1.2.4.4 pour chaque acide aminé Fmoc-protégé dans la C' n '-direction terminus pour synthétiser le peptide d’intérêt.
- Après l’étape finale de déprotection N-terminale, transférer la résine dans une seringue jetable frittée. Laver la résine avec DMF (3 x 5 mL) et le dichlorométhane (DCM, 3 x 5 mL).
Remarque : La résine peut-être être conservée après lavage dans un dessiccateur à vide de DCM. Si la résine a été stockée avant l’accouplement, vérifier que vous pour gonfler la résine dans le DMF avant la réaction de couplage. - Coupler le précurseur dithiolane (1) sur N-terminal du peptide sur la résine en ajoutant 4 équivalents de 1, 5 mL de DMF, 4 équivalents de HBTU et 10 équivalents de N, N-diisopropyléthylamine (DIPEA). Préactiver le mélange de couplage pendant 10 min avant d’ajouter à la résine contenant une seringue frittée.
- Secouez la réaction de couplage pendant 2 h. Après 2 h, laver la résine avec DMF (3 x 5 mL) et répéter la réaction de couplage avec agitation du jour au lendemain.
- Après le deuxième couplage, laver la résine avec DMF (3 x 5 mL) et de DCM (3 x 5 mL).
Remarque : La résine peut être stockée à ce point sous vide jusqu’au décolleté.
- La déprotection de thioacétate et de clivage du Peptide de résine
- Pour déprotéger le groupe thioacétate partir du précurseur de dithiolane aminée, transférer la résine séchée dans un tube de réaction de micro-ondes de 10 mL et ajouter 2 mL de DMF. Laisser l’échangeur gonfler, ajouter un petit magnétique au navire et remettre en suspension avec une faible vitesse de l’agitateur magnétique pendant 15 min.
- Ajouter 2 mL de concentré hydroxyde d’ammonium, cap de la cuve de réaction avec les septa silicone et placez la cuve dans un réacteur de micro-ondes en utilisant les paramètres de micro-ondes de 75 ° C pendant 45 min en remuant.
- Après que la réaction de micro-ondes est terminée, transférer la résine dans une seringue jetable propre frittée. Laver avec DMF (2 x 5 mL) et de méthanol (MeOH, 2 x 5 mL).
- Ajouter une solution concentrée d’hydroxyde d’ammonium dans le méthanol (1:4), pour un volume total de 5 mL. Autorisation d’agiter pendant la nuit pour augmenter l’oxydation intramoléculaire du pont disulfure dans dithiolane ring.
- Laver la résine avec MeOH (2 x 5 mL) et de DCM (3 x 5 mL).
Remarque : La résine séchée peut-être être stockée à ce stade dans un dessiccateur à vide. - Ajouter le cocktail de clivage de la résine contenant la seringue en agitant doucement pendant 1,5 h. Le clivage cocktail utilisé est l’acide trifluoroacétique (TFA) de 95 %, 2,5 % triisopropylsilane (conseils) et 2,5 % d’eau à un volume total de 5 mL.
ATTENTION : Travailler sous hotte chimique seulement. TFA est volatil et corrosif.
Remarque : Pour la majorité des séquences de peptides et acides aminés sidechain groupes protecteurs, la solution de cocktail de clivage ci-dessus est suffisante ; Toutefois, des cocktails de clivage alternatif peuvent être nécessaire pour certaine acides aminés de la chaîne de la côté protection de groupes (en particuliers peptides contenant Cys, Met, Trp et Arg) ou autre résine chimie20. - Précipiter le peptide brut dans 25 mL d’éther froid dans un tube conique de 50 mL par addition de goutte à goutte de la seringue frittée. Le peptide précipite sous forme de solide blanc. Granule le peptide par centrifugation à 1300 x g pendant 10 min. décanter soigneusement l’éther dans un récipient séparé pour la collecte des déchets.
- Ajouter un autre 25 mL d’éther diéthylique dans le tube conique et remettre en suspension le précipité au vortex. Répétez la centrifugation à 1300 x g pendant 10 min et éliminer l’éther diéthylique à nouveau. Sécher le culot sous vide.
- Purification de 1, 2-Dithiolane modifiée Peptide
Remarque : Purifier le peptide brut par HPLC en phase inverse. Recueillir et combiner les pics de peptide et confirmer la masse par spectrométrie de masse MALDI-TOF.- Dissoudre le culot de peptide brut dans une quantité minimale d’acétonitrile avec 0,1 % TFA. En raison d’hydrophobicité de peptide et la propension de l’agrégation, doucement chauffer l’échantillon à 40 ° C à l’aide de solubilité.
Remarque : Éviter les plus élevés de températures et de sonication du peptide afin d’éviter les éventuels disulfure échange réactions21,22,23. - Pour préparer 1 mL de peptide brut purification HPLC, ajouter 400 μL de stock de peptide concentré dans l’acétonitrile à 600 μL de H2O avec 0,1 % TFA et filtrer à travers un filtre de seringue 22 μm dans un flacon HPLC. L’isopropanol 5 % supplémentaires peut être ajouté pour empêcher la précipitation et l’agrégation du peptide.
- Purifier le peptide en utilisant la colonne semi-préparative C-18 avec un débit de 3 mL/min par rapport à un gradient linéaire de 15-55 % d’acétonitrile dans 20 min. jeu de détecteurs UV à 222 nm (dorsale de l’amide) et 330 nm (pont disulfure). Rassembler et combiner les pics d’intérêt (Figure 2 a).
- Confirmer la masse de produit de peptide par spectromètre de masse MALDI-TOF en mode réflectron (Figure 2 b). Pour l’analyse, mélangez 0,5 μL de peak recueillie sur la plaque MALDI avec 0,5 μL de matrice (DHB) l’acide 2, 5-dihydroxybenzoïque (10 mg/mL DHB dans 50 % d’acétonitrile, 0,1 % TFA).
Remarque : Communs adduits de MALDI-TOF spectrométrie de masse incluent le sodium et sel de potassium d’adduits ([M + Na]+ et [M + K]+) pics. Dessalage de l’échantillon avant l’analyse est recommandé si les sommets de l’adduit sel suppriment le signal du pic principal [M + H]+ . En outre, un pic oxydé de [M + O]+ est également détecté dans le peptide de 1, 2-dithiolane modifiée. Un rapport sur laser induite par oxydation de l’ionisation de MALDI à l’aide de la matrice DHB suggère que les facteurs dont la concentration de l’échantillon, solvant et intensité du laser peuvent être modifiées pour limiter la MALDI induite par oxydation artefact24. - Après confirmation de MALDI-TOF de la masse correcte, lyophiliser le peptide après congélation flash. Conserver la poudre lyophilisée peptide sous vide jusqu'à l’Assemblée.
- Dissoudre le culot de peptide brut dans une quantité minimale d’acétonitrile avec 0,1 % TFA. En raison d’hydrophobicité de peptide et la propension de l’agrégation, doucement chauffer l’échantillon à 40 ° C à l’aide de solubilité.
2. caractérisation des supramoléculaire auto-assemblage Structures
-
Formation de fibres amyloïdes
- Pour préparer l’auto-assemblage solution, peser 1 mg de la poudre de peptide à l’aide d’une balance analytique. Dissoudre dans un mélange (pH 7.5) de 20 % d’acétonitrile et de 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acide (HEPES) dans un tube de microtubes de 1,5 mL, à une concentration finale de 1 mg/mL peptide Assemblée du mélange. Vortex solution d’assemblage et laisser monter à température ambiante.
-
Caractérisation spectroscopique des fibres amyloïdes
- Suivez le processus d’assemblage de peptide par spectroscopie infrarouge à transformée de Fourier (FTIR) tous les jours. Un pic large centré autour de 1670 cm-1 est la signature IR dus aux peptides non assemblés dans l' exemple17. Les échantillons de l’Assemblée de peptide prennent généralement une à deux semaines pour le pic large démontée à disparaître et arriver à maturation.
- Sécher une partie aliquote de 8-10 μL de la solution de montage comme une fine pellicule sur le cristal de diamant de RTA. Surveiller la disparition d’un pic d’eau grandes et larges de 1640 à 1630 cm-1 que les formes du feuil sec.
- Acquisition de spectres IR de 1500-1800 cm-1 avec une moyenne de 50 scanne avec une résolution de-1 cm 2. Acquérir et soustraire les scans de fond avant chaque analyse d’échantillon. La signature IR pour l’assemblage de feuillet β est un pic entre 1625 et 1635 cm-1 (Figure 3 a)25,26.
- Caractériser l’ensemble de peptide dans des structures supramoléculaires riches feuillet β par dichroïsme circulaire (CD). Enregistrer les spectres à l’aide d’un spectropolarimètre CD avec un système de contrôle de température Peltier.
- Distribuer 30 μL de la solution d’assemblage dans une cuvette de longueur de chemin d’accès de 0,1 mm.
Remarque : Un porte-cuve est nécessaire pour le fixer et positionner la cellule de longueur de chemin d’accès court dans l’instrument. - Pour chaque gamme, définissez l’instrument CD aux paramètres suivants : analyse des longueurs d’onde de 300 nm à 180 nm, taux d’echantillonage de 100/min, largeur de bande de 1 nm, 25 ° C, en moyenne trois balayages.
- Recueillir un éventail de la mémoire tampon (20 % d’acétonitrile/10 mM, HEPES, pH 7,5) et soustraire de chaque analyse de l’échantillon sous forme de contrôle. La signature de CD pour les β-feuilles est qu'une ellipticité minimale centrée autour de 220 nm (Figure 3 b)27.
- Distribuer 30 μL de la solution d’assemblage dans une cuvette de longueur de chemin d’accès de 0,1 mm.
- Suivez le processus d’assemblage de peptide par spectroscopie infrarouge à transformée de Fourier (FTIR) tous les jours. Un pic large centré autour de 1670 cm-1 est la signature IR dus aux peptides non assemblés dans l' exemple17. Les échantillons de l’Assemblée de peptide prennent généralement une à deux semaines pour le pic large démontée à disparaître et arriver à maturation.
-
Microscopie de fibres amyloïdes
- Laisser deux à trois semaines pour les échantillons de peptide à mûrir dans des structures supramoléculaires riches feuillet β.
Remarque : Les assemblys peuvent être photographiées en utilisant la microscopie électronique à transmission (TEM) aux premiers stades de la procédure de l’Assemblée ainsi.- Pipeter 10 μL de la solution d’assemblage de peptide à la surface de la grille de carbone TEM.
Remarque : prenez soin de ne pas pour toucher le bout de la pipette à la surface de la grille. Haute précision, à fermeture automatique pinces servent à retenir la grille TEM pendant la préparation. - Attendre 1-2 min pour permettre les assemblées s’adsorber sur la surface de la grille. Retirer les excès d’échantillon en touchant le papier filtre au bord de la grille.
- Préparer une tache 2 % de l’acétate d’uranyle en ajoutant 100 μL d’eau déionisée à la solution d’acétate d’uranyle 4 % disponibles dans le commerce. Distribuer 10 μL de la tache de l’acétate d’uranyle de 2 % sur la surface de la grille et incuber pendant 2-3 min. Après l’incubation, enlever tache excès en touchant le papier filtre au bord de la grille.
- Placer les grilles TEM dans un dessiccateur à vide pendant la nuit. Conserver sous vide jusqu'à l’imagerie.
- Les échantillons préparés avec TEM (Figure 3) de l’image. Voici les paramètres typiques pour la microscopie : images à grossissements allant de 9 300 X 23, 000 X, filament de tungstène avec une tension d’accélération de 120 kV.
Remarque : ImageJ peut être utilisé pour mesurer la largeur de la fibre moyenne des structures supramoléculaires d’acquis TEM images28.
ATTENTION : Veuillez consulter toutes les fiches de données de sécurité (SDS) avant utilisation. Plusieurs produits chimiques utilisés dans la synthèse, la purification, et la caractérisation des peptides auto-assemblage décrit 1, 2-dithiolane modifiée corrosifs ou toxiques et ne doit être utilisé sous une hotte chimique. Utilisez toujours l’équipement de protection individuelle approprié (y compris les lunettes de sécurité, blouse de laboratoire, pleine longueur pantalon, chaussures fermées) lorsque vous travaillez dans le laboratoire.
- Pipeter 10 μL de la solution d’assemblage de peptide à la surface de la grille de carbone TEM.
- Laisser deux à trois semaines pour les échantillons de peptide à mûrir dans des structures supramoléculaires riches feuillet β.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
En dehors de la synthèse en une étape initiale de la molécule précurseur de dithiolane, le reste de la synthèse de peptide de 1, 2-dithiolane modifiée se produit sur un support solide (Figure 1 a). La conversion de 3-bromo - 2-(bromométhyl) propionique acide 3-(acetylthio) -2-(acetylthiomethyl), acide propanoïque, le précurseur de dithiolane, est confirmée par 1H et de 13C RMN (Figure 1 b et C) dont il est couplé à la libre Amine aminée d’un peptide encore sur la résine. La déprotection du thioacétate de thiols avec de l’hydroxyde d’ammonium est effectuée à l’aide d’un réacteur de micro-ondes et le 1, 2-dithiolane est oxydé pendant la nuit dans le méthanol, avant que le peptide de 1, 2-dithiolane modifiée est clivé de la résine. Le peptide brut est purifié par inversion de phase HPLC (Figure 2 a) et la masse du produit est confirmé par spectrométrie de masse MALDI-TOF (Figure 2 b).
Le peptide purifié 1, 2-dithiolane s’assemble en fibres amyloïdes matures pendant 2-3 semaines. FT-IR (Figure 3 a) et spectroscopie CD (Figure 3 b) sont utilisés pour suivre le processus d’assemblage et de caractériser la conformation β-feuille allongée. Les fibres sont imagés par TEM (Figure 3).
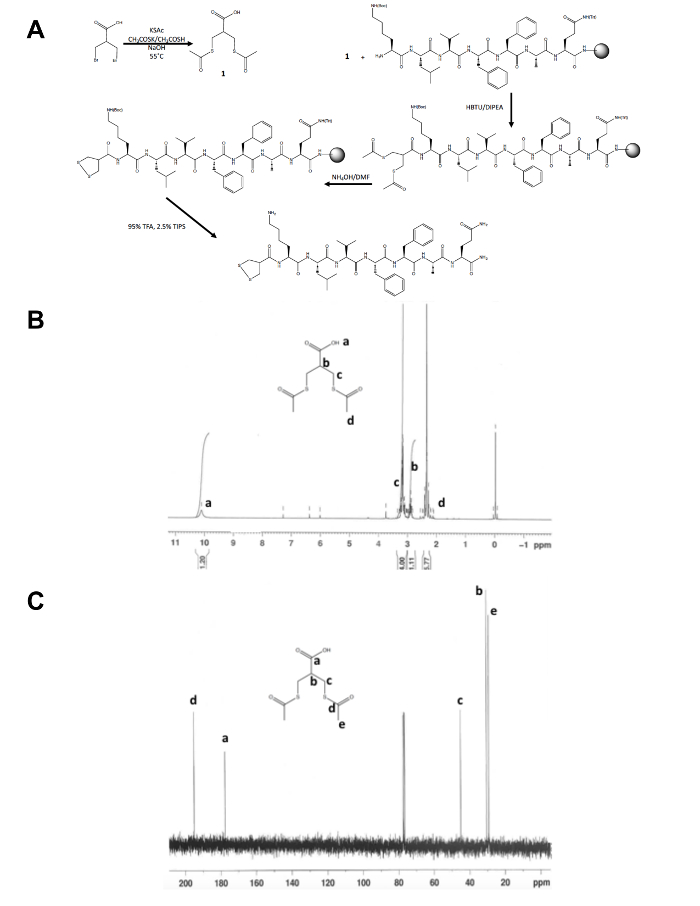
Figure 1. Schéma synthétique pour la caractérisation de la molécule précurseur de 1, 2-dithiolane. (A) schéma synthétique du peptide finale 1, 2-dithiolane modifiée, 1, 2-dithiolane-KLVFFAQ-NH2. (B) 1H-RMN du 3-(acetylthio) -2-(acetylthiomethyl) de l’acide propanoïque CDCl3 à 300 MHz. (C)13C-RMN du 3-(acetylthio) -2 - acide propanoïque (acetylthiomethyl) dans CDCl3 à 75 MHz. s’il vous plaît cliquez ici pour obtenir une version agrandie de cette figure.

Figure 2. Synthèse de 1, 2-dithiolane modifiée peptide. Chromatogramme HPLC (A) de la purification de 1, 2-dithiolane - KLVFFAQ-NH2. (B) le spectre de masse MALDI-TOF du pic principal de purification HPLC (temps de rétention de ~17.5 min) en mode réflectron, à l’aide de la matrice DHB confirme la masse calculée de 1, 2-dithiolane-KLVFFAQ-NH2. Communs adduits sont également identifiés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3. La caractérisation supramoléculaire de 1, 2-dithiolane modifiée peptide. (A) FT-IR des fibres de 1 mg/mL 1, 2-dithiolane-KLVFFAQ-NH2 assemblés en 10 mM HEPES, pH 7,5 sur 20 % CH3CN. Le pic à 1627 cm-1 est compatible avec les peptides assemblés dans une conformation β-feuille. (B) CD des fibres de 1 mg/mL 1, 2-dithiolane-KLVFFAQ-NH2 assemblés en 10 mM HEPES, pH 7,5 sur 20 % CH3CN. L’ellipticité minimum à 218 nm est compatible avec les peptides assemblés dans une conformation β-feuille. (C) Image de la fibre d’amyloïde de 1, 2-dithiolane-KLVFFAQ-NH2 (colorant négatif de 2 % d’acétate d’uranyle) par TEM. Barre d’échelle est de 100 nm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Cet article explique les détails de la synthèse et la purification d’un peptide auto-assemblage de N-terminal 1, 2-dithiolane modifiée et la caractérisation des structures supramoléculaires qui en résulte. La synthèse du peptide 1, 2-dithiolane rapporté ici a des avantages, y compris une synthèse en une étape pour produire le précurseur dithiolane, 3-(acetylthio) -2-acide propanoïque (acetylthiomethyl) et la résine sur micro-ondes réaction de déprotection de la précurseur thioacétate de groupe pour obtenir la fraction oxydée 1, 2-dithiolane utilisant de l’hydroxyde d’ammonium comme une alternative plus sûre à la déprotection de l’hydrazine toxique indiqué précédemment29protecteur. La synthèse de peptide de phase solide dans l’ensemble du peptide 1, 2-dithiolane (Figure 1 a) peut facilement être modifiée en changeant la longueur de la séquence et la composition, y compris en utilisant Fmoc-protégé des acides aminés non naturels et la chimie de résine C-terminale en fonction de de nombreuses applications de recherche différents.
Afin d’éviter des sous-produits indésirables peptide lorsque les acides aminés à chaînes latérales nucléophile ou les acides aminés avec groupes protecteurs ont produits de clivage réactive, charognards supplémentaires s’ajouteront au clivage cocktail20; Un clivage de test d’une petite portion (moins de 10 % du total des résines) peut-être être effectué avant l’étape de déprotection sur résine micro-ondes afin d’assurer un haut rendement de la réaction de couplage. À l’aide de la colonne et conditions CLHP décrites dans le rapport, le pic de peptide précurseur thioacétate protégées 1, 2-dithiolane élue 5 min après le peptide dételé amines libres. Si une quantité importante de peptide amine libre reste, une autre étape de couplage avec 3-(acetylthio) -2-acide propanoïque (acetylthiomethyl) est recommandé. La liaison disulfure intramoléculaire 1, 2-dithiolane est détectée sur la CLHP en surveillant l’absorbance de liaison disulfure faible à 330 nm. Le pic HPLC correspondant à la 1, 2-dithiolane oxydé est confirmé en ajoutant 100 L de tris(2-carboxyethyl)phosphine(TCEP) de 100 mM à un échantillon de peptide dans une HPLC séparé exécuter. Le thiol PTCE réduit contenant peptide auront un temps de rétention différent que le peptide disulfide oxydé. Le thiol contenant peptide élué environ 1 min plus tard que le peptide disulfide à l’aide de la colonne et les conditions décrites dans le rapport. Une matrice MALDI alternative adaptée aux peptides est α-cyano-4-hydroxycinnamique (ACSSD) et est préparée en ajoutant 1 mL de 50 % d’acétonitrile avec 0,1 % TFA à 5 mg de CHCA. Les échantillons peuvent être dessalées à l’aide d’une zip de C18-pointe avant analyse de masse MALDI-TOF si les sommets de l’adduit sel (Na+ et K+) suppriment significativement le pic [M + H]+ .
La séquence peptidique choisie pour ces études est dérivée de hollandais mutant de la peptide Aβ associé à la maladie d’Alzheimer30et a déjà montrée de s’auto-assembler en fibres amyloïdes de β-feuilles parallèles16,17 . Comme le montre les résultats représentatifs, Figure 3 a-C, le peptide de 1, 2-dithiolane-KLVFFAQ-NH2 assemble également en fibres amyloïdes. L’amide FTIR j’étends centrée à 1627cm-1 et CD ellipticité minimum à 218 nm sont des signatures spectroscopiques des assemblys de β-feuille25,26,27et le tronçon de carbonyle CO à 1 676 cm-1 correspondant à commandé les interactions de la glutamine chaîne latérale suggèrent que les peptides sont organisés en brins β parallèle16,31,32.
Images de microscopie électronique de transmission, à l’aide de colorant négatif acétate d’uranyle de 2 %, montrent des fibres supramoléculaires longues et sinueuses qui sont environ 10 nm de large. Les fibres du peptide N-terminal acétylé, Ac-KLVFFAQ-NH2, sont lisses et droites, d’une largeur légèrement supérieure de presque 12 nm16. Préparation des grilles TEM et acquisition d’images étant un processus intensif de temps, il est préférable de préparer plusieurs grilles de TEM partir du même échantillon d’assemblage à la fois de diverses concentrations de peptide. Préparer un échantillon dilué pour TEM (01:50 ou 1/100) aux côtés de l’exemple de solution de montage original. Les fibres amyloïdes à des concentrations élevées peuvent adhérer au réseau en touffes ou des correctifs et acquisition d’images de fibres individuelles peut s’avérer difficile. Il est important de voir les bords des fibres individuelles pour les mesures de la largeur et la visualisation de fibre hélicité est souvent obscurcie par échantillons surpeuplées.
Comme plus d’applications à l’aide de biomatériaux supramoléculaires sont explorées, il y a une nécessité d’intégrer les groupements fonctionnels potentiellement réactifs qui sont orthogonaux pour le processus d’auto-assemblage dans les monomères auto-assemblage. Les méthodes décrites dans le présent rapport mettent en évidence une approche sur la résine à la synthèse d’un peptide auto-assemblage de 1, 2-dithiolane modifiée et caractérisation spectroscopique des structures supramoléculaires.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Les auteurs tiennent à remercier Dr B. Ellen Scanley pour sa formation technique et aider grâce à la TEM au Connecticut State Colleges and University (CSCU) Center for Nanotechnology et Dr Ishita Mukerji à la Wesleyan University pour son CD spectrophotomètre. Le travail a été en partie pris en charge par l’Institut des sciences à l’Université de Fairfield, la NASA Connecticut Space Grant Consortium et par la National Science Foundation sous Grant nombre CHE-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



