Summary
פרוטוקול לסינתזה של 1, 2-dithiolane ששינה פפטיד ואפיון המבנים סופרא מולקולרית הנובע פפטיד הרכבה עצמית.
Abstract
הדו ח מתמקד הסינתזה של קצה אמיני 1, 2-dithiolane שינוי עצמי וההספק פפטיד, אפיון וכתוצאה מכך התאספו עצמית מבנים סופרא מולקולרית. המסלול סינתטי מנצל מוצק-פאזי פפטיד סינתזה עם המושבים על-שרף של dithiolane מולקולה קודמן, 3-(acetylthio)-2-חומצה propanoic (acetylthiomethyl), את thioacetate בסיוע מיקרוגל deprotection של פפטיד אמיני לפני המחשוף הסופי של השרף להניב את 1, 2-dithiolane ששינה פפטיד. לאחר הטיהור ביצועים גבוהים כרומטוגרפיה נוזלית (HPLC) של פפטיד 1, 2-dithiolane, נגזר ליבת nucleating פפטיד Aβ הקשורים עם מחלת אלצהיימר, מוצג על פפטיד להרכיב עצמי לתוך סיבי עמילואיד קרוס-β. פרוטוקולים לאפיין את סיבי עמילואיד על ידי פורייה-ספקטרוסקופיית (FT-IR), קיווטות ספקטרוסקופיה (CD) במיקרוסקופ אלקטרונים הילוכים (TEM) מוצגים. השיטות של שינוי N-מסוף עם moiety 1, 2-dithiolane פפטידים עצמית וההספק מאופיין היטב עכשיו ניתן לסייר כמערכות מודל לפיתוח אסטרטגיות ההרכבה שלאחר השינוי ולחקור דינמי כימיה קוולנטיות על פפטיד סופרא מולקולרית nanofiber משטחים.
Introduction
הקשר הפפטידי חזקים ויוצרים כימיה מעורב פפטיד מוצק-שלב הסינתזה ולעשות היכולת לשלוט רצף באורך ו הלחנה של פפטידים בעצמם למבנים סופרא מולקולרית שדה חקר בכבדות. הגורמים לשלוט ולייצב את מבנים מורכבים עצמית פפטיד, כולל שרשרת הצד הסטריים אלקטרוסטאטיות, מימן, וכוחות אפקטים הידרופובי1, לשמש ערכה של כללי עיצוב. כמו המחקר לתוך אלה כללי עיצוב בסיסי ממשיך להתקדם, הצעד ההגיוני הבא בפפטיד כוללת הרכבה עצמית הרחבת המגוון של מבנים מבוססת על פפטיד ופונקציות. בעוד עצמית בהרכבת פפטידים נמצאים biomaterial רב-תכליתי נעשה בהם שימוש ביו יישומים רבים על-ידי כיוונון פפטיד רצף או מכלול התנאים2,3,4, הפיתוח של אסטרטגיות שינויים שלאחר ההרכבה פפטיד nanofibers5,6,7,8,9 נשאר אזור יחסית שאינו גלוי.
כימיה exchange ותיול דיסולפידי דינמי על פני השטח של מבנים סופרא מולקולרית היא אזור בעל פוטנציאל תשואה biomaterials חדש ופונקציונלי. שילוב של 1, 2-dithiolane moieties (בדרך כלל נגזרת של חומצה ליפואית (la) או חומצה asparagusic (aa)) דווחו ליפוזום מערכות10,11,12,copolymers בלוק13, וכן ארגון עוגנים משטחים14,15. במסמך זה, אנחנו מדווחים על סינתזה ואפיון של פפטיד עצמית וההספק המופק nucleating הליבה של פפטיד Aβ הקשורים עם מחלת אלצהיימר ששונתה ב קצה אמיני עם קבוצה פונקציונלית 1, 2-dithiolane16, 17. הסיבים סופרא מולקולרית וכתוצאה מכך עכשיו לשמש פלטפורמה ניסיוני ללמוד את תגובתיות דיסולפידי-exchange ותיול על פני השטח סופרא מולקולרית של סיבי עמילואיד18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. סינתזה ולטיהור 1, 2-Dithiolane ששינה פפטיד
- סינתזה של קודמן dithiolane, 3-(acetylthio)-2-חומצה propanoic (acetylthiomethyl)19.
- להוסיף 1 גר' 3-ברומו - 2-(bromomethyl) חומצה propionic (1 equiv.) מומס כמות מינימלית של NaOH M 1 (כ- 4 מ"ל) אל בקבוק התגובה התחתון עגול 25-mL עם ערבוב-55 מעלות צלזיוס. לאטום את הבקבוקון התגובה עם septa ומניחים תחת חנקן אווירה.
- להכין פתרון המכיל 1.49 גרם אשלגן thioacetate (3.2 equiv.) ב- 4 מ"ל של מים יונים ו- 3 מ"ל של חומצה גופרתית 2 מ' (H2אז4) כדי ליצור thioacetic חומצה בחיי עיר.
- משוך את הפתרון חומצה thioacetic לתוך מזרק פלסטיק חד פעמיות 10 מ ל, במקום מחט על המזרק. להוסיף את התערובת dropwise הבקבוקון התגובה על ידי פירסינג דרך septa עם המחט. המשך התגובה בין לילה-55 מעלות צלזיוס.
- נטר את התגובה על ידי שכבה דקה כרומטוגרפיה (TLC) על צלחות254 סיליקה ג'ל 60 F באמצעות תערובת של מתנול דיכלורומתאן (1:9). דמיינו את התקדמות התגובה על ידי הכתם הירוק bromocresol. המוצר כולל Rf = 0.57.
- לאחר התגובה המלאה ומצוננים לטמפרטורת החדר, acidify את התערובת עד ה-pH 1 עם 2 M H2אז4. מפריד שמן צהוב טובה מתוך פתרון.
- לחלץ את המוצר עם הכלורופורם קר (40 מ ל x 3). לשלב את שכבות אורגני ויבש מעל מגנזיום גופרתי. הסר את הכלורופורם תחת לחץ מופחת.
- לאשר את זהותו של המוצר מבודד, 1, על ידי תהודה מגנטית גרעינית (NMR) ספקטרוסקופיה כפי שמוצג דמויות 1B ו- C. לצפות את התוצאות הבאות: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H) 3.2 (ז, ח 4), 2.9 (ז, ח 1), 2.4 (s, 6-אייץ '); 13 C NMR, CDCl3, 75 מגה-הרץ: d = 195.1 (CH3ג'OS-), 177.6 (-אוC), 45.1 (CH2S-), 30.5 (CH), 29.2 (-SCOCH3).
הערה: המוצר הוא שמן צהוב ויש לו את התשואה הכוללת של 83%. להשתמש במוצר ללא טיהור נוסף.
- SPPS ו---שרף צימוד של קודמן Dithiolane
הערה: הסינתזה שלב מוצק פפטיד המתוארים להלן נערך על סינתיסייזר פפטיד אוטומטיות, בעקבות הפרוטוקולים של היצרן המומלצת. הגדרות של ריאגנטים עשוי להיות מותאם לכלים מסחריים אחרים או בעת שימוש מיוחדים חומצות אמינו.- שוקלים לצאת 0.156 גר' רינק אמיד 4-methylbenzhydrylamine (MBHA) שרף (0.1 mmol) ומניחים בתוך קיבול התגובה. להתנפח השרף ב- dimethylformamide (DMF) למשך לפחות 15 דקות לפני תחילתה של הסינתזה.
- שוקלים לצאת 4 במקבילות של כל fluorenylmethyloxycarbonyl (Fmoc) מוגן חומצת אמינו (0.4 mmol) רצף, 0.152 גר' N, N, N', N'- tetramethyl-O-(1H- benotriazol-1-yl) אורניום hexafluorophosphate (0.4 mmol, HBTU) עבור כל חומצה אמינית ברצף. בכל מחסנית מכיל חומצת אמינו המוגנים Fmoc והן HBTU.
- לאחר הפעלת סינתזה קדם כל בדיקות על סינתיסייזר (למלא ריאגנטים, ריקון ריאגנט קווים, המרפד את כל הבקבוקים ריאגנט), למקם את מכלי חומצת אמינו הקרוסלה ב- C' ל N' כיוון טרמינוס. הנח מחסנית ריקה לאחר התנוחה הסופית חומצת אמינו עבור השלב הסופי של deprotection Fmoc N-מסוף.
- לסנתז את פפטיד באמצעות ההגדרות המומלצות סטנדרטי.
- Deprotect קבוצת Fmoc של השרף עם 5 מ של 20% פיפרידין ב DMF (5 דקות x 2).
- לשטוף את השרף עם DMF (6 x 5 מ"ל) לפני השלב צימוד.
- עבור צעד וזיווג, להוסיף 4 מיליליטר 0.4 M N-methylmorpholine DMF חומצת אמינו המוגנים באמצעות Fmoc ו- HBTU. להפעיל את הפתרון המוגנים Fmoc חומצת אמינו עבור 30 s לפני העברת הפתרון מיכל התגובה.
הערה: סינתיסייזר פפטיד אוטומטית תערובות השרף, הפתרון על ידי גז2 N מבעבעים כל 30 s עבור 20 דקות בזמן התגובה צימוד מתרחש. עבור סינתזה פפטיד ידנית, הנח את הכלי התגובה על תפקודי לב / נשימה במהירות נמוכה משך השלב צימוד. - מסננים את הפתרון ולשטוף השרף עם DMF (3 x 5 מ"ל).
- חזור על שלבים 1.2.4.1 דרך 1.2.4.4 עבור כל חומצת אמינו המוגן על-ידי Fmoc ב C' ל N'-terminus כיוון לסנתז את פפטיד עניין.
- לאחר השלב הסופי deprotection N-מסוף, להעביר את השרף לתוך מזרק חד פעמיות fritted. לשטוף את השרף עם DMF (3 x 5 מ"ל), דיכלורומתאן (DCM, 3 x 5 מ"ל).
הערה: ניתן לאחסן השרף לאחר DCM כביסה ב desiccator ואקום. אם השרף היה מאוחסן הקודמת לצימוד, ודא להתנפח השרף ב DMF לפני התגובה צימוד. - כמה מבשר dithiolane (1) ל N-הסופית של פפטיד בשרף על-ידי הוספת 4 במקבילות של 1, 5 מ של DMF, המקבילים 4 HBTU ושווי 10 של N, N-diisopropylethylamine (DIPEA). מראש להפעיל את התערובת צימוד 10 דקות לפני הוספת שרף המכיל מזרק fritted.
- לנער את התגובה צימוד כבר שעתיים. לאחר 2 h, לשטוף את השרף עם DMF (3 x 5 מ"ל) וחזור על התגובה צימוד עם טלטולים למשך הלילה.
- לאחר המושבים השנייה, לשטוף השרף עם DMF (3 x 5 מ"ל) ו DCM (3 x 5 מ"ל).
הערה: השרף ניתן לאחסן בנקודה זו תחת ואקום עד המחשוף.
- Thioacetate Deprotection, פפטיד המחשוף של שרף
- כדי deprotect את הקבוצה thioacetate מן ההתחלה dithiolane אמיני, להעביר את השרף מיובשים צינור התגובה מיקרוגל 10 מ"ל ולהוסיף 2 מיליליטר DMF. לאפשר לשרף להתנפח, להוסיף פס קטן מערבבים מגנטי לכלי השיט, וכן להשעות מחדש עם מהירות נמוכה של בחישה מגנטית למשך 15 דקות.
- להוסיף 2 מיליליטר מרוכז אמוניה מימית, קפטן הספינה התגובה עם septa סיליקון, ולמקם את מיכל התגובה לתוך כור מיקרוגל משתמש בהגדרות מיקרוגל של 75 מעלות צלזיוס במשך 45 דקות עם ערבוב.
- בתום התגובה מיקרוגל, להעביר את השרף לתוך מזרק חד פעמיות נקי fritted. לשטוף עם DMF (2 x 5 מ"ל), מתנול (MeOH, 2 x 5 מ"ל).
- להוסיף פתרון של. אמוניה מימית מרוכזים ב מתנול (1:4), עבור הנפח הכולל של 5 מ. יוצאים לרעוד לילה כדי להגביר חמצון התפלגות של קשר דיסולפידי בטבעת dithiolane.
- לשטוף את השרף עם MeOH (2 x 5 מ"ל) ו DCM (3 x 5 מ"ל).
הערה: שרף יבשים ניתן לאחסן ב- desiccator ואקום בשלב זה. - להוסיף את הקוקטייל המחשוף שרף המכיל את המזרק עם מנענע בעדינות עבור 1.5 h. המחשוף קוקטייל בשימוש היא 95% חומצה trifluoroacetic (TFA), 2.5% triisopropylsilane (טיפים), 2.5% מים-הנפח הכולל של 5 מ.
התראה: לעבוד תחת fume כימי המנוע בלבד. TFA הוא תנודתי, מאכל.
הערה: עבור רוב פפטיד רצפי חומצות אמינו sidechain הגנה על קבוצות, הפתרון קוקטייל מעל המחשוף מספיקה; עם זאת, קוקטיילים המחשוף אלטרנטיבית עשוי להיות נחוץ עבור מסוימים שרשרת הצד של חומצת אמינו מגנה על קבוצות (פפטידים מסוים המכיל Cys, Met, Trp Arg) או נוספות כימיה שרף20. - לזרז את פפטיד גסה לתוך 25 מיליליטר קר דיאתיל אתר צינור חרוטי 50 מ על-ידי חיבור dropwise של המזרק fritted. פפטיד ארגונייט שוקע כמו מוצק לבן. צניפה פפטיד על ידי צנטריפוגה-1300 גרם x עבור 10 דקות decant בקפידה את דיאתיל אתר לתוך מיכל נפרדת לאיסוף פסולת.
- להוסיף עוד 25 מ של דיאתיל אתר צינור חרוטי, מחדש להשעות את התמיסה על-ידי vortexing. אני חוזר על צנטריפוגה-1300 גרם x 10 דקות, decant של דיאתיל אתר שוב. יבש בגדר תחת ואקום.
- טיהור של 1, 2-Dithiolane ששינה פפטיד
הערה: לטהר את פפטיד גולמי על ידי היפוך פאזה-HPLC. לאסוף, לשלב את הפסגות פפטיד ואשר המסה באמצעות ספקטרומטר מסה MALDI-TOF.- להמיס בגדר פפטיד גסה כמות מינימלית של acetonitrile עם 0.1% TFA. הודות hydrophobicity של פפטיד של צבירת הנטייה, בעדינות לחמם את הדגימה ב 40 ° C כדי לסייע מסיסות.
הערה: להימנע גבוה טמפרטורות sonication של פפטיד על מנת למנוע פוטנציאליים דיסולפידי חילופי תגובות21,22,23. - כדי להכין 1 מ"ל של פפטיד גולמי לטיהור HPLC, להוסיף μL 400 מניות פפטיד מרוכזים ב acetonitrile 600 μL של H2O עם 0.1% TFA וסינון דרך מסנן מזרק 22 μm לתוך בקבוקון HPLC. ניתן להוסיף אלכוהול איזופרופיל נוספת 5% כדי למנוע צבירת פפטיד משקעים.
- לטהר פפטיד באמצעות העמודה למחצה מפוח C-18 עם קצב זרימה של 3 mL/min מעל מעבר צבע ליניארי של 15-55% acetonitrile ב- 20 מינימלית קבע את גלאי UV 222 nm (אמיד backbone), 330 nm (קשר דיסולפידי). לאסוף ולשלב את הפסגות של הריבית (איור 2 א).
- לאשר את המסה המוצר פפטיד באמצעות ספקטרומטר מסה MALDI-TOF במצב reflectron (איור 2B). לניתוח, מערבבים 0.5 μL של שיא שנאספו על הצלחת MALDI עם 0.5 μL של 2, 5-dihydroxybenzoic חומצה (DHB) מטריקס (10 מ"ג/מ"ל DHB ב- 50% acetonitrile, 0.1% TFA).
הערה: המשותף adducts ב MALDI-TOF ספקטרומטר מסה כוללים הנתרן, אשלגן מלח adduct ([M + Na]+ , [M + K]+) פסגות. Desalting המדגם לפני הניתוח מומלץ אם הפסגות adduct מלח לדכא את האות של הפסגה [M + H]+ הראשי. בנוסף, לשיא מחמצנים [M + O]+ הוא זוהה גם בפפטיד 1, 2-dithiolane שונה. דו ח על לייזר המושרה חמצון מ יינון MALDI באמצעות מטריצת DHB עולה כי גורמים שונים, לרבות ריכוז מדגם, הממס, לייזר בעוצמה יכול להיות שונה כדי להגביל את החפץ חמצון MALDI המושרה24. - לאחר אישור MALDI-תוף של המסה נכונה, lyophilize פפטיד לאחר הקפאה פלאש. לשמור את האבקה פפטיד lyophilized תחת ואקום עד העצרת.
- להמיס בגדר פפטיד גסה כמות מינימלית של acetonitrile עם 0.1% TFA. הודות hydrophobicity של פפטיד של צבירת הנטייה, בעדינות לחמם את הדגימה ב 40 ° C כדי לסייע מסיסות.
2. אפיון סופרא מולקולרית מבני הרכבה עצמית
-
היווצרות של סיבי עמילואיד
- כדי להכין הרכבה עצמית פתרון, לשקול את 1 מ ג של האבקה פפטיד באמצעות איזון האנליטי. להתמוסס אל תוך תערובת (pH 7.5) של 20% acetonitrile ו 10 מ מ (4-(2-hydroxyethyl)-1-piperazineethanesulfonic חומצה (HEPES) בצינור 1.5 mL-microcentrifuge, כדי ריכוז סופי של 1 מ"ג/מ"ל פפטיד הרכבה תערובת. מערבולת הפתרון הרכבה ולהשאיר להרכיב בטמפרטורת החדר.
-
אפיון ספקטרוסקופיות של סיבי עמילואיד
- בצע את תהליך ההרכבה פפטיד דרך פורייה-(FTIR) ספקטרוסקופיית כל כמה ימים. לשיא רחבה סביב 1670 ס מ-1 הוא חתימת האינפרא-אדום הנובעים פפטידים unassembled מדגם ה-17. הדגימות הרכבה פפטיד שבד כ שבוע עד שבועיים הפסגה unassembled רחבה להיעלם ולהגיע ההבשלה.
- יבשה aliquot של 8-10 μL של הפתרון הרכבה כמו סרט דק של קריסטל יהלום ATR. לפקח על היעלמותו של שיא מים רחבה ועמוקה של 1640 עד 1630 ס מ-1 כטפסים הסרט יבש.
- רוכשים את ספקטרום אינפרא-אדום בין 1500-1800 ס מ-1 בממוצע 50 סריקות עם רזולוציה-1 2 ס מ. לרכוש ולהחסיר את הרקע סריקות לפני כל סריקה הדגימה. חתימת האינפרא-אדום עבור β-גיליון ההרכבה היא שיא חדה בין 1625, 1635 ס מ-1 (באיור 3 א)25,26.
- לאפיין את מכלול פפטיד למבנים סופרא מולקולרית עשיר β-גיליון על-ידי קיווטות (CD). לתעד את הספקטרום באמצעות spectropolarimeter תקליטור עם מערכת בקרת טמפרטורה Peltier.
- פיפטה 30 μL של הפתרון הרכבה ב microcuvette אורך הנתיב 0.1 מ מ.
הערה: בעל תא צורך מלחציים ולמיקומו בתא אורך הנתיב הקצר המכשיר. - עבור כל הספקטרום, להגדיר כלי תקליטור הפרמטרים הבאים: סריקה אורכי הגל של 300 ננומטר 180 ננומטר, קצב סריקה של 100 לדקה, רוחב פס של 1 ננומטר, 25 ° C, ממוצע של שלושה סריקות.
- לאסוף קשת של המאגר (20% acetonitrile/10 מ מ HEPES, pH 7.5), להפחית מכל סריקה מדגם כפקד. חתימה תקליטור עבור גליונות β הוא שמינימום ellipticity ממורכז nm (איור 3B) בסביבות 22027.
- פיפטה 30 μL של הפתרון הרכבה ב microcuvette אורך הנתיב 0.1 מ מ.
- בצע את תהליך ההרכבה פפטיד דרך פורייה-(FTIR) ספקטרוסקופיית כל כמה ימים. לשיא רחבה סביב 1670 ס מ-1 הוא חתימת האינפרא-אדום הנובעים פפטידים unassembled מדגם ה-17. הדגימות הרכבה פפטיד שבד כ שבוע עד שבועיים הפסגה unassembled רחבה להיעלם ולהגיע ההבשלה.
-
מיקרוסקופיה של סיבי עמילואיד
- לאפשר שבועיים עד שלושה שבועות על הדגימות פפטיד להבשיל למבנים סופרא מולקולרית עשיר β-גיליונות.
הערה: ההרכבות יכול לדימות שימוש במיקרוסקופ אלקטרונים הילוכים (TEM) בשלבים מוקדמים יותר של תהליך ההרכבה גם כן.- פיפטה 10 μL של הפתרון הרכבה פפטיד על גבי המשטח של רשת פחמן TEM.
הערה: הקפידו לא לגעת בקצה פיפטה השטח רשת. ברמת דיוק גבוהה, סגירה עצמית פינצטה משמשים להכלת הרשת TEM במהלך ההכנה. - המתן 1-2 דקות כדי לאפשר את ההרכבות לספוח על פני הרשת. להסיר את עודף לדוגמה על-ידי נגיעה נייר סינון על הקצה של הרשת.
- להכין כתם אצטט uranyl 2% על-ידי הוספת 100 μL של מים יונים זמינים מסחרית 4% uranyl אצטט פתרון. פיפטה 10 μL של 2% uranyl אצטט הכתם על גבי משטח רשת, תקופת דגירה של 2-3 דקות. לאחר הדגירה, להסיר את הכתם עודף על-ידי נגיעה נייר סינון על הקצה של הרשת.
- מקם את רשתות TEM desiccator ואקום למשך הלילה. לאחסן תחת ואקום עד הדמיה.
- תמונה הדגימות מוכן עם TEM (איור 3C). פרמטרים טיפוסי של מיקרוסקופיית הם כדלקמן: תמונות בהגדלה ועד 9,300 X 23, 000 X, נימה טונגסטן עם מתח מאיץ של 120 kV.
פתק: ניתן להשתמש ImageJ כדי למדוד את רוחב סיב הממוצע של המבנים סופרא מולקולרית של תמונות TEM רכשה28.
אזהרה: נא עיין כל גליונות נתונים בטיחות רלוונטי (מרחביות) לפני השימוש. מספר כימיקלים המשמשים הסינתזה, טיהור, ואפיון של פפטידים עצמית וההספק 1, 2-dithiolane שמתואר לשנות מאכל או רעילים אמורה לשמש רק תחת ברדס fume כימי. השתמש תמיד המתאים ציוד מגן אישי (כולל בטיחות משקפיים, חלוק המעבדה, מכנסיים באורך מלא, נעליים סגורות) כאשר עובד במעבדה.
- פיפטה 10 μL של הפתרון הרכבה פפטיד על גבי המשטח של רשת פחמן TEM.
- לאפשר שבועיים עד שלושה שבועות על הדגימות פפטיד להבשיל למבנים סופרא מולקולרית עשיר β-גיליונות.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
מלבד הסינתזה הראשונית של צעד אחד של מולקולה קודמן dithiolane, מתרחשת שאר הסינתזה פפטיד 1, 2-dithiolane שונה על תמיכה מלאה (איור 1 א'). ההמרה של 3-ברומו - 2-(bromomethyl) חומצה propionic 3-(acetylthio)-2-חומצה propanoic (acetylthiomethyl), מבשר dithiolane, אושר על ידי 1H ו- 13NMR C (איור 1B ו- C) לפני זה משולב חינם קצה אמיני אמין של פפטיד עדיין בשרף. Deprotection של thioacetate כדי תיולים עם אמוניה מימית מתבצעת באמצעות כור מיקרוגל, 1, 2-dithiolane הוא מחומצן בין לילה ב מתנול לפני פפטיד 1, 2-dithiolane ששינה הוא ביקע מן השרף. פפטיד גולמי מטוהר על-ידי היפוך פאזה HPLC (איור 2 א), המסה של המוצר אושר על ידי MALDI-TOF ספקטרומטר מסה (איור 2B).
פפטיד מטוהרים 1, 2-dithiolane עצמי מרכיבה לתוך סיבי עמילואיד בוגרת במשך 2-3 בשבוע. FT-IR (איור 3 א) וספקטרוסקופיה CD (איור 3B) משמשים כדי לעקוב אחר תהליך ההרכבה כדי לאפיין את קונפורמציה β-גליון מורחב. הסיבים הם צילמו על ידי TEM (איור 3C).
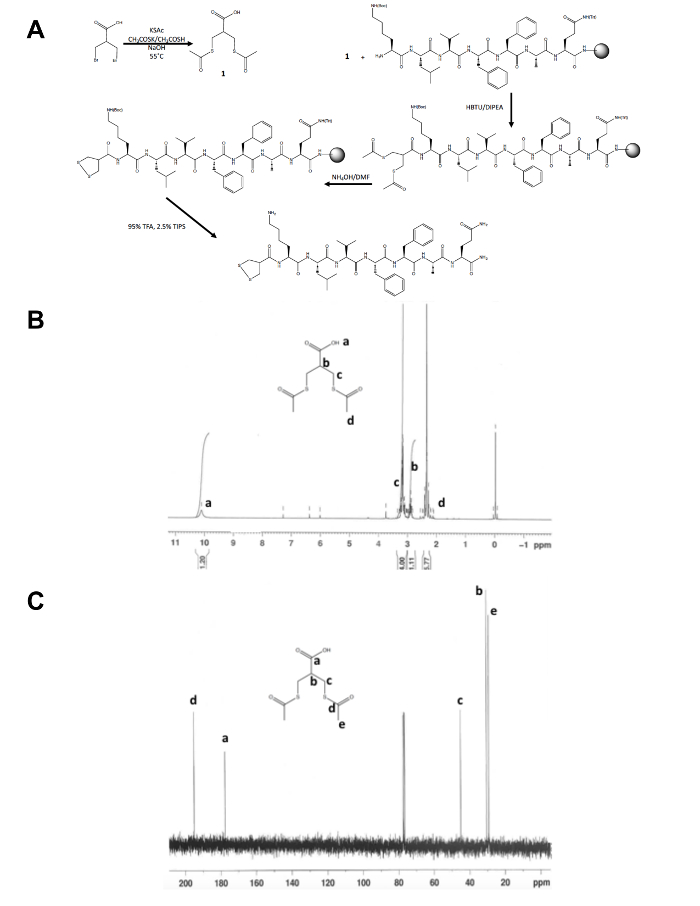
איור 1. ערכת סינתטי עבור אפיון מולקולה קודמן 1, 2-dithiolane. (א) סכימת סינתטי של פפטיד סופי 1, 2-dithiolane ששינה, 1, 2-dithiolane-KLVFFAQ-NH2. (B) 1H-NMR של 3-(acetylthio)-2 - חומצה propanoic (acetylthiomethyl) CDCl3 -300 MHz. (ג)13C-NMR של 3-(acetylthio)-2 - חומצה propanoic (acetylthiomethyl) CDCl3 -75 מגה -הרץ. לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

באיור 2. סינתזה של 1, 2-dithiolane ששינה פפטיד. Chromatogram (א) HPLC של הטיהור של 1, 2-dithiolane - KLVFFAQ-NH2. MALDI-תוף הספקטרום המונית של הפסגה המרכזית של HPLC טיהור (זמן השמירה של ~17.5 דקות) במצב reflectron באמצעות מטריצת DHB (B) , מאשר המסה המחושבת של 1, 2-dithiolane-KLVFFAQ-NH2... Adducts קומון מזוהות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3. אפיון סופרא מולקולרית של 1, 2-dithiolane ששינה פפטיד. (א) FT-IR של 1 מ"ג/מ"ל 1, 2-dithiolane-KLVFFAQ-NH2 סיבים התאספו 10 מ מ HEPES, pH 7.5 ב- 20% CH3CN. הפסגה-1627 ס מ-1 היא עקבית פפטידים התאספו קונפורמציה β-גיליונות. (B) תקליטור של 1 מ"ג/מ"ל 1, 2-dithiolane-KLVFFAQ-NH2 סיבים התאספו 10 מ מ HEPES, pH 7.5 ב- 20% CH3CN. Ellipticity המינימום ב- 218 ננומטר הוא תואם פפטידים התאספו קונפורמציה β-גיליונות. (ג) תמונה של סיבי עמילואיד 1, 2-dithiolane-KLVFFAQ-NH2 (שלילית כתם של 2% uranyl אצטט) על ידי TEM. סרגל קנה מידה הוא 100 ננומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
מאמר זה דן הפרטים של שניהם הסינתזה ו הטיהור של פפטיד עצמית וההספק 1, 2-dithiolane ששינה N-מסוף ואפיון של המבנים סופרא מולקולרית וכתוצאה מכך. הסינתזה של פפטיד 1, 2-dithiolane שדווחו פה יש את היתרונות, כולל סינתזה של צעד אחד כדי לייצר מבשר dithiolane, 3-(acetylthio)-2-חומצה propanoic (acetylthiomethyl), ו---השרף מיקרוגל deprotection התגובה של קודמן thioacetate מגן קבוצתית להניב את moiety 1, 2 מחומצנת-dithiolane ניצול אמוניה מימית כפי חלופה בטוחה יותר deprotection הידרזין רעילים שדווח בעבר29. הסינתזה פפטיד הכולל מוצק-פאזי של פפטיד 1, 2-dithiolane (איור 1 א') ניתן לשנות בקלות על-ידי שינוי הרכב, לרבות שימוש המוגנים Fmoc חומצות אמינו לא טבעיות, וכימיה שרף של C-מסוף כדי שיתאימו לאורכה רצף יישומי מחקר שונים רבים.
על מנת למנוע תוצרי לוואי לא רצויות פפטיד כאשר חומצות האמינו את הצד נוקלאופילי שרשראות או של חומצות אמינו עם הגנה על קבוצות יש פצילות תגובתי מוצרים, כדאי להוסיף אוכלי נבלות נוספים המחשוף קוקטייל20. ניתן לבצע עם המחשוף בדיקה של חלק קטן (פחות מ 10% של שרף סה כ) לפני השלב deprotection מיקרוגל בשרף על מנת להבטיח תשואה גבוהה של ריאקציות מצומדות. באמצעות העמודה HPLC בתנאים המתוארים בדו ח, הפסגה פפטיד קודמן מוגן 1, 2-dithiolane thioacetate elutes 5 דקות לאחר פפטיד חשיפות amine חינם. אם כמות משמעותית של פפטיד amine חינם נשאר, צעד נוסף צימוד עם 3-(acetylthio)-2-חומצה propanoic (acetylthiomethyl) מומלץ. התפלגות 1, 2-dithiolane דיסולפידי הוא זוהה ב- HPLC על ידי ניטור של ספיגת קשר דיסולפידי חלש ב-330 ננומטר. הפסגה HPLC התואם 1, 2-dithiolane מחמצנים אושר על ידי הוספת 100 לליטר tris(2-carboxyethyl)phosphine(TCEP) 100 מ מ מדגם פפטיד ב- HPLC נפרדים לרוץ. תיול TCEP מופחת שמכיל פפטיד יהיו זמן שמירה שונה מאשר פפטיד דיסולפידי מחומצן. תיול שמכיל פפטיד elutes כ 1 דקות מאוחר יותר פפטיד דיסולפידי באמצעות העמודה בתנאים המתוארים בדו ח. מטריצה MALDI חלופי מתאים עבור פפטידים חומצה α-cyano-4-hydroxycinnamic (CHCA), מוגש על-ידי הוספת 1 מ"ל של 50% acetonitrile עם 0.1% TFA 5 מ ג של CHCA. יכול להיות desalted את הדגימות באמצעות סי18 zip-טיפ לפני ניתוח המוני MALDI-TOF אם הפסגות מלח adduct (Na+ ו- K+) באופן משמעותי לדכא את הפסגה [M + H]+ .
הרצף פפטיד במחירים מחקרים אלה נגזר מהמילה ההולנדית מוטציה של Aβ-פפטיד הקשורים עם מחלת אלצהיימר30ולאחר שהוצג בעבר להרכיב עצמי לתוך סיבי עמילואיד גליונות β מקבילים16,17 . כפי שמוצג בתוצאות נציג, איור 3 א-Cפפטיד 1, 2-dithiolane-KLVFFAQ-NH2 מרכיב גם לתוך סיבי עמילואיד. אמיד FTIR אני למתוח מרוכז בכל 1627 ס מ-1 ו- CD ellipticity מינימום-218 nm הן חתימות ספקטרוסקופיות של הרכבות β-גליון25,26,27ולאחר סיום קרבוניל CO ב ס 1676-1 המקביל הורה גלוטמין צד-שרשרת אינטראקציות מציע פפטידים מאורגנים בβ-רצחניים16,31,32.
שידור תמונות מיקרוסקופ אלקטרונים, באמצעות 2% uranyl אצטט כתם שלילי, להראות מורחבת, פיתול סופרא מולקולרית בסיבים כ 10 ננומטר רוחב. הסיבים של פפטיד N-מסוף acetylated, Ac-KLVFFAQ-NH2, הם ישר, עם רוחב מעט גדול יותר של nm כמעט 1216וחלקה. מאז הכנת TEM רשתות ורכישת תמונות הוא תהליך אינטנסיבי זמן, מומלץ להכין מספר רשתות TEM מדגם הרכבה אותו בבת אחת משתנה פפטיד ריכוזים. היכונו מדגם מדולל TEM (1:50 או 1: 100) לצד המדגם המקורי של פתרון הרכבה. סיבי עמילואיד בריכוזים גבוהים עשויים לדבוק הרשת גושים או מדבקות, תמונות של סיבים בודדים עשוי להיות קשה. חשוב לראות את הקצוות של סיבים בודדים עבור מידות רוחב, הפריט החזותי של סיבים helicity מעורפל לעתים קרובות על ידי דגימות צפוף.
יישומים נוספים באמצעות biomaterials סופרא מולקולרית נידונות להיות, יש צורך לשלב קבוצות פונקציונליות פוטנציאל תגובתי כי הם אורתוגונלית כדי תהליך הרכבה עצמית לתוך מונומרים וההספק עצמית. השיטות שתוארו בדו ח זה הדגש גישה בשרף את הסינתזה של פפטיד עצמית וההספק 1, 2-dithiolane שינוי ואפיון ספקטרוסקופיות של המבנים סופרא מולקולרית.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים אין לחשוף.
Acknowledgments
המחברים רוצה תודה ד ר ב' אלן Scanley שלה הדרכה טכנית ולעזור להשתמש TEM את מכללות מדינת קונטיקט ומרכז האוניברסיטה (CSCU) של ננו-טכנולוגיה, ד ר Ishita Mukerji באוניברסיטת מתה עבור גישה אל הדיסק שלה ספקטרופוטומטרים. העבודה שדווחה באופן חלקי נתמך על ידי המכון למדע באוניברסיטת פיירפילד, נאס א קונטיקט החלל מענק האיחוד, ועל -ידי הקרן הלאומית למדע תחת גרנט מספר צ'ה-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



