Summary
Un protocollo per la sintesi di un 1,2-dithiolane modificato peptide e la caratterizzazione delle strutture supramolecolari derivanti dal peptide self-assembly.
Abstract
Questo rapporto si concentra sulla sintesi di un N-terminale 1,2-dithiolane modificate autoassemblanti peptide e la caratterizzazione del risultante self-assembled strutture supramolecolari. Il percorso sintetico si avvale della sintesi del peptide di fase solida con l'accoppiamento su resina della molecola del precursore dithiolane, 3-(acetylthio) -2-acido propanoico (acetylthiomethyl) e il Tio acetato assistita da microonde deprotection del peptide N-terminale prima scissione finale dalla resina di cedere l'1,2-dithiolane per volta peptide. Dopo la purificazione di cromatografia liquida ad alte prestazioni (HPLC) del peptide 1,2-dithiolane, derivato dal nucleo nucleanti del peptide Aβ associato a malattia di Alzheimer, il peptide è indicato per assemblarsi in fibre amiloidi Croce-β. Protocolli per caratterizzare le fibre amiloidi-trasformata di Fourier spettroscopia infrarossa (FT-IR), spettroscopia di dicroismo circolare (CD) e microscopia elettronica a trasmissione (TEM) sono presentati. I metodi di modificazione del N-terminale con una molecola di 1,2-dithiolane a peptidi autoassemblanti ben caratterizzati ora possono essere esplorati come sistemi modello per sviluppare strategie di modificazione post-montaggio e dinamica chimica covalente e dintorni superfici di nanofibra peptide supramolecolari.
Introduction
Il legame peptidico robusto formando chimica coinvolta nella sintesi del peptide di fase solida e la capacità di controllare la composizione e la lunghezza della sequenza rendono i peptidi che auto-assemblarsi in strutture supramolecolari un campo fortemente ricercato. I fattori che controllano e stabilizzano strutture auto-assemblate del peptide, tra cui la catena laterale sterico e interazioni elettrostatiche, legame idrogeno e idrofobo effetti1, servono come un insieme di regole di progettazione. Come la ricerca in queste regole fondamentali di progettazione continua a progredire, il logico passo successivo nel peptide coinvolge auto-assemblaggio sta espandendo la diversità delle funzioni e strutture basate su peptidi. Durante l'auto-assemblaggio di peptidi sono un biomateriale versatile che sono stati utilizzati per molte applicazioni biomediche sintonizzando il peptide sequenza o assieme condizioni2,3,4, lo sviluppo di strategie per modifiche post-montaggio al peptide nanofibre5,6,7,8,9 rimane un'area relativamente inesplorata.
Chimica di cambio e del tiolo bisolfuro dinamico alla superficie delle strutture supramolecolari è un'area che ha il potenziale per produrre biomateriali nuovi e funzionale. L'incorporazione di 1,2-dithiolane moiety (comunemente un derivato di acido lipoico (la) o acido asparagusic (aa)) sono stati segnalati in liposomi sistemi10,11, blocco copolimeri12,13e come organizzazione di ancoraggi alle superfici14,15. Qui, segnaliamo la sintesi e la caratterizzazione di un peptide autoassemblanti derivato dal nucleo nucleanti del peptide Aβ associato con la malattia di Alzheimer che è stata modificata al N-terminale con un gruppo funzionale di 1,2-dithiolane16, 17. Le fibre risultanti supramolecolari ora servono come piattaforma sperimentale per lo studio della reattività di bisolfuro-cambio e tiolo alla superficie supramolecolare di fibre amiloidi18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. sintesi e purificazione di 1,2-Dithiolane modificati Peptide
- Sintesi di dithiolane precursore, 3-(acetylthio) -2-(acetylthiomethyl) acido propanoico19.
- Aggiungere 1 g di 3-bromo - 2-(bromomethyl) acido propionico (1 equiv.) dissolto in quantità minima di 1 M NaOH (circa 4 mL) in un pallone di reazione di 25 mL fondo tondo con agitazione a 55 ° C. Sigillare il pallone di reazione con un setti e posto sotto atmosfera di azoto.
- Preparare una soluzione contenente 1,49 g di Tio acetato di potassio (3.2 equiv.) in 4 mL di acqua deionizzata e 3 mL di acido solforico 2M (H2SO4) creare thioacetic acid in situ.
- Tirare la soluzione di acido thioacetic in una siringa di plastica monouso da 10 mL e inserire un ago sulla siringa. Aggiungere goccia a goccia la miscela per il pallone di reazione forando attraverso i setti con l'ago. Continuare la reazione durante la notte a 55 ° C.
- Monitorare la reazione di cromatografia su strato sottile (TLC) su gel di silice 60 F254 piastre utilizzando una miscela di metanolo e diclorometano (1:9). Visualizzare lo stato di avanzamento di reazione dalla macchia di verde di bromocresolo. Il prodotto ha un Rf = 0,57.
- Dopo la reazione è completa e raffreddati a temperatura ambiente, acidificare la miscela a pH 1 con 2 M H2così4. Un olio giallo separa dalla soluzione.
- Estrarre il prodotto con cloroformio freddo (40 mL x 3). Unire i livelli organici e asciugare su solfato di magnesio. Rimuovere il cloroformio sotto pressione ridotta.
- Confermare l'identità del prodotto isolato, 1, dalla spettroscopia di risonanza magnetica nucleare (NMR), come mostrato nelle figure 1B e C. Aspettiamo i seguenti risultati: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H), 3.2 (m, H 4), 2,9 (m, H 1) 2.4 (s, 6 H); 13 C NMR, CDCl3, 75 MHz: d = 195,1 (OS-3Cdi CH), 177,6 (-COOH), 45,1 (-CH2S-), 30.5 (CH), 29.2 (-SCOCH3).
Nota: Il prodotto è un olio giallo e presenta un rendimento complessivo di 83%. Utilizzare il prodotto senza ulteriore purificazione.
- SPPS e accoppiamento su resina di Dithiolane precursore
Nota: La sintesi peptidica in fase solida descritta di seguito è stato condotto su un sintetizzatore di peptidi automatizzato, seguendo protocolli del produttore consigliato. Impostazioni e i reagenti possono essere adattati per altri strumenti commerciali o quando si utilizza aminoacidi specializzati.- Pesare 0,156 g di resina di Rink ammide 4-methylbenzhydrylamine (MBHA) (0,1 mmol) e posto in un recipiente di reazione. Gonfiare la resina in dimetilformammide (DMF) per almeno 15 minuti prima dell'inizio della sintesi.
- Pesare fuori 4 equivalenti di ogni fluorenylmethyloxycarbonyl (Fmoc) protetto dell'amminoacido (0,4 mmol) nella sequenza e 0,152 g di N, N, N', N'- tetrametil-O-(1H- benotriazol-1-yl) uranio esafluorofosfato (0,4 mmol, HBTU) per ogni amminoacido nella sequenza. Ogni cartuccia contiene HBTU sia il Fmoc-protetto dell'amminoacido.
- Dopo aver eseguito tutte le pre-sintesi controlla sul sintetizzatore (riempire i reagenti, svuotate le linee dei reagenti e pressurizzato tutti i flaconi di reagente), posizionare le cartucce dell'aminoacido in giostra in C' a N' direzione capolinea. Inserire una cartuccia vuota dopo la posizione finale dell'aminoacido per la fase finale di deprotezione Fmoc N-terminale.
- Sintetizzare il peptide utilizzando le impostazioni consigliate standard.
- DEPROTECT gruppo Fmoc dalla resina con 5 mL di 20% piperidina in DMF (5 min x 2).
- Lavare la resina con DMF (6 x 5 mL) prima della fase di accoppiamento.
- Per un passaggio di singolo accoppiamento, aggiungere 4 mL di 0,4 M N-metilmorpholin-in DMF al Fmoc-protetto dell'aminoacido e HBTU. Attivare la soluzione di Fmoc-protetto dell'amminoacido per 30 s prima di trasferire la soluzione per il recipiente di reazione.
Nota: Il sintetizzatore di peptidi automatizzato mescola la resina e la soluzione di bubbling N2 gas ogni 30 s per 20 minuti mentre la reazione di accoppiamento si svolge. Per sintesi peptidica manuale, posizionare il recipiente di reazione su agitatore orbitale a bassa velocità per tutta la durata del passaggio del giunto. - Scolare la soluzione e lavare la resina con DMF (3 x 5 mL).
- Ripetere i passaggi da 1.2.4.1 attraverso 1.2.4.4 per ogni amminoacido Fmoc-protetto in C' a N'-direzione capolinea di sintetizzare il peptide di interesse.
- Dopo il passaggio finale per la deprotezione N-terminale, è possibile trasferire la resina in una siringa monouso sinterizzata. Lavare la resina con DMF (3 x 5 mL) e diclorometano (DCM, 3 x 5 mL).
Nota: La resina può essere conservata dopo DCM di lavaggio in un essiccatore sotto vuoto. Se la resina è stata memorizzata precedente accoppiamento, assicurati di gonfiare la resina in DMF prima la reazione di accoppiamento. - Coppia il precursore dithiolane (1) a N-terminale del peptide su resina aggiungendo 4 equivalenti di 1, 5 mL di DMF, 4 equivalenti di HBTU e 10 equivalenti di N, N-diisopropylethylamine (DIPEA). Pre-attivare la miscela di accoppiamento per 10 min prima di aggiungere la resina contenente la siringa sinterizzato.
- Agitare la reazione di accoppiamento per 2 h. Dopo 2 h, lavare la resina con DMF (3 x 5 mL) e ripetere la reazione di accoppiamento con l'agitazione durante la notte.
- Dopo il secondo accoppiamento, lavare la resina con DMF (3 x 5 mL) e DCM (3 x 5 mL).
Nota: La resina può essere conservata a questo punto sotto vuoto fino fenditura.
- Tio acetato deprotezione e fenditura del Peptide dalla resina
- Per deprotect il gruppo Tio acetato dal precursore dithiolane N-terminale, trasferire la resina essiccata in una provetta di reazione microonde 10 mL e aggiungere 2 mL di DMF. Lasciare che la resina si gonfiano, aggiungere una piccola ancoretta magnetica alla nave e risospendere con una bassa velocità di agitazione magnetica per 15 min.
- Aggiungere 2 mL di concentrato idrossido di ammonio, il recipiente di reazione con i setti del silicone di cap e posizionare il recipiente di reazione in un reattore a microonde utilizzando le impostazioni di forno a microonde di 75 ° C per 45 minuti con agitazione.
- Dopo la reazione di forno a microonde è completa, è possibile trasferire la resina in una siringa monouso pulito sinterizzata. Lavare con DMF (2 x 5 mL) e metanolo (MeOH, 2 x 5 mL).
- Aggiungere una soluzione concentrata di idrossido di ammonio in metanolo (1:4), per un volume totale di 5 mL. Lasciare a scuotere una notte per aumentare l'ossidazione intramolecolare del legame bisolfurico dithiolane ring.
- Lavare la resina con MeOH (2 x 5 mL) e DCM (3 x 5 mL).
Nota: La resina essiccata può essere memorizzata in un essiccatore sotto vuoto a questo punto. - Aggiungere il cocktail di clivaggio della resina contenente la siringa con agitando delicatamente per 1,5 h. Il clivaggio cocktail utilizzato è 95% acido trifluoroacetico (TFA), 2,5% triisopropylsilane (suggerimenti) e 2,5% acqua ad un volume totale di 5 mL.
Attenzione: Lavorare sotto cappa chimica. TFA è volatile e corrosivi.
Nota: Per la maggior parte delle sequenze peptidiche e dell'aminoacido sidechain protezione dei gruppi, la suddetta soluzione cocktail di clivaggio è sufficiente; Tuttavia, cocktail di clivaggio alternativo può essere necessaria per alcuni catena laterale dell'amminoacido proteggere gruppi (in particolare peptidi contenenti Cys, Met, Trp e Arg) o altra resina chimica20. - Precipitare il peptide grezzo in 25 mL di etere etilico freddo in una provetta conica da 50 mL di aggiunta goccia a goccia dalla siringa sinterizzata. Il peptide precipita come solido bianco. Pellet il peptide mediante centrifugazione a 1300 x g per 10 min. decantare con attenzione l'etere etilico in un contenitore separato per la raccolta dei rifiuti.
- Aggiungere un altro 25 mL di etere etilico a tubo conico e risospendere il precipitato nel Vortex. Ripetere la centrifugazione a 1300 x g per 10 min e decantare l'etere etilico nuovamente. Asciugare il pellet sotto vuoto.
- Purificazione di 1,2-Dithiolane per volta Peptide
Nota: Purificare il peptide grezzo da HPLC in fase inversa. Raccogliere e combinare le cime del peptide e confermare la massa mediante spettrometria di massa MALDI-TOF.- Dissolva la pallina del peptide grezzo in quantità minima di acetonitrile con 0,1% TFA. A causa di idrofobicità di peptide e la propensione di aggregazione, delicatamente riscaldare il campione a 40 ° C per facilitare la solubilità.
Nota: Evitare di più alte temperature e sonicazione del peptide per prevenire potenziali bisolfuro cambio reazioni21,22,23. - Per preparare 1 mL del peptide grezzo per purificazione HPLC, aggiungere 400 μL di brodo concentrato del peptide in acetonitrile a 600 µ l di H2O con 0,1% TFA e filtro attraverso un filtro per siringa 22 μm in un flacone HPLC. Un ulteriore 5% isopropanolo possa essere aggiunti per evitare la precipitazione e l'aggregazione del peptide.
- Purificare il peptide utilizzando C-18 semi-preparatorio colonna con una portata di 3 mL/min su una sfumatura lineare di 15-55% acetonitrile in 20 min. Set i rivelatori UV a 222 nm (spina dorsale ammide) e 330 nm (legame disolfuro). Raccogliere e combinare i picchi di interesse (Figura 2A).
- Confermare la massa di prodotto del peptide di spettrometro di massa MALDI-TOF in modalità reflectron (Figura 2B). Per l'analisi, mescolare 0,5 μL di picco raccolto sulla piastra MALDI con 0,5 μL della matrice di acido (DHB) 2,5-dihydroxybenzoic (10 mg/mL DHB in 50% acetonitrile, 0,1% TFA).
Nota: Comune addotti in MALDI-TOF spettrometria di massa includono il sodio e sale di potassio del complesso ([M + Na]+ e [M + K]+) picchi. Il campione prima dell'analisi di desalificazione è consigliata se le cime di sale addotto sopprimono il segnale del picco principale [M + H]+ . Inoltre, un picco ossidato di [M + O]+ è anche rilevato nel peptide 1,2-dithiolane per volta. Un rapporto sull'ossidazione di laser indotta dall'ionizzazione MALDI utilizzando matrice DHB suggerisce che fattori quali la concentrazione del campione, solvente e intensità del laser possono essere modificati per limitare il MALDI indotta da ossidazione artefatto24. - Dopo la conferma della corretta messa di MALDI-TOF, lyophilize il peptide dopo il congelamento flash. Mantenere la polvere liofilizzata peptide sotto vuoto fino all'assemblaggio.
- Dissolva la pallina del peptide grezzo in quantità minima di acetonitrile con 0,1% TFA. A causa di idrofobicità di peptide e la propensione di aggregazione, delicatamente riscaldare il campione a 40 ° C per facilitare la solubilità.
2. caratterizzazione di supramolecolari auto-assemblaggio di strutture
-
Formazione di fibre amiloidi
- Per preparare l'auto-assemblaggio soluzione, pesare 1 mg di polvere di peptide utilizzando una bilancia analitica. Sciogliere in una miscela (pH 7,5) di 20% acetonitrile e 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic, acido (HEPES) in una provetta da microcentrifuga da 1,5 mL, ad una concentrazione finale di miscela di assemblaggio del peptide 1 mg/mL. Vortex la soluzione di montaggio e congedo per assemblare a temperatura ambiente.
-
Caratterizzazione spettroscopica delle fibre amiloidi
- Seguire il processo di assemblaggio del peptide tramite spettroscopia di trasformata di Fourier infrarossa (FTIR) ogni pochi giorni. Un vasto picco centrato intorno 1670 cm-1 è la firma di IR derivanti da peptidi smontati in esempio17. Gli esempi di montaggio del peptide di solito prendono una o due settimane per il vasto picco smontato a scomparire e raggiunge la maturazione.
- Secco un'aliquota dell'8-10 μL della soluzione di montaggio come una sottile pellicola sul cristallo diamante ATR. Monitorare la scomparsa di un picco di acqua grande e ampio da 1640 a 1630 cm-1 come le forme di film secco.
- Acquisire spettri IR da 1500-1800 cm-1 in media 50 scansioni con una risoluzione di 2 cm-1 . Acquisire e sottrarre le scansioni in background prima di ogni scansione del campione. La firma di IR per l'assemblaggio di β-foglio è un picco acuto tra il 1625 e 1635 cm-1 (Figura 3A)25,26.
- Caratterizzare l'assembly del peptide in β-foglio ricche strutture supramolecolari mediante dicroismo circolare (CD). Registrare gli spettri utilizzando un spectropolarimeter CD con un sistema di controllo temperatura Peltier.
- Aggiungere 30 μL della soluzione di montaggio in un microcuvette di lunghezza di percorso 0,1 mm.
Nota: Un supporto delle cellule è necessaria per il bloccaggio e posizionare la cella di lunghezza di percorso breve nello strumento. - Per ogni spettro, impostare lo strumento CD ai seguenti parametri: scansione lunghezze d'onda di 300 nm a 180 nm, frequenza di scansione di 100/min, larghezza di banda di 1 nm, 25 ° C, media di tre scansioni.
- Raccogliere uno spettro del buffer (20% acetonitrile/10 mM HEPES, pH 7.5) e sottrarre da ogni scansione del campione come un controllo. La firma di CD per β-fogli è che un ellitticità minimo centrato circa 220 nm (Figura 3B)27.
- Aggiungere 30 μL della soluzione di montaggio in un microcuvette di lunghezza di percorso 0,1 mm.
- Seguire il processo di assemblaggio del peptide tramite spettroscopia di trasformata di Fourier infrarossa (FTIR) ogni pochi giorni. Un vasto picco centrato intorno 1670 cm-1 è la firma di IR derivanti da peptidi smontati in esempio17. Gli esempi di montaggio del peptide di solito prendono una o due settimane per il vasto picco smontato a scomparire e raggiunge la maturazione.
-
Microscopia di fibre amiloidi
- Consentire due o tre settimane per i campioni del peptide di maturare in β-foglio ricche strutture supramolecolari.
Nota: Gli assembly possono essere imaged mediante microscopia elettronica a trasmissione (TEM) nelle fasi precedenti del processo di assemblaggio.- Pipettare 10 μL della soluzione di montaggio peptide sulla superficie della griglia del carbone TEM.
Nota: fare attenzione per non toccare la punta della pipetta di superficie della griglia. Alta precisione, a chiusura automatica pinzette vengono utilizzate per contenere la griglia TEM durante la preparazione. - Attendere 1-2 min per consentire gli assembly di adsorbire sulla superficie della griglia. Rimuovere l'eccesso esempio toccando la carta da filtro al bordo della griglia.
- Preparare una colorazione di acetato di uranile 2% aggiungendo 100 μL di acqua deionizzata per soluzione di acetato di uranile 4% commercialmente disponibili. Aggiungere 10 μL della macchia di acetato di uranile 2% sulla superficie della griglia e incubare per 2-3 min. Dopo l'incubazione, rimuovere l'eccesso macchia toccando la carta da filtro al bordo della griglia.
- Posizionare le griglie TEM in un essiccatore sotto vuoto durante la notte. Conservare sotto vuoto fino a formazione immagine.
- Immagine i campioni preparati con TEM (Figura 3). Parametri tipici per microscopia sono come segue: immagini a ingrandimenti che vanno da 9.300 X-23, 000 X, filamento di tungsteno con una tensione di accelerazione di 120 kV.
Nota: ImageJ può essere utilizzato per misurare la larghezza media della fibra delle strutture supramolecolari di acquisite TEM immagini28.
Attenzione: Si prega di consultare tutte le schede di dati di sicurezza (SDS) prima dell'uso. Parecchi prodotti chimici utilizzati nella sintesi, purificazione e caratterizzazione di peptidi autoassemblanti descritto 1,2-dithiolane per volta sono corrosivi o tossici e deve essere utilizzato solo sotto una cappa chimica. Sempre utilizzare appropriati dispositivi di protezione individuale (tra cui occhiali protettivi, camice da laboratorio, lunghezza pantaloni, Scarpe chiuse) quando si lavora in laboratorio.
- Pipettare 10 μL della soluzione di montaggio peptide sulla superficie della griglia del carbone TEM.
- Consentire due o tre settimane per i campioni del peptide di maturare in β-foglio ricche strutture supramolecolari.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A parte la sintesi di uno stadio iniziale della molecola precursore dithiolane, il resto della sintesi del peptide di 1,2-dithiolane per volta si verifica su supporto solido (Figura 1A). La conversione di 3-bromo - 2-(bromomethyl) propionico acido 3-(acetylthio) -2-(acetylthiomethyl) propionico acido, il precursore di dithiolane, è confermata da 1H e 13C NMR (Figura 1B e C) prima di esso è accoppiato alla libera Ammina N-terminale di un peptide ancora sulla resina. La deprotezione del Tio acetato di tioli con idrossido di ammonio viene eseguita utilizzando un reattore a microonde e l'1,2-dithiolane viene ossidato durante la notte in metanolo prima il peptide di 1,2-dithiolane per volta viene scisso dalla resina. Il peptide grezzo viene purificato mediante HPLC (Figura 2A) in fase inversa e massa del prodotto è confermata mediante spettrometria di massa MALDI-TOF (Figura 2B).
Il peptide purificato 1,2-dithiolane, auto-assembla in fibre amiloidi maturi su un periodo di 2-3 settimane. FT-IR (Figura 3A) e spettroscopia CD (Figura 3B) vengono utilizzati per seguire il processo di assemblaggio e di caratterizzare l'estesa conformazione β-foglio. Le fibre sono ripreso da TEM (Figura 3).
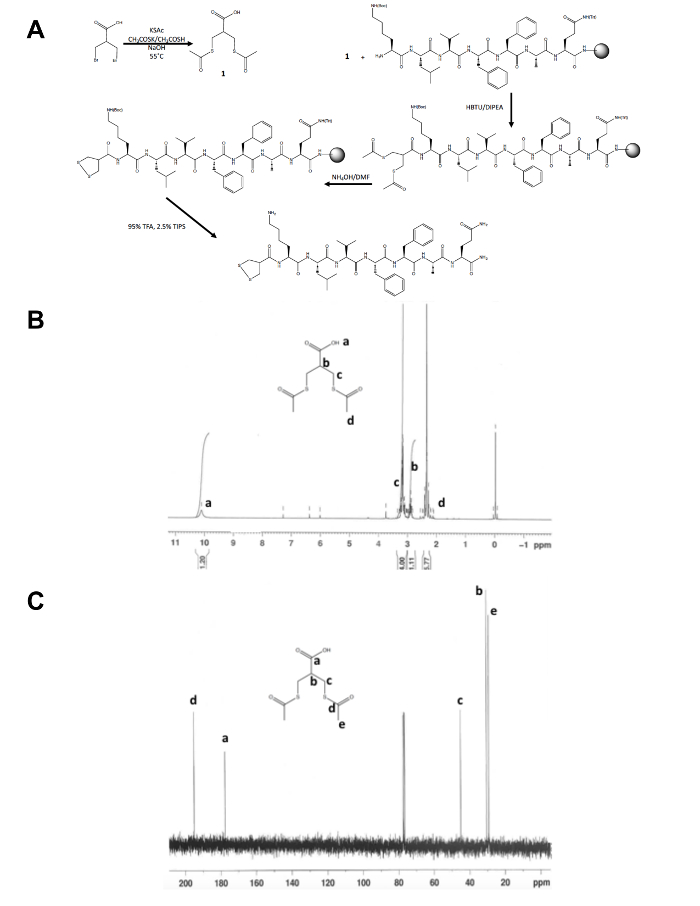
Figura 1. Schema sintetico per la caratterizzazione della molecola del precursore di 1,2-dithiolane. (A) schema sintetico del peptide finale 1,2-dithiolane per volta, 1,2-dithiolane-KLVFFAQ-NH2. (B) 1H-NMR di 3-(acetylthio) -2-(acetylthiomethyl) acido propanoico CDCl3 a 300 MHz. (C)13C-NMR del 3-(acetylthio) -2-(acetylthiomethyl) propionico acido CDCl3 a 75 MHz. Clicca qui per visualizzare una versione ingrandita di questa figura.

Figura 2. Sintesi di 1,2-dithiolane per volta peptide. Cromatogramma HPLC (A) dalla purificazione di 1,2-dithiolane - KLVFFAQ-NH2. (B) spettro di massa MALDI-TOF del picco principale da purificazione HPLC (tempo di ritenzione del ~17.5 min) in modalità reflectron utilizzando matrice DHB conferma la massa calcolata di 1,2-dithiolane-KLVFFAQ-NH2. Comune addotti sono anche identificati. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3. Supramolecolari caratterizzazione di 1,2-dithiolane per volta peptide. (A) FT-IR di fibre 1,2-dithiolane-KLVFFAQ-NH2 1 mg/mL assemblati in 10 mM HEPES, pH 7.5 in 20% CH3CN. Il picco a 1627 cm-1 è coerenza con i peptidi assemblati in una conformazione β-foglio. (B) CD delle fibre di 1mg/mL 1,2-dithiolane-KLVFFAQ-NH2 assemblati in 10 mM HEPES, pH 7.5 in 20% CH3CN. L'ellitticità minimo a 218 nm è coerente con i peptidi assemblati in una conformazione β-foglio. (C) immagine della fibra dell'amiloide 1,2-dithiolane-KLVFFAQ-NH2 (macchia negativa del 2% acetato di uranile) di TEM. Barra della scala è di 100 nm. Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Questo articolo discute i dettagli sia la sintesi e la purificazione di un peptide di autoassemblanti 1,2-dithiolane per volta N-terminale e la caratterizzazione delle strutture supramolecolari risultante. La sintesi del peptide 1,2-dithiolane segnalato qui presenta i vantaggi, tra cui una sintesi di uno stadio per produrre il precursore dithiolane, 3-(acetylthio) -2-acido propanoico (acetylthiomethyl) e la resina il forno a microonde deprotezione reazione dei Tio acetato precursore protezione gruppo per produrre la frazione ossidata 1,2-dithiolane utilizzando idrossido di ammonio come un'alternativa più sicura per la deprotezione di idrazina tossica riferito precedentemente29. La sintesi peptidica in fase solida nel complesso del peptide 1,2-dithiolane (Figura 1A) possono essere facilmente modificata modificando la lunghezza della sequenza e la composizione, compreso l'uso di Fmoc-protetto amminoacidi non naturali e C-terminale resina chimica per soddisfare molte applicazioni di ricerca diversi.
Al fine di evitare sottoprodotti indesiderati peptide quando gli aminoacidi con catene laterali nucleofila o gli aminoacidi con gruppi di protezione sono prodotti di clivaggio reattiva, ulteriori organismi saprofagi dovrebbero aggiungersi al clivaggio cocktail20. Una fenditura di prova di una piccola parte (meno del 10% del totale resina) devono essere eseguita prima del passaggio di deprotezione microonde su resina per garantire un'alta resa di reazione di accoppiamento. Utilizzando la colonna e condizioni HPLC descritte nella relazione, il picco di Tio acetato protetto 1,2-dithiolane precursore del peptide eluisce 5 min dopo il peptide disgiunto ammina libera. Se una quantità significativa di peptide ammina libera rimane, un altro passo di accoppiamento con 3-(acetylthio) -2-acido propanoico (acetylthiomethyl) è raccomandato. Il ponte disolfuro intramolecolari 1,2-dithiolane viene rilevato su HPLC monitorando l'assorbanza di legame disolfuro debole a 330 nm. Il picco HPLC corrispondente per il 1,2-dithiolane ossidato è confermato aggiungendo 100 L di 100 mM tris(2-carboxyethyl)phosphine(TCEP) ad un campione di peptide in un separato HPLC eseguire. Il tiolo TCEP ridotto contenenti peptidi avrà un tempo di conservazione diversi rispetto il peptide ossidata disolfuro. Il tiolo contenenti peptidi eluisce circa 1 min oltre il peptide di bisolfuro utilizzando la colonna e le condizioni descritte nella relazione. Una matrice di MALDI alternativa adatta per peptidi è acido α-ciano-4-idrossicinnamico (CHCA) ed è preparata aggiungendo 1 mL di acetonitrile 50% con 0,1% TFA a 5 mg di CHCA. I campioni possono essere dissalati utilizzando una C18 zip-punta prima dell'analisi di massa MALDI-TOF, se i picchi di sale addotto (Na+ e K+) sopprimono significativamente il picco [M + H]+ .
La sequenza del peptide scelta per questi studi è derivata dall'olandese mutante del peptide Aβ-associato a malattia di Alzheimer30e precedentemente è stata indicata ad assemblarsi in fibre amiloidi di parallelo β-fogli16,17 . Come mostrato nei risultati rappresentativi, Figura 3A-C, il peptide di 1,2-dithiolane-KLVFFAQ-NH2 assembla anche in fibre amiloidi. L'ammide FTIR ho tratto centrato al 1627cm-1 e CD ellitticità minimo a 218 nm sono firme spettroscopiche di assembly di β-foglio25,26,27e il tratto di carbonilico CO a 1676 cm-1 corrispondenti a ordinato interazioni di catena laterale di glutamina suggeriscono che i peptidi sono organizzati in parallelo β-fili16,31,32.
Visualizza immagini di microscopia elettronica di trasmissione, utilizzando 2% macchia negativa dell'acetato di uranile, estese e torcitura fibre supramolecolari che sono circa 10 nanometro di larghezza. Le fibre del peptide N-terminale acetilato, Ac-KLVFFAQ-NH2, sono liscio e dritto, con una larghezza leggermente più grande di quasi 12 nm16. Poiché preparazione griglie TEM e l'acquisizione di immagini è un processo intensivo di tempo, si consiglia di preparare diverse griglie TEM dallo stesso campione di assemblaggio in una sola volta di varie concentrazioni di peptide. Preparare un campione diluito per TEM (01:50 o 1: 100) a fianco del campione di soluzione di montaggio originale. Le fibre amiloidi alle alte concentrazioni possono aderire alla griglia in ciuffi o patch e acquisizione immagini delle singole fibre può essere difficile. È importante vedere i bordi delle singole fibre per le misure di larghezza e la visualizzazione di fibra elicità è spesso oscurata dai campioni sovraffollati.
Come altre applicazioni utilizzando biomateriali supramolecolari sono in fase di studio, c'è la necessità di integrare gruppi funzionali potenzialmente reattivi che sono ortogonali per l'auto-assemblaggio processo in monomeri autoassemblanti. I metodi descritti in questo rapporto evidenziano un approccio su resina per la sintesi di un peptide autoassemblanti 1,2-dithiolane per volta e caratterizzazione spettroscopica delle strutture supramolecolari.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Gli autori piacerebbe ringraziare il Dr. B. Ellen Scanley per la sua formazione tecnica e aiuto utilizzando il TEM al Connecticut State Colleges e Università (CSCU) centro per le nanotecnologie e Dr. Ishita Mukerji alla Wesleyan University per l'accesso al suo CD spettrofotometro. Il lavoro segnalato è stata in parte sostenuto dall'Istituto scienza alla Fairfield University, la NASA Connecticut Space Grant Consortium e dalla National Science Foundation sotto Grant numero-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



