Summary
כאן אנו מציגים טנדם מסה ספקטרומטר מבוססי פרוטוקול עבור כימות של אנטיביוטיקה בשימוש תכוף יחידות טיפול נמרץ, כלומר cefepime, meropenem, ציפרופלוקסאצין, moxifloxacin, לינזוליד ו piperacillin.
Abstract
אין הביקוש וגובר סמים טיפולית בקרה של אנטיביוטיקה על מתקנים קליניים רבים, במיוחד בכל הקשור ליישום התוכניות סדרנות לאנטיביוטיקה חולים.
העבודה הנוכחית, אנו מציגים עבור כימות של cefepime, meropenem, ציפרופלוקסאצין, moxifloxacin, לינזוליד ו piperacillin, נפוץ פרוטוקול מולטיפלקס ביצועים גבוהים נוזלי כרומטוגרפיה-טנדם ספקטרומטר מסה (HPCL-MS/MS) אנטיביוטיקה ביחידות לטיפול נמרץ. השיטה בעבר אומתה באופן מקיף על-פי המנחה של סוכנות התרופות האירופית.
לאחר ניקיון מדגם מהירה, analytes המופרדים על עמודה HPLC C8 הפוכה-שלב תוך ארבע דקות, לכמת בתקנים המתאימים יציב התווית על-ידי איזוטופ פנימי יינון (ESI +) ספקטרומטריית ספקטרומטריית electrospray בתגובה מרובים זמן ניטור (MRM). השיטה הציג משתמשת במכשור פשוטה של הגדרת תנאים כרומטוגרפי אחיד, המאפשר לפיקוח סמים טיפולית אנטיביוטי יומי וחזק במעבדות קליניות. עקומת כיול מתפרסת על-פני הטווח פרמוקוקינטיים ריכוז, כולל כמויות לאנטיביוטיקה קרוב הריכוז המעכב מינימלי (MIC) של חיידקים רגישים ריכוזי שיא (Cmax) שמושגות עם בולוס משטרי המינהל. ללא הצורך של דילול סרום לפני הניקוי לדוגמה, האזור שמתחת עקומת לכל אנטיביוטיקה מנוהל ניתן לקבל באמצעות מדידות מרובות.
Introduction
למרות אנטיביוטיקה מהפכה המנהג של תרופות, זיהומים חיידקיים חמור נשארים גורם התחלואה והתמותה מחלות קריטיות1. בהקשר זה, ניהול בקשה צימקינד מתאימים במינון נאותה יש חשיבות מעייניו עבור בקרת מחלות2.
גוף גדל והולך של ראיות מדגים כי הטיפול הניסיוני עם ותתנו לו אנטיביוטיקה הופך יותר ויותר בעייתי עם המורכבות של אוכלוסיות החולה. זה נכון במיוחד עבור יחידות טיפול נמרץ (ICU), איפה השתנות הבין-אישי עצום של מפתח-פרמקוקינטיקה ופרמקודינמיקה (PK) פרמטרים נצפית לעתים קרובות3,4. בהתאם לכך, נמרץ נמצאים בסיכון מיידית של רמות מתחת לרמה תרפויטית עם הסכנה הצלחה טיפולית לא מספיקות5,6. מצד שני, מטופלים שלא לצורך נחשפים ריכוזים גבוהים יתר על המידה לאנטיביוטיקה, שעלולים לגרום תופעות לוואי קשות עם אין יתרונות קליניים7. שימוש לרעה לאנטיביוטיקה והן את מינון לא מספיק יש גם מונעת להפצת עמידות לאנטיביוטיקה, אשר הופך איום ההולכת בריאות הציבור8.
כדי לשפר את השימוש באנטיביוטיקה, כדי לשמר את effectivenessas שלהם זמן רב ככל האפשר, ארגון הבריאות העולמי השיקה תוכנית פעולה גלובלי על ההתנגדות מיקרוביאלית של 20159. תוכניות סדרנות באנטיביוטיקה מהווים יסוד חיוני השימוש מיקרוביאלית שקולה הלאומי לבריאות הציבור אסטרטגיות10, עוזר קלינאים כדי לשפר את איכות הטיפול בחולה11 , באותו זמן, באופן משמעותי הפחתת ה12של עמידות לאנטיביוטיקה. מיקרוביאלית מינון בחולים בודדים באמצעות היישום של סמים טיפולית ניטור (TDM) הוא כלי המפתח בהקשר זה13.
עד כה, TDM זמינים מסחרית מבחני זמינות רק עבור אנטיביוטיקה glycopeptide ו- aminoglycosides. כימות של חומרים ממחלקות אחרות דרושים בדרך כלל פיתוח שיטות שבאתר או האימות עלול להיות מסורבל. לכן, נציג בפירוט את פרוטוקול חזקים מבוססי ספקטרומטר מסה assay יכול לשמש עבור כימות של האנטיביוטיקה הרלוונטיים ביותר בטיפול נמרץ בתוך טווחים שלהם ריכוז הרלוונטית קלינית14. השיטה הוקמה לאחרונה במתקן שלנו ספקטרומטר מסה, הוחל על השגרה TDM בטיפול נמרץ מאז. ההליך משתמש הגדרה אנליטית פשוטה ופשוט עם ניקיון מדגם אחיד, המאפשר ליישום מהיר TDM לאנטיביוטיקה במתקנים רבים עם יכולות ספקטרומטר מסה.
הפרוטוקול המתואר כאן היה אופטימיזציה עבור כימות של cefepime, meropenem, ציפרופלוקסאצין, moxifloxacin, לינזוליד ו piperacillin בנסיוב אדם, באמצעות איזוטופ דילול כרומטוגרפיה נוזלית (LC) בשילוב עם זוגיים מסה מסות (MS/MS). על דילול איזוטופ מתודולוגיה LC-MS/MS, תרכובות התווית על-ידי איזוטופ יציב נוספים מדגם של עניין עם מטריצה ספציפיים (למשל, סרום). התווית על-ידי איזוטופ תקנים ניתן להבדיל בין עמיתו ללא תווית שלהם, כלומר analyte של עניין, עקב משקלות שונים מולקולרית של המולקולה טבעיים ומוצרים שלהם פיצול, כינה מעבר האב-יון-כדי-הבת-יון. התווית על-ידי איזוטופ תרכובות יש של התנהגות הכוללת physicochemical כמעט זהים לעומת עמיתו ללא תווית שלהם, הם סטנדרטים פנימיים אידיאלי עבור MS/MS, המאפשר כימות כמעט מטריצה שאינו תלוי analyte עם רמה גבוהה של דיוק15. כיום, יציב התווית על-ידי איזוטופ פנימיים סטנדרטים רבים יכול לשמש על כימות מולקולה קטנה, כולל את TDM של antimicrobials, זמינים מסחרית.
ההפרדה כרומטוגרפי של analytes אנטיביוטי בפרוטוקול המתואר מתבצע עם אנליטי C8 אלקיל-שרשרת-אורך אחורי-פאזי טור (100 מ מ x 2.1 מ מ, מיקרומטר 3-גודל החלקיקים). במהלך פיתוח שיטה, הגורמים פנימי סטנדרטי מטריקס מנורמלת עבור כל analytes היה בין 94.6% ל- % 105.4, עם מקדם וריאציה של ≤8.3%14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
הערה: מומלץ לעבוד בשכונה fume בעת טיפול הממס האורגני, כגון מתנול. להכין כל מאגרי שלבים ניידים במבחנות הנפחי. אם לא צוין אחרת, ניתן לאחסן את הפתרונות בטמפרטורת החדר במשך עד חודש לאחר ההכנה.
1. הכנת כיילים ודוגמאות בקרת איכות
הערה: גליון ניתוח הנתונים המתאימים עבור הכנת מלאי ופתרונות ספייק ניתנת קובץ משלים. מסיבות של עקיבות, הכנס היצרן, קטלוג, ומספר הרבה של אנטיביוטיקה כל העמודות המתאימות. להמיס כל אנטיביוטיקה לאחסון קר ב 4 ° C ולשמור את זמן העבודה קצר ככל האפשר.
- להכין 100 מ של 25% מתנול במים: prefill סטריליות של 100 מ עם 25 מ של מתנול מוחלטת ולמלא אותו עד 100 מ ל מים מזוקקים.
- הכינו 10 מ"ל של 200 מ"מ חומצה אצטית במים: prefill סטריליות של 10 מ"ל עם 9 מ ל מים כיתה HPLC, להוסיף µL 115 של חומצה אצטית (99.5% טוהר, 17.4 מ') ולהוסיף מים מזוקקים עד 10 מ"ל.
- להכין 25 מ של 25% מתנול במים עם חומצה אצטית 20 מ מ: prefill סטריליות 25 מ עם 2.5 מ של התמיסה המימית 200 מ"מ חומצה אצטית, להוסיף 6.25 מ של מתנול מוחלטת אותם למלא את הבקבוק 25 מ ל מים מזוקקים.
- השתמש בקנה מידה דיוק לשקול כמויות נאות אנטיביוטיקה צינורות חרוט 15-mL כפי שמתואר קובץ משלים העמודה המשקל ההתחלתי.
- להכין מלאי פתרונות של fluoroquinolones, ציפרופלוקסאצין, moxifloxacin במים 25% מתנול-כולל חומצה אצטית מ מ 20. כדי לעשות זאת, להוסיף את העוצמה המתאימה הכמויות משוקלל כפי שמתואר קובץ משלים בעמודה "עוצמה' הסופי". להתמוסס במהירות את האנטיביוטיקה fluoroquinolone באמבט אולטרסאונד למשך 2 דקות, ועל ידי vortexing אינטנסיבי.
- להכין מלאי פתרונות של cefepime, meropenem, לינזוליד piperacillin ב- 25% מתנול-המים. כדי לעשות זאת, להוסיף את העוצמה המתאימה הכמויות משוקלל כפי שמתואר קובץ משלים של עמודה נפח סופי , במהירות להמיס את האנטיביוטיקה על-ידי vortexing אינטנסיבי. להמיס meropenem כמו החומר האחרון.
- לשלב את הפתרונות מניות של כל אנטיביוטיקה כפי שמתואר בתרשים קובץ משלים להניב tenfold מרוכז ספייק-פתרונות האחסון המתאימים של פתרון מניות .
- ספייק בתשעה כרכים של סרום ללא סמים עם אמצעי אחסון אחד הפתרונות ספייק מרוכז tenfold כדי להשיג את הנסיוב כיילים 0-7 ושולט איכות (QC) א-ד לדוגמה, להוסיף 0.5 מ של ספייק פתרון עד 4.5 מ"ל של נסיוב צינור פוליפרופילן 10-mL, דגירה זה למשך 15 דקות אחסון הקרה-4 מעלות צלזיוס על מערבל רולר ב-50 סל ד.
- השתמש פיפטה החוזרות על עצמן כדי ליצור 100 aliquots µL של כיילים, QCs צינורות פוליפרופילן 1.5 מ.
- אחסן את כיילים, פקדים איכות ופתרונות לאנטיביוטיקה מניות ב- 80 ° C עד שישה חודשים.
- עבור כל אנטיביוטיקה, גם להכין פתרון מסודר המכיל 1,000 מ ג/ליטר של אנטיביוטיקה יחיד. לדלל את הפתרון מניות המתאימות עם diluent המתאים (למשל, עבור ציפרופלוקסאצין, שימוש 25% מתנול-מים כולל 20 מ מ חומצת חומץ).
הערה: הפתרונות לאנטיביוטיקה מסודר נדרשים עבור הכלי-הכוונון בלבד.
2. הכנת המיקס סטנדרטים פנימיים
הערה: סטנדרטים פנימיים הם התווית על-ידי איזוטופ עמיתיהם של analytes עניין הנוספים מדגם במהלך ניקוי הדגימה. כמו הסטנדרטים פנימי יש כמעט זהה הכולל physicochemical המאפיינים המקבילים ללא תווית, הם לפצות על ההשפעות מטריצה של דגימה נתון.
- הכינו 10 מ"ל של 50% מתנול במים על ידי הוספת 5 מ של מתנול מוחלטת בקבוקון טלטול 10 מ"ל, למלא אותו עד 10 מ"ל מים מזוקקים.
- הכינו 10 מ"ל של 50% מתנול במים כולל חומצה אצטית 20 מ מ. כדי לעשות זאת, להוסיף 1 מ"ל של חומצה אצטית 200 מ"מ בקבוקון 10 מ"ל, הוסף 5 מ של מתנול מוחלטת וכיצד למלא אותו עד 10 מ"ל מים מזוקקים.
- ליצור פתרונות מניות של סטנדרטים פנימיים (IS) עם 1,000 מ ג/ליטר ישירות בהבקבוקונים המסופקים על ידי היצרן. להמיס cefepime -13C12D3 סולפט, מים מזוקקים, meropenem-D6, לינזוליד-D3ו- piperacillin-D5 בפתרון מתנול מים 50%. להמיס ציפרופלוקסאצין-D8 במים-50% מתנול עם 20 מ מ אצטט ו moxifloxacin הידרוכלוריד -13C1ד3 -מים מזוקקים עם אצטט 20 מ מ.
- לשלב את הפתרונות מניות הוא צינור פוליפרופילן 1.5 mL להניב עושי מרוכז פנימי סטנדרטי שילוב. להוסיף 10 µL של cefepime -13C12D3, 10 µL של meropenem-D6, 1 µL של ציפרופלוקסאצין-D8, 2 µL של moxifloxacin הידרוכלוריד -13C1D3, 2 µL של לינזוליד-D 3, ו µL 10 piperacillin-D5 כדי µL 965 של 25% מתנול-מים.
- לאחסן את הפתרונות מניות תקן פנימי המיקס עושי IS מרוכז ב-80 מעלות צלזיוס.
3. החולה מדגם אחסון
הערה: ודא הסרום מתקבל מהר ככל האפשר שרשרת קר של דגימות קפוא נשמר.
- לאסוף את הדם כל הצינורות אוסף סרום.
- תן שקריש הדם למשך 20-30 דקות בטמפרטורת החדר.
- הפרד את הנסיוב ממחזור הדם על ידי צנטריפוגה ב x 2,000 g למשך 10 דקות.
- להעביר את תגובת שיקוע צינור נקי פוליפרופילן.
- לאחסן את הנסיוב עד שישה חודשים ב-80 מעלות צלזיוס עד זה הינו לבדיקה. לחלופין, לאחסן את הדגימות עד 3 ימים ב-20 ° C.
4. מאגר הכנה כרומטוגרפיה
- כדי להכין 1 מ' formate אמוניום במים, להמיס 6.306 גר' אמוניום formate ב- 100 מ של מים כיתה HPLC באמצעות בקבוקון שייק 100 מ. לאחסן את הפתרון עד חודש-4 מעלות צלזיוס.
- להכין הנייד שלב של [10 מ מ אמוניום formate בחומצה מים-formic (99.9:0.1 v/v)]. Prefill סטריליות של 1,000 מ עם-500 מ ל מים כיתה HPLC, להוסיף 1 מ"ל חומצה פורמית, 10 מ של הפתרון formate אמוניום 1 מ', למלא אותו עד 1000 מ"ל מים כיתה HPLC. העברת ניידים שלב א' לבקבוק זכוכית נקי וחבר מערכת HPLC. חנות סלולרי שלב עד שבועיים בטמפרטורת החדר.
- הכן השלב ניידים מתנול מוחלטת B. העברת HPLC-כיתה לתוך בקבוק זכוכית נקי וחבר מערכת HPLC.
- להשתמש במתנול מוחלט כפי המחט לשטוף הממס, להתחבר הצינור המתאים בקבוק הזכוכית המכיל ניידים שלב ב'
- ליצור את החותם של הממס לטיהור של חומצה מתנול-מים-formic (7:92.9:0.1, וי/v/v). Prefill סטריליות של 1,000 מ עם 500 מ ל מים מזוקקים, להוסיף 70 מ של מתנול מוחלטת, 1 מ"ל חומצה פורמית, ולהוסיף מים מזוקקים עד 1000 מ"ל. העברת הממס לבקבוק זכוכית נקי וחבר אותו עם מערכת HPLC.
הערה: מערכות תעשיה שונים להשתמש גם חזק וגם מרכך לשטוף המחט חלש. במקרה כזה, להכין את הפתרונות לשטוף, בהתאם להמלצות היצרן. לדוגמה, כביסה חזקה עם אלכוהול מתנול-מים-isopropylic (70:20:10, וי/v/v) והחלשים לשטוף עם מים-מתנול (95:5, וי/v).
5. כלי נגינה כוונון
הערה: שלב זה מתבצע עבור הסידור של השיטה-ספקטרומטר מסה ספציפיים.
- לדלל את analyte מסודר 1,000 מ ג/ליטר ו פתרונות סטנדרטיים פנימי 1:10 או בטחונות בתערובת של שלב נייד A ו- B (50: 50, וי/v), בהתאם עוצמות האות גלאי. לכוון את ספקטרומטר מסה עם הפונקציה כוונון אוטומטי או לעשות כוונון ידני מעברים הבאים יונים של האב-על-בת14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167.1 / 400.0), meropenem (384.1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ציפרופלוקסאצין (332.0 > 231.0/245.0), ציפרופלוקסאצין-D8 (340.1 > 235.1/249.3), moxifloxacin (402.0 > 261.0/383.9), moxifloxacin-13 C1ד3 (406.1 > 265.1/388.0), לינזוליד (338.0 > 235.0/296.0), לינזוליד-D3 (341.1 > 235.1/297.1), piperacillin (518.0 > 143.0/358.9), ו- piperacillin-D5 (523.1 > 142.8/364.1).
- עבור מכשירים עם הכיוונון האוטומטי, השתמש בפונקציה כוונון אוטומטי כדי להתאים באופן אוטומטי את המתח ואת ההגדרות של הים MS דרך גלאי.
- עבור מכשירים עם כוונון ידני, התאם את ההגדרות (למשל, התנגשות של מתח חשמלי אנרגיית התנגשות) עד אופטימום (בדרך כלל המקסימום) עוצמת האות מתקבל ב הגלאי עבור כל יון האב ובתו. לדוגמה, תקע יתד ערבוב, לספק סלולרי שלב A ו- B (50: 50, וי/v) 0.5 mL/min ו ברציפות להשרות התקן לאנטיביוטיקה או פנימי מסודר עם קצב זרימה של 0.1 mL/min.
6. HPLC-MS/MS הקמה
הערה: תכונות של ספקטרומטר המסה של מערכת HPLC (כולל את מזהמי מזון), התוכנה המתאימה תלויה היצרן. להתאים את הפרמטרים ספקטרומטר מסה וההליך שטיפת בהתאם להמלצות היצרן.
- לאחסן את הפרמטרים ספקטרומטר מסה מקביל 'MS לכוון את הקובץ ". השתמש ספקטרומטריית electrospray יינון במצב חיובי (ESI +) עבור כל analytes. להתאים את הגדרות מקור יון עבור המכשיר בשימוש (לדוגמה, מתח נימי של 1.5 kV מקור חום של 120 ° C, desolvation לטמפרטורה של 400 מעלות צלזיוס, קצב זרימת גז desolvation של 600 ל/ש, של מתח עדשה RF של 0.1 V, זמן להתעכב של 80 ms).
- ציין analyte ואת הסטנדרטים פנימית לכוון פרמטרים (למשל, מתח נימי, התנגשות אנרגיה) 'קובץ MS'.
- להגדיר את התנאים תעשיה כדלקמן, 'כניסת קובץ ': הטמפרטורה מדגם ב 10 ° C עם מגבלה של ± 5 ° C; הרצף שטיפת-1 x לטיהור-שטיפת-נקה עם µL 600 לטהר אמצעי חלופי.
- ב הנ 'כניסת קובץ ', קבע הזרימה בשיעור עד 0.4 או 0.5 mL/min, זמן ריצה ל 4 דקות, ממגבלת לחץ גבוה לבר 345, עמודה לטמפרטורה של 30 מעלות צלזיוס עם מגבלה של ± 5 ° C. הוסף את שם הממס ניידים שלבים A ו- B ולהגדיר אותם A B/93% 7%, בהתאמה.
- תוכנית מעבר הצבע כרומטוגרפי ב 'כניסת קובץ ' כדלקמן: 0.00 – 0.10 דקות עם 7% ניידים שלב א' B/93%, 0.11 – 0.60 דקות עם 65% ניידים שלב א' B/35%, 0.61 – 2.10 דקות עם 95% ניידים שלב א' B/5%, 2.11-4.00 דקות עם 7% ניידים שלב א B/93%
הערה: לחשב את עוצמת הקול של עמודות נוספות, העיכוב אמצעי האחסון עבור פלטפורמת פלייבק, ואת הגורמים השמירה analyte כמתואר ב- USP < 621 > בדיקות ה-מנחה16.
7. מדגם מדידה מאסטר קובץ
הערה: עם 'הקבצים הראשית של מדידה מדגם ', הדגימות החולה שצוינו, הניתוח HPLC-MS/MS ולאחר הערכת הנתונים מתבצע. נוצרים שני קבצי תבנית נפרדת כולל זוג שליטה נמוכה, באיכות גבוהה; תבנית אחת כוללת זוג QC A ו- C, השני QC זוג אחד B ו- d
- ליצור חדש 'הקבצים הראשית של מדידה מדגם '. בחר הנ 'MS לכוון קובץ ', 'קובץ MS', 'כניסת קובץ' (סעיף 6), להוסיף אותן בכל שורה לדוגמה, וציין את עוצמת הקול של הזרקת עם 15 µL.
- . עולה, להוסיף "הטקסט לדוגמה" כיילים 0-7, בקרת איכות (QC) זוג/C או זוג QC b/D.
- ציין את סוג הדגימה. בחר את סוג הדגימה "המוסר" כיילים, "QC" עבור זוגות בקרת איכות.
- ציין את הריכוז של כל חומר אנטיביוטי המתאים כיילים, פקדים איכות (ראה את הגיליון האלקטרוני, ריכוז [µg/mL] קאל 0 7 – Cal, QC/C או b/D,).
- התוכנית 'שיטת הערכת נתונים '. השתמש המעברים היו ממוטבת במהלך המכשיר כוונון (סעיף 5). תואם כל אנטיביוטיקה הסטנדרטי התווית על-ידי איזוטופ המתאים (למשל, meropenem - meropenem-ד6).
8. לטעום ניקוי וניתוח HPLC-MS/MS
הערה: עבור כל דגימה אצווה, פקד איכות מזווג עם נמוך וגבוה לאנטיביוטיקה ריכוז (QC/C או b QC/D) מעובד, מנותח. בין קבוצות שונות, הדגימות QC לזווג משמשים ברצף חלופי (למשל, ביום 1, בחר 'הקבצים הראשית של מדידה מדגם ' כולל QC זוג/ג; ביום 2, בחר הזוג QC כולל אחד b/D. העיבוד של הדוגמאות סרום מודגם באיור1.
- להכין הסוכן משקעים 10% - מתילטרט-בוטיל אתר ב מתנול (10:90, וי/v) (לדוגמה, prefill 25-mL סטריליות עם 2.5 מ של מתיל -טרט-בוטיל אתר ממלאים אותו 25 מ ל מתנול מוחלטת).
- הצב השלב הפוך C8 אל החדר לעמודה. לחבר אותו HPLC וספקטרומטר מסה בכיוון הזרימה.
- צור רשימת הדגימה. פתח המתאים 'הקבצים הראשית של מדידה מדגם ' תבנית ולהוסיף הדגימות המטופל נועד להיות מעובד לרשימה. ליצור קבוצות של עד 20 דגימות החולה קווינו עם הזוג בקרת איכות המתאימים.
- רטוב-ראש הממשלה באמצעות מערכת HPCL 'כניסת קובץ ' לשלוט בתוכנה: להגדיר את הפונקציה "ראש רטוב" לשלב ניידים 50% A/50% B ולאחר רטוב-ראש למשך 2 דקות עם קצב זרימה של 1 מ"ל לדקה.
- רענן את המזרק. כדי לעשות זאת, לבצע 6 קווים של 600 µL בתוכנה שליטה.
- Equilibrate העמודה שלב הפוכה C8. באמצעות התוכנה, להפעיל את זרימת 'כניסת קובץ ' ולא לשטוף את זה עם 7% ניידים שלב א' B/93% למשך תקופה מינימלית של 5 דקות, באמצעות קצב זרימה של 0.5 מ ל לדקה אימות הטמפרטורה עמודה של 30 ° C.
- להפשיר את הדגימות החולה, aliquot אחד של כיילים 0-7, וזוג בקרת איכות (או A / B או C/D).
- באמצעות פיפטה החוזרות על עצמן, להוסיף 25 µL של המיקס תקן פנימי 100 µL כיל, QC מדגם, או סרום החולה צינור פוליפרופילן 1.5 mL, ו מערבולת הצינור לכמה שניות.
- דגירה את התערובת למשך 5 דקות בטמפרטורת החדר ב- benchtop מטרף (למשל, ב- 1,200 סל ד).
- פיפטה החוזרות על עצמן, להוסיף 150 µL של ריאגנט משקעים לתערובת רגיל לדוגמה-פנימיים.
- שוב, מערבולת הצינור לכמה שניות, דגירה זה עבור 5 דקות בטמפרטורת החדר ב- benchtop מטרף (למשל, ב- 1,200 סל ד).
- Centrifuge את המתלים ב x 20,000 g ומפרידה שולחן 10 דקות ב 4 º C.
- לדלל את תגובת שיקוע 1:3 עם HPLC כיתה מים באמצעות בקבוקון זכוכית עם מיקרו-הוספת וטען שזה מעובד כמו דגימות תעשיה.
- להפעיל באופן ידני את הניתוח HPLC-MS/MS 'קובץ בקרת מדידה לדוגמה '.
הערה: עבור אחסון ממושך, לשטוף ביסודיות את העמודה אנליטי על פי ההמלצה של היצרן [למשל, 0.5 mL/min מתנול-מים (50: 50, וי/v)] כדי למנוע התמוטטות בשלב.

איור 1: ייצוג סכמטי של הניקוי דגימה. חלבון משקעים לעבר כוח צנטריפוגלי גבוהה מעניקה גלולה צפופה, ברור supernatant, כמסמן את המשקעים חלבון הושלמה. זמן העיבוד כולה הוא כ- 30 דקות, כולל ניקוי מדגם, ההפרדה כרומטוגרפי של הניתוח MS/MS. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
9. איכות הערכת ו כמת
- כדי לעבד את הדגימות, פתח המתאים 'קובץ בקרת מדידה לדוגמה ', בחר את כיילים, פקדים איכות ודוגמאות המטופל ולאחר להעריך אותם עם 'אנטיביוטיקה כימות שיטת '.
- בדוק אם הפסגות עבור analyte ספציפיים משולבים כהלכה. בדוק את הפסגות כל כיל, QC של החולה מדגם, באופן ידני שהשער אותם על הבסיס במידת הצורך.
- ללמוד את עקומת כיול ולבדוק אם זה עומד בקריטריונים איכות הבאות: א) ליניאריות על הטווח כולו כיול, שיטת r2 b) מקדם כיול > 0.995, ג) סטיית כל כיול סטנדרטי בתוך ± 15% ערך נומינלי, למעט הגבול התחתון של כימות (LLOQ), שבו נדרשת ± 20%.
- דחה תקן כיול לא עמידה בקריטריונים הנ ל ולהעריך מחדש את עקומת כיול, כולל ניתוח רגרסיה.
- ללמוד את הפקדים איכות ולבדוק אם הסטיות נמצאים במרחק ± 15% של נירות ערך.
- אם הריכוז של מדגם החולה עולה ריכוז כיל הגבוהה, לדלל את הדגימה עם מים מזוקקים, עד ל- 1:5 (למשל, µL 100 של נסיוב בתוספת 400 µL של מים מזוקקים) לפני הניקוי מדגם. Reperform צעדים 8.8 – 8.14 למדגם הספציפי הזה, לעבד אותו מחדש.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
באמצעות פרוטוקול המתואר, chromatogram טיפוסי מתוארת באיור2. על-פי ארצות הברית הפרמה קופיאה (USP) כרומטוגרפיה הנחיות16, עמודה האחסון מת בהמערכת הנוכחית נקבע עם ~0.22 mL והאחסון עמודות נוספות (כולל את מזרק, אבובים, מחברים) עם ~0.08 מל ', מתן אמצעי העיכוב של ~0.30 מ. הגורמים השמירה מחושבת עבור כל analytes היו 2.8 (עבור cefepime) - 4.2 (עבור piperacillin).
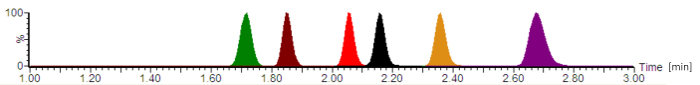
איור 2: טיפוסי chromatogram אנליטית עם עוצמות האות מנורמל. האנטיביוטיקה הם eluting לפי הסדר הבא: לינזוליד moxifloxacin (שחור), ציפרופלוקסאצין (אדום), meropenem (חום), cefepime (ירוק), (כתום), ו- piperacillin (סגול). הפעמים השמירה, אשר מקבלים דקות ולאחר בסימטריות שיא analyte משתנים, בהתאם ההרכב המדויק של שלבי ניידים, קצב הזרימה, הצנרת כרומטוגרפיה, עידן עמודה אנליטית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
איור 3A מכיל רשימה תרשים הדוגמה על הדגימות מעובד, לרבות כיילים 0 - 7 ("Kalibrator 0" - "Kalibrator 7"), פקדים איכות, סרה החולה, מסומנים עם המספר הזרקה (#); זיהוי הדגימה את הטקסט (טקסט לדוגמה); הריכוז נמדד ב- mg/L (.conc.); סוג הדגימה זה ריק, תקן, בקרת איכות, או החולה מדגם (סוג); ריכוז הנומינלי כיילים ב- mg/L (ריכוז או משחק סטנדרטי); זמן השמירה אנליטי (RT); בתגובה כי הוא היחס של אזור הפסגה של האזור analyte/שיא IS (תגובה); הסטייה מן הערך הנומינלי ריכוז (% Dev); המיקום מבחנה (בקבוקון); בזמן הרכישה (Acq.Time). הפרמטר מפתח המשמש עבור כימות הוא התגובה, הולך וגדל בהדרגה עם הריכוז analyte, עקב כמות נוספת התווית על-ידי איזוטופ תקן פנימי מתמיד.
איור 3B מציג עקומת כיול. רגרסיה, המקדם של נחישות r2 צריכה להיות > 0.995. המודל כיול הבא משמש עבור כל analytes תיאר בשיטה זו: עקומת סוג = ליניארית; מקור = כלול; שקלול = 1 / x; שינוי ציר = אף אחד. בדוגמה הנתונה, עקומת כיול של פקדים איכות למלא את כל קריטריוני איכות: r2 > 0.995 את עקומת הכיול ואת סטיית את כיילים (כולל את LLOQ) והדוגמאות QC נמצא ± 15% של נירות ערך.
המעברים נמדד יון אב-אל-בת (MRM) מקבלים איור 3C, מציג ארבע הפסגות במקביל השמירה: שתי הפסגות העליונות מתארים שני מעברים זה נמדדים עבור analyte עניין, שתי הפסגות התחתון מייצגים מעברים בזכות הסטנדרטים המתאימים פנימי התווית על-ידי איזוטופ. להערכת איכות, הפסגות analyte בחלונות זמן השמירה המתאימות בדק באופן חזותי, reintegrated באופן ידני על הבסיס, בעת הצורך.
הריכוז המעכב מינימלית (MIC) הוא המרכיב המרכזי של TDM מיקרוביאלית, הגדרת החשיפה פרמוקוקינטיים הנדרש להשגת היעד pharmacodynamic/פרמקוקינטיקה ופרמקודינמיקה (PK/KD) יחס13,17. בהתאם לכך, רמות ריכוז היעד TDM לאנטיביוטיקה באים לידי ביטוי ביחס מיקרופון לנגיף סיבתי. בהתחשב בכך הפעולה של בטא אנטיביוטיקה lactam הוא תלוי זמן, היעילות שלהם מוגדל דרך ההישג של ריכוז טיפולית החורגות מיקרופון 4 x-5 x (מטרים > 4-5 x מיקרופון). כאשר מול גורמי מחלה זיהומית לא ידוע, טווח היעד שוקת ריכוז piperacillin (חלבון-לא מאוגד) חינם היא, אפוא, 64 mg/L, המייצגים כ 90 מ"ג/ליטר piperacillin סה כ18.
המטופל הראשון (דוגמה #11) יש רמת שוקת משביע רצון גבוהה סרום piperacillin 83.4 mg/L זה גם מספיק גורמים מחוללי הבעיה, כגון Pseudomonas aeruginosa. החולה השני (דוגמה #12) יש ריכוז של 0.2 מ"ג/ליטר, אשר מתחת כיל הנמוך (LLOQ). אולי שיחזר המטופל, הניהול של piperacillin הופסק. התוצאה "< 0.5 מ ג / ל' הוא, לכן, דיווח במערכת מידע בבית החולים. החולה השלישי (דוגמה #13) יש ריכוז שוקת piperacillin נמוכה של רק 5.3 מ ג/ליטר שאינה מספיקה רוב ברור של פתוגנים. יעיל מיקרוביאלית בכימותרפיה, המינון צריך להיות מוגברת על ידי הרופא.
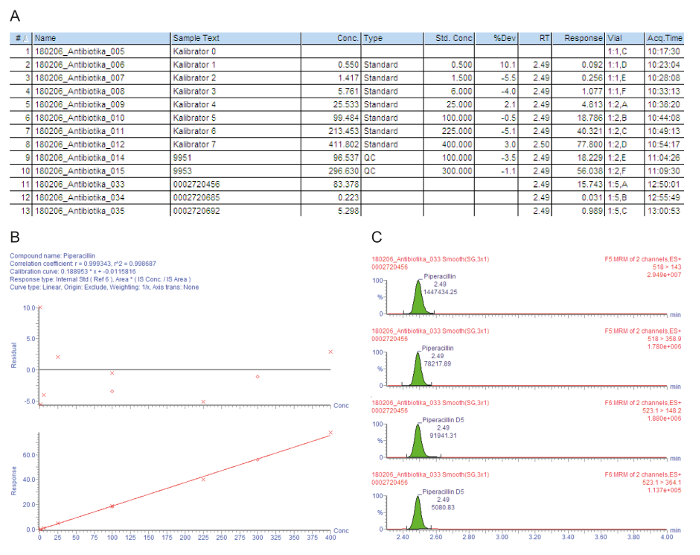
איור 3: הערכת איכות למופת, כימות עבור piperacillin analyte. לוחות אלה מייצגים ניתוח הנתונים ספקטרומטר מסה. (א) לוח זה מציג רשימת הדגימה, לרבות כיילים (רגיל, דגימות #1 - #8), פקדים איכות (QC, דגימות #9 ו- #10), החולה סרה (דוגמאות #11 - #13). כיל 0 מתייחס ריק ללא analyte, אבל עם התוספת של תקן פנימי. 9951 מייצג QC B, מייצג 9953 QC ד (B) לוח זה מראה את עקומת כיול עבור piperacillin. הסטיות אחוז מן הריכוזים כיל הנומינלי מקבלים את הגרף העליון (y-ציר: שיורית), הגרף התחתון מתאר את טווח כיול ליניארי. (ג) לוח זה מציג את זמן התגובה מרובים ניטור (MRM) piperacillin, המקביל פנימי סטנדרטי piperacillin-D5 למדגם סרום החולה #12. מעברים יון אב-אל-בת שני מוצגים עם עוצמות האות בהתאמה מזמנם השמירה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
קובץ משלים. אנא לחץ כאן כדי להוריד את הקובץ.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
כתב יד זה, אנחנו מדווחים הפרוטוקול עבור שיטה מבוססת ספקטרומטר מסה טנדם פשוט וחזק עבור כימות של אנטיביוטיקה נפוצות על טיפול נמרץ19, כלומר cefepime, meropenem, ציפרופלוקסאצין, moxifloxacin, לינזוליד, ו piperacillin14. גיליון מלווה את כתב היד עבור הכנת פתרונות מניות לאנטיביוטיקה כיילים, בקרת איכות, לוקח בחשבון את הטוהר של האנטיביוטיקה, את המשקל המולקולרי של counterions שלהם. בהתחשב בכך ריכוזי האנטיביוטיקה גבוהים למדי, כימות שלהם צריך להיות שום אתגר מסוים מנקודת מבט אנליטית. בהתאם לכך, אנו בטוחים כי פרוטוקול זה הוא החלים על פלטפורמות פלייבק שונות של MS. על שיטת העברה, מומלץ לכמת את עוצמת הקול של עמודות נוספות וזמן העיכוב אמצעי האחסון של המערכת כרומטוגרפי שלהם וכדי להתאים את ההתחלה הדרגתיות בהתאם16. במהלך קביעת שיטה, גם צריך להיות מוערך המערכת עבור carry-over, במידת הצורך, מדגם ריק חייב להיות מוזרק לאחר הדגימות הגבוהה כיל, החולה עם ריכוזים גבוהים לאנטיביוטיקה. משתמשים בחשבון גם את האפשרות של רוויה גלאי המתרחשת כאשר יונים רבות מדי להיכנס בספקטרומטר טנדם. ניתן לסלק רוויה גלאי הרלוונטיים עם כמויות הזרקת קטנים יותר, לדילול analyte גבוה יותר במהלך הניקוי מדגם ו/או על detuning של היעד analyte (למשל, הקטנת את ההגדרות של האופטימלית מתח).
בניגוד לשיטות אחרות, הטווח כיול מאפשר שני של כימות של ריכוזים קרוב המיקרופון של פתוגנים רגישים, כמו גם ריכוז שיא (cmax) שמושגות עם הממשל בולוס. הגבוה ביותר Cmax-הערכים עבור מבוגרים מדווחים בין הסדינים מידע מקצועי התואם בטיחות התרופה מסד הנתונים של ה-FDA כדלקמן: 163.9 mg/L cefepime20, 112 מ ג/ליטר meropenem21, 4.6 מ ג/ליטר עבור ציפרופלוקסאצין22 , 4.1 mg/L עבור moxifloxacin2321.2 mg/L עבור לינזוליד24, 298 מ ג/ליטר של piperacillin25. ריכוז לאנטיביוטיקה ניטור מחזור הדם של החולה מאפשר התאמה במינון כדי הרגישות של פתוגנים מעורב, אך ניתן להשיג האזור פרמוקוקינטיים מתחת לעקומה באמצעות לקיחת דמים מרובים עם נתון פרוטוקול.
אנטיביוטיקה רבים (במיוחד lactam בטא meropenem) הם לא יציב מבחינה כימית פעם התפרקה. השלב הקריטי ביותר של פרוטוקול זה היא, אפוא, ההכנה של פתרונות מניות, כיילים, פקדים איכות תחת בתנאי קור26,27. . במובן הזה, זה גם חיוני כדי להקפיא דוגמיות המטופל מהר ככל האפשר. למרות סרום אחסון ב-80 מעלות צלזיוס מומלץ26, ניסויים היציבות שלנו מראים כי דגימות ניתן גם לאחסן ל-3 ימים ב-20 ° C ללא כל ירידה משמעותית של ריכוזים אנטיביוטיקה (אפילו ברמות שוקת).
אנו ממליצים על ביצוע בדיקת התאמת המערכת לפני כל ניתוח HPLC-MS/MS דוגמאות החולה (למשל, עם כיל 3). באופן כללי, בדיקת התאמת המערכת משמשת כדי לאמת את הדיר של מערכת LC-MS/MS, כדי לראות אם זה גם מספיק לניתוח להיעשות. כך, למשל, הפחתת עוצמות האות נגרמות על ידי זיהום של חרוט לטאטא MS, אשר, לאחר מכן, דורש ניקוי שלה עם הממס האורגני. כדי לשמור על מקור MS נקי, שסתום הפניית יכול להיות מוצג לאחר העמודה כרומטוגרפיה, בימוי "נטול analyte" חלקים של השלב נייד כדי הבזבוז לפני שהם מגיעים את ספקטרומטר מסה. מצד שני, גידול הכוללת של הלחץ יכול לציין עמודה סתימת לאורך זמן. כדי להגדיל את העמודה אריכות ימים השימוש במסנן precolumn חסכונית היא recommendable. אם הלחץ עדיין ממשיך להוות בעיה, קצב זרימה של 0.4 mL/min יכול לשמש גם במעבר כרומטוגרפי של פרוטוקול זה.
מגבלה מינור של טכניקה זו היא כי זה דורש שלושה שלבים ידניים נפרדים עבור ניקיון מדגם, וכתוצאה מכך זמן סבב סך של-30 דקות להוסיף את התווית על-ידי איזוטופ סטנדרטים פנימיים לסוכן משקעים עשוי לחסוך זמן העיבוד. עם זאת, זה צריך להיעשות רק עבור שיעורי תפוקה גבוהה דגימה ולבזות עם משקעים הסוכן אחסונן בקור (למשל, ב-20 מעלות צלזיוס), כמו הסטנדרטים פנימי גם במבחנה בטמפרטורות גבוהות.
הפרוטוקול המתואר פותחה עבור מדגם עיבוד צינורות פוליפרופילן mL 1.5 סטנדרטי. קצב תפוקה גבוהה יותר יהיה צורך באנטיביוטיקה TDM, ניתן לשדרג את ההליך לתבנית צלחת רב טוב באמצעות צנטריפוגה נאותה מוסיף או מסנן צלחות עם יריעה ואקום.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים אין לחשוף.
Acknowledgments
המחברים תודה ד ר Schütze לעזרתו עם הקמת השיטה שהוצגו, ד ר צולר על המידע בעל ערך לגבי הטווח הנכון כיול. המחברים גם להכיר את הצוות הטכני של המתקן ספקטרומטר מסה.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



