Summary
Aquí presentamos un protocolo de masa basado en la espectrometría de tándem para la cuantificación de los antibióticos utilizados en unidades de cuidados intensivos, es decir, cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolid y piperacilina.
Abstract
Hay una demanda creciente para el monitoreo de drogas terapéuticas de antibióticos en muchas instalaciones clínicas, particularmente con respecto a la implementación de programas de administración de antibióticos del hospital.
En el presente trabajo, presentamos un protocolo multiplex alto rendimiento líquido cromatografía-espectrometría total en tándem (HPLC-MS/MS) para la cuantificación de cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolid y piperacilina, utilizados antibióticos en unidades de cuidados intensivos. El método comprensivo anteriormente se validó según la pauta de la Agencia Europea de medicamentos.
Después de una limpieza rápida de la muestra, los analitos son separados en una columna HPLC de fase reversa C8 dentro de 4 minutos y cuantificados con el correspondientes estables isótopo-etiquetada estándares internos en espectrometría de masas por electrospray ionización (ESI +) en reacción de múltiples tiempo control (MRM). El método presentado utiliza una instrumentación simple ajuste con condiciones cromatográficas uniforme, lo que permite el seguimiento diario y robusto antibiótico terapéutico en los laboratorios clínicos. La curva de calibración extiende el rango de concentración farmacocinética, así como antibióticos cantidades cerca de la concentración inhibitoria mínima (CIM) de las bacterias susceptibles y las concentraciones máximas (Cmax) que se obtienen con bolo regímenes de administración. Sin la necesidad de la dilución de suero antes de la limpieza de la muestra, puede obtenerse el área bajo la curva para un antibiótico administrado a través de mediciones múltiples.
Introduction
Aunque los antibióticos han revolucionado la práctica de la medicina, graves infecciones bacterianas siguen siendo una causa importante de morbilidad y mortalidad en enfermedades graves1. En este sentido, la administración pronta de un antiinfeccioso adecuado en una dosis adecuada es de importancia superior para el control de la enfermedad2.
Un creciente cuerpo de evidencia demuestra que el tratamiento empírico con antibióticos de amplio espectro se está convirtiendo en cada vez más problemático con la complejidad de las poblaciones de pacientes. Esto es especialmente cierto para unidades de cuidados intensivos (UCI), donde una enorme variabilidad interindividual de los parámetros farmacocinéticos claves del (PK) con frecuencia se observa3,4. En consecuencia, pacientes de la UCI están en riesgo inminente de niveles sub-terapéuticos con el peligro de un escaso éxito terapéutico5,6. Por otra parte, pacientes exponen innecesariamente a excesivamente altas concentraciones de antibióticos que pueden resultar en eventos adversos graves con ningún beneficios clínicos7. El mal uso de antibióticos y la dosificación insuficiente también han impulsado la difusión de la resistencia a los antibióticos, que se está convirtiendo en una amenaza creciente para la salud pública8.
Para mejorar el uso de antibióticos y para preservar su effectivenessas tiempo como sea posible, la Organización Mundial de la salud ha puesto en marcha un plan de acción global sobre resistencia a los antimicrobianos en 20159. Los programas de administración de antibióticos constituyen una piedra angular esencial de uso prudente de antimicrobiano en la salud pública nacional estrategias10, ayudando a los médicos a mejorar significativamente la calidad de atención del paciente11 y, al mismo tiempo, la reducción de la resistencia a los antibióticos12. Antimicrobiano dosis en pacientes individuales a través de la aplicación de drogas terapéuticas (TDM) el monitoreo es un instrumento clave en este contexto13.
Hasta la fecha, disponible en el mercado TDM ensayos sólo están disponibles para los antibióticos glucopéptidos y aminoglucósidos. La cuantificación de sustancias de otras clases comúnmente requiere un desarrollo interno o validación que puede resultar engorroso. Por lo tanto, presentamos en detalle el protocolo para un ensayo basada en espectrometría de masa sólido que puede ser utilizado para la cuantificación de los principales antibióticos en UCI dentro de sus rangos de concentración relevante clínica14. El método fue establecido recientemente en nuestro centro de espectrometría de masas y se ha aplicado para la rutina de TDM en UCI desde entonces. El procedimiento utiliza un marco analítico sencillo y simple con una limpieza uniforme de la muestra, lo que permite la rápida aplicación de antibiótico TDM en muchas instalaciones con capacidades de espectrometría de masas.
El protocolo descrito aquí fue optimizado para la cuantificación de cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolid y piperacilina en suero humano, usando la cromatografía de líquidos de dilución isotópica (LC) en combinación con un tándem masa Espectrometría (MS/MS). Para la dilución del isótopo metodología LC-MS/MS, compuestos marcados con isótopos estables se añaden a una muestra de interés con una matriz específica (p. ej., suero). Normas de marcado con el isótopo pueden distinguirse de sus contrapartes sin etiqueta, es decir el analito de interés, debido a distintos pesos moleculares de la molécula natural y sus productos de fragmentación, como una transición de padres-ion a hija-ion. Compuestos marcados con isótopos tienen un comportamiento general fisicoquímico idéntico en comparación con su contraparte sin etiqueta, son normas internas ideal para MS/MS, lo que permite una cuantificación del analito casi independiente de la matriz con un alto grado de precisión15. Hoy en día, muchos estables isótopo-etiquetada estándares internos que pueden utilizarse para la cuantificación de moléculas pequeñas, como el TDM de antimicrobianos, están disponibles en el mercado.
La separación cromatográfica de los analitos antibióticos en el protocolo descrito se realiza con una columna de fase inversa de longitud de la cadena alquil C8 analítica (100 mm x 2,1 mm, 3 μm tamaño de las partículas). Durante el desarrollo del método, los factores internos estándar matriz normalizada para todos los analitos fue entre 94,6% y 105,4%, con un coeficiente de variación de ≤8.3%14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Nota: Se recomienda para trabajar en una campana de humos al manipular disolventes orgánicos, como el metanol. Preparar todos los búferes y fases móviles en matraces aforados. Si no indique lo contrario, las soluciones se pueden almacenar a temperatura ambiente hasta 1 mes después de la preparación.
1. preparación de los calibradores y las muestras de Control de calidad
Nota: Una hoja de análisis de datos correspondientes para la preparación de soluciones stock y spike se da en el Archivo suplementario. Por razones de trazabilidad, inserte el fabricante, número de catálogo y mucho número de cada antibiótico en las columnas correspondientes. Disolver todos los antibióticos en una cámara frigorífica a 4 ° C y mantener el tiempo de trabajo tan corto como sea posible.
- Preparar 100 mL de metanol al 25% en agua: rellenar previamente un matraz aforado de 100 mL con 25 mL de metanol absoluto y completar hasta 100 mL con agua destilada.
- Preparar 10 mL de ácido acético de 200 mM en agua: rellenar previamente un matraz aforado de 10 mL con 9 mL de agua de calidad HPLC, agregar 115 μl de ácido acético glacial (99.5% de pureza, 17,4 M) y agregar agua destilada hasta 10 mL.
- Preparar 25 mL de metanol al 25% en agua con ácido acético al 20 mM: rellenar previamente un matraz aforado de 25 mL con 2,5 mL de la solución de ácido acético acuoso 200 mM, añadir 6,25 mL de metanol absoluto y llenar el matraz de 25 mL con agua destilada.
- Utilice una balanza de precisión para pesar la cantidad adecuada de antibióticos en tubos cónicos de 15 mL como se describe en el Archivo suplementario en el peso inicialde la columna.
- Preparar las soluciones madre de las fluoroquinolonas, ciprofloxacino y moxifloxacina en el 25% metanol-agua, incluidas 20 mM acético ácido. Para ello, agregue el volumen correspondiente a las cantidades ponderadas como se describe en el Archivo suplementario en la columna "volumen final". Disolver rápidamente los antibióticos de fluoroquinolona en un baño de ultrasonido por 2 min y todo con un vórtex intenso.
- Preparar soluciones de cefepima, linezolid, meropenem y piperacilina en el 25% de metanol-agua. Para ello, agregue el volumen correspondiente a las cantidades ponderadas como se describe en el Archivo adicional en el volumen final de la columna y disolver rápidamente los antibióticos con un vórtex intenso. Meropenem se disuelven como la última sustancia.
- Combinar las soluciones stock de los antibióticos como se describe en la tabla de volumen correspondiente de solución madre en el Archivo suplementario para rendimiento de espiga-soluciones concentradas diez veces.
- Punto nueve volúmenes de suero libre de drogas con un volumen de las soluciones de punto concentrada diez veces para obtener los calibradores de suero 0 – 7 y los controles de calidad (QC) un-D. Por ejemplo, Añadir 0,5 mL de solución de punto a 4,5 mL de suero en un tubo de polipropileno de 10 mL e incubar durante 15 min en el almacenamiento en frío a 4 ° C en un mezclador de rodillos a 50 rpm.
- Utilizar una pipeta repetitiva para generar 100 alícuotas de μl de los calibradores y QCs en tubos de polipropileno de 1.5 mL.
- Almacenar los calibradores, controles de calidad y soluciones antibióticas a-80 ° C hasta por seis meses.
- Para cada antibiótico, también preparar una solución limpia que contiene 1.000 mg/L de un antibiótico único. Diluir la solución correspondiente con un diluyente apropiado (por ejemplo, para ciprofloxacin, use 25% metanol-agua 20 mM acético).
Nota: Las soluciones de antibióticas aseadas son necesarias para la afinación de instrumento sólo.
2. preparación de la mezcla de estándares internos
Nota: Los estándares internos son contrapartes marcada con isótopo de los analitos de interés que se añaden a una muestra durante la limpieza de la muestra. Como las normas internas tienen casi idénticas propiedades físico-químicas en general a sus homólogos sin etiqueta, compensan los efectos de la matriz de una muestra determinada.
- Preparar 10 mL de metanol al 50% en agua añadiendo 5 mL de metanol absoluto a un matraz de 10 mL agitar y completar a 10 mL con agua destilada.
- Preparar 10 mL de metanol 50% en agua, incluyendo el ácido acético 20 mM. Para ello, añada 1 mL de ácido acético de 200 mM a un matraz de 10 mL, agregar 5 mL de metanol absoluto y completar hasta 10 mL con agua destilada.
- Generar soluciones de estándares internos (si) con 1.000 mg/L en los frascos de proporcionado por el fabricante. Disolver el cefepime -13C12D3 sulfato en agua destilada, meropenem-D6, linezolid-D3y piperacilina-D5 en una solución de metanol-agua 50%. Ciprofloxacina-D8 en 50% de metanol-agua con 20 mM acetato y moxifloxacina clorhidrato -13C1D3 en agua destilada con acetato de 20 mM se disuelven.
- Combinar las soluciones stock es en un tubo de polipropileno de 1.5 mL para producir una mezcla estándar interna concentrada por cinco veces. Añadir 10 μl de cefepime -13C12D3, 10 μl de meropenem-D6, 1 μl de ciprofloxacina-D8, 2 μl de moxifloxacina clorhidrato -13C1D3, 2 μl de linezolid-D 3y 10 μl de piperacilina-D5 a 965 μl de metanol-agua de 25%.
- Almacenar las soluciones stock estándar internas y la quíntuple mezcla concentrada es a-80 ° C.
3. paciente almacenamiento
Nota: Asegúrese de que el suero se obtiene tan rápido como sea posible y que se mantenga la cadena de frío de las muestras congeladas.
- Recoger la sangre en los tubos de suero.
- Deje que el coágulo de sangre de 20-30 min a temperatura ambiente.
- Separar el suero de la sangre por centrifugación a 2.000 x g por 10 min.
- Transferir el sobrenadante a un tubo limpio de polipropileno.
- Almacenar el suero hasta seis meses a-80 ° C hasta que se ensayaron. También puede almacenar las muestras hasta 3 días a-20 ° C.
4. preparación tampón para cromatografía
- Para preparar 1 M formiato de amonio en agua, disolver 6,306 g de formiato de amonio en 100 mL de agua de calidad HPLC utilizando un matraz de 100 mL batido. Almacenar la solución hasta 1 mes a 4 ° C.
- Preparar el móvil un [formiato de amonio 10 mM en ácido fórmico-agua (99.9:0.1 v/v)] de la fase. Rellenar previamente un matraz aforado de 1.000 mL con 500 mL de agua de calidad HPLC, añadir 1 mL de ácido fórmico y 10 mL de la solución de formiato de amonio de 1 M y completar hasta 1.000 mL con agua de calidad HPLC. Fase móvil A la transferencia a un frasco de vidrio limpio y conectar al sistema de HPLC. Fase móvil de la tienda hasta 2 semanas a temperatura ambiente.
- Preparar la fase móvil metanol absoluto B. transferencia grado HPLC en un frasco de vidrio limpio y conectar al sistema de HPLC.
- Utilizar metanol absoluto como disolvente de lavado de la aguja y conecte el tubo correspondiente a la botella de vidrio que contiene la fase móvil B.
- Generar el sello y purgación solvente de ácido fórmico de metanol-agua (7:92.9:0.1, v/v/v). Rellenar previamente un matraz aforado de 1.000 mL con 500 mL de agua destilada, agregar 70 mL de metanol absoluto, 1 mL de ácido fórmico y añadir agua destilada a 1000 mL. Transferir el solvente a un frasco de vidrio limpio y conectar con el sistema HPLC.
Nota: Varios sistemas de muestreadores utilizan un fuerte y un solvente de lavado de aguja débil. En tal caso, preparar las soluciones de lavado según las recomendaciones del fabricante. Por ejemplo, el lavado fuerte con alcohol metanol-agua-isopropylic (70:20:10, v/v/v) y los débiles lavar con agua-metanol (95: 5, v/v).
5. instrumento Tuning
Nota: Este paso se realiza para el establecimiento del método en un espectrómetro de masas específico.
- Diluir el analito aseado 1.000 mg/L y soluciones estándar interno 1:10 o 1: 100 en una mezcla de la fase móvil A y B (50: 50, v/v), dependiendo de la intensidad de señal de detector. Sintonizar el espectrómetro de masas con la función autotune o hacer un ajuste manual para los siguientes iones de padre a hija transiciones14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167,1 / 400.0), meropenem (384.1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ciprofloxacina (332.0 > 231.0/245.0), ciprofloxacina-D8 (340.1 > 235.1/249.3), moxifloxacina (402.0 > 261.0/383.9), moxifloxacina-13 C1D3 (406.1 > 265.1/388.0), linezolid (338.0 > 235.0/296.0), linezolid-D3 (341.1 > 235.1/297.1), piperacilina (518.0 > 143.0/358.9) y piperacilina-D5 (523.1 > 142.8/364.1).
- Para instrumentos con autotuning, utilice la función autotune para ajustar automáticamente el voltaje y la configuración de la entrada de MS a través de los detectores.
- Para instrumentos con sintonización manual, ajustar los parámetros (por ejemplo, voltaje de choque y energía de la colisión) hasta el óptimo (generalmente el máximo) intensidad de la señal se obtiene en el detector para cada ion de padre e hija. Por ejemplo, una mezcla t del enchufe, entregar la fase móvil A y B (50: 50, v/v) a 0,5 mL/min e infundir continuamente el estándar de antibiótico o interno aseado con un caudal de 0,1 mL/min.
6. configuración HPLC-MS/MS
Nota: Cuenta del espectrómetro de masas, HPLC sistema (incluyendo el inyector automático) y el software correspondiente dependen del fabricante. Adaptar los parámetros del espectrómetro de masas y el procedimiento de lavado según las recomendaciones del fabricante.
- Almacenar los parámetros de espectrómetro de masas en un correspondiente 'MS tune archivo '. Uso de ionización por electrospray en modo positivo (ESI +) para todos los analitos. Adaptar la configuración de fuente de iones para el instrumento utilizado (por ejemplo, una tensión capilar de 1.5 kV, una temperatura de fuente de 120 ° C, una temperatura de 400 ° C de desolvation, un desolvation gas caudal 600 L/h, un voltaje de RF lente de 0.1 V y un tiempo de permanencia de 80 ms).
- Especificar el analito y estándares internos ajustar parámetros (por ejemplo, la tensión capilar, energía de la colisión) en un 'MS archivo de '.
- Establecer las condiciones de muestreadores como sigue en la 'archivo de entrada ': la temperatura de la muestra a 10 ° C con un límite de ± 5 ° C; la secuencia de lavado en x 1 purga-lavado-purga con 600 μl de purga reemplazo de volumen.
- En la mencionada 'archivo de entrada ', establecer el caudal de 0,4 o 0,5 mL/min, el tiempo de ejecución a 4 minutos, el límite superior de presión de 345 bar y la temperatura de la columna a 30 ° C con un límite de ± 5 ° C. Agregue el nombre solvente de fases móviles A y B y les B/93% al 7%, respectivamente.
- Programa el gradiente cromatográfico en el 'archivo de entrada ' como sigue: 0.00 – 0.10 min con fase móvil de 7% B/93% A, 0,11 – 0,60 min con fase móvil 65% B/35% A, 0,61 – 2.10 min con la fase móvil 95% B/5% A, 2.11 – 4.00 min con fase móvil de 7% B/93% A.
Nota: Calcular el volumen de la columna extra, el volumen de retención para la plataforma instrumental y los factores de retención del analito según lo descrito en la USP < 621 > cromatografía pauta16.
7. muestra medición Master File
Nota: Con el 'ejemplo de archivo de medición principal ', se especifican las muestras de pacientes, el análisis de HPLC-MS/MS se inicia y se realiza la evaluación de datos. Se generan dos archivos de plantilla separados, incluyendo un par de control de baja y alta calidad; una plantilla incluye control de calidad par A y C, el otro un par de control de calidad B y D.
- Crear una nueva 'ejemplo medición principal de archivo '. Seleccione la mencionada 'MS tune archivo ', 'MS archivo de 'y 'archivo de entrada' (sección 6), en cada línea de muestra y se especifica el volumen de inyección con 15 μl.
- En orden ascendente, añadir el "texto de ejemplo" para calibradores 0 – 7 y control de calidad (QC) par aire acondicionado o control de calidad par B/D.
- Especificar el tipo de muestra. Seleccione el tipo de muestra "estándar" para los calibradores y "Control de calidad" para los pares de control de calidad.
- Especificar la concentración de cada sustancia antibiótica para los correspondientes calibradores y controles de calidad (ver la hoja de cálculo, concentración [μg/mL] Cal 7 – Cal 0, control de calidad del aire/acondicionado o B/D,).
- Programa de la 'método de evaluación de datos '. Utilizar las transiciones que fueron optimizadas en el instrumento de ajuste (artículo 5). Coincidir con cada antibiótico con el correspondiente marcado con el isótopo estándar (e.g., meropenem - meropenem-D6).
8. limpieza y análisis de HPLC-MS/MS de la muestra
Nota: Por cada lote de muestras, un control de calidad vinculado con una concentración de antibiótica alta y baja (aire acondicionado de control de calidad o control de calidad B/D) es procesado y analizado. Entre diversas hornadas, las muestras pareadas de control de calidad se utilizan en una secuencia alternativa (p. ej., el día 1, seleccione el 'muestra medición maestra de archivos ' incluyendo control de calidad par aire acond., en el día 2, seleccionar el par de control de calidad incluyendo una B/D. El procesamiento de las muestras de suero se ilustra en la figura 1.
- Preparar el agente de precipitación 10% metil -tert-éter butílico en metanol (10:90, v/v) (p. ej., matraz aforado de prellenado a 25 mL con 2,5 mL de metil -tert-éter butílico y completar a 25 mL con metanol absoluto).
- Coloque la fase reversa C8 en la cámara de la columna. Conecte el HPLC y el espectrómetro de masas en la dirección del flujo.
- Generar la lista de muestra. Abrir el correspondiente 'muestra medición maestra de archivos ' plantilla y agregar las muestras de pacientes para procesar a la lista. Generar grupos de hasta 20 muestras de pacientes y flanco con el par de control de calidad correspondiente.
- Mojado-prime el sistema HPLC utilizando el 'archivo de entrada ' software de control: la función de "primer mojado" a 50% fase móvil B A/50% y mojado-prime por 2 min con un flujo de 1 mL/min.
- Actualizar la jeringa. Para ello, ejecutar 6 trazos de 600 μL en el software de control.
- Equilibrar la columna de fase reversa C8. El software, activar el flujo de la 'archivo de entrada ' y lavarlo con 7% móvil fase B/93% A un mínimo de 5 minutos, utilizando una tasa de flujo de 0,5 mL/min Verifique la temperatura de la columna de 30 ° C.
- Descongelar las muestras de pacientes, una alícuota de calibradores 0 – 7 y un par de control de calidad (A / B o C/D).
- Con una pipeta repetitiva, añada 25 μl de la mezcla estándar interna al calibrador μl 100, muestra del control de calidad o suero del paciente en un tubo de polipropileno de 1.5 mL y agitar el tubo durante unos segundos.
- Incubar la mezcla durante 5 minutos a temperatura ambiente en un agitador de sobremesa (por ejemplo, a 1.200 rpm).
- Con una pipeta repetitiva, añadir 150 μL de un reactivo de precipitación a la mezcla estándar interno a la muestra.
- Otra vez, mezclar el tubo para unos pocos segundos e incubar 5 min a temperatura ambiente en un agitador de sobremesa (por ejemplo, a 1.200 rpm).
- Centrifugar la suspensión a 20.000 x g en una centrífuga de mesa durante 10 min a 4 ° C.
- Diluir el sobrenadante 1:3 con agua de calidad HPLC utilizando un frasco de vidrio con una inserción de micro y cargar muestras procesadas como para el inyector automático.
- Iniciar el análisis de HPLC-MS/MS el 'ejemplo medición control de archivo '.
Nota: Para un almacenamiento prolongado, deje correr la columna analítica según las recomendaciones del fabricante [p. ej., 0,5 mL/min metanol-agua (50: 50, v/v)] para evitar el colapso de la fase.

Figura 1: representación esquemática de la limpieza de la muestra. Precipitación de proteínas en la alta fuerza centrífuga da un pellet denso y claro sobrenadante, indicando eso precipitación de la proteína fue completa. Todo el tiempo de procesamiento es aproximadamente 30 minutos, incluyendo el análisis MS/MS, la limpieza de la muestra y la separación cromatográfica. Haga clic aquí para ver una versión más grande de esta figura.
9. cuantificación y evaluación de la calidad
- Para procesar las muestras, abrir el correspondiente 'archivo de control de medición muestra ', seleccione los calibradores, controles de calidad y muestras de pacientes y evaluarlos con el 'método de cuantificación de antibióticos '.
- Verificar si los picos para un analito se integran correctamente. Inspeccione los picos para cada calibrador, control de calidad y muestra del paciente y reintegrarlos manualmente en la línea de base si es necesario.
- Estudio de la curva de calibración y determinar si satisface los siguientes criterios de calidad: a) linealidad sobre el rango entero de calibración, b) un coeficiente de calibración r2 > 0.995, c) la desviación de cada calibración estándar dentro de ± 15% de la valor nominal, excepto por el límite inferior de cuantificación (LLOQ), donde se requiere ± 20%.
- Rechazar un estándar de calibración que no cumplan con los criterios antes mencionados y evaluar la curva de calibración, incluyendo el análisis de regresión.
- Los controles de calidad de estudio y examinar si las desviaciones son dentro de ± 15% del valor nominal.
- Si la concentración de una muestra del paciente excede la concentración del calibrador más alto, diluir la muestra con agua destilada, hasta 1:5 (p. ej., 100 μl de suero plus 400 μL de agua destilada) antes de la limpieza de la muestra. Reperform pasos 8.8 – 8.14 para muestra específica y reprocesarlo.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Utilizando el protocolo descrito, un cromatograma típico se muestra en la figura 2. Según el United States Pharmacopeia (USP) cromatografía directrices16, se determinó el volumen muerto de la columna en el sistema actual con ~0.22 mL y el volumen de la columna extra (incluyendo los conectores, inyector y tubería) con ~0.08 mL, dando un volumen de retención de ~0.30 mL. Los factores de retención calculado para todos los analitos fueron 2.8 (para cefepime) - 4.2 (para piperacilina).
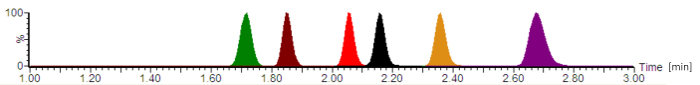
Figura 2: cromatograma típico analítico con intensidades de la señal normalizada. Los antibióticos son liberadores de fármacos en el siguiente orden: cefepime (verde), meropenem (marrón), ciprofloxacina (rojo), moxifloxacina (negro), linezolid (naranja) y piperacilina (púrpura). Los tiempos de retención, que se dan en minutos, y las simetrías del pico de analito varían, dependiendo de la composición exacta de las fases móvil, el caudal, la tubería de la cromatografía y la edad de la columna analítica. Haga clic aquí para ver una versión más grande de esta figura.
Figura 3A contiene una lista de tabla de muestra para las muestras procesadas, incluyendo los calibradores 0 - 7 ("Lo 0" - "Lo 7"), controles de calidad y el suero del paciente, que se indica con el número de inyección (#); el texto de la identificación de muestra (Muestra); la concentración medida en mg/L (Conc.); el tipo de muestra que es un espacio en blanco, estándar, control de calidad o muestra de paciente (tipo); la concentración nominal de los calibradores en mg/L (Est Conc); el tiempo de retención analítica (RT); la respuesta que es la relación entre el área de pico de la zona del pico de analito es (respuesta); la desviación del valor nominal de concentración (% Dev); la posición del frasco (Vial); y el tiempo de la adquisición (Acq.Time). El parámetro clave utilizado para la cuantificación es la respuesta, aumentando gradualmente con la concentración de analito, debido a la constante cantidad de estándar interno agregado marcados con isótopos.
Figura 3B muestra la curva de calibración. En regresión, el coeficiente de determinación r2 debe ser > 0.995. El siguiente modelo de calibración se utiliza para todos los analitos descritos en este método: curva tipo = lineal; origen = incluido; ponderación = 1 / x; transformación del eje = de nada. En el ejemplo dado, la curva de calibración y controles de calidad cumplen todos los criterios de calidad:2 r > 0.995 para la curva de calibración y la desviación de los calibradores (incluyendo el LLOQ) y las muestras de control de calidad está dentro de ± 15% del valor nominal.
Las transiciones de medición ion de padre a hija (MRM) se dan en la figura 3, que muestra cuatro picos en el mismo tiempo de retención: los dos picos superiores representan dos transiciones que se miden para el analito de interés, los dos picos más bajos representan el transiciones para el estándar interno marcado con el isótopo correspondiente. Para la evaluación de la calidad, los picos del analito en las ventanas de tiempo de retención respectivos son comprobar visualmente y manualmente reintegrados en la línea de fondo, cuando sea necesario.
La concentración mínima inhibitoria (MIC) es el componente central del TDM antimicrobiano, definir la exposición farmacocinética que es necesaria para alcanzar un destino farmacocinético/farmacodinámico (PK/KD) cociente13,17. En consecuencia, los niveles de concentración de antibiótico TDM de destino se expresan en relación a la CMI del patógeno causal. Dado que la acción de los antibióticos beta-lactámicos es dependiente del tiempo, su eficacia se maximiza mediante el logro de las concentraciones terapéuticas que superan el MIC 4 x-5 x (fT > 4-5 x MIC). Frente a patógenos infecciosos desconocidos, el rango de concentración de destino a través de piperacilina (proteína-desatado) libre es, por lo tanto, 64 mg/L, correspondiente a aproximadamente 90 mg/L de piperacilina total18.
El primer paciente (muestra #11) tiene un nivel de canal alto satisfactoria del suero de piperacilina 83,4 mg/L que también es suficiente para patógenos de problema, tales como Pseudomonas aeruginosa. El segundo paciente (muestra #12) tiene una concentración de aproximadamente 0,2 mg/L, que está por debajo del calibrador más bajo (LLOQ). Tal vez el paciente ha recuperado y se discontinuó la administración de piperacilina. El resultado "< 0,5 mg / L", por lo tanto, se divulgan en el sistema de información del hospital. El tercer paciente (ejemplo 13 #) tiene una concentración de canal de piperacilina baja de sólo 5,3 mg/L que no es suficiente para la mayoría de los patógenos. Para la quimioterapia antimicrobiana eficaz, debe aumentarse la dosis por el médico.
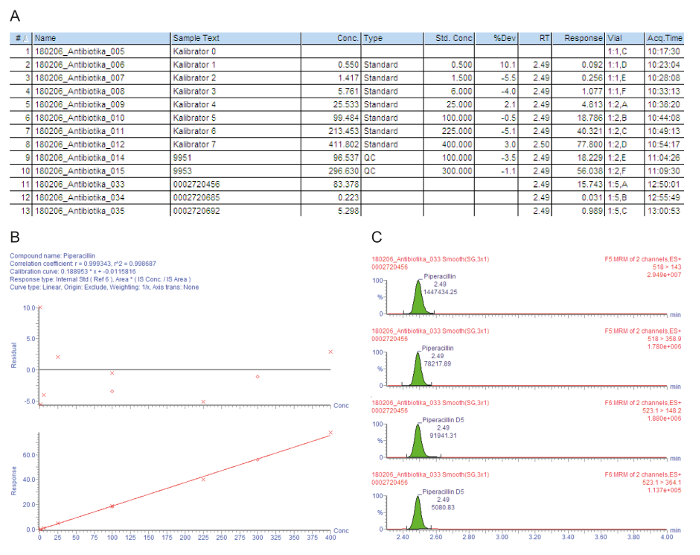
Figura 3: evaluación de la calidad ejemplar y cuantificación para el analito piperacilina. Estos paneles representan el análisis de datos de espectrometría de masas. (A) este panel muestra la lista de la muestra, incluyendo el suero del paciente (muestras #11 al #13), calibradores (estándar, las muestras #1 - #8) y controles de calidad (control de calidad, muestras #9 y #10). Calibrador 0 se refiere al espacio en blanco sin analito, pero con la adición de un estándar interno. 9951 representa control de calidad B, 9953 representa D. control de calidad (B) este panel muestra la curva de calibración para piperacilina. Las desviaciones del porcentaje de las concentraciones del calibrador nominales se dan en el gráfico superior (y-axis: residual), el gráfico inferior representa el intervalo de calibración lineal. (C) este panel muestra el tiempo de reacción múltiple (MRM) de monitoreo para la piperacilina y el correspondiente interna estándar piperacilina-D5 para la muestra de suero del paciente #12. Dos transiciones de padre a hija de iones se presentan con su tiempo de retención y la intensidad de señal correspondiente. Haga clic aquí para ver una versión más grande de esta figura.
Archivo suplementario. Haga clic aquí para descargar este archivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En este manuscrito, se presenta el protocolo para un método de masa basado en la espectrometría de tándem sencillo y robusto para la cuantificación de los antibióticos utilizados en el ICU19, es decir, cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolid, y piperacilina14. Una hoja de cálculo acompaña el manuscrito para la preparación de soluciones stock de antibióticos, calibradores y controles de calidad, teniendo en cuenta la pureza de los antibióticos y el peso molecular de los counterions. Dado que las concentraciones de los antibióticos son más bien altas, su cuantificación no debe ser ningún desafío particular desde una perspectiva analítica. Por consiguiente, estamos seguros de que este protocolo es aplicable a varios MS plataformas instrumentales. Para una transferencia del método, los usuarios se recomienda cuantificar el volumen de la columna extra y volumen de retención de su sistema cromatográfico y adaptar el principio de gradiente por consiguiente tiempo16. Durante la configuración de método, el sistema también debe ser evaluado para las indemnizaciones y, si es necesario, una muestra en blanco debe ser inyectada después de las muestras de calibrador y paciente mayor con altas concentraciones de antibióticos. Los usuarios también deben considerar la posibilidad de saturación del detector que se produce cuando demasiados iones entran en un espectrómetro de masas tándem. Saturación del detector pertinentes puede eliminarse con volúmenes más pequeños de la inyección, una mayor dilución del analito durante la limpieza de la muestra, o una desintonización de un analito Diana (p. ej., degradar los valores de tensión óptima).
Contrariamente a otros métodos, el rango de calibración permite tanto una cuantificación de las concentraciones de cerca del MIC de los patógenos susceptibles, así como las concentraciones máximas (cmax) que se obtienen con la administración de un bolo. El más alto Cmax-valores para adultos son registrados en las correspondientes hojas de información profesional sobre la base de datos de seguridad de medicamentos por la FDA como sigue: 163,9 mg/L para cefepime20, 112 mg/L para meropenem21, 4,6 mg/L para ciprofloxacino22 , 4,1 mg/L para la moxifloxacina23y 21,2 mg/L para linezolid24298 mg/L para piperacilina25. Monitoreo de concentración antibiótica en la circulación sanguínea del paciente permite un ajuste de dosis a la susceptibilidad de los patógenos involucrados, pero el farmacocinético área bajo la curva también se puede obtener a través de múltiples muestras de sangre con el dado Protocolo.
Muchos antibióticos (especialmente betalactámicos meropenem) son químicamente inestables una vez disuelto. El paso más crítico en este protocolo es, por lo tanto, la preparación de las soluciones madre, calibradores y controles de calidad bajo condiciones de frío26,27. En ese sentido, también es esencial para congelar las muestras de pacientes tan pronto como sea posible. Aunque se recomienda el almacenamiento de suero a-80 ° C26, nuestros experimentos de estabilidad muestran que muestras también puede ser almacenan 3 días a-20 ° C sin ninguna disminución significativa de las concentraciones de antibióticos (incluso en los niveles de canal).
Se recomienda realizar una prueba de idoneidad del sistema antes de cada análisis HPLC-MS/MS de las muestras del paciente (p. ej., con calibrador 3). Generalmente, una prueba de aptitud del sistema se utiliza para verificar la repetibilidad del sistema LC-MS/MS y a ver si también es adecuado para el análisis a realizar. Así, por ejemplo, disminución de intensidades de la señal son causados por una contaminación del cono de barrido de MS, que, entonces, requiere su limpieza con un disolvente orgánico. Para limpiar la fuente MS, una válvula de desviación puede ser introducida después de la columna de cromatografía, dirigiendo "libre de analito" porciones de la fase móvil a la basura antes de que alcancen el espectrómetro de masas. Por otro lado, un aumento total de la presión puede indicar la columna que con el tiempo. Para aumentar la columna de uso de longevidad de un filtro de precolumn rentable es recomendable. Si la presión sigue siendo un problema, un caudal de 0,4 mL/min puede utilizarse con el gradiente cromatográfico en el presente Protocolo.
Una menor limitación de esta técnica es que requiere tres pasos manual separados para limpiar de muestra, dando por resultado un tiempo total de aproximadamente 30 minutos agregar los estándares internos marcados con isótopos para el agente de precipitación puede ahorrar algunos tiempo de procesamiento. Sin embargo, esto debe hacerse sólo para velocidades de alto rendimiento y con la precipitación agente se almacenan en frío (por ejemplo, a-20 ° C), como los estándares internos que también degrada en vitro a temperaturas elevadas.
Se ha desarrollado el protocolo descrito para la muestra en tubos de polipropileno de 1.5 mL estándar. Debe exigirse para TDM antibiótico una mayor tasa de rendimiento, el procedimiento puede actualizarse para el formato de placa multi-bien con un colector de vacío centrífuga adecuada insertos o placas de filtro.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Los autores agradecen a Dr. Schütze por su ayuda a establecer el método presentado y Dr. Zoller por el valioso aporte con respecto a la gama de calibración apropiada. Los autores reconocen también el personal técnico de las instalaciones de la espectrometría de masas.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



