Summary
Her presenterer vi en tandem masse massespektrometri-basert protokoll for kvantifisering av brukte antibiotika i intensivavdelinger, nemlig cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid og piperacillin.
Abstract
Det er en stadig økende behov for terapeutisk medikament overvåking av antibiotika inne mange klinisk fasiliteter, særlig med hensyn til implementering av sykehuset antibiotika forvaltning programmer.
I arbeidet presenterer vi en multiplex høyytelses flytende kromatografi-tandem massespektrometri (HPCL-MS/MS) protokoll for kvantifisering av cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid og piperacillin, brukte antibiotika i intensivavdelinger. Metoden ble tidligere grundig validert i henhold til veiledning av den europeiske Legemidler Agency.
Etter en rask eksempel opprydding, er analytter atskilt i en C8 omvendt-fase HPLC kolonne 4 minutter og kvantifisert med tilsvarende stabil isotop-merket interne standarder i electrospray ionization (ESI +) massespektrometri flere reaksjon tid avlytting (MRM). Presentert metoden bruker en enkel instrumentering sette uniform brukt kromatografiske forholdene, slik at for daglig og robust antibiotika terapeutisk medikament overvåking i kliniske laboratorier. Kalibreringskurven spenner over fjellkjeden farmakokinetiske konsentrasjon, og dermed inkludert antibiotika mengder nær den minimale inhibitoriske konsentrasjonen (MIC) av mottakelige bakterier og topp konsentrasjoner (Cmax) er oppnådd med bolus administrasjon regimer. Uten nødvendigheten av serum fortynning før prøve oppryddingen kan området under kurven for en administrert antibiotika oppnås gjennom flere målinger.
Introduction
Selv om antibiotika har revolusjonert praktisering av medisin, fortsatt alvorlige bakterielle infeksjoner en ledende årsak til sykelighet og dødelighet i kritiske sykdommer1. I denne forbindelse er rask administrasjonen av en egnet anti-infective i en tilstrekkelig dosering av den øverste betydningen for sykdom kontroll2.
En voksende mengde bevis viser at empirisk behandling med bredspektret antibiotika blir stadig mer problematisk med kompleksiteten i pasientgrupper. Dette gjelder særlig for intensivavdelinger (ICU), hvor en enorm Inter-individuelle variasjon av nøkkelparametere farmakokinetiske (PK) er ofte observert3,4. Følgelig er ICU pasienter overhengende fare for sub terapeutiske nivåer med fare for en utilstrekkelig terapeutiske suksess5,6. Så igjen, utsettes pasienter unødig for overdrevent høy antibiotikumet konsentrasjonene som kan føre til alvorlige bivirkninger klinisk fordeler7. Både Antibiotikum misbruk og utilstrekkelig dosering har også bidratt til spredning av antibiotikaresistens, som blir en stadig voksende trussel mot folkehelsen8.
Forbedre bruken av antibiotika og bevare deres effectivenessas har lenge som mulig, Verdens helseorganisasjon lansert en global handlingsplan på resistensutvikling i 20159. Antibiotika forvaltning programmer utgjør en vesentlig hjørnestein for forsvarlig antimikrobielle bruk i nasjonale offentlige helse strategier10, hjelper klinikere å forbedre kvaliteten på pasientomsorgen11 , og samtidig, redusere antibiotikaresistens12. Antimikrobielle dosering i individuelle pasienter gjennom anvendelse av terapeutisk medikament overvåking (TDM) er et sentralt virkemiddel i denne sammenheng13.
Til dags dato, kommersielt tilgjengelig TDM er analyser bare tilgjengelige for glycopeptide antibiotika og aminoglycosides. Kvantifisering av stoffer fra andre klasser krever vanligvis en in-house metodeutvikling eller validering som kan være tungvint. Vi har derfor presentere i detalj protokollen for en robust masse massespektrometri-basert analyse som kan brukes for kvantifisering av de mest relevante antibiotika i ICU i deres klinisk relevante konsentrasjon områder14. Metoden ble nylig etablert i våre massespektrometri anlegg og har vært brukt for rutinen TDM i ICU siden da. Fremgangsmåten bruker en grei og enkel analytisk innstilling med en ensartet utvalg opprydding, slik at den raske gjennomføringen av antibiotika TDM i mange fasiliteter med massespektrometri evner.
Protokollen beskrevet her var optimalisert for kvantifisering av cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid og piperacillin i humant serum, bruke isotop fortynning flytende kromatografi (Langbane) i kombinasjon med en tandem masse massespektrometri (MS-/ MS). For isotop uttynnet LC--MS-/ MS metodikk, er stabil isotop-merket forbindelser lagt til et utvalg av interesse med en bestemt matrise (f.eks, serum). Isotop-merket standarder kan skilles fra sine umerkede motpart, nemlig analytt interesse, på grunn av ulike molekylvekt av naturlige molekylet og deres fragmentering produkter, kalt en overordnet-ion-til-datter-ion overgang. Som isotop-merket forbindelser har en nesten identisk total mekanisk-opptreden i forhold til deres umerkede motpart, er de ideelle interne standarder for MS/MS, slik at en nesten matrix-uavhengig analytt kvantifisering med en høy grad av nøyaktigheten15. Nowadays, er mange stabil isotop-merket interne standarder som kan brukes til små-molekylet kvantifisering, inkludert TDM av poesi aksent, kommersielt tilgjengelig.
Brukt kromatografiske separasjon av antibiotika analytter i beskrevet protokollen utføres med en analytisk C8 alkyl-kjedelengde omvendt-fase kolonne (100 mm x 2.1 mm, 3 µm partikkel-størrelse). Under metodeutvikling, interne standard normalisert matrix faktorene for alle analytter var 94.6% og 105.4%, med en variasjonskoeffisienten ≤8.3%14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Merk: Det anbefales å innarbeide avtrekksvifte ved håndtering av organisk løsemiddel, som metanol. Forberede alle buffere og mobile faser i volumetriske flasker. Hvis ikke annet er angitt, kan løsningene lagres ved romtemperatur for opptil 1 måned etter forberedelse.
1. forberedelse kalibratorer og kvalitetskontroll prøver
Merk: En tilsvarende analyse datablad for utarbeidelse av aksjer og spike løsninger er gitt i Supplerende fil. På grunn av sporbarhet, setter du inn produsenten og katalognummer partinummer til hver antibiotika i kolonnene tilsvarende. Oppløse alle antibiotika i en kald oppbevaring på 4 ° C og holde arbeidstid så kort som mulig.
- Forberede 100 mL 25% metanol i vann: prefill en 100 mL volumetriske kolbe med 25 mL absolutt metanol og fylle den opp til 100 mL med destillert vann.
- Forberede 10 mL av 200 mM eddiksyre i vann: prefill en 10 mL volumetriske kolbe med 9 mL HPLC klasse vann, legge til 115 µL iseddik (99,5% renhet, 17.4 M) og legge destillert vann opp til 10 mL.
- Forberede 25 mL av 25% metanol i vann med 20 mM eddiksyre: prefill en 25 mL volumetriske kolbe med 2,5 mL av vandig 200 mM eddiksyre løsning legge 6,25 mL av absolutt metanol og fyll opp flasken til 25 mL med destillert vann.
- Bruk en presisjon skala for å veie riktige mengder av antibiotika i 15-mL konisk rør som Supplerende fil i kolonnen opprinnelig vekt.
- Klargjør lager løsninger på fluoroquinolones, ciprofloxacin og moxifloxacin i 25% metanol-vannet inkludert 20 mM eddiksyre. Vil legge det tilsvarende volumet til avveid antallene som Supplerende fil i kolonnen "siste volum". Raskt oppløse fluoroquinolone antibiotika i ultralydbad i 2 minutter og intense vortexing.
- Klargjør lager løsninger av cefepime, meropenem, linezolid og piperacillin i 25% metanol-vannet. Å gjøre dette, legge det tilsvarende volumet til avveid antallene som Supplerende fil i kolonnen siste volum og raskt oppløse antibiotika av intens vortexing. Løs opp meropenem som siste stoffet.
- Kombinere lager løsninger av alle antibiotika som beskrevet i tilsvarende antall lagerløsning diagrammet i Supplerende fil å gi tidoblet konsentrert spike-løsninger.
- Spike ni mengder narkotika-fritt serum med ett volum av tidoblet konsentrert spike løsninger å få serum kalibratorer 0-7 og kvalitet kontroller (QC) A-D. For eksempel Legg til 0,5 mL av spike løsning til 4,5 mL av serum i et 10-mL polypropylen rør og ruge det i 15 min i kjølelager på 4 ° C på en rull mikser på 50 rpm.
- Bruk en repeterende pipette for å generere 100 µL dele kalibratorer og QCs i 1,5 mL polypropylen rør.
- Lagre kalibratorer, kvalitetskontroll og antibiotika lager løsninger på-80 ° C i opp til seks måneder.
- For hver antibiotika, også tilberede en ryddig løsning som inneholder 1000 mg/L av en enkelt antibiotika. Fortynne den tilsvarende lager løsningen med en passende fortynner (f.eksfor ciprofloxacin, bruke 25% metanol-vann inkludert 20 mM eddiksyre).
Merk: Ryddig antibiotika løsningene er nødvendig for instrument-tuning bare.
2. utarbeidelse av interne standarder Mix
Merk: Interne standarder er isotop-merket kolleger på analytter rundt som legges til et utvalg under eksempel opprydding. Som interne standarder har nesten identisk total mekanisk-egenskaper for motpartene umerket, kompensere de for matrise i en gitt utvalg.
- Forberede 10 mL av 50% metanol i vann ved å legge til 5 mL av absolutt metanol en 10 mL riste flasken og fylle den opp til 10 mL med destillert vann.
- Forberede 10 mL av 50% metanol i vann inkludert 20 mM eddiksyre. Vil legge til 1 mL av 200 mM eddiksyre en 10 mL kolbe, legge til 5 mL av absolutt metanol og fylle den opp til 10 mL med destillert vann.
- Generere lager løsninger av interne standarder (IS) med 1000 mg/L direkte i hetteglass leveres av produsenten. Oppløse cefepime -13C12D3 sulfate i destillert vann, meropenem-D6, linezolid D3og piperacillin-D5 i en 50% metanol-vann løsning. Oppløse ciprofloxacin D8 i 50% metanol-vann med 20 mM acetate og moxifloxacin hydrochloride -13C1D3 i destillert vann med 20 mM acetate.
- Kombinere er lager løsninger i et 1,5 mL polypropylen rør til en femdoblet konsentrert interne standard blanding. Legge til 10 µL cefepime -13C12D3, 10 µL av meropenem-D6, 1 µL ciprofloxacin D8, 2 µL av moxifloxacin hydrochloride -13C1D3, 2 µL av linezolid-D 3, og 10 µL piperacillin-D5 til 965 µL av 25% metanol-vann.
- Lagre de interne standard lager løsningene og femdoblet konsentrert er blandingen på-80 ° C.
3. pasient eksempel lagring
Merk: Kontroller at serum oppnås så fort som mulig og at den kalde kjeden av frosne prøvene opprettholdes.
- Samle hele blodet i serum samling rør.
- La blodpropp i 20-30 min ved romtemperatur.
- Skill serum fra blodet fra med sentrifugering 2000 x g i 10 min.
- Overføre nedbryting til en ren polypropylen rør.
- Lagre serum opp til seks måneder ved-80 ° C, analyseres det er. Du kan også lagre prøvene opp til 3 dager på 20 ° C.
4. buffer forberedelse for kromatografi
- For å forberede 1 M ammonium formiat i vann, løses 6.306 g ammonium formiat på 100 mL HPLC klasse vann med en 100 mL riste kolbe. Lagre løsningen opp til 1 måneden på 4 ° C.
- Forberede mobil fase en [10 mM ammonium formiat på vann-formic syre (99.9:0.1 v/v)]. Prefill en 1000 mL volumetriske kolbe med ca 500 mL HPLC klasse vann, Legg 1 mL av maursyre og 10 mL 1 M ammonium formiat løsningen, og fylle det 1000 mL med HPLC klasse vann. Overføre mobile fase A til en ren glassflaske og koble det til HPLC. Lagre mobile fase opptil 2 uker ved romtemperatur.
- Forberede den mobile fasen B. overføring HPLC-grade absolutt metanol i en ren glassflaske og koble det til HPLC.
- Bruke absolutte metanol nålen vask løsemiddel og koble tilsvarende røret til glassflaske med mobile fase B.
- Generere segl og et purge løsemiddel metanol-vann-formic syre (7:92.9:0.1, v/v/v). Prefill en 1000 mL volumetriske kolbe med ca 500 mL destillert vann, Legg 70 mL absolutt metanol, 1 mL av maursyre, og Legg destillert vann til 1000 mL. Overføre løsemiddelet til en ren glassflaske og koble den med HPLC systemet.
Merk: Ulike autosampler systemer bruker både et sterkt og en svak nål vask løsemiddel. I slike tilfeller Forbered vask løsningene i henhold til produsentens anbefalinger. For eksempel vask sterke vask med metanol-vann-isopropylic alkohol (70:20:10, v/v/v) og svake med vann-metanol (95:5, v/v).
5. apparatet Tuning
Merk: Dette trinnet utføres av metoden på en bestemt masse spectrometer.
- Fortynne pen 1000 mg/L analytt og interne standard løsninger 1:10 eller 1: 100 i en blanding av mobile fase A og B (50/50, v/v), avhengig av detektor signal intensiteter. Tune det masse spectrometer med funksjonen autotune eller gjøre en manuell innstilling for de følgende foreldre-å-datter ioner overganger14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167.1 / 400.0), meropenem (384.1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ciprofloxacin (332.0 > 231.0/245.0), ciprofloxacin D8 (340.1 > 235.1/249.3), moxifloxacin (402.0 > 261.0/383.9), moxifloxacin-13 C1D3 (406.1 > 265.1/388.0), linezolid (338.0 > 235.0/296.0), linezolid D3 (341.1 > 235.1/297.1), piperacillin (518.0 > 143.0/358.9), og piperacillin-D5 (523.1 > 142.8/364.1).
- Bruk funksjonen autotune å automatisk justere innstillingene på MS vik og spenning gjennom detektorer for instrumenter med autotuning.
- For instrumenter med Manuell tuning, justere innstillingene (f.eks, kollisjon spenning og kollisjon energi) til optimal (vanligvis maksimalt) hentes signal intensitet på detektoren for hver forelder og datter ion. For eksempel kobler en blanding tee, levere mobile fase A og B (50/50, v/v) på 0,5 mL/min og kontinuerlig infundere pen antibiotika eller intern standard med en flow rate på 0,1 mL/min.
6. HPLC-MS/MS oppsett
Merk: Har masse spectrometer, HPLC system (inkludert autosampler) og den tilhørende programvaren avhenger av produsenten. Tilpasse parameterne masse spectrometer og vaskeprosedyren i henhold til produsentens anbefalinger.
- Lagre masse spectrometer parameterne i en tilsvarende 'MS tune filen '. Bruk electrospray ioniseringen i positiv modus (ESI +) for alle analytter. Tilpasse ion kilde innstillingene for instrumentet brukes (f.eks, en kapillær spenning på 1,5 kV, en kilde temperatur på 120 ° C, en desolvation temperatur på 400 ° C, en desolvation gass flow rate på 600 L/t, en RF linsen spenning 0,1 V og bor tiden 80 ms).
- Angi analytt og interne standarder finjustere parametere (f.eks, kapillære spenning, kollisjon energi) i en 'MULTIPLE Sclerosis arkiv '.
- Angi autosampler betingelsene som følger i den 'innløp filen ': eksempel temperaturen på 10 ° C med en grense + 5 ° C; vask rekkefølgen på 1 x purge-vask-purge med en 600 µL tømme volum erstatning.
- I de ovennevnte 'innløp filen ', angi flyten rate 0,4 eller 0,5 mL/min, operasjonstiden til 4 min, høy trykkgrensen 345 bar, og kolonnen temperaturen 30 ° c med en grense på ± 5 ° C. Legge til løsemiddel navnet på mobile phases A og B og sette dem til 7% B/93% A, henholdsvis.
- Programmet brukt kromatografiske forløpningen i den 'innløp filen ' som følger: 0,00-0,10 min med 7% mobile fasen B/93% A, 0,11-0.60 min med 65% mobile fasen B/35% A, 0,61-2.10 min med 95% mobile fase B/5% A, 2.11-4.00 min med 7% mobile fasen B/93% A.
Merk: Beregne ekstra kolonner volumet, hold opp volumet instrumental plattformen og analytt oppbevaring faktorer som beskrevet i USP < 621 > kromatografi retningslinje16.
7. eksempel måling Master fil
Merk: Med det 'eksempelfilen måling master', pasientprøvene angis, HPLC--MS-/ MS analysen startes og data evaluering utføres. To separate malfiler inkludert en lav - og høy kvalitet kontroll par genereres; en mal inneholder QC par A og C, den andre en QC par B og D.
- Opprette en ny 'eksempelfilen måling master'. Velg de ovennevnte 'MS tune filen ', 'MULTIPLE Sclerosis arkiv ', og "innløp fil" (inndelingen 6), sette dem i hver prøve linje, og angi injeksjon volumet med 15 µL.
- I stigende rekkefølge, Legg "eksempelteksten" for kalibratorer 0-7 og kvalitetskontroll (QC) par A/C eller QC par B/D.
- Angi utvalg. Velg eksempel "standard" for kalibratorer og "QC" for kvalitetskontroll parene.
- Angi konsentrasjonen av hver antibiotisk stoff for tilsvarende kalibratorer og kvalitetskontroll (se regnearket konsentrasjonen [µg/mL] Cal 7-Cal 0, QC A/C eller B/D,).
- Programmet den 'evaluering datametode '. Bruke var optimalisert under instrumentet tuning (del 5). Match hver Antibiotikum med tilhørende isotop-merket standarden (f.eks, meropenem - meropenem-D6).
8. eksempel opprydding og HPLC--MS-/ MS analyse
Merk: For hvert eksempel parti, er et par kvalitetskontroll med en lav og høy antibiotika konsentrasjon (QC A/C eller QC B/D) behandlet og analysert. Mellom forskjellige bunker, sammenkoblede QC eksemplene brukes i en annen rekkefølge (f.ekspå dag 1, Velg den 'eksempelfilen måling master' inkludert QC par A/C, dag 2, Velg en inkludert QC paret B/D. Behandling av serum prøvene er illustrert i figur 1.
- Forberede nedbør agent 10% metyl -tert-butyl-Eter i metanol (10:90, v/v) (f.eks, prefill en 25-mL volumetriske kolbe med 2,5 mL metyl -tert-butyl-Eter og fylle det 25 mL med absolutt metanol).
- Plass C8 omvendt fasen i kolonnen kammeret. Koble til HPLC og masse spectrometer i retning av flyten.
- Generere eksempellisten. Åpne den tilsvarende 'eksempelfilen måling master' mal og legge pasientprøvene skal behandles i listen. Generere grupper av opptil 20 pasientprøvene og flanke dem med tilsvarende kvalitetskontroll paret.
- Våt-prime HPCL systemet benytter det 'innløp filen ' styre programvare: Angi funksjonen "våt prime" til 50% mobile fase A/50% B og våt-prime i 2 minutter med en flow rate på 1 mL/min.
- Oppdater sprøyten. Vil kjøre 6 strøk av 600 µL i Kontrollprogramvaren.
- Equilibrate kolonnen C8 omvendt fase. Bruke programvaren og slå på strømmen i den 'innløp filen ' og skylle den med 7% mobile fasen B/93% A for et minimum av 5 min, ved hjelp av en strømningshastighet på 0,5 mL/min. Kontroller kolonnen temperaturen på 30 ° C.
- Tine pasientprøvene, en aliquot av kalibratorer 0-7 og noen kvalitetskontroll (opprette en A / B eller C/D).
- En repeterende pipette, legge til 25 µL av interne standard blandingen til 100 µL kalibrator, QC utvalg eller pasienten serum 1,5 mL polypropylen rør, og vortex tube i noen sekunder.
- Inkuber blandingen for 5 min ved romtemperatur på en Borstemmaskin shaker (f.ekspå 1200 rpm).
- Med en repeterende pipette, legge 150 µL av en nedbør reagens til eksempel-intern standard mix.
- Igjen, vortex tube for et par sekunder og ruge det i 5 minutter ved romtemperatur på en Borstemmaskin shaker (f.ekspå 1200 rpm).
- Sentrifuge suspensjon på 20.000 x g i en tabletop centrifuge for 10 min på 4 ° C.
- Fortynn nedbryting 1:3 med HPLC klasse vann med en hetteglass med en mikro-inn og laste det som behandlet prøver å autosampler.
- Manuelt starte HPLC--MS-/ MS analyse i den 'måling kontroll eksempelfilen '.
Merk: For langvarig lagring, skyll grundig analytisk kolonnen i henhold til produsentens anbefaling [f.eks0,5 mL/min metanol-vann (50/50, v/v)] å hindre fase kollaps.

Figur 1: skjematisk fremstilling av prøve oppryddingen. Protein nedbør på høy sentrifugalkraften gir tett pellets og klare supernatant, som angir at protein nedbør var ferdig. Hele behandlingstiden er ca 30 min, inkludert eksempel opprydding, brukt kromatografiske separasjon og MS-/ MS analysen. Klikk her for å se en større versjon av dette tallet.
9. kvalitetsvurdering og måling
- Behandle prøvene, åpne den tilsvarende 'måling kontroll eksempelfilen ', Velg kalibratorer, kvalitetskontroll og pasientprøvene og vurdere dem med den 'antibiotika kvantifisering metoden '.
- Sjekk om toppene for en bestemt analytt er riktig integrert. Inspisere toppene for hver kalibrator, QC, og pasienten utvalg, og manuelt reintegrere dem på grunnlinjen om nødvendig.
- Studere kalibreringskurven og undersøke om det oppfyller følgende kvalitetskriterier: a) linearitet over hele kalibrering området, b) en kalibrering koeffisienten r2 > 0.995, c) avviket i hver kalibrering standard innenfor ± 15% av den nominell verdi, bortsett fra den laveste grensen for kvantifisering (LLOQ), der det kreves ± 20%.
- Avvise en kalibrering standard uoverensstemmelse med de nevnte vilkårene og revurdere kalibreringskurven, inkludert regresjonsanalysen.
- Studier av kvalitetskontroll og undersøke om avvikene er innenfor ± 15% av den nominelle verdien.
- Hvis konsentrasjonen av en pasient prøve overskrider konsentrasjonen av høyeste kalibrator, fortynne prøven med destillert vann, opp til 1:5 (f.eks, 100 µL av serum pluss 400 µL destillert vann) før prøve oppryddingen. Reperform trinn 8,8-8.14 for den bestemte prøven og behandle den.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Bruker beskrevet protokollen, er en typisk chromatogram avbildet i figur 2. Ifølge USA Pharmacopeia (USP) kromatografi retningslinjer16, kolonnen døde volumet i systemet ble bestemt med ~0.22 mL og ekstra kolonner volumet (inkludert injektor, rør og kontakter) med ~0.08 mL, gir et hold opp volum ~0.30 ml. De beregnede oppbevaring faktorene for alle analytter var 2.8 (for cefepime) - 4.2 (for piperacillin).
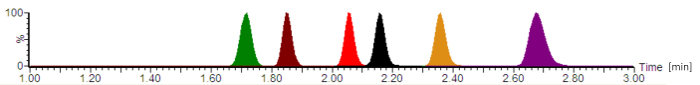
Figur 2: typisk analytisk chromatogram med normalisert signal intensiteter. Antibiotika er eluting i følgende rekkefølge: cefepime (grønn), meropenem (brun), ciprofloxacin (rød), moxifloxacin (svart), linezolid (oransje), og piperacillin (lilla). Tid, som er gitt i minutter, og analytt peak symmetrier varierer, avhengig av nøyaktig sammensetningen av mobile faser, vannmengden, kromatografi slangen og analytisk kolonnen alder. Klikk her for å se en større versjon av dette tallet.
Figur 3A inneholder diagram eksempelliste for behandlet prøvene, inkludert kalibratorer 0 - 7 ("Kalibrator 0" - "Kalibrator 7"), kvalitetskontroll og pasienten sera, som angis med injeksjon nummer (#); Identifikasjon eksempelteksten (Eksempeltekst); målt konsentrasjonen i mg/L (Conc.); hvilken utvalg som er enten en tom, standard, kvalitetskontroll eller pasienten utvalg (Type). nominell konsentrasjonen av kalibratorer i mg/L (Standard Kons); analytiske oppbevaringsperioden (RT); svaret som er forholdet mellom peak området analytt/peak området er (svar); avviket fra den nominelle konsentrasjon verdien (% Dev); flaske plasseringen (medisinglass); og oppkjøpet tid (Acq.Time). Nøkkelparameteren brukes for kvantifiseringen er svaret, gradvis øke med analytt konsentrasjonen, på grunn av den konstante mengden av ekstra isotop-merket interne standard.
Figur 3B viser kalibreringskurven. I regresjon skal koeffisienten besluttsomhet r2 > 0.995. Følgende kalibrering modell brukes for alle analytter beskrevet i denne metoden: kurve type = lineær; opprinnelse = inkludert; vekt = 1 / x; aksen transformasjon = ingen. I den gitte eksemplet kalibreringskurven og kvalitetskontroll oppfylle alle kvalitetskriterier: r2 > 0.995 for kalibreringskurven og avvik kalibratorer (inkludert LLOQ) og QC prøvene er innenfor ± 15% av den nominelle verdien.
Målt foreldre-å-datter ion overganger (MRM) er gitt i Figur 3 c, viser fire topper oppbevaring samtidig: de to øverste toppene avbilder to overganger som måles for analytt rundt, lavere to toppene representerer den overganger for tilsvarende isotop-merket interne standard. For kvalitet vurderingen, analytt toppene i respektive oppbevaring tidsvinduer visuelt kontrolleres og manuelt reintegrert på grunnlinjen, når det er nødvendig.
Den minimal inhibitoriske konsentrasjonen (MIC) er den sentrale delen av antimikrobielle TDM, definere farmakokinetiske eksponering som kreves for å oppnå en mål farmakokinetiske/Farmakodynamiske (PK/KD) forholdet13,17. Følgelig er målet antibiotika TDM konsentrasjon nivået uttrykt i forhold til MIC av forårsaker patogen. Gitt at handlingen av beta-Laktam antibiotika er tidsavhengige, deres effekt er maksimert gjennom oppnåelse av de terapeutiske konsentrasjonene som overskrider MIC 4 x-5 x (fT > 4-5 x MIC). Når mot ukjent smittsomme patogener, er gjennom konsentrasjon målområdet for gratis (protein-ubundet) piperacillin derfor 64 mg/L, tilsvarende ca 90 mg/L total piperacillin18.
Første pasienten (eksempel #11) har en tilfredsstillende høy serum gjennom 83.4 mg/L piperacillin som er også tilstrekkelig for problemet patogener, som Pseudomonas aeruginosa. Andre pasienten (eksempel #12) har en konsentrasjon av ca 0.2 mg/L, som er under den laveste kalibratoren (LLOQ). Kanskje pasienten er gjenopprettet, og administrasjonen av piperacillin ble avviklet. Resultatet "< 0,5 mg / L", derfor rapporteres i informasjonssystemet sykehus. Tredje pasienten (eksempel #13) har en lav piperacillin gjennom konsentrasjon av bare 5,3 mg/L som ikke er tilstrekkelig for et klart flertall av patogener. For effektiv antimikrobiell kjemoterapi, bør dosen økes av lege.
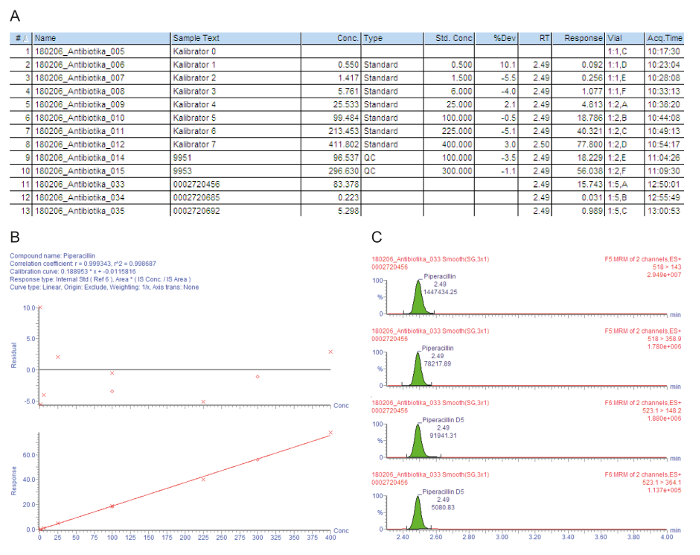
Figur 3: eksemplarisk kvalitetsvurdering og måling for analytt piperacillin. Disse panelene representerer massespektrometri dataanalyse. (A) dette panelet viser eksempellisten, inkludert kalibratorer (Standard, prøver #1 - #8), kvalitetskontroll (QC, prøver #9 og #10) og pasienten sera (eksempler #11 - #13). Kalibrator 0 refererer til tomt uten analytt, men med tillegg av en intern standard. 9951 representerer QC B, 9953 representerer QC D. (B) dette panelet viser kalibreringskurven for piperacillin. Prosentvis avvik fra de nominelle kalibrator konsentrasjonene er gitt i øverste grafen (y-aksen: gjenværende), lavere grafen viser lineær kalibrering området. (C) dette panelet viser flere reaksjonstid overvåking (MRM) for piperacillin og tilsvarende interne standard piperacillin-D5 pasienten serum eksempel #12. To foreldre-å-datter ion overganger presenteres med tiden og respektive signal intensiteter. Klikk her for å se en større versjon av dette tallet.
Ekstra fil. Klikk her for å laste ned denne filen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I dette manuskriptet vi rapportere protokollen for enkel og robust tandem masse massespektrometri-basert metode for kvantifisering av brukte antibiotika i ICU19, nemlig cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid, og piperacillin14. Et regneark følger manuskriptet for utarbeidelse av antibiotika lager løsninger, kalibratorer og kvalitetskontroll, tar hensyn til renheten av antibiotika og molekylvekt av deres counterions. Gitt at konsentrasjonen av antibiotika er ganske høy, skal kvantifisering ingen spesiell utfordring fra en analytisk perspektiv. Følgelig, vi er overbevist om at denne protokollen gjelder ulike MS instrumental plattformer. For metoden overføring, brukernes er oppmuntret å kvantifisere ekstra kolonner volumet og holder opp volumet av deres brukt kromatografiske system og tilpasse gradient start tid tilsvarende16. Under metode satt opp, systemet bør også vurderes for bære-over, og eventuelt et tomt utvalg må injiseres etter høyeste kalibrator og pasient prøvene med høy antibiotikumet konsentrasjonene. Brukere må også vurdere muligheten for detektor metning som forekommer når for mange ioner angir en tandem masse spectrometer. Relevante detektor metning kan fjernes med mindre injeksjon volumer, en høyere analytt fortynning under eksempel opprydding, og/eller en detuning av et mål analytt (f.eksnedprioritere de optimale spenning innstillingene).
I motsetning til andre metoder kan kalibrering området både en kvantifisering av konsentrasjoner nær MIC utsatt patogener, samt topp konsentrasjoner (cmax) er oppnådd med en bolus-administrasjon. Den høyeste C-max-verdier for voksne er rapportert i tilsvarende profesjonell informasjonsark for FDA stoffet sikkerhet databasen som følger: 163.9 mg/L for cefepime20, 112 mg/L for meropenem21, 4.6 mg/L for ciprofloxacin22 , 4.1 mg/L for moxifloxacin23og 21.2 mg/L linezolid24298 mg/L for piperacillin25. Antibiotika konsentrasjon overvåking i pasientens blodsirkulasjonen tillater en dose tilpasning til mottakelighet involvert patogener, men farmakokinetiske området under kurven kan også oppnås gjennom flere blod prøvetaking med den angitte protokollen.
Mange antibiotika (spesielt beta-Laktam meropenem) er kjemisk ustabilt når oppløst. Det viktigste trinnet i denne protokollen er derfor utarbeidelse av lager løsninger, kalibratorer og kvalitetskontroll under kalde forhold26,27. I den forbindelse er det også viktig å fryse pasientprøvene så raskt som mulig. Selv om serum lagring ved-80 ° C anbefales26, lagres vår stabilitet eksperimenter Vis som også kan til 3 dager på 20 ° C uten noen betydelig reduksjon av antibiotika konsentrasjoner (selv på gjennom nivåene).
Det anbefales at du utfører en systemtest for egnethet før hver HPLC--MS-/ MS analyse av pasientprøvene (f.eksmed kalibrator 3). Vanligvis brukes en systemtest egnetheten å bekrefte repeatability av LC--MS-/ MS systemet og se om det er også tilstrekkelig for analyse gjøres. Således, for eksempel synkende signal intensiteter er forårsaket av en forurensning av MS feie membran, som deretter krever sin rengjøring med en organisk løsemiddel. For å holde MS kilden ren, kan en divert ventil bli introdusert etter kolonnen kromatografi regi "analytt-free" deler av den mobile fasen til avfall før de når den masse spectrometer. På den annen side, kan en generell økning av trykket indikere kolonnen tilstopping over tid. For å øke kolonnen er levetid bruken av et kostnadseffektivt precolumn filter tilrådelig. Hvis presset fortsetter å være et problem, kan en strømningshastighet på 0,4 mL/min også brukes med brukt kromatografiske gradient i denne protokollen.
En mindre begrensninger av denne teknikken er at det krever tre separate manuelle trinn for eksempel opprydding, resulterer i en total behandlingstid på ca 30 min. legge isotop-merket interne standarder til nedbør agent kan spare noen behandlingstiden. Men dette bør bare gjøres for høy gjennomstrømming samplingsfrekvenser og med nedbør agent lagres i kaldt (f.ekspå 20 ° C), som de interne standardene også fornedre i vitro ved høye temperaturer.
Beskrevet protokollen er utviklet for prøve behandling i standard 1,5 mL polypropylen rør. Bør en høyere gjennomstrømningshastighet være nødvendig for antibiotika TDM, kan prosedyren oppgraderes til flere godt plate format med tilstrekkelig sentrifuge innsettinger eller filter plater med en vakuum manifold.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Forfatterne takker Dr. Schütze for hans hjelp med å etablere presentert metoden og Dr. Zoller for verdifulle innspill om riktig kalibrering området. Forfatterne også erkjenner den tekniske staben av massespektrometri.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



