Summary
Aqui nós apresentamos um protocolo de massa baseado em espectrometria em tandem para a quantificação dos antibióticos usados com frequência em unidades de cuidados intensivos, nomeadamente cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolida e piperacillin.
Abstract
Há uma crescente demanda para a monitorização de drogas terapêuticas de antibióticos em muitas instalações clínicas, particularmente no que se refere a implementação de programas de manejo de antibióticos de hospital.
No trabalho atual, apresentamos um protocolo multiplex alta performance líquida cromatografia-tandem espectrometria de massa (HPLC-MS/MS) para a quantificação de cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolida e piperacillin, comumente usado antibióticos em unidades de terapia intensiva. O método foi validado anteriormente exaustivamente de acordo com a orientação da Agência Europeia de medicamentos.
Depois de uma limpeza rápida da amostra, os analitos são separados em uma coluna HPLC de fase reversa C8 dentro de 4 minutos e quantificados com estáveis isótopo-rotulados internas normas correspondentes em espectrometria de massa electrospray ionização (ESI +) na reação de vários tempo de monitoramento (MRM). O método apresentado utiliza uma instrumentação simples configuração com condições cromatográficas uniformes, permitindo o acompanhamento diária e robusta droga terapêutica antibiótica em laboratórios clínicos. A curva de calibração estende o intervalo de concentração farmacocinética, assim, incluindo antibióticos quantidades perto da concentração inibitória mínima (MIC) de bactérias sensíveis e concentrações de pico (Cmáx) que são obtidas com bólus regimes de administração. Sem a necessidade da diluição do soro antes da limpeza da amostra, a área sob a curva para um antibiótico administrado pode ser obtida por meio de várias medições.
Introduction
Embora os antibióticos revolucionaram a prática da medicina, infecções bacterianas graves permanecem das principais causas de morbidade e mortalidade em doenças críticas1. A este respeito, a administração imediata de um anti-infeccioso apropriado em uma dosagem adequada é da mais alta importância para doença controle2.
Um corpo crescente de evidências demonstra que o tratamento empírico com antibióticos de amplo espectro está se tornando cada vez mais problemático com a complexidade de populações de pacientes. Isto é especialmente verdadeiro para unidades de terapia intensiva (UTI), onde uma enorme variabilidade inter individual dos principais parâmetros de farmacocinética (PK) é frequentemente observada3,4. Assim, pacientes de UTI são em risco iminente de níveis sub-terapêuticos com o perigo de um sucesso terapêutico insuficiente5,6. Então, novamente, os pacientes desnecessariamente estão expostos a excessivamente altas concentrações de antibióticas que podem resultar em efeitos adversos graves com nenhum benefícios clínicos7. Tanto o abuso de antibióticos e a dosagem insuficiente também têm impulsionado a disseminação da resistência aos antibióticos, o que está se tornando uma ameaça crescente para a saúde pública8.
Para melhorar o uso de antibióticos e para preservar a sua effectivenessas o máximo possível, a Organização Mundial de saúde lançou um plano de ação global sobre a resistência antimicrobiana em 20159. Programas de manejo de antibióticos constituam um pilar essencial da utilização prudente de antimicrobianos em saúde pública estratégias10, ajudando os médicos a melhorar a qualidade do atendimento ao paciente11 e, ao mesmo tempo, significativamente reduzir a resistência aos antibióticos de12. Antimicrobiana de dosagem em pacientes individuais através da aplicação de drogas terapêuticas (TDM) de monitoramento é um instrumento-chave nesta contexto13.
Até à data, TDM disponível comercialmente ensaios estão disponíveis somente para o glicopeptídeo antibióticos e aminoglicosídeos. A quantificação de substâncias provenientes de outras classes comumente requer um desenvolvimento in-house método ou a validação que pode ser trabalhoso. Nós, portanto, apresentamos detalhadamente o protocolo para um ensaio de espectrometria de massa base robusto que pode ser usado para a quantificação dos antibióticos mais relevantes na UTI dentro de suas clínicas relevantes concentração varia14. O método foi recentemente estabelecido em nossas instalações de espectrometria de massa e tem sido aplicado para a rotina de TDM na UTI desde então. O procedimento usa uma configuração analítica simples e simples com uma limpeza da amostra uniforme, permitindo a rápida implementação de antibiótico TDM em muitas instalações com capacidades de espectrometria de massa.
O protocolo descrito aqui foi otimizado para a quantificação de cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolida e piperacillin no soro humano, usando cromatografia líquida de diluição de isótopos (LC) em combinação com um tandem mass espectrometria (MS/MS). Para a diluição do isótopo metodologia de LC-MS/MS, compostos rotulados de isótopos estáveis são adicionados a uma amostra de interesse com uma matriz específica (por exemplo, o soro). Isótopo-rotulado padrões podem ser distinguidos de suas contrapartes sem rótulo, ou seja o analito de interesse, devido a diferentes pesos moleculares da molécula natural e seus produtos de fragmentação, denominados uma transição de pai-íon-para-filha-ion. Como isótopo-rotulado compostos têm um comportamento geral, físico-químico quase idêntico em comparação com suas contrapartes sem rótulo, que são padrões internos ideais para o MS/MS, permitindo uma quantificação do analito quase independente de matriz com um elevado grau de precisão de15. Hoje em dia, muitos estáveis isótopo-rotulado padrões internos que podem ser usados para quantificação da pequeno-molécula, incluindo a TDM de antimicrobianos, estão disponíveis comercialmente.
A separação cromatográfica de analitos antibióticos no protocolo descrito é executada com uma C8 alquil-comprimento cadeia reversa-fase coluna analítica (100 mm x 2,1 mm, 3 µm-tamanho de partícula). Durante o desenvolvimento do método, os fatores internos padrão normalizado matriz para todos os analitos foi entre 94,6% e 105,4%, com um coeficiente de variação de ≤8.3%14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Nota: É recomendável trabalhar em uma coifa quando manusear os solventes orgânicos, tais como metanol. Prepare todos os buffers e fases móveis em balões volumétricos. Especificação em contrário, as soluções podem ser armazenadas à temperatura ambiente por até 1 mês após a preparação.
1. preparação dos calibradores e amostras de controlo de qualidade
Nota: Uma folha de análise de dados correspondente para a preparação de soluções estoque e spike é dado no Arquivo suplementar. Por razões de rastreabilidade, inserir o fabricante, número de catálogo e muito número de cada antibiótico nas colunas correspondentes. Dissolver todos os antibióticos em um armazenamento de frio em 4 ° C e manter o tempo de trabalho mais curto possível.
- Preparar 100 mL de metanol a 25% em água: prefill num balão volumétrico de 100 mL com 25 mL de metanol absoluto e preenchê-lo até 100 mL com água destilada.
- Prepare-se 10 mL de ácido acético a 200 mM em água: prefill um balão volumétrico de 10 mL com 9 mL de água de grau HPLC, adicione 115 µ l de ácido acético (99,5% de pureza, 17,4 M) e adicionar água destilada de 10 mL.
- Prepare-se 25 mL de metanol a 25% em água com ácido acético de 20 mM: prefill num balão volumétrico de 25 mL com 2,5 mL da solução de ácido acético aquoso 200mm, adicionar 6,25 mL de metanol absoluto e encher o balão de 25 mL com água destilada.
- Use uma balança de precisão para pesar as quantidades adequadas de antibióticos em tubos cônicos de 15 mL, conforme descrito no Arquivo suplementar na coluna peso inicial.
- Prepare Soluções conservadas em estoque do fluoroquinolonas, ciprofloxacina e moxifloxacina em 25% metanol-água incluindo 20 mM de ácido acético. Para fazer isso, adicione o volume correspondente às quantidades ponderadas conforme descrito no Arquivo suplementar na coluna "volume final". Dissolva rapidamente os antibióticos fluoroquinolona em banho de ultra-som por 2 min e pela intensa utilização do vortex.
- Prepare soluções estoque de cefepime, meropenem, linezolida e piperacillin na 25% metanol-água. Para fazer isso, adicione o volume correspondente às quantidades ponderadas conforme descrito no Arquivo suplementar na coluna volume final e dissolver rapidamente os antibióticos pela intensa utilização do vortex. Dissolva o meropenem como última substância.
- Combine as soluções estoque de todos os antibióticos, conforme descrito no quadro correspondente volume de solução-mãe no Arquivo suplementar para produzir pico-soluções concentradas de dez vezes.
- Spike nove volumes de soro livre de drogas, com um volume das soluções dez vezes para obter os calibradores de soro 0 – 7 pico concentrada e controles de qualidade (QC) A – i. Por exemplo, adicionar 0,5 mL de solução de pico de 4,5 mL de soro em um tubo de polipropileno de 10 mL e ele incube por 15 min no armazenamento frio a 4 ° C, em um misturador de rolo a 50 rpm.
- Use uma pipeta repetitiva para gerar 100 alíquotas µ l dos calibradores e QCs em tubos de polipropileno de 1,5 mL.
- Armazene os calibradores, controles de qualidade e soluções antibióticas de estoque a-80 ° C por até seis meses.
- Para cada antibiótico, também prepare uma solução pura contendo 1.000 mg/L de um único antibiótico. Dilua a solução estoque correspondente com um diluente apropriado (por exemplo, para a ciprofloxacina, 25% de uso metanol-água, incluindo 20 mM de ácido acético).
Nota: As soluções antibióticas pura são necessárias para o ajuste de instrumento apenas.
2. preparação da mistura padrões internos
Nota: As normas internas são homólogos isótopo-rotulado de analitos de interesse que são adicionadas a uma amostra durante a limpeza da amostra. Como as normas internas têm propriedades em geral, físico-químicas quase idênticas a suas contrapartes sem rótulo, compensar os efeitos de matriz de uma determinada amostra.
- Prepare-se 10 mL de metanol a 50% em água, adicionando 5 mL de metanol absoluto para um balão de 10 mL batido e preenchê-lo até 10 mL com água destilada.
- Prepare-se 10 mL de metanol a 50% na água, incluindo o ácido acético de 20 mM. Para fazer isso, adicione 1 mL de ácido acético de 200 mM para um balão de 10 mL, adicionar 5 mL de metanol absoluto e preenchê-lo até 10 mL com água destilada.
- Gere soluções estoque de normas internas (IS) com 1.000 mg/L diretamente em frascos fornecidos pelo fabricante. Dissolva a cefepime -13C12D3 sulfato de sódio em água destilada, meropenem-D6, linezolid-D3e piperacillin-D5 em uma solução de metanol-água de 50%. Dissolva a ciprofloxacina-D8 em 50% de metanol-água com 20mm de acetato e moxifloxacina cloridrato -13C1D3 em água destilada com acetato de 20 mM.
- Combine as soluções estoque IS em um tubo de polipropileno de 1,5 mL para produzir uma mistura de padrão interna concentrada quintuplicou. Adicionar 10 µ l de cefepime -13C12D3, 10 µ l de meropenem-D6, 1 µ l de ciprofloxacina-D8, 2 µ l de moxifloxacin hydrochloride -13C1D3, 2 µ l de linezolid-D 3e 10 µ l de piperacillin-D5 a 965 µ l de 25% de metanol-água.
- Armazenar as soluções estoque padrão internas e quintuplicou mistura concentrada IS a-80 ° C.
3. se o paciente amostra armazenamento
Nota: Certifique-se que o soro é obtido o mais rápido possível e que a cadeia de frio de amostras congeladas é mantida.
- Colete o sangue em tubos de coleta de soro.
- Deixe o coágulo de sangue para 20-30 min à temperatura ambiente.
- Separe o soro do sangue por centrifugação a 2.000 x g durante 10 minutos.
- Transferi o sobrenadante para um tubo limpo de polipropileno.
- Armazene o soro até seis meses a-80 ° C até que é analisada. Alternativamente, armazenar as amostras até 3 dias a-20 ° C.
4. buffer preparação para cromatografia
- Para preparar 1 M formiato de amônio em água, dissolva 6,306 g de formiato de amônio em 100 mL de água de grau HPLC utilizando um balão de 100 mL batido. Armazenar a solução até 1 mês a 4 ° C.
- Preparar o mobile fase um [formiato de amônio 10 mM em ácido fórmico a água (99.9:0.1 v/v)]. Prefill num balão volumétrico de 1.000 mL com cerca de 500 mL de água de grau HPLC, adicionar 1 mL de ácido fórmico e 10 mL da solução 1 M-formiato de amônio e preenchê-lo para 1.000 mL com água de grau HPLC. Transferir a fase móvel A uma garrafa de vidro limpa e conectá-lo ao sistema de HPLC. Fase móvel de armazenamento por até 2 semanas em temperatura ambiente.
- Preparar a fase móvel absoluto metanol grau CLAE B. transferência dentro de uma garrafa de vidro limpa e conectá-lo ao sistema de HPLC.
- Use metanol absoluto como a agulha lavar com solvente e ligar o tubo correspondente para o frasco de vidro contendo a fase móvel B.
- Gere o selo e um solvente de limpeza de ácido fórmico metanol-água (7:92.9:0.1, v/v/v). Prefill num balão volumétrico de 1.000 mL com cerca de 500 mL de água destilada, adicionar 70 mL de metanol absoluto, 1 mL de ácido fórmico e adicionar água destilada até 1.000 mL. Transferir o solvente para um frasco de vidro limpo e conectá-lo com o sistema HPLC.
Nota: Vários sistemas de mostruário usam um forte e um solvente de lavagem agulha fraco. Nesse caso, prepare as soluções de lavagem de acordo com as recomendações do fabricante. Por exemplo, fazer a lavagem forte com álcool metanol-água-isopropylic (70:20:10, v/v/v) e o fraco com metanol-água (95:5, v/v).
5. o instrumento de otimização
Nota: Esta etapa é executada para a afinação do método em um espectrômetro de massa específico.
- Dilua o analito puro 1.000 mg/L e a soluções padrão interno 01:10 ou 1: 100 em uma mistura de fase móvel A e B (50: 50, v/v), dependendo da intensidade de sinal do detector. Sintonizar o espectrômetro de massa com a função de autotune ou fazer uma sintonia manual para os seguintes íons de pai para filha transições14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167,1 / 400,0), meropenem (384.1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ciprofloxacina (332.0 > 231.0/245.0), ciprofloxacina-D8 (340.1 > 235.1/249.3), moxifloxacina (402.0 > 261.0/383.9), moxifloxacina-13 C1D3 (406,1 > 265.1/388.0), linezolida (338.0 > 235.0/296.0), linezolid-D3 (341.1 > 235.1/297.1), piperacillin (518.0 > 143.0/358.9) e piperacillin-D5 (523.1 > 142.8/364.1).
- Para instrumentos com ajuste automático, use a função autotune para ajustar automaticamente a voltagem e as configurações de entrada do MS através dos detectores.
- Para instrumentos com sintonia manual, ajustar as configurações (por exemplo, tensão de colisão e energia de colisão) até o ideal (geralmente o máximo) intensidade de sinal é obtida no detector para cada íon de pai e filha. Por exemplo, conecte uma mistura tee, entregar a fase móvel A e B (50: 50, v/v) em 0,5 mL/min e infundir continuamente o padrão puro de antibiótico ou interno com um caudal de 0,1 mL/min.
6. set-up HPLC-MS/MS
Nota: Apresenta o espectrômetro de massa, sistema HPLC (incluindo o mostruário), e o software correspondente dependem do fabricante. Adapte os parâmetros do espectrômetro de massa e o procedimento de lavagem de acordo com as recomendações do fabricante.
- Armazenar os parâmetros de espectrômetro de massa em um correspondente 'MS sintonizar o arquivo '. Use electrospray ionização em modo positivo (ESI +) para todos os analitos. Adaptar-se as configurações de fonte do íon para o instrumento utilizado (por exemplo, uma tensão capilar de 1,5 kV, temperatura fonte de 120 ° C, uma temperatura de desolvation de 400 ° C, uma taxa de fluxo de gás de desolvation de 600 L/h, uma tensão de lente de RF de 0,1 V e um tempo de interrupção de 80 ms).
- Especificar o analito e padrões internos ajustar parâmetros (por exemplo, tensão capilar, energia de colisão) em um 'MS arquivo '.
- Definir as condições de mostruário da seguinte forma na 'arquivo de entrada ': temperatura da amostra entre 10 ° C, com um limite de ± 5 ° C; a sequência de lavagem em 1 x limpeza lavagem-limpeza com uma 600 µ l purgar a reposição volêmica.
- No referido 'arquivo de entrada ', defina o fluxo taxa de 0,4 ou 0,5 mL/min, o tempo de execução para 4 min, o limite de alta pressão de 345 bar e a temperatura da coluna a 30 ° C, com um limite de ± 5 ° C. Adicione o nome de solvente de fases móveis A e B e defini-las para A B/93% de 7%, respectivamente.
- Programa cromatográfico gradiente no 'arquivo de entrada ' da seguinte forma: 0,00 – 0,10 min com fase móvel de 7% A B/93%, 0,11 – 0,60 min com 65% de fase móvel A B/35%, 0.61 – 2.10 min com fase móvel 95% A B/5%, 2.11 – 4.00 min com 7% de fase móvel B/93% A.
Nota: Calcule o volume extracoluna, o volume Mantenha-se para a plataforma instrumental e os fatores de retenção do analito conforme descrito na orientação USP < 621 > cromatografia16.
7. amostra medida mestre arquivo
Nota: Com o 'arquivo mestre de medição de amostra ', das amostras são especificadas, a análise de HPLC-MS/MS é iniciada e a avaliação de dados é realizada. Dois arquivos de modelo separado, incluindo um par de controle de baixa e alta-qualidade são gerados; um modelo inclui par QC A e C, o outro um QC par B e D.
- Criar um novo 'arquivo mestre de medição de amostra '. Selecione o referido 'MS sintonizar o arquivo ', 'MS arquivo 'e 'arquivo de entrada' (secção 6), inseri-los em cada linha da amostra e especificar o volume de injeção com 15 µ l.
- Em ordem crescente, adicione o texto"amostra" para calibradores 0 – 7 e controle de qualidade (QC) par a/c ou QC par b/d.
- Especifica o tipo de amostra. Selecione o tipo de amostra "padrão" para os calibradores e "QC" para os pares de controle de qualidade.
- Especifica a concentração de cada substância antibiótica para o correspondentes calibradores e controles de qualidade (consulte a planilha, concentração [µ g/mL] Cal 0 7 – Cal, QC a/c ou b/d,).
- Programa o 'método de avaliação de dados '. Use as transições otimizadas durante o instrumento de otimização (secção 5). Corresponde cada antibiótico com o padrão de isótopo-rotulado correspondente (por exemplo, meropenem - meropenem-D6).
8. limpeza e HPLC-MS/MS-análise da amostra
Nota: Para cada lote de amostra, um controle de qualidade emparelhado com uma concentração baixa e alta antibiótico (QC/c ou b/d QC) é processado e analisado. Entre diferentes lotes, as amostras emparelhadas de QC são usadas em uma sequência alternativa (por exemplo, no dia 1, selecione o 'arquivo mestre de medição de amostra ' incluindo QC emparelhar a/c; no dia 2, selecione o par QC incluindo um b/d. O processamento das amostras de soro é ilustrado na Figura 1.
- Preparar o agente de precipitação 10% metil -tert-butílico em metanol (10:90, v/v) (por exemplo, balão volumétrico prefill um 25 mL com 2,5 mL de metil -tert-butílico e preenchê-lo para 25 mL com metanol absoluto).
- Coloque a fase reversa C8 na câmara de coluna. Conectá-lo ao HPLC e espectrômetro de massa, na direção do fluxo.
- Gere a lista de amostra. Abra o correspondente 'arquivo mestre de medição de amostra ' modelo e adicionar destinadas a ser processado para a lista das amostras. Geram grupos de até 20 amostras de pacientes e flanqueá-los com o par correspondente do controle de qualidade.
- Molhado-prime o sistema HPLC utilizando o 'arquivo de entrada ' controlar software: definir a função de "prime molhado" para a fase móvel 50% B A/50% e molhado-prime por 2 min com uma taxa de fluxo de 1 mL/min.
- Atualize a seringa. Para fazer isso, execute 6 traços de 600 µ l do software de controle.
- Equilibrar a coluna de fase reversa C8. Usando o software, ligue o fluxo na 'arquivo de entrada ' e nivelá-lo com 7% móvel fase B/93% A durante um período mínimo de 5 min, usando uma taxa de fluxo de 0,5 mL/min. verificar a temperatura da coluna de 30 ° C.
- Descongelar as amostras de pacientes, uma alíquota de calibradores 0 – 7 e um par de controle de qualidade (A / B ou C/D).
- Com uma pipeta repetitiva, adicione 25 µ l da mistura padrão interna para o calibrador de 100 µ l, amostra QC ou soro em um tubo de polipropileno de 1,5 mL e o tubo de vórtice por alguns segundos.
- Incube a mistura durante 5 min à temperatura ambiente em um shaker de bancada (por exemplo, a 1.200 rpm).
- Com uma pipeta repetitiva, adicione 150 µ l de um reagente de precipitação à mistura amostra-interno padrão.
- Novamente, vórtice o tubo por alguns segundos e ele incube durante 5 min à temperatura ambiente em um shaker de bancada (por exemplo, a 1.200 rpm).
- Centrifugar a suspensão de 20.000 x g em uma centrífuga de mesa para 10 min a 4 ° C.
- Diluir o sobrenadante 1:3 com água de grau HPLC usando um frasco de vidro com uma microinserção e carregá-lo como processadas amostras para o mostruário.
- Iniciar manualmente a análise HPLC-MS/MS 'arquivo de controle de medição de amostra '.
Nota: Para um armazenamento prolongado, lave minuciosamente a coluna analítica de acordo com a recomendação do fabricante [por exemplo, 0,5 mL/min. o metanol-água (50: 50, v/v)] para evitar o colapso de fase.

Figura 1: representação esquemática da limpeza amostra. Precipitação de proteínas em alta força centrífuga dá uma pelota densa e sobrenadante claro, indicando a precipitação de proteínas foi completa. Todo o tempo de processamento é de aproximadamente 30 min, incluindo a limpeza da amostra, a separação cromatográfica e a análise de MS/MS. Clique aqui para ver uma versão maior desta figura.
9. quantificação e avaliação da qualidade
- Para processar as amostras, abrir o correspondente 'arquivo de controle de medição de amostra ', selecione os calibradores, controles de qualidade e as amostras dos pacientes e avaliá-las com o 'método de quantificação de antibióticos '.
- Verifique se os picos de um analito específico são devidamente integrados. Inspecione os picos para cada calibrador, QC e amostra do paciente e manualmente reintegrá-los na linha de base, se necessário.
- Estudo da curva de calibração e examinar se satisfaz os seguintes critérios de qualidade: a) linearidade sobre toda calibração, b) e um coeficiente de calibração r2 > 0.995, c) o desvio-padrão ± 15% de cada calibração a valor nominal, exceto para o limite inferior de quantificação (LLOQ), onde a ± 20% é necessária.
- Rejeitar um padrão de calibração não conformes com os critérios acima mencionados e re-avaliar a curva de calibração, incluindo a análise de regressão.
- Estudar os controles de qualidade e examinar se os desvios forem ± 15% do valor nominal.
- Se a concentração de uma amostra do paciente excede a concentração do calibrador maior, dilua a amostra com água destilada, até a 1:5 (por exemplo, 100 µ l de soro mais 400 µ l de água destilada) antes da limpeza da amostra. Reperform passos 8,8 – 8.14 para esse exemplo específico e reprocessá-lo.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Usando o protocolo descrito, um cromatograma típico é retratado na Figura 2. De acordo com o United States Pharmacopeia (USP) cromatografia diretrizes16, determinou-se o volume morto de coluna no actual sistema com ~0.22 mL e o volume extracoluna (incluindo o injector, tubos e conectores) com ~0.08 mL, dando um volume Mantenha-se de ~0.30 mL. Os fatores de retenção calculado para todos os analitos foram 2.8 (para cefepime) - 4.2 (para piperacillin).
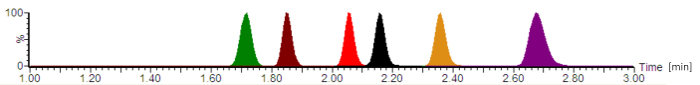
Figura 2: cromatograma analítica típica com intensidades de sinal normalizado. Os antibióticos eluting na seguinte ordem: cefepime (verde), meropenem (marrom), ciprofloxacina (vermelho), moxifloxacina (preto), linezolida (laranja) e piperacillin (roxo). Os tempos de retenção, que são dadas em minutos, e as simetrias de pico do analito variam, dependendo da composição exata das fases móveis, a taxa de fluxo, a tubagem de cromatografia e a idade da coluna analítica. Clique aqui para ver uma versão maior desta figura.
Figura 3A contém uma lista de exemplo de gráfico para as amostras processadas, incluindo os calibradores 0 - 7 ("Kalibrator 0" - "Kalibrator 7"), controlos de qualidade e dos doentes, que são indicados com o número de injeção (#); o texto de identificação de amostra (Sample Text); a concentração medida em mg/L (conc.); o tipo de amostra que é um espaço em branco, padrão, controle de qualidade ou amostra do paciente (tipo); a concentração nominal dos calibradores em mg/L (Std Conc); o tempo de retenção analítica (RT); a resposta que é a relação entre a área do pico da área de analito/pico IS (resposta); o desvio do valor nominal de concentração (% Dev); a posição do frasco (frasco); e o tempo de aquisição (Acq.Time). O parâmetro chave usado para a quantificação é a resposta, aumentando gradualmente com a concentração do analito, devido à quantidade constante de adicionado isótopo-etiquetadas padrão interno.
Figura 3B mostra a curva de calibração. Na regressão, o coeficiente de determinação r2 deve ser > 0.995. O modelo de calibração a seguir é usado para todos os analitos descritos neste método: curva tipo = linear; origem = incluído; ponderação = 1 / x; transformação de eixo = none. No exemplo dado, a curva de calibração e controles de qualidade cumprir todos os critérios de qualidade: r2 > 0.995 para a curva de calibração e o desvio dos calibradores (incluindo o LLOQ) e as amostras QC é ± 15% do valor nominal.
As transições de íon medido de pai para filha (MRM) são dadas na Figura 3, mostrando quatro picos ao mesmo tempo de retenção: os dois picos superiores retratam duas transições que são medidas para o analito de interesse, os dois picos mais baixos representam o transições para o padrão interno correspondente isótopo-rotulados. Para a avaliação da qualidade, os picos do analito nas janelas de tempo de retenção respectivos são verificados visualmente e manualmente reintegrados na linha de base, quando necessário.
A concentração minimamente inibitória (MIC) é o componente central do TDM antimicrobiana, definindo a exposição farmacocinética que é necessário para atingir um alvo farmacocinético/farmacodinâmico (PK/KD) relação13,17. Nesse sentido, os níveis de concentração alvo antibióticos TDM são expressas em relação o MIC do patógeno causador. Dado que a ação de antibióticos beta-lactâmicos é dependente do tempo, sua eficácia é maximizada através a realização das concentrações terapêuticas que excedem o MIC-4 x 5 x (fT > MIC 4-5x). Ao enfrentar o desconhecido patógenos infecciosos, o intervalo de concentração de calha de alvo de piperacillin livre (desvinculado de proteína) é, portanto, 64 mg/L, correspondente a cerca de 90 mg/L de piperacillin total18.
O primeiro paciente (amostra #11) tem um nível de calha de soro alta satisfatória de piperacillin 83,4 mg/L que também é suficiente para patógenos de problema, como Pseudomonas aeruginosa. O segundo paciente (amostra #12) tem uma concentração de cerca de 0,2 mg/L, que está abaixo o calibrador menor (LLOQ). Talvez o paciente tenha se recuperado, e a administração de piperacillin foi descontinuada. O resultado "< 0,5 mg / L" é, portanto, relatado em sistema de informação do hospital. O terceiro paciente (amostra #13) tem uma concentração de calha de piperacillin baixa de apenas 5,3 mg/L que não é suficiente para a clara maioria dos patógenos. Para quimioterapia antimicrobiana eficaz, a dose deve ser aumentada pelo médico.
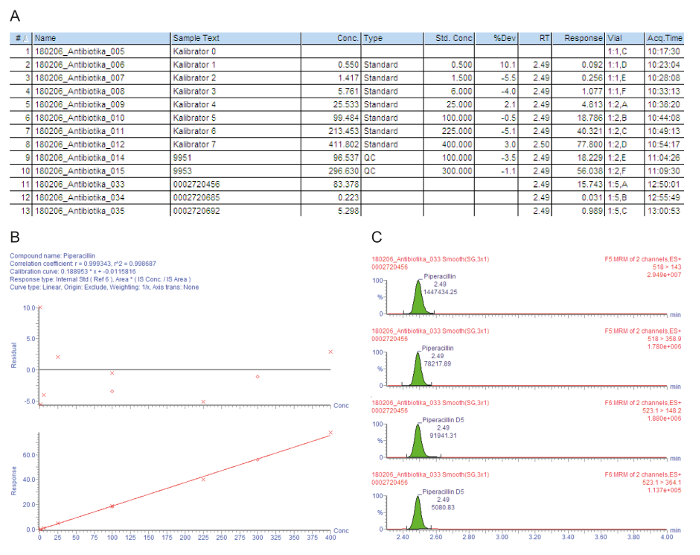
Figura 3: avaliação da qualidade exemplar e quantificação para o analito piperacillin. Estes painéis representam a análise de dados de espectrometria de massa. (A), este painel mostra a lista de exemplo, incluindo os calibradores (padrão, amostras #1 - #8), controles de qualidade (QC, amostras #9 e #10) e dos doentes (amostras #11 - #13). Calibrador 0 refere-se o espaço em branco, sem substância, mas com a adição de um padrão interno. 9951 representa B QC, 9953 representa QC d (B), este painel mostra a curva de calibração para piperacillin. Os desvios percentuais das concentrações nominais Calibrador são dadas no gráfico superior (y-eixo: residual), o gráfico inferior representa o intervalo linear de calibração. (C), este painel mostra o tempo de reação múltiplo monitoramento (MRM) para piperacillin e o correspondente interno padrão piperacillin-D5 para amostra de soro paciente #12. Duas transições de pai para filha íon são apresentadas com seu tempo de retenção e sinal respectivas intensidades. Clique aqui para ver uma versão maior desta figura.
Arquivo suplementar. Clique aqui para baixar este arquivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Neste manuscrito, relatamos o protocolo para um método de massa baseado em espectrometria de tandem simples e robusta para a quantificação dos antibióticos usados com frequência em ICU19, cefepime, meropenem, ciprofloxacina, moxifloxacina, linezolida, e piperacillin14. Uma planilha acompanha o manuscrito para a preparação de soluções estoque antibióticas, calibradores e controles de qualidade, tendo em conta a pureza dos antibióticos e o peso molecular do seus counterions. Dado que as concentrações dos antibióticos são bastante elevadas, sua quantificação não deve ser nenhum desafio particular do ponto de vista analítico. Nesse sentido, estamos confiantes de que o presente protocolo é aplicável para diversas plataformas de instrumental de MS. Para uma transferência de método, os usuários são encorajados a quantificar o volume extracoluna e mantenha-se volume de seu sistema cromatográfico e adaptar-se o início do gradiente conformemente tempo16. Durante a instalação do método, o sistema também deve ser avaliado para reporte e, se necessário, uma amostra em branco deve ser injectada após as amostras mais altas de Calibrador e paciente com altas concentrações de antibióticas. Os usuários também devem considerar a possibilidade de saturação do detector que ocorre quando há muitos íons insere um espectrômetro de massa em tandem. Saturação de detector relevantes pode ser eliminada com menores volumes de injeção, uma maior diluição do analito durante a limpeza da amostra, e/ou um desvio de um analito de destino (por exemplo, degradando as configurações de voltagem ideal).
Ao contrário de outros métodos, o intervalo de calibração permite tanto uma quantificação das concentrações perto o MIC de patógenos sensíveis, bem como as concentrações de pico (cmáx) que são obtidas com uma administração em bolus. O mais alto Cmáx-valores para adultos são relatados nas fichas de informação profissional correspondente no banco de dados de segurança de drogas FDA como segue: 163,9 mg/L por cefepime20, 112 mg/L para meropenem21, 4,6 mg/L para a ciprofloxacina22 , 4,1 mg/L de moxifloxacina23, 21,2 mg/L para linezolid24e 298 mg/L para piperacillin25. Monitoramento de concentração de antibiótica na circulação de sangue do paciente permite um ajuste da dose para a susceptibilidade dos patógenos envolvidos, mas a farmacocinética área sob a curva também pode ser obtida através de amostragem múltipla de sangue com o dado protocolo.
Muitos antibióticos (especialmente beta-lactama meropenem) são quimicamente instáveis uma vez dissolvido. O passo mais crítico neste protocolo é, portanto, a preparação de soluções estoque, calibradores e controles de qualidade sob condições frias26,27. Neste contexto, é também essencial para congelar amostras de pacientes tão rapidamente quanto possível. Embora o armazenamento de soro a-80 ° C é recomendado26, nossos experimentos de estabilidade, mostrar que as amostras também pode ser armazenados até 3 dias a-20 ° C, sem qualquer diminuição significativa das concentrações de antibióticos (mesmo quando os níveis de calha).
Recomendamos a realização de um teste de adequação do sistema antes de cada análise HPLC-MS/MS de amostras de doentes (por exemplo, com o calibrador 3). Geralmente, um teste de adequação do sistema é usado para verificar a repetibilidade do sistema de LC-MS/MS e ver se também é adequada para a análise de ser feito. Assim, por exemplo, diminuindo as intensidades de sinal são causadas por uma contaminação do cone de varredura de MS, que, em seguida, requer sua limpeza com um solvente orgânico. Para manter a fonte MS limpo, uma válvula de desvio pode ser introduzida após a coluna de cromatografia, direcionando o "analito livre" porções da fase móvel para os resíduos antes que eles atinjam o espectrômetro de massa. Por outro lado, um aumento global da pressão pode indicar coluna entupimento ao longo do tempo. Para aumentar a coluna recomenda-se uso de longevidade de um filtro de pré custo-benefício. Se a pressão ainda continua a ser um problema, uma vazão de 0,4 mL/min também pode ser usada com o gradiente de cromatografia em fase gasosa no presente protocolo.
Uma menor limitação dessa técnica é que exige três etapas manuais separadas para limpar amostra, resultando em um tempo de retorno total de aproximadamente 30 min. adicionar os isótopo-rotulado padrões internos para o agente de precipitação pode salvar alguns tempo de processamento. No entanto, isso só deve ser feito para taxas de transferência de amostra alta e com a precipitação agente sendo armazenado no frio (por exemplo, a-20 ° C), como as normas internas também degrada em vitro em temperaturas elevadas.
O protocolo descrito foi desenvolvido para processamento em polipropileno tubos padrão 1,5 mL de amostra. Uma maior taxa de transferência deve ser exigida para TDM antibiótico, o procedimento pode ser atualizado para o formato de placa multi bem usando inserções de centrífuga adequada ou placas de filtro com um distribuidor de vácuo.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Os autores agradecer Dr. Schütze por sua ajuda com o que estabelece o método apresentado e Dr. Zoller pela valiosa contribuição a respeito do intervalo de calibração adequada. Os autores também reconhecem a equipe técnica do centro de espectrometria de massa.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



