Summary
Här presenterar vi ett tandem mass spectrometry-baserat protokoll för kvantifiering av vanliga antibiotika inom intensivvården, nämligen cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid och piperacillin.
Abstract
Det finns en ständigt ökande efterfrågan på terapeutisk övervakning av antibiotika i många kliniska faciliteter, särskilt när det gäller genomförandet av sjukhuset antibiotika stewardship program.
I det nuvarande arbetet presenterar vi ett multiplex high-performance liquid chromatography-tandem masspektrometri (HPCL-MS/MS) protokoll för kvantifiering av cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid och piperacillin, vanligen används antibiotika inom intensivvården. Metoden validerades tidigare utförligt enligt riktlinje av Europeiska läkemedelsmyndigheten.
Efter en snabb prov rensning av analyter separeras i en C8 omvänd-phase HPLC-kolonn inom 4 minuter och kvantifieras med motsvarande stabil isotop-märkt interna standarder i elektrospray masspektrometri jonisering (ESI +) i flera reaktion tid övervakning (MRM). Den presenterade metoden använder en enkel instrumentering med enhetliga gaskromatografiska förhållanden, vilket möjliggör den dagliga och robust antibiotika terapeutisk övervakning i kliniska laboratorier. Kalibreringskurvan sträcker sig över den farmakokinetiska koncentrationsintervall, därmed inklusive antibiotika belopp nära den minsta hämmande koncentrationen (MIC) av mottagliga bakterier och maximal koncentration (Cmax) som erhålls med bolus administration behandlingsregimer. Utan att serumspädningen innan provet rensningen, kan arean under kurvan för en administrerad antibiotika erhållas genom flera mätningar.
Introduction
Även om antibiotika har revolutionerat praktisk medicin, förbli svåra bakterieinfektioner en ledande orsak till sjuklighet och dödlighet i kritiska sjukdomar1. I detta avseende är snabb administrering av en lämplig anti-infective i en adekvat dosering av översta betydelse för sjukdom kontroll2.
En växande mängd bevis visar att empirisk behandling med bredspektrumantibiotika blir alltmer problematisk med komplexiteten i patientpopulationer. Detta är särskilt sant för intensivvårdsavdelningar (IVA), där en enorm interindividuell variabilitet av viktiga farmakokinetiska (PK) parametrar observeras ofta3,4. Följaktligen, ICU patienter löper överhängande risk för sub terapeutiska nivåer med faran av en otillräcklig terapeutisk framgång5,6. Då igen, utsätts patienter onödigt för alltför höga antibiotiska koncentrationerna som kan resultera i allvarliga biverkningar med inga kliniska fördelar7. Både antibiotika missbruk och otillräcklig dosering har också underblåst spridning av antibiotikaresistens, som blir ett växande hot mot folkhälsan8.
Att förbättra användningen av antibiotika och att bevara deras effectivenessas har länge som möjligt, Världshälsoorganisationen lanserat en global handlingsplan om antibiotikaresistens i 20159. Antibiotikum stewardship program utgör en viktig hörnsten i återhållsam antimikrobiella användning i nationella folkhälsan strategier10, att hjälpa klinikerna att avsevärt förbättra kvaliteten på patientvården11 och, samtidigt, att minska antibiotikaresistens12. Antimikrobiella dosering hos enskilda patienter genom tillämpning av terapeutisk övervakning (TDM) är ett viktigt instrument i detta sammanhang13.
Hittills, kommersiellt tillgängliga TDM finns analyser endast tillgängliga för glykopeptider antibiotika och aminoglykosider. Kvantifiering av ämnen från andra klasser kräver vanligen en egen metodutveckling eller validering som kan vara besvärligt. Vi presenterar därför i detalj protokollet för en robust mass spectrometry-baserad analys som kan användas för kvantifiering av de mest relevanta antibiotika i ICU inom deras kliniska relevanta koncentration spänner14. Metoden nyligen etablerats i vår masspektrometri anläggning och har tillämpats för rutinen TDM i ICU sedan dess. Proceduren använder en okomplicerad och enkel analytisk inställning med en enhetlig prov rensning, vilket möjliggör ett snabbt genomförande av antibiotika TDM i den utmärkta servicen och de suveräna faciliteterna med masspektrometri kapacitet.
Protokollet beskrivs här var optimerad för kvantifiering av cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid och piperacillin i humant serum med isotopen utspädning vätskekromatografi (LC) i kombination med en tandem mass masspektrometri (MS/MS). För Isotoputspädning LC-MS/MS metod läggs stabil isotop-märkt föreningar till ett urval av intresse med en specifik matris (t.ex., serum). Isotop-märkt standarder kan skiljas från sin omärkta motsvarighet, nämligen analyten av intresse, på grund av olika molekylvikter av naturliga molekylen och fragmentering produkter, kallas en förälder-ion-till-dotter-Jon övergång. Isotop-märkt föreningar har en nästan identisk övergripande fysikalisk-kemiska beteende jämfört med deras omärkt motsvarighet, är de idealiska interna standarder för MS/MS, vilket gör att en nästan matrix-oberoende analyten kvantifiering med en hög grad av noggrannhet15. Numera är många stabil isotop-märkt interna standarder som kan användas för småmolekylär kvantifiering, inklusive TDM av antimikrobiella medel, kommersiellt tillgängliga.
Kromatografisk separation av den antibiotiska analyter i protokollet beskrivs utförs med en analytisk C8 alkyl-kedja-längd bakåt-phase-kolonn (100 mm x 2,1 mm, 3 µm partikel-storlek). Under metodutvecklingen var de inre standard normaliserade matrix faktorerna för alla analyter mellan 94,6 och 105,4 procent, med en variationskoefficient för ≤8.3%14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Obs: Det rekommenderas att arbeta i dragskåp vid hantering av organiskt lösningsmedel, såsom metanol. Förbereda alla buffertar och mobila faser i mätkolvar. Om inte annat anges, kan lösningarna förvaras vid rumstemperatur i upp till 1 månad efter beredning.
1. beredning av kalibratorer och kvalitetskontroll prover
Obs: En motsvarande analys datablad för beredning av lager och spike lösningar ges i den Kompletterande fil. På grund av spårbarhet, infoga tillverkaren, katalognummer och ett partinummer för varje antibiotikum i motsvarande kolumner. Lös alla antibiotika i en kall förvaring vid 4 ° C och hålla arbetstiden som är så korta som möjligt.
- Förbereda 100 mL 25% metanol i vatten: prefill en 100 mL mätkolv med 25 mL av absoluta metanol och fylla den upp till 100 mL med destillerat vatten.
- Förbereda 10 mL 200 mM ättiksyra i vatten: prefill en mätkolv på 10 mL med 9 mL vatten av HPLC-kvalitet, lägga till 115 µL isättika (99,5% renhet, 17,4 M) och destillerat vatten upp till 10 mL.
- Förbereda 25 mL 25% metanol i vatten med 20 mM ättiksyra: prefill en 25 mL mätkolv med 2,5 mL vattenlösning 200 mM ättiksyralösning, lägga till 6,25 mL absolut metanol och fylla upp kolven till 25 mL med destillerat vatten.
- Använd en precision skala för att väga korrekt mängden antibiotika i 15 mL koniska rör som beskrivs i den Kompletterande fil i kolumnen ursprungliga vikt.
- Förbereda stamlösningar av fluorokinoloner, ciprofloxacin och moxifloxacin i 25% metanol-vatten inklusive 20 mM ättiksyra. Gör detta genom att lägga till motsvarande volym till de vägda kvantiteterna som beskrivs i den Kompletterande fil i kolumnen ”slutlig volym”. Snabbt upplösa fluorokinolon antibiotika i ett ultraljudsbad i 2 min och intensiv vortexa.
- Förbereda stamlösningar av cefepime, meropenem, linezolid och piperacillin i 25% metanol-vatten. Att göra detta, Lägg till motsvarande volym till de vägda kvantiteterna som beskrivs i den Kompletterande fil i kolumnen slutlig volym och snabbt upplösa antibiotika vid intensiv vortexa. Lös upp meropenem som sista ämne.
- Kombinera stamlösningar av alla antibiotika som beskrivs i motsvarande volym av stamlösningen av diagrammet i den Kompletterande fil avkastning tiofaldigt koncentrerade spike-lösningar.
- Spike nio volymer av drogfria serum med en volym av tiofaldigt koncentrerad spike lösningar att erhålla de serum kalibratorer 0 – 7 och kvalitet styr (QC) A – D. Till exempel, tillsätt 0,5 mL spike lösning till 4,5 mL serum i en 10 mL polypropylen rör och inkubera det i 15 min i kall lagring vid 4 ° C på en rulle mixer på 50 rpm.
- Använda en repetitiv pipett för att generera 100 µL alikvoter av kalibratorer och QCs i 1,5 mL polypropylene rören.
- Lagra kalibratorer, kvalitetskontroller och antibiotika stamlösningar vid-80 ° C i upp till sex månader.
- För varje antibiotikum, också förbereda en snygg lösning innehåller 1000 mg/L av en enda antibiotika. Späd den motsvarande utgångslösningen med en lämplig spädningsvätska (t.ex., för ciprofloxacin, använda 25% metanol-vatten inklusive 20 mM ättiksyra).
Anmärkning: De snygga antibiotika lösningarna behövs för instrument-trimma bara.
2. beredning av den interna standarder Mix
Obs: Interna standarder är isotopen-märkt motsvarigheter av de analyter som läggs till ett prov under provet rensning. Som de interna standarderna har nästan identiska övergripande fysikalisk-kemiska egenskaper till motsvarigheterna i omärkta, kompensera de för matrix effekterna av ett givet prov.
- Förbereda 10 mL 50-procentig metanol i vatten genom att tillsätta 5 mL absolut metanol till en 10 mL skaka kolven och fylla den upp till 10 mL med destillerat vatten.
- Förbereda 10 mL 50-procentig metanol i vatten inklusive 20 mM ättiksyra. Att göra detta, tillsätt 1 mL 200 mM ättiksyra till en 10 mL mätkolv, tillsätt 5 mL av absoluta metanol och fylla den upp till 10 mL med destillerat vatten.
- Generera stamlösningar av interna standarder (IS) med 1000 mg/L direkt i injektionsflaskorna som tillhandahålls av tillverkaren. Lös cefepime -13C12D3 sulfat i destillerat vatten, meropenem-D6, linezolid-D3och piperacillin-D5 i en 50% metanol-vatten-lösning. Lös upp ciprofloxacin-D8 i 50% metanol-vatten med 20 mM acetat och moxifloxacin hydroklorid -13C1D3 i destillerat vatten med 20 mM acetat.
- Kombinera är lager lösningarna i ett 1,5 mL polypropylen rör ge en femfaldig koncentrerade interna standard mix. Tillsätt 10 µL av cefepime -13C12D3, 10 µL meropenem-D6, 1 µL av ciprofloxacin-D8, 2 µL av moxifloxacin hydroklorid -13C1D3, 2 µL av linezolid-D 3, och 10 µL av piperacillin-D5 till 965 µL av 25% metanol-vatten.
- Lagra de inre lager standardlösningarna och femfaldig koncentrerad IS blandning vid-80 ° C.
3. patientprov lagring
Anmärkning: Se till att serumet erhålls så fort som möjligt och att kylkedjan av frysta prover upprätthålls.
- Samla hela blodet i serum samling rören.
- Låt blodpropp för 20 – 30 min i rumstemperatur.
- Separera serum från blodet genom centrifugering vid 2000 x g i 10 min.
- Överför supernatanten till en ren polypropylen rör.
- Lagra serum upp till sex månader vid-80 ° C tills det har analyserats. Du kan också lagra proverna upp till 3 dagar vid-20 ° C.
4. buffert beredning för kromatografi
- För att förbereda 1 M ammonium formate i vatten, lös 6.306 g ammonium formate i 100 mL HPLC grade vatten med hjälp av en shake 100 mL-mätkolv. Lagra lösningen upp till 1 månad vid 4 ° C.
- Förbereda mobilen fasen en [10 mM ammonium formate i vatten-myrsyra (99.9:0.1 v/v)]. Prefill en 1 000 mL-mätkolv med cirka 500 mL vatten av HPLC-kvalitet, tillsätt 1 mL myrsyra och 10 mL av 1 M ammonium formate lösningen och fyll den till 1 000 mL med vatten av HPLC-kvalitet. Överföra mobil fas A till en ren glasflaska och Anslut den till HPLC-systemet. Förvara mobil fas upp till 2 veckor i rumstemperatur.
- Förbereda den mobila fasen B. överföring HPLC-kvalitet absolut metanol i en ren glasflaska och Anslut den till HPLC-systemet.
- Använd absoluta metanol som nålen tvätta lösningsmedel och ansluta motsvarande röret till glasflaska innehållande mobil fas B.
- Generera tätningen och en purge lösningsmedel av metanol-vatten-myrsyra (7:92.9:0.1, v/v/v). Prefill en 1 000 mL-mätkolv med ca 500 mL destillerat vatten, tillsätt 70 mL absolut metanol, 1 mL myrsyra, och Tillsätt destillerat vatten till 1 000 mL. Överför vätskan till en ren glasflaska och Anslut den med HPLC system.
Obs: Olika autosampler system använder både en stark och en svag nål tvätta vätska. I ett sådant fall, förbereda de tvätta lösningarna enligt tillverkarens rekommendationer. Till exempel tvätta den starka tvätten med metanol-vatten-isopropylic alkohol (70:20:10, v/v/v) och svaga med vatten-metanol (95:5, v/v).
5. instrument Tuning
Obs: Detta steg utförs för metoden på en specifik masspektrometer struktur.
- Späd snyggt 1000 mg/L analyten och interna standardlösningarna 1:10 eller 1: 100 i en blandning av mobil fas A och B (50: 50, v/v), beroende på detektorn signal stödnivåerna. Finjustera masspektrometer med autotune funktion eller göra en manuell sökning för följande överordnade-till-dotter joner övergångar14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167,1 / 400,0), meropenem (384,1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ciprofloxacin (332,0 > 231.0/245.0), ciprofloxacin-D8 (340,1 > 235.1/249.3), moxifloxacin (402,0 > 261.0/383.9), moxifloxacin-13 C1D3 (406.1 > 265.1/388.0), linezolid (338,0 > 235.0/296.0), linezolid-D3 (341,1 > 235.1/297.1), piperacillin (518.0 > 143.0/358.9), och piperacillin-D5 (523.1 > 142.8/364.1).
- För instrument med autotuning, funktionen autotune att automatiskt justera spänningen och inställningar av MS inlopp genom detektorerna.
- För instrument med manuell inställning, justera inställningarna (t.ex., kollision spänning och kollision energi) tills optimaln (vanligtvis högst) erhålls signalintensitet på detektorn för varje förälder och dotter ion. Till exempel koppla en blandande tee, leverera mobil fas A och B (50: 50, v/v) på 0,5 mL/min och kontinuerligt ingjuta snyggt antibiotikum eller interna standarden med en flödeshastighet av 0,1 mL/min.
6. HPLC-MS/MS Set-up
Obs: Har en masspektrometer, HPLC system (inklusive autosampler) och motsvarande programvara beror på tillverkaren. Anpassa parametrarna masspektrometer och tvätta förfarandet enligt tillverkarens rekommendationer.
- Lagra masspektrometer parametrarna i en motsvarande 'MS tune fil '. Använda elektrospray jonisering i positivt läge (ESI +) för alla analyter. Anpassa ion källa inställningarna för de instrument som används (t.ex., en kapillär spänning 1,5 kV, en källa temperatur av 120 ° C, en desolvering temperatur på 400 ° C, en desolvering gasflödet 600 L/h, en RF lins spänning 0,1 V och en uppehållstid av 80 ms).
- Ange den analyt och interna standarder finjustera parametrar (t.ex., kapillär spänning, kollision energi) i en 'MS filen '.
- Ange villkor efter autosampler som följer i den 'inlopp filen ': provtemperaturen vid 10 ° C med en gräns på ± 5 ° C; Tvätta sekvensen på 1 x purge-tvätta-purge med en 600 µL rensa volym ersättare.
- I ovan nämnda 'inlopp filen ', ange den flödeshastighet till 0,4 eller 0,5 mL/min, körtid till 4 min, tryck höga gränsen till 345 bar och kolumn temperaturen till 30 ° C med en gräns på ± 5 ° C. Lägg namnet lösningsmedel av mobila faser A och B och ställa dem till 7% B/93% A, respektive.
- Programmera den kromatografiska lutningen i den 'inlopp filen ' enligt följande: 0,00-0,10 min med 7% Rörlig fas B/93% A, 0,11 – 0,60 min med 65% Rörlig fas B/35% A, 0,61 – 2.10 min med 95% Rörlig fas B/5% A, 2.11 – 4.00 min med 7% Rörlig fas B/93% A.
Obs: Beräkna volymen extra kolumner, håll upp volymen för instrumental-plattformen, och de analyt kvarhållande faktorerna som beskrivs i USP < 621 > kromatografi riktlinje16.
7. prov mätning Master File
Obs: Med den 'exempelfil mätning master', patientproverna specificeras, HPLC-MS/MS analysen startas och data utvärderingen utförs. Två separata mallfiler inklusive ett låg - och hög kvalitet kontroll par genereras. en mall innehåller QC par A och C, det andra en QC paret B och D.
- Skapa en ny 'exempelfil mätning master'. Välj ovan nämnda 'MS tune fil ', 'MS filen ', och 'inlopp fil' (avsnitt 6), infoga dem i varje prov rad och ange injektionsvolymen med 15 µL.
- Lägg till den ”exempeltexten” för kalibratorer 0 – 7 och kvalitetskontroll (QC) par luftkonditionering eller QC par B/D i stigande ordning.
- Ange provtypen. Välj vilken provet ”standard” för kalibratorer och ”QC” för kvalitetskontroll paren.
- Ange koncentrationen av varje ämne som antibiotika för motsvarande kalibratorer och kvalitetskontroller (se kalkylblad, koncentration [µg/mL] Cal 7 – Cal 0, QC/c eller B/D,).
- Program den 'data utvärderingsmetod '. Använd de övergångar som var optimerad under instrumentet tuning (avsnitt 5). Matcha varje antibiotikum med motsvarande isotop-märkt standarden (t.ex., meropenem - meropenem-D6).
8. prova rensning och HPLC-MS/MS-analys
Obs: För varje prov, en parkopplad kvalitetskontroll med en låga och höga antibiotikakoncentrationen (QC luftkonditionering eller QC B/D) bearbetas och analyseras. Mellan olika partier, de parade QC-proverna används i en alternativa sekvens (t.ex., dag 1, Välj den 'exempelfil mätning master' bland annat QC para a/c, dag 2, Välj en inklusive QC paret B/D. Bearbetning av serumprov illustreras i figur 1.
- Förbereda nederbörd agenten 10% metyl -tert-butyleter läcker ut i metanol (10:90, v/v) (t.ex., prefill en 25 mL mätkolv med 2,5 mL av metyl -tert-butyleter läcker och fyll den till 25 mL med absoluta metanol).
- Plats C8 omvänd fas in i kolumnen kammaren. Ansluta det till HPLC och masspektrometer i riktning mot flödet.
- Generera listan provet. Öppna motsvarande 'exempelfil mätning master' mall och lägga till patientproverna avsedda att bearbetas till listan. Skapa grupper av upp till 20 patientprover och omge dem med motsvarande kvalitetskontroll paret.
- Våt-prime HPCL systemet genom den 'inlopp filen ' styra programvara: Ställ in funktionen ”våta prime” till 50% Rörlig fas A/50% B och våt-prime för 2 min med en flödeshastighet av 1 mL/min.
- Uppdatera sprutan. Gör detta genom att köra 6 slag på 600 µL i programvaran kontroll.
- Temperera kolumnen C8 omvänd fas. Med programvaran, slå på flödet i den 'inlopp filen ' och spola det med 7% mobil fas B/93% A i minst 5 min, med en flödeshastighet av 0,5 mL/min. Kontrollera kolumnen temperatur 30 ° C.
- Tina patientproverna, en alikvot av kalibratorer 0 – 7 och en kvalitetskontroll par (antingen A / B eller C/D).
- Med repetitiva pipett, lägga till 25 µL av den interna standarda mix till 100 µL kalibrator, QC prov eller patientens serum i en 1,5 mL polypropylen rör och vortex röret i några sekunder.
- Inkubera blandningen för 5 min i rumstemperatur på en bänkmonterade-shaker (t.ex., vid 1200 rpm).
- Med repetitiva pipett Tillsätt 150 µL av nederbörd reagens till prov-inre standard mixen.
- Igen, vortex röret för några sekunder och inkubera det 5 min i rumstemperatur på en bänkmonterade-shaker (t.ex., vid 1200 rpm).
- Centrifugera suspensionen vid 20 000 x g i en bordsskiva Centrifugera under 10 minuter vid 4 ° C.
- Späd supernatanten 1:3 med HPLC grade vatten med en injektionsflaska av glas med en mikro-infoga och ladda den som behandlade proverna till autosampler.
- Manuellt starta den HPLC-MS/MS-analysen i den 'exempelfil mätning kontroll '.
Obs: För långvarig lagring, spola analyskolonnen enligt tillverkarens rekommendation [e.g., 0,5 mL/min metanol-vatten (50: 50, v/v)] för att förhindra fas kollaps.

Figur 1: Schematisk bild av provet rensningen. Protein nederbörd på hög centrifugalkraften ger en tät pellet och klar supernatant, vilket indikerar att protein nederbörd var fullständig. Hela handläggningstiden är ca 30 min, inklusive prov rensningen, kromatografisk separation och den MS/MS-analysen. Klicka här för att se en större version av denna siffra.
9. kvalitetsbedömning och kvantifiering
- För att bearbeta proverna, öppna motsvarande 'exempelfil mätning kontroll ', Välj kalibratorer, kvalitetskontroller och patientprover och utvärdera dem med den 'antibiotika kvantifiering metod '.
- Kontrollera om topparna för en viss analyt integreras ordentligt. Inspektera topparna för varje kalibrator, QC och patientprov och manuellt återanpassas på baslinjen vid behov.
- Studera kalibreringskurvan och undersöka om det uppfyller följande kvalitetskriterier: a) linjäritet över hela kalibreringsområdet, b) en kalibrering koefficienten r2 > 0,995, c) avvikelsen för varje kalibrering som är standard inom ± 15% av den nominellt värde, utom den nedre gränsen för kvantifiering (LLOQ), där ± 20% krävs.
- Avvisa en kalibrering standard inte uppfyller ovanstående kriterier och omvärdera kalibreringskurvan, inklusive regressionsanalysen.
- Studera kvalitetskontroller och undersöka om avvikelserna är inom ± 15% av det nominella värdet.
- Om koncentrationen av ett patientprov överskrider koncentrationen av den högsta kalibratorn, späd provet med destillerat vatten, upp till 1:5 (t.ex., 100 µL serum plus 400 µL destillerat vatten) innan provet rensningen. Reperform steg 8,8 – 8.14 för det särskilda provet och omarbeta den.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Genom att använda protokollet beskrivs, avbildas ett typiskt kromatogram i figur 2. Enligt USA farmakopén (USP) kromatografi riktlinjer16, fastställdes den kolumn död volymen i det nuvarande systemet med ~0.22 mL och extra-kolumn volymen (inklusive injektor, slangar och kopplingar) med ~0.08 mL, ger en hold-up-volym ~0.30 ml. De beräkna kvarhållande faktorerna för alla analyter var 2,8 (för cefepime) - 4.2 (för piperacillin).
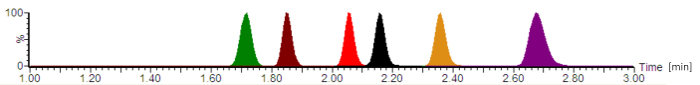
Figur 2: typiska analytiska kromatogrammet med normaliserade signal stödnivåer. Antibiotika eluering i följande ordning: cefepime (grön), meropenem (brun), ciprofloxacin (röd), moxifloxacin (svart), linezolid (orange), och piperacillin (lila). Retentionstiderna, som anges i minuter och de analyt peak symmetrier varierar beroende på den exakta sammansättningen av de mobila faserna, flödet, kromatografi slangen och analyskolonnen ålder. Klicka här för att se en större version av denna siffra.
Figur 3A innehåller en lista med exempel diagram för de behandlade proverna, inklusive kalibratorer 0 - 7 (”Kalibrator 0” - ”Kalibrator 7”), kvalitetskontroller och patientsera, som indikeras med antalet injektion (#); identifiering exempeltexten (Exempeltext); den uppmätta koncentrationen i mg/L (Konc.); den Provtyp av som är antingen en blank, standard, kvalitetskontroll eller patientprov (typ); den nominella koncentrationen hos kalibratorer i mg/L (Std. Conc); den analytiska retentionstiden (RT); det svar som är förhållandet mellan topparean för analyten/topparean IS (svar); avvikelsen från nominell koncentration värdet (% Dev); injektionsflaska position (injektionsflaska); och förvärvet tid (Acq.Time). Den viktiga parametern som används för kvantifiering är svar, gradvis ökande med Analytens koncentration, på grund av konstant mängden tillsatt isotop-märkt intern standard.
Figur 3B visar kalibreringskurvan. I regression bör koefficienten för bestämning r2 > 0,995. Följande kalibrering modell används för alla analyter som beskrivs för denna metod: kurva typ = linjär; ursprung = ingår; viktning = 1 / x; Axis omvandling = ingen. I det givna exemplet, den kalibreringskurvan och kvalitetskontroller uppfylla alla kvalitetskriterier: r2 > 0,995 för kalibreringskurvan och avvikelsen av de Kalibratorer (inklusive LLOQ) och QC proverna är inom ± 15% av det nominella värdet.
De uppmätta förälder-till-dotter ion övergångarna (MRM) ges i figur 3 c, visar fyra toppar på samma retentionstid: de två övre topparna skildrar två övergångar som mäts för analyten sevärdheter, de nedersta två topparna representerar den övergångar för motsvarande isotop-märkt intern standard. För kvalitetsbedömningen, analyten topparna i respektive retention tid Fönstren visuellt kontrolleras och manuellt återintegreras på baslinjen, vid behov.
Den minimalt hämmande koncentrationen (MIC) är den centrala komponenten i antimikrobiell TDM, definiera den farmakokinetiska exponeringen som krävs för att uppnå ett mål farmakokinetiska/farmakodynamiska (PK/KD) baserat på13,17. Följaktligen uttrycks de mål antibiotika TDM koncentration i förhållande till MIC för orsakande patogen. Tanke på att effekten av beta-laktamantibiotika är tidsberoende, deras effektivitet maximeras genom att uppnå de terapeutiska koncentrationer som överstiger MIC 4 x-5 x (fT > 4-5 x MIC). Inför okända smittsamma patogener, är koncentration målintervallet tråg gratis (protein-obundet) piperacillin därför 64 mg/L, motsvarande cirka 90 mg/L totalt piperacillin18.
Den första patienten (prov #11) har en tillfredsställande hög serum tråg 83,4 mg/L piperacillin att räcker också för problemet patogener, såsom Pseudomonas aeruginosa. Den andra patienten (prov #12) har en koncentration av cirka 0,2 mg/L, vilket är lägre än den lägsta kalibratorn (LLOQ). Kanske patienten återhämtat sig, och administrationen av piperacillin avbröts. Resultatet ”< 0,5 mg / L”, därför rapporteras i systemet för sjukhus. Den tredje patienten (prov #13) har en låg piperacillin dalkoncentration endast 5,3 mg/l som inte är tillräckligt för en klar majoritet av patogener. För effektiv antimikrobiell kemoterapi, bör dosen ökas av läkaren.
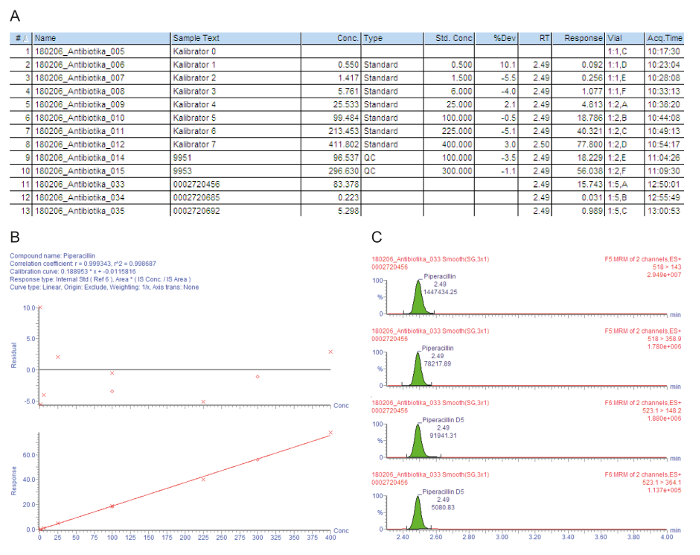
Figur 3: exemplariskt kvalitetsbedömning och kvantifiering för den analyt piperacillin. Dessa paneler representerar masspektrometri dataanalys. (A) i denna panel visas listan prov, inklusive Kalibratorer (Standard, prov #1 - #8), kvalitetskontroller (QC, prover #9 och #10) och patientsera (prov #11 - #13). Kalibrator 0 refererar till tomrummet utan analyt, men med tillägg av en intern standard. 9951 representerar QC B, 9953 representerar QC D. (B) denna panel visar kalibreringskurvan för piperacillin. Procentuella avvikelser från nominella kalibrator koncentrationerna ges i den övre grafen (y-axeln: residual), nedre grafen skildrar linjär kalibreringsområdet. (C), denna panel visar flera reaktionstiden övervakning (MRM) för piperacillin och motsvarande interna standard piperacillin-D5 för patientens serumprov #12. Två överordnade-till-dotter ion övergångar presenteras med sin retentionstiden och respektive signal stödnivåer. Klicka här för att se en större version av denna siffra.
Kompletterande fil. Vänligen klicka här för att hämta den här filen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I detta manuskript, redovisar vi protokollet för en enkel och robust tandem mass spectrometry-baserad metod för kvantifiering av ofta använda antibiotika i ICU19, nämligen cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid, och piperacillin14. Ett kalkylblad medföljer manuskriptet för beredning av antibiotika stamlösningar, kalibratorer och kvalitetskontroller, med hänsyn till renheten av antibiotika och molekylvikten för deras counterions. Med tanke på att halterna av antibiotika är ganska höga, bör deras kvantifiering ingen särskild utmaning från ett analytiskt perspektiv. Därför är vi övertygade om att detta protokoll är tillämpligt till olika MS instrumental plattformar. För en metod överföring, användare uppmuntras att kvantifiera den extra-kolumn volymen och hold-up volymen av deras kromatografisystemet och anpassa lutning start tid med detta16. Under metod set-up, systemet bör också utvärderas för överföring och, om nödvändigt, ett blindprov måste injiceras efter de högsta kalibrator och patienten proverna med hög antibiotiska koncentrationerna. Användare måste också överväga möjligheten att detektorn mättnad som uppstår när alltför många joner anger en tandem masspektrometer. Relevanta detektor mättnad kan undanröjas med mindre injektionsvolymer, en högre analyten utspädning under provet rensningen, och/eller en omstämning av en mål-analyt (t.ex., nedgradering optimal spänning inställningar).
I motsats till andra metoder tillåter kalibreringsområdet både en kvantifiering av koncentrationer nära MIC för mottagliga patogener, samt maximala koncentrationer (cmax) som erhålls med en bolusdos. Den högsta Cmax-värden för vuxna redovisas i motsvarande professionella faktabladen på FDA läkemedlet säkerhetsdatabasen enligt följande: 163,9 mg/L för cefepime20, 112 mg/L för meropenem21, 4,6 mg/L för ciprofloxacin22 , 4,1 mg/L för moxifloxacin23, 21,2 mg/L för linezolid24och 298 mg/L för piperacillin25. Antibiotikakoncentrationen i patientens blodcirkulation möjliggör dosjustering till känsligheten av de inblandade patogenerna, men den farmakokinetiska arean under kurvan kan också erhållas genom flera blodprov med den givna protokoll.
Många antibiotika (särskilt betalaktam-meropenem) är kemiskt instabila gång upplöst. Det mest kritiska steget i detta protokoll är därför beredning av stamlösningar, kalibratorerna och kvalitetskontroller under kalla förhållanden26,27. I det avseendet är det också viktigt att frysa patientprover så snabbt som möjligt. Även om serum lagring vid-80 ° C rekommenderas26, lagras våra stabilitet experiment visar att prover kan till 3 dagar vid-20 ° C utan någon betydande minskning av antibiotika koncentrationer (även på de lägsta nivåerna).
Vi rekommederar en lämplighet systemtest före varje HPLC-MS/MS-analys av patientprover (t.ex., med kalibrator 3). I allmänhet används ett systemtest lämplighet att kontrollera repeterbarheten av LC-MS/MS systemet och se om det också är lämpliga för analys göras. Således för anföra som exempel, orsakas minskande signal stödnivåer av en förorening av MS sopa konen, som sedan kräver dess rengöring med ett organiskt lösningsmedel. För att hålla MS källan rent, kan en Vidarekoppla ventil införas efter kolumnen kromatografi, styra ”analyten-fri” delar av den mobila fasen att avfallet innan de når masspektrometer. Däremot, kan en total ökning av trycket Ange kolumn igensättning över tid. För att öka kolumnen är livslängd användning av en kostnadseffektiv precolumn filter recommendable. Om trycket fortsätter att vara ett problem, användas ett flöde av 0,4 mL/min med den kromatografiska lutningen i detta protokoll.
En mindre begränsning av denna teknik är att det krävs tre separata manuella steg för provet saneringen, vilket resulterar i en total handläggningstid på cirka 30 min. att lägga de isotop-märkt interna standarderna till nederbörd agenten kan spara några bearbetningstid. Men detta bör endast göras för höga samplingsfrekvenser genomströmning och med nederbörden agent lagras i kyla (t.ex., vid-20 ° C), som de interna standarderna också brytas ned i vitro vid förhöjda temperaturer.
Protokollet beskrivs har utvecklats för prov bearbetning i standard 1,5 mL polypropylene rören. Bör krävas en högre genomströmning för antibiotika TDM, kan förfarandet uppgraderas i flera platta format i adekvat centrifug skär eller filter plattor med ett vakuum samlingsrör.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har något att avslöja.
Acknowledgments
Författarna tacka Dr Schütze för hans hjälp med att upprätta den presenterade metoden och Dr Zoller för värdefull input om korrekt kalibreringsområdet. Författarna också erkänna den tekniska personalen i anläggningen masspektrometri.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



