Summary
Her præsenterer vi en tandem massespektrometri-baseret protokol til kvantificering af ofte anvendte antibiotika i intensivafdelinger, nemlig cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid og piperacillin.
Abstract
Der er en stigende efterspørgsel efter terapeutiske drug overvågning af antibiotika i mange kliniske faciliteter, især med hensyn til gennemførelsen af hospital antibiotika stewardship programmer.
I den nuværende arbejde præsenterer vi en multiplex high performance liquid chromatography-tandem massespektrometri (HPCL-MS/MS) protokol til kvantificering af cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid og piperacillin, anvendte antibiotika i intensivafdelinger. Metoden var tidligere omfattende valideret efter retningslinje for det Europæiske Lægemiddelagentur.
Efter en hurtig prøve oprydning, er analysander adskilt på en C8 kolonne med omvendt-fase HPLC i 4 minutter og kvantificeret med de tilsvarende stabil isotop-mærket interne standarder i electrospray Ionisation (ESI +) massespektrometri i flere reaktion tid overvågning (MRM). Metoden præsenteret bruger en enkel instrumentation indstilling med ensartet chromatografiske betingelser, giver mulighed for den daglige og robust antibiotika terapeutiske narkotika overvågning i kliniske laboratorier. Kalibreringskurven strækker sig over den farmakokinetiske koncentrationsområde, hvorved herunder antibiotika mængder tæt på den minimale hæmmende koncentration (MIC) af modtagelige bakterier og peak koncentration (Cmax), som er opnået med bolus forvaltning regimer. Uden behovet for serumfortynding før prøven oprydning, kan arealet under kurven for en administreret antibiotika opnås gennem flere målinger.
Introduction
Selv om antibiotika har revolutioneret lægegerningen, fortsat alvorlige bakterielle infektioner en førende årsag til sygelighed og dødelighed i kritiske sygdomme1. I denne henseende er hurtig administration af en egnet antiinfektiøs i en tilstrækkelig dosis den øverste betydning for disease kontrol2.
En voksende mængde af beviser viser, at den empiriske behandling med bredspektret antibiotika er ved at blive mere og mere problematisk med kompleksiteten af patientgrupper. Dette er især sandt for intensivafdelinger (ICU), hvor en enorm mellem individuelle variation af nøgleparametre, farmakokinetiske (PK) er ofte observeret3,4. I overensstemmelse hermed, ICU patienter er i overhængende fare for sub terapeutiske niveauer med faren for en utilstrækkelig terapeutiske succes5,6. Så igen, er patienter unødigt udsat for for høje koncentrationer af antibiotikum, der kan resultere i alvorlige uønskede hændelser med ingen kliniske ydelser7. Både antibiotika misbrug og den utilstrækkelige dosering har også næret udbredelsen af antibiotikaresistens, der bliver en stigende trussel mod folkesundheden8.
At forbedre brugen af antibiotika og bevare deres effectivenessas har længst muligt, Verdenssundhedsorganisationen lanceret en global handlingsplan om antimikrobiel resistens i 20159. Antibiotika stewardship programmer udgør en afgørende hjørnesten i fornuftig antimikrobiel brug i nationale offentlige sundhed strategier10, hjælpe klinikere til at forbedre kvaliteten af patientbehandlingen11 og på samme tid betydeligt at reducere antibiotikaresistens12. Antimikrobiel dosering i enkelte patienter gennem anvendelse af terapeutiske drug overvågning (TDM) er et centralt instrument i denne sammenhæng13.
Til dato, kommercielt tilgængelige TDM er assays kun tilgængelige for glycopeptidgruppen antibiotika og aminoglykosider. Kvantificering af stoffer fra andre klasser kræver normalt en in-house metodeudvikling eller validering, der kan være besværligt. Derfor præsenterer vi, detaljeret protokol for en robust massespektrometri-baseret analyse, der kan bruges til kvantificering af de mest relevante antibiotika i ICU inden for deres kliniske relevante koncentration intervaller14. Metoden blev for nylig etableret i vores massespektrometri anlæg og har ansøgt om rutine TDM i ICU siden da. Proceduren, der bruger en enkelt og ligetil analytisk indstilling med en ensartet prøve oprydning, giver mulighed for en hurtig gennemførelse af antibiotika TDM i mange faciliteter med massespektrometri kapaciteter.
Protokollen beskrevet her var optimeret til kvantificering af cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid og piperacillin i humant serum, ved hjælp af isotop fortynding væskekromatografi (LC) i kombination med en tandem masse massespektrometri (MS/MS). For isotop fortynding LC-MS/MS metode, er stabil isotop-mærket forbindelser føjet til en prøve af interesse med en bestemt matrix (f.eks., serum). Isotop-mærket standarder kan skelnes fra deres umærkede modstykke, nemlig analysanden af interesse, på grund af forskellige molekylvægte, inden den naturlige molekyle og deres opsplitning produkter, betegnes som en forælder-ion-til-datter-ion overgang. Som isotop-mærket forbindelser har en næsten identisk samlet fysisk-kemiske adfærd i forhold til deres umærkede modstykke, er de ideelle interne standarder for MS/MS, giver mulighed for en næsten matrix-uafhængig analyt kvantificering med en høj grad af nøjagtighed15. I dag, er mange stabile isotop-mærket interne standarder, som kan bruges til små-molekyle kvantificering, herunder TDM af antimikrobielle stoffer, kommercielt tilgængelige.
Kromatografiske adskillelse af de antibiotika analysander i den beskrevne protokol er udført med en analytisk C8 alkyl-kæde-længde omvendt-fase kolonne (100 mm x 2,1 mm, 3 µm-partikelstørrelse). Under metodeudvikling var de interne standard normaliseret matrix faktorer for alle analysander mellem 94,6% og 105,4%, med en koefficient på variation af ≤8.3%14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Bemærk: Det anbefales at arbejde i et stinkskab ved omgangen med organiske opløsningsmidler, såsom methanol. Forberede alle buffere og mobile faser i målekolber. Hvis ikke andet er angivet, kan løsningerne, der opbevares ved stuetemperatur i op til 1 måned efter tilberedning.
1. fremstilling af kalibratorer og prøver, kvalitetskontrol
Bemærk: En tilsvarende analyse på data-ark til fremstilling af materiel og spike løsninger er givet i Supplerende fil. Af hensyn til sporbarheden, indsætte fabrikanten, katalog nummer og en masse antallet af hver antibiotika i de tilsvarende kolonner. Opløse alle antibiotika i et kølerum ved 4 ° C og holde den arbejdstid, der er så korte som muligt.
- Forberede 100 mL 25% methanol i vand: prefill en 100 mL målekolbe med 25 mL af absolutte methanol og fyld den op til 100 mL med destilleret vand.
- Forberede 10 mL af 200 mM eddikesyre i vand: prefill en 10 mL målekolbe med 9 mL vand af HPLC-renhed, tilføje 115 µL iseddike (99,5% renhed, 17.4 M) og tilsættes destilleret vand op til 10 mL.
- Forberede 25 mL 25% methanol i vand med 20 mM eddikesyre: prefill en 25 mL målekolbe med 2,5 mL vandig 200 mM eddikesyreopløsning, tilføje 6,25 mL absolutte methanol og fylde kolben til 25 mL med destilleret vand.
- Bruge en præcision skala for at veje de korrekte mængder af antibiotika i 15 mL konisk rør som beskrevet i den Supplerende fil i kolonnen startvægt.
- Forberede stamopløsninger af fluoroquinoloner, ciprofloxacin og moxifloxacin i 25% methanol-vand, herunder 20 mM eddikesyre. For at gøre dette, skal du tilføje de tilsvarende volumen til de vejede mængder, som beskrevet i den Supplerende fil i kolonnen "endelige mængden". Hurtigt opløses fluoroquinolon antibiotika i en ultralyd bath for 2 min og intens vortexing.
- Forberede stamopløsninger af cefepime, meropenem, linezolid og piperacillin i 25% methanol-vand. For at gøre dette, tilføjes de vejede mængder den tilsvarende mængde, som beskrevet i den Supplerende fil i kolonnen endelige rumfang og hurtigt opløses antibiotika ved intens vortexing. Opløse meropenem som det sidste stof.
- Kombinere stamopløsninger af alle antibiotika, som beskrevet i den tilsvarende mængde stamopløsning diagram i Supplerende fil at give tifold koncentreret spike-løsninger.
- Spike ni mængder narkotika serum med et volumen på de tifold koncentreret spike løsninger til at opnå serum kalibratorer 0 – 7 og kvalitet kontrol (QC) A-D. For eksempel, tilsættes 0,5 mL spike 4,5 ml serum i en 10 mL polypropylen tube og Inkuber det i 15 min i kølerum ved 4 ° C på en valse mixer på 50 rpm.
- Bruge en gentagende pipette til at generere 100 µL delprøver af kalibratorer og QCs i 1,5 mL polypropylen rør.
- Opbevar kalibratorer, kvalitetskontrol og antibiotika stamopløsninger ved-80 ° C i op til seks måneder.
- For hver antibiotikum, også forberede en pæn opløsning indeholdende 1.000 mg/L af et enkelt antibiotikum. Fortynd den tilsvarende stamopløsning med en passende fortyndingsmiddel (f.eks.for ciprofloxacin, bruge 25% methanol-vand herunder 20 mM eddikesyre).
Bemærk: De pæn antibiotika løsninger er nødvendige for instrument-tuning kun.
2. forberedelse af interne standarder Mix
Bemærk: Interne standarder er isotop-mærket kolleger af analysander af interesse, der føjes til en prøve under prøve oprydning. Som de interne standarder har næsten identiske samlet fysisk-kemiske egenskaber til deres umærkede modparter, kompensere de for matrix effekten af en given prøve.
- Forbered 10 mL 50% methanol i vand ved at tilføje 5 mL af absolutte methanol til en 10 mL ryste kolben og fyld den op til 10 mL med destilleret vand.
- Forberede 10 mL 50% methanol i vand, herunder 20 mM eddikesyre. At gøre dette, tilsættes 1 mL af 200 mM eddikesyre til en 10 mL målekolbe, der tilsættes 5 mL af absolutte methanol og fyld den op til 10 mL med destilleret vand.
- Generere stamopløsninger af interne standarder (IS) med 1.000 mg/L direkte i hætteglas leveret af producenten. Opløse cefepime -13C12D3 sulfat i destilleret vand, meropenem-D6, linezolid-D3og piperacillin-D5 i en 50% methanol-vand løsning. Opløse ciprofloxacin-D8 i 50% methanol-vand med 20 mM acetat og moxifloxacin hydrochlorid -13C1D3 i destilleret vand med 20 mM acetat.
- Kombinere er stamopløsninger i 1,5 mL polypropylen rør til at give en femdoblet koncentreret intern standard blanding. Tilsæt 10 µL af cefepime -13C12D3, 10 µL af meropenem-D6, 1 µL af ciprofloxacin-D8, 2 µL af moxifloxacin hydrochlorid -13C1D3, 2 µL af linezolid-D 3, og 10 µL af piperacillin-D5 til 965 µL af 25% methanol-vand.
- Gemme de interne standard stamopløsninger og femdoblet koncentreret IS blandingen ved-80 ° C.
3. patienten prøve opbevaring
Bemærk: Sikre at serum er fremstillet så hurtigt som muligt og at kølekæden af frosne prøver opretholdes.
- Indsamle fuldblod i serum indsamling rør.
- Lad blodprop i 20-30 min. ved stuetemperatur.
- Adskille serum fra blod ved centrifugering ved 2.000 x g i 10 min.
- Overføre supernatanten til en ren polypropylen tube.
- Gemme serum op til seks måneder på-80 ° C, indtil det er analyseret. Alternativt kan du gemme prøverne op til 3 dage på-20 ° C.
4. buffer forberedelse til kromatografi
- For at forberede 1 M ammonium formate i vand, opløses 6.306 g ammoniumsulfat formate i 100 mL vand af HPLC ved hjælp af en 100 mL ryste kolben. Gemme løsningen op til 1 måned ved 4 ° C.
- Forberede mobilen fase en [10 mM ammonium formate i vand-myresyre syre (99.9:0.1 v/v)]. Prefill en 1000 mL målekolbe med ca. 500 mL vand af HPLC-renhed, tilsættes 1 mL myresyre og 10 mL 1 M ammonium formate løsning og fylde det til 1000 mL med vand af HPLC-renhed. Overføre Mobil fase A til en ren glasflaske og Tilslut det til HPLC. Butik Mobil fase et op til 2 uger ved stuetemperatur.
- Forberede den mobile fase B. overførsel HPLC-grade absolutte methanol i en ren glasflaske og Tilslut det til HPLC.
- Brug absolutte methanol som nålen vaske opløsningsmiddel og forbinde de tilsvarende tube til glasflaske indeholdende Mobil fase B.
- Generere segl og oploesningsmiddel udrensning af methanol-vand-myresyre syre (7:92.9:0.1, v/v/v). Prefill en 1000 mL målekolbe med ca. 500 mL destilleret vand, tilføje 70 mL absolutte methanol, 1 mL myresyre, og der tilsættes destilleret vand til 1000 mL. Overføre opløsningsmidlet til en ren glasflaske og forbinde det med HPLC-systemet.
Bemærk: Forskellige autosampler systemer bruger både en stærk og en svag nål vask opløsningsmiddel. I så fald forberede vask løsningerne i henhold til producentens anbefalinger. For eksempel gør den stærke vask med methanol-vand-isopropylic alkohol (70:20:10, v/v/v) og den svage vask med vand-methanol (95:5, v/v).
5. instrument Tuning
Bemærk: Dette trin er udført for opsætning af metoden på en bestemt massespektrometer.
- Fortynd pæn 1.000 mg/L analysanden og intern standard løsninger 1:10 eller 1: 100 i en blanding af mobil fase A og B (50: 50, v/v), afhængigt af detektor signal intensiteter. Tune massespektrometer med funktionen autotune eller gøre en manuel indstilling for følgende overordnede til datter ioner overgange14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167,1 / 400.0), meropenem (384.1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ciprofloxacin (332.0 > 231.0/245.0), ciprofloxacin-D8 (340.1 > 235.1/249.3), moxifloxacin (402.0 > 261.0/383.9), moxifloxacin-13 C1D3 (406.1 > 265.1/388.0), linezolid (338.0 > 235.0/296.0), linezolid-D3 (341.1 > 235.1/297.1), piperacillin (518.0 > 143.0/358.9), og piperacillin-D5 (523.1 > 142.8/364.1).
- For instrumenter med autotuning, skal du bruge funktionen autotune automatisk justere spænding og indstillinger af MS fjorden gennem detektorerne.
- For instrumenter med manuel tuning, justere indstillingerne (f.eks., kollision spænding og kollisionen energi) indtil optimalt (normalt maksimalt) opnås signal intensitet på detektor for hver moder- og datterkernerne ion. For eksempel, stik en blanding tee, levere Mobil fase A og B (50: 50, v/v) på 0,5 mL/min og løbende indgyde den pæn antibiotika eller intern standard med en gennemstrømningshastighed på 0,1 mL/min.
6. HPLC-MS/MS Set-up
Bemærk: Har den massespektrometer, HPLC system (herunder autosampler) og den tilsvarende software afhænger af producenten. Tilpasse parametrene massespektrometer og vask procedure efter fabrikantens anvisninger.
- Gemme massespektrometer parametre i en tilsvarende 'MS tune filen '. Bruge electrospray Ionisation i den positive tilstand (ESI +) for alle analysander. Tilpasse indstillingerne ion kilde for instrumentet anvendes (f.eks., en kapillær spænding på 1,5 kV, en kilde temperatur på 120 ° C, en desolvation temperaturer på 400 ° C, en desolvation strømningshastighed af 600 L/h, en RF linse spænding på 0,1 V og en hviletid på 80 ms).
- Angiv den pågældende analysand og interne standarder tune parametre (f.eks., kapillær spænding, kollisionen energi) i en 'MS filen '.
- Angive autosampler betingelser som følger i den»inlet fil ': prøve temperatur ved 10 ° C med en grænse på ± 5 ° C; vask sekvens på 1 x Rens-vask-opgøret med en 600 µL purge volumen udskiftning.
- I ovennævnte "inlet filen ', sæt strømmen sats til 0,4 eller 0.5 mL/min., kørslen til 4 min, pres høj grænse til 345 bar og kolonne temperaturen til 30 ° C med en grænse på ± 5 ° C. Tilføje opløsningsmiddel navnet på mobile faser A og B og sæt dem til 7% B/93% A, henholdsvis.
- Programmere den kromatografisk forløb i den "inlet fil ' som følger: 0,00-0,10 min med 7% Mobil fase B/93% A, 0,11-0,60 min med 65% Mobil fase B/35% A, 0,61-2.10 min med 95% Mobil fase B/5% A, 2.11-4.00 min med 7% Mobil fase B/93% A.
Bemærk: Beregne extra-kolonne volumen, hold up lydstyrken for den instrumentale platform, og analysanden fastholdelse faktorer som beskrevet i USP < 621 > kromatografi retningslinje16.
7. prøve måling Master File
Bemærk: Med den 'prøve måling master filen ', de patientprøver er angivet, HPLC-MS/MS analyse er startet og data evaluering udføres. To separate skabelonfiler herunder en lav og høj kvalitet kontrol par genereres; en skabelon indeholder QC par A og C, den anden en QC par B og D.
- Opret en ny 'prøve måling master filen '. Vælg den ovennævnte 'MS tune filen ', 'MS fil ', og "indløb fil" (afsnit 6), Indsæt dem i hver prøve linje, og Angiv Injektionsvolumen med 15 µL.
- I stigende rækkefølge, skal du tilføje "sample text" for kalibratorer 0 – 7 og kvalitetskontrol (QC) par a/c eller QC par B/D.
- Angive prøvetypen. Vælg prøvetypen "standard" for kalibratorer og "QC" for kvalitetskontrol par.
- Angiv koncentrationen af hver antibiotiske stof for tilsvarende kalibratorer og kvalitetskontrol (Se regnearket, koncentration [µg/mL] Cal 7-Cal 0, QC/c eller B/D,).
- Program for 'data evalueringsmetode '. Bruge de overgange, der var optimeret under instrumentet tuning (afsnit 5). Matche hver antibiotika med tilsvarende isotop-mærket standard (fx, meropenem - meropenem-D6).
8. prøve oprydning og HPLC-MS/MS analyse
Bemærk: Til hver prøve batch, en parret kvalitetskontrol sæt med en lav og høj antibiotikum koncentration (QC AC eller QC B/D) er behandlet og analyseret. Mellem forskellige partier, anvendes de parrede QC prøver i en alternativ sekvens (f.eks.dag 1, vælge den 'prøve måling master filen ' herunder QC parret/c; på dag 2, vælge den ene herunder QC par B/D. Behandling af serumprøver er illustreret i figur 1.
- Forberede nedbør agent 10% methyl -tert-butylether i methanol (10:90, v/v) (fx, Udfyld en 25-mL målekolbe med 2,5 mL af methyl -tert-butylether og fylde det til 25 mL med absolut methanol).
- Placer C8 omvendt fase i kolonne kammer. Tilslut det til HPLC og massespektrometer i retning af strømmen.
- Generere listen prøve. Åbn de tilsvarende 'prøve måling master filen ' skabelon og tilføje patientprøver beregnet til at blive behandlet på listen. Generere grupper af op til 20 patientprøver og flanke dem med tilsvarende kvalitetskontrol parret.
- Wet-prime HPCL system ved hjælp af den "inlet fil ' styre software: indstille funktionen"wet prime"til 50% Mobil fase A/50% B, og våd-prime i 2 min. med en gennemstrømningshastighed på 1 mL/min.
- Opdater sprøjten. For at gøre dette, skal du udføre 6 streger af 600 µL i control-software.
- Reagensglasset C8 kolonnen med omvendt fase. Ved hjælp af software, tænde for strømmen i den "inlet fil ' og skyl det med 7% Mobil fase B/93% A for et minimum af 5 min, ved hjælp af en flow-hastighed på 0,5 mL/min. Kontroller kolonnen temperatur på 30 ° C.
- Optø de patientprøver, en alikvot af kalibratorer 0-7 og en kvalitetskontrol par (A / B eller C/D).
- Med gentagne pipette, tilføje 25 µL af den interne standard blanding til 100 µL kalibrator, QC prøve eller patientens serum i en 1,5 mL polypropylen rør og vortex røret i et par sekunder.
- Inkuber blandingen i 5 min ved stuetemperatur på benchtop shaker (f.eks.ved 1.200 omdrejninger).
- Med gentagne pipette, Tilføj 150 µL af en nedbør reagens til prøve-intern standard mix.
- Igen, vortex rør i et par sekunder og Inkuber det i 5 min ved stuetemperatur på benchtop shaker (f.eks.ved 1.200 omdrejninger).
- Centrifugeres suspension på 20.000 x g i en bordplade centrifugeres i 10 min. ved 4 ° C.
- Fortynd supernatanten 1:3 med vand af HPLC ved hjælp af et hætteglas med en mikro-Indsæt og indlæse den som forarbejdede prøver at autosampler.
- Manuelt starte HPLC-MS/MS analyse den 'måling kontrol eksempelfilen '.
Bemærk: For langvarig oplagring, skyl grundigt kolonnen analytiske ifølge producentens henstilling [f.eks.0,5 mL/min. methanol-vand (50: 50, v/v)] at forhindre fase sammenbrud.

Figur 1: skematisk fremstilling af prøve oprydning. Protein nedbør på høj centrifugalkraften giver en tæt pellet og klart supernatanten, der angiver at protein nedbør var komplet. Den hele behandlingstid er ca. 30 min., herunder prøve oprydning, kromatografisk separation og MS/MS-analyse. Venligst klik her for at se en større version af dette tal.
9. vurdering og kvantificering
- For at behandle prøverne, åbne den tilsvarende 'måling kontrol eksempelfilen ', Vælg kalibratorer, kvalitetskontrol og patientprøver og evaluere dem med den 'antibiotika kvantificering metode '.
- Kontrollere, om toppe for en specifik analysand er ordentligt integreret. Inspicér toppene for hver kalibrator, QC, og patienten prøve, og manuelt reintegrere dem på basislinjen, hvis nødvendigt.
- Studere kalibreringskurven og undersøge, om det opfylder følgende kvalitetskriterier: a) linearitet over hele kalibreringsområdet, b) en kalibrering koefficient Rasmussen2 > 0.995, c) afvigelsen af hver kalibreringsstandardens inden for ± 15% af den nominel værdi, bortset fra den nedre grænse for kvantificering (LLOQ), hvor der kræves ± 20%.
- Afvise en kalibrering standard ikke opfylder ovennævnte kriterier og revurdere kalibreringskurven, herunder regressionsanalysen.
- Studere kvalitetskontrol og undersøge, om afvigelserne ligger inden for ± 15% af den nominelle værdi.
- Hvis koncentrationen af en patient prøve overstiger koncentrationen af den højeste kalibrator, fortyndes prøven med destilleret vand, op til 1:5 (fx, 100 µL serum plus 400 µL destilleret vand) før prøven oprydning. Reperform skridt 8,8-8.14 for det specifikke eksempel og oparbejder det.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ved hjælp af beskrevet protokollen, er en typisk kromatogrammet afbildet i figur 2. Ifølge USA farmakopé (USP) kromatografi retningslinjer16kolonne dødvolumen i det nuværende system blev fastsat med ~0.22 mL og ekstra-kolonne volumen (herunder injektor, slanger og stik) med ~0.08 mL, giver et hold-up volumen af ~0.30 mL. De beregnede fastholdelse faktorer for alle analysander var 2.8 (for cefepime) - 4,2 (for piperacillin).
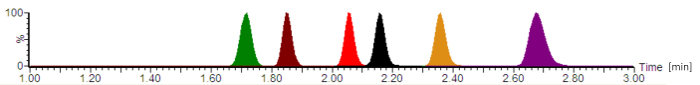
Figur 2: typisk analytiske kromatogrammet med normaliseret signal intensiteter. Antibiotika eluerer i følgende rækkefølge: cefepime (grøn), meropenem (brun), ciprofloxacin (rød), moxifloxacin (sort), linezolid (orange), og piperacillin (lilla). Retentionstiderne, som er angivet i minutter, og analysanden peak symmetrier varierer, afhængigt af den nøjagtige sammensætning af de mobile faser, strømningshastighed, kromatografi slangen og analytiske kolonne alder. Venligst klik her for at se en større version af dette tal.
Figur 3A indeholder en sample diagram liste for de forarbejdede prøver, herunder kalibratorer 0 - 7 ("Kalibrator 0" - "Kalibrator 7"), kvalitetskontrol, og patienten sera, der er angivet med nummeret injektion (#); identifikation eksempeltekst (Eksempeltekst); den målte koncentration i mg/L (koncentreret); prøvetype, som er en tom, standard, kvalitetskontrol eller patienten prøve (Type); den nominelle koncentration af kalibratorer i mg/L (Std. konc); den analytiske retentionstiden (RT); det svar, som er forholdet mellem topareal af analyt/topareal IS (svar); afvigelsen fra den nominelle koncentration værdi (% Dev); hætteglasset position (hætteglas); og erhvervelse tid (Acq.Time). Parameteren nøgle anvendes til kvantitativ bestemmelse er det svar, gradvist stigende med analysandens koncentration, på grund af konstante mængden af tilsat isotop-mærket intern standard.
Figur 3B viser kalibreringskurven. I regression bør koefficienten for bestemmelse r2 > 0.995. Den følgende kalibrering model bruges til alle analysander beskrevet i denne metode: kurven type = lineær; oprindelse = inkluderet; vægtning = 1 / x; akse transformation = ingen. I eksemplet med given kalibreringskurven og kvalitetskontrol opfylde alle kvalitetskriterier: r2 > 0.995 for kalibreringskurven og afvigelse af kalibratorer (herunder LLOQ) og QC prøver er inden for ± 15% af den nominelle værdi.
De målte forælder til datter ion overgange (MRM) gives i figur 3 c, viser fire toppe på samme retentionstid: de to øverste tinder skildrer to overgange, der er målt for analysanden af interesse, til lavere to toppe repræsenterer den overgange til den tilsvarende isotop-mærket intern standard. For kvalitetsvurdering, er analysandens toppe i respektive fastholdelse tidsvinduer visuelt kontrolleres og manuelt reintegreres på baseline, når det er nødvendigt.
Den minimalt hæmmende koncentration (MIC) er den centrale komponent i den antimikrobielle TDM, definere den farmakokinetiske eksponering, der er nødvendige for at nå et target farmakokinetiske/farmakodynamiske (PK/KD) forholdet13,17. I overensstemmelse hermed, målværdier til koncentrationen af antibiotika TDM er udtrykt i forhold til MIC af de sygdomsfremkaldende patogener. Handlingen af beta-lactam antibiotika er tidsafhængig, deres effektivitet er maksimeret gennem opnåelse af de terapeutiske koncentrationer, der overstiger MIC 4 x-5 x (fT > 4-5 x MIC). Når de står ukendt smittefarlige patogener, er målinterval lavpunktet koncentration af frie (protein-ubundet) piperacillin, derfor, 64 mg/L, svarende til ca 90 mg/L total piperacillin18.
Den første patient (sample #11) har en tilfredsstillende høj serum lavpunktet niveau af 83,4 mg/L piperacillin, som også er tilstrækkelig for problem patogener, såsom Pseudomonas aeruginosa. Den anden patient (sample #12) har en koncentration på ca 0.2 mg/L, hvilket er under de laveste kalibrator (LLOQ). Måske patienten er genoprettet, og administrationen af piperacillin ophørte. Resultatet "< 0,5 mg / L" er, derfor, rapporterede i hospitalet informationssystem. Den tredje patient (sample #13) har en lav piperacillin lavpunktet koncentration på kun 5,3 mg/L, ikke der er tilstrækkelig for et klart flertal af patogener. For effektiv antimikrobiel kemoterapi, bør dosis øges af lægen.
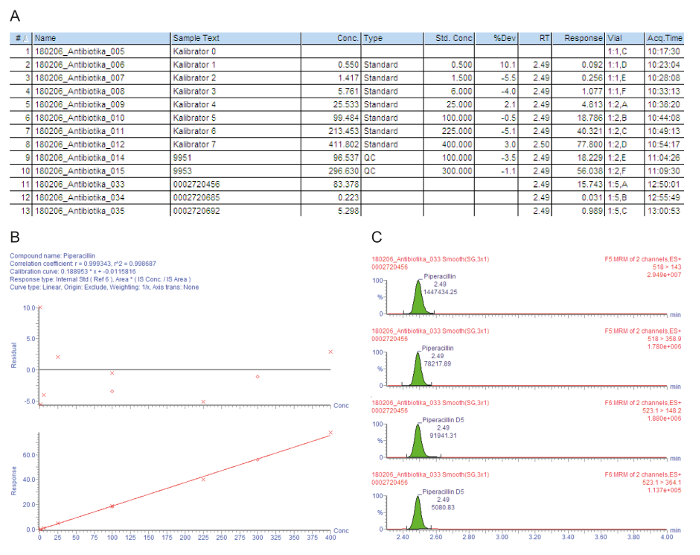
Figur 3: eksemplarisk kvalitetsvurdering og kvantificering for analysanden piperacillin. Disse paneler repræsenterer massespektrometri dataanalyse. (A) dette panel viser listen prøve, herunder kalibratorer (Standard, prøver #1 - #8), kvalitetskontrol (QC, prøver #9 og #10) og patient sera (prøver #11 - #13). Kalibrator 0 refererer til blank uden analysand, men med tilføjelse af en intern standard. 9951 repræsenterer QC B, 9953 repræsenterer QC D. (B) dette panel viser kalibreringskurven for piperacillin. De procentvise afvigelser fra nominel kalibrator koncentrationer findes i den øverste Graf (y-akse: resterende), den nederste graf viser den lineære kalibreringsområdet. (C) dette panel viser flere reaktionstiden overvågning (MRM) for piperacillin og den tilsvarende intern standard piperacillin-D5 for patient serumprøven #12. To overordnede til datter ion overgange er præsenteret med deres retentionstid og respektive signal intensiteter. Venligst klik her for at se en større version af dette tal.
Supplerende fil. Venligst klik her for at downloade denne fil.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I dette manuskript, rapporterer vi protokol for en enkel og robust tandem massespektrometri-baseret metode til kvantificering af ofte anvendte antibiotika i ICU19, nemlig cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid, og piperacillin14. Et regneark ledsager manuskript til forberedelse af antibiotika stamopløsninger, kalibratorer og kvalitetskontrol, under hensyntagen til renheden af antibiotika og molekylvægt af deres counterions. Koncentrationer af antibiotika er temmelig høj, bør deres kvantificering ingen særlig udfordring fra et analytisk perspektiv. Derfor er vi overbevist om, at denne protokol gælder for forskellige MS instrumental platforme. Til overførsel metode brugere opfordres til at kvantificere den ekstra kolonne volumen og hold up volumen af deres kromatografiske system og til at tilpasse den gradient start tid derfor16. Under metode set-up, systemet bør også vurderes til overførsel, og om nødvendigt en blindprøve skal injiceres efter de højeste kalibrator og patient prøver med høje koncentrationer af antibiotikum. Brugere skal også overveje muligheden af detektor mætning, der opstår, når alt for mange ioner indtaste en tandem massespektrometer. Relevante detektor mætning kan elimineres med mindre injektionsvolumener, en højere analysand fortyndingsluft under prøven oprydning og/eller en stemning af en analysanden (f.eks.deklassering optimale spænding indstillinger).
I modsætning til andre metoder giver kalibreringsområdet både en kvantitativ bestemmelse af koncentrationer tæt på MIC af modtagelige patogener, samt peak koncentration (cmax), som er opnået med en bolus administration. Den højeste Cmax-værdier for voksne er rapporteret i de tilsvarende faglige faktablade på FDA drug safety database som følger: 163.9 mg/L for cefepime20, 112 mg/L for meropenem21, 4,6 mg/L for ciprofloxacin22 , 4,1 mg/L for moxifloxacin23, 21.2 mg/L for linezolid24og 298 mg/L for piperacillin25. Antibiotikum koncentration overvågning i patientens blod omløb tillader en dosis justering af modtagelighed af de involverede patogener, men det farmakokinetiske arealet under kurven kan også opnås gennem flere udtagning af blodprøve med den givne protokol.
Mange antibiotika (især beta-lactam meropenem) er kemisk ustabile engang opløst. Det mest afgørende skridt i denne protokol er derfor fremstilling af stamopløsninger, kalibratorer og kvalitetskontrol under kolde betingelser26,27. I forbindelse er det også vigtigt at fryse patientprøver så hurtigt som muligt. Selvom serum opbevaring ved-80 ° C anbefales26, gemt vores stabilitet eksperimenter viser, at prøver kan også være til 3 dage på-20 ° C uden nogen betydelige fald i antibiotika koncentrationer (selv på lavpunktet niveauer).
Vi anbefaler, at udføre en system egnethedstest før hver HPLC-MS/MS analyse af patientprøver (f.eks.med kalibrator 3). Generelt, en system egnethedstest bruges til at kontrollere repeterbarhed af LC-MS/MS system og se om det er også passende for analyse skal gøres. Således, for eksempel, faldende signal intensiteter er forårsaget af en forurening af MS feje kegle, som derefter, kræver sin rengøring med et organisk opløsningsmiddel. For at holde MS kilde ren, kan en Omstil ventil indføres efter kolonnen kromatografi, lede "analysand-fri" dele af den mobile fase affald, før de når den massespektrometer. På den anden side kan en samlet stigning i trykket angive kolonne tilstopning over tid. For at øge kolonnen er levetiden brug af en omkostningseffektiv precolumn filter anbefalelsesværdige. Hvis trykket stadig fortsætter med at være et problem, kan en gennemstrømningshastighed på 0,4 mL/min. også bruges med den kromatografisk forløb i denne protokol.
En mindre begrænsning af denne teknik er, at det kræver tre separate manuelle trin til prøve oprydning, hvilket resulterer i en samlet behandlingstid på ca 30 min. tilføjer de isotop-mærket interne standarder til nedbør agent kan gemme nogle behandlingstid. Men dette bør kun gøres for høj sample overførselshastigheder og med nedbøren agent er oplagt i koldt (f.eks.ved-20 ° C), som de interne standarder også nedbrydes i vitro ved forhøjede temperaturer.
Den beskrevne protokol er blevet udviklet for prøve behandling i standard 1,5 mL polypropylen rør. Bør en højere overførselshastighed kræves for antibiotika TDM, kan proceduren, der opgraderes til formatet multi godt plade ved hjælp af passende centrifuge skær eller filter plader med en vakuum manifold.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Forfatterne takker Dr. Schütze for hans hjælp med oprettelse af metoden præsenteres og Dr. Zoller for værdifuld input med hensyn til ordentlig kalibreringsområdet. Forfatterne også anerkende det tekniske personale af massespektrometri facilitet.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



