Summary
Hier presenteren we een tandem massa spectrometrie-protocol voor de kwantificering van vaak gebruikte antibiotica in de intensieve zorg eenheden, namelijk cefepime, meropenem ciprofloxacine, moxifloxacin, linezolid en piperacillin.
Abstract
Er is een toenemende vraag naar de therapeutische drug monitoring van antibiotica in veel klinische faciliteiten, met name ten aanzien van de uitvoering van ziekenhuis antibiotica stewardship programma's.
In het huidige werk presenteren we een multiplex krachtige vloeibare chromatografie-tandem massaspectrometrie (HPCL-MS/MS)-protocol voor de kwantificering van cefepime, meropenem ciprofloxacine, moxifloxacin, linezolid en piperacillin, gebruikte antibiotica in de intensieve zorg eenheden. De methode was eerder uitgebreid gevalideerd volgens het richtsnoer van het Europees Geneesmiddelenbureau.
Na een snelle monster opruimen, zijn de analyten afgescheiden in een C8-omgekeerde-fase HPLC-kolom binnen 4 minuten en gekwantificeerd met de overeenkomstige stabiele isotoop gelabelde interne standaarden in electrospray ionisatie (ESI +) massaspectrometrie in meerdere reactie tijd toezicht (MRM). De onderhavige methode gebruikt een eenvoudige instrumentatie instellen met uniforme chromatografische voorwaarden, waardoor de dagelijkse en robuuste antibiotica therapeutische drug monitoring in klinische laboratoria. De kalibratiekromme overspant het farmacokinetische concentratiebereik, waardoor met inbegrip van antibiotica bedragen dicht bij de minimale remmende concentratie (MIC) van gevoelige bacteriën en piekconcentraties (Cmax) die worden verkregen met bolus administratie regimes. Zonder de noodzaak van de serumverdunning voor het opruimen van de steekproef, kan het oppervlak onder de kromme voor een door de overheid gereguleerde antibioticum verkregen worden door meerdere metingen.
Introduction
Hoewel antibiotica hebben een revolutie teweeggebracht in de uitoefening van de geneeskunde, blijven ernstige bacteriële infecties een belangrijke oorzaak van morbiditeit en mortaliteit in kritische ziekten1. In dit verband is het snel beheer van een geschikt infectiebestrijdende in een adequate dosering van het bovenste belang voor disease control2.
Een groeiende hoeveelheid bewijs toont aan dat de empirische behandeling met breedspectrum antibiotica steeds problematisch met de complexiteit van de patiënt populaties wordt. Dit geldt met name voor intensive care units (ICU), waar een enorme tussen individuele variabiliteit van sleutelparameters farmacokinetische (PK) wordt vaak waargenomen3,4. Dienovereenkomstig, ICU patiënten zijn bij dreigend sub therapeutische niveaus met het gevaar van een onvoldoende therapeutisch succes5,6. Dan weer, patiënten onnodig blootgesteld aan te hoge antibiotica concentraties die leiden ernstige ongewenste voorvallen met geen klinische voordelen7 tot kunnen. Zowel de antibiotica misbruik en de onvoldoende dosering hebben ook de verspreiding van resistentie tegen antibiotica, die steeds een groeiende bedreiging voor de volksgezondheid8aangewakkerd.
Verbeteren van het gebruik van antibiotica en het behoud van hun effectivenessas heeft lang mogelijk, de World Health Organization een globaal actieplan inzake antimicrobiële resistentie in 20159. Antibiotica stewardship programma's vormen een essentiële hoeksteen van verstandig antimicrobiële gebruik in nationale volksgezondheid strategieën10, clinici aanzienlijk te verbeteren de kwaliteit van patiëntenzorg11 en, tegelijkertijd, helpen vermindering van de resistentie tegen antibiotica12. Antimicrobiële dosering in individuele patiënten door de toepassing van een therapeutische drug monitoring (TDM) is een belangrijk instrument in dit kader13.
Tot op heden, verkrijgbare TDM zijn testen alleen beschikbaar voor de glycopeptide-antibiotica en de aminoglycosiden. De kwantificering van stoffen van andere klassen vereist vaak een in-house methode ontwikkeling of validering die kan erg onhandig zijn. Daarom presenteren we, in detail het protocol voor een robuuste massa spectrometrie gebaseerde assay die kan worden gebruikt voor de kwantificering van de meest relevante antibiotica in ICU binnen hun klinische relevante concentratie bereiken14. De methode werd onlangs opgericht in onze faciliteit van de Spectrometrie van de massa en de routine TDM in ICU sindsdien heeft aangevraagd. De procedure wordt een eenvoudig en simpel en analytische instelling met een uniforme monster opruimen, zodat voor de snelle uitvoering van antibiotica TDM in vele faciliteiten met massaspectrometrie mogelijkheden.
Het protocol hier beschreven is geoptimaliseerd voor de kwantificering van cefepime, meropenem ciprofloxacine, moxifloxacin, linezolid en piperacillin in menselijk serum, isotope verdunning vloeistofchromatografie (LC) gebruiken in combinatie met een tandem massa spectrometrie (MS/MS). Voor de isotoop verdunning LC-MS/MS methodologie, zijn stabiele isotoop-geëtiketteerden verbindingen toegevoegd aan een monster van belang met een specifieke matrix (bv, serum). Isotoop-geëtiketteerden normen kunnen worden onderscheiden van hun labelloze tegenhanger, namelijk de analyt van belang, als gevolg van verschillende molecuulgewicht van de natuurlijke molecule en hun fragmentatie producten, genoemd de overgang van een bovenliggende-ion-naar-dochter-ion. Isotoop-geëtiketteerden verbindingen hebben een bijna identieke algemene fysisch-chemische gedrag ten opzichte van hun labelloze tegenhanger, zijn ze ideaal interne standaarden voor de MS/MS, waardoor een kwantificering van de analyt bijna matrix-zelfstandige met een hoge mate van nauwkeurigheid15. Tegenwoordig zijn veel stabiele isotoop gelabelde interne standaarden die kunnen worden gebruikt voor kleine-molecuul kwantificering, met inbegrip van de TDM van antimicrobiële middelen, commercieel verkrijgbaar.
De gaschromatografische scheiding van de antibiotica analyten in het beschreven protocol wordt uitgevoerd met een analytische C8 alkyl-keten-length omgekeerde-phase kolom (100 mm x 2.1 mm, 3 µm-deeltjesgrootte). Tijdens de ontwikkeling van de methode was de factoren van de interne standaard genormaliseerde matrix voor alle analyten 94,6% à 105,4%, met een variatiecoëfficiënt van14%≤8.3.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Opmerking: Het wordt aanbevolen te werken in een zuurkast bij de verwerking van organisch oplosmiddel, zoals methanol. Bereiden alle buffers en mobiele fasen in volumetrische kolven. Als niet elders genoemd, kunnen de oplossingen bij kamertemperatuur worden opgeslagen voor tot 1 maand na bereiding.
1. voorbereiding van de kalibratoren en kwaliteitscontrole monsters
Opmerking: Een overeenkomstige data analyse sheet voor de voorbereiding van de voorraad en spike oplossingen wordt gegeven in het Aanvullende bestand. Omwille van de traceerbaarheid, de fabrikant, catalogusnummer en een lotnummer van elke antibioticum invoegen in de corresponderende kolommen. Los van alle antibiotica in een koude opslag bij 4 ° C en de arbeidstijd zo kort mogelijk houden.
- 100 mL 25% methanol in water bereiden: prefill een maatkolf van 100 mL met 25 mL van absolute methanol en vullen tot 100 mL met gedestilleerd water.
- 10 mL 200 mM azijnzuur in water bereiden: prefill een maatkolf 10 mL met 9 mL HPLC rang water, voeg 115 µL ijsazijn (99,5% zuiverheid, 17.4 M) en gedestilleerd water toevoegen tot 10 mL.
- Bereiden van 25 mL voor 25% methanol in water met 20 mM azijnzuur: een maatkolf van 25 mL prefill met 2,5 mL van de oplossing van waterige 200 mM azijnzuur, voeg 6,25 mL absolute methanol, en vul de maatkolf aan tot 25 mL met gedestilleerd water.
- Gebruik een precisie-schaal om te wegen van de juiste hoeveelheid antibiotica in 15 mL conische buisjes, zoals beschreven in het Aanvullend bestand in de kolom begingewicht.
- Bereiden van stamoplossingen van de fluoroquinolones, ciprofloxacine en moxifloxacin in de 25% methanol-water, inclusief 20 mM azijnzuur. Om dit te doen, door het bijbehorende volume aan de gewogen hoeveelheden toevoegen zoals beschreven in het Aanvullend bestand in de kolom "eindvolume". Snel los de antibiotica van de fluoroquinolone in een ultrasoonbad gedurende 2 minuten, en door intense vortexing.
- Bereiden van stamoplossingen van cefepime, meropenem, linezolid en piperacillin in de 25% methanol / water. Om dit te doen, het bijbehorende volume de gewogen hoeveelheden toevoegen, zoals beschreven in het Aanvullend bestand in de kolom eindvolume en snel het ontbinden van de antibiotica door de intense vortexing. Meropenem ontbinden als laatste stof.
- Combineer de voorraadoplossingen van alle antibiotica zoals beschreven in de bijbehorende volume van de stockoplossing grafiek in het Aanvullende bestand vertienvoudigd geconcentreerde spike-oplossingen opleveren.
- Spike negen volumes van drugsvrije serum met een volume van het tienvoudige geconcentreerde spike oplossingen te verkrijgen van de serum kalibratoren 0 – 7 en kwaliteit controle (QC) A-D. Bijvoorbeeld, Voeg 0,5 mL van spike oplossing aan 4.5 mL serum in een polypropyleen 10 mL-buis en het Incubeer gedurende 15 min. in de koude opslag bij 4 ° C op een roller mixer op 50 rpm.
- Gebruik een repetitieve pipet te genereren van 100 µL aliquots van de kalibratoren en QCs in 1,5 mL polypropyleen-buizen.
- Sla de kalibratoren, kwaliteitscontroles en antibiotica stamoplossingen bij-80 ° C voor maximaal zes maanden.
- Voor elke antibioticum, ook bereid een nette oplossing met 1000 mg/L voor een enkel antibioticum. Verdun de overeenkomstige stockoplossing met een passende verdunningsmiddel (bijvoorbeeldvoor ciprofloxacine, 25% methanol-water gebruiken met inbegrip van 20 mM azijnzuur).
Opmerking: De nette antibiotica oplossingen zijn vereist voor het instrument-tuning alleen.
2. voorbereiding van de interne standaarden Mix
Opmerking: Interne standaarden zijn isotoop-geëtiketteerden tegenhangers van de analyten van belang die zijn toegevoegd aan een monster bij monster schoonmaak. Als de interne standaarden bijna identieke algemene fysisch-chemische eigenschappen aan hun labelloze tegenhangers hebben, compenseren ze de matrixeffecten van een monster.
- 10 mL 50% methanol in water door toevoeging van 5 mL van absolute methanol in een maatkolf 10 mL shake bereiden en vul het tot 10 mL met gedestilleerd water.
- Bereiden van 10 mL 50% methanol in water, inclusief 20 mM azijnzuur. Om dit te doen, voeg 1 mL azijnzuur 200 mM in een maatkolf 10 mL, voeg 5 mL van absolute methanol en vullen tot 10 mL met gedestilleerd water.
- Genereren van stamoplossingen van interne standaarden (IS) met 1000 mg/L direct in de flesjes geleverd door de fabrikant. Los cefepime -13C12D3 sulfaat in gedestilleerd water, meropenem-D6, linezolid-D3en piperacillin-D,5 in een 50% methanol / water-oplossing. Ontbinden ciprofloxacine-D8 in 50% methanol / water met 20 mM acetaat en moxifloxacin hydrochloride -13C,1D3 in gedestilleerd water met 20 mM acetaat.
- Het combineren van de stamoplossingen IS in een tube 1,5 mL polypropyleen opleveren een vijfvoudige geconcentreerde interne standaard mix. Voeg 10 µL van cefepime -13C12D3, 10 µL van meropenem-D6, 1 µL van ciprofloxacine-D8, 2 µL van moxifloxacin hydrochloride -13C1D3, 2 µL van linezolid-D 3, en 10 µL van piperacillin-D5 tot 965 µL van 25% methanol / water.
- Opslaan van de interne standaard stamoplossingen en de vijfvoudige geconcentreerd IS mix van-80 ° C.
3. patiënten Sample opslag
Opmerking: Zorg ervoor dat het serum zo snel mogelijk wordt verkregen en dat de koudeketen van bevroren monsters in stand is gehouden.
- Het verzamelen van de volbloed in het serum collectie buizen.
- Laat de bloedklonter gedurende 20 tot 30 minuten bij kamertemperatuur.
- Scheiden het serum van het bloed door centrifugeren bij 2.000 x g gedurende 10 minuten.
- Het supernatant overbrengen in een schone polypropyleen buis.
- Het serum tot opslaan tot zes maanden bij-80 ° C totdat het is bepaald. U kunt ook de monsters tot opslaan 3 dagen bij-20 ° C.
4. buffer voorbereiding voor chromatografie
- Los 6.306 g ammonium formate in 100 mL HPLC rang water met behulp van een maatkolf van 100 mL schudden om te bereiden 1 M ammonium formate in water. De oplossing tot opslaan 1 maand bij 4 ° C.
- Voorbereiden van de mobiele fase een [10 mM ammonium formate in water-mierenzuur zuur (v/v 99.9:0.1)]. Prefill een maatkolf van 1000 mL met ongeveer 500 mL HPLC rang water, voeg 1 mL mierenzuur en 10 mL van de 1 M ammonium formate oplossing en vullen tot 1000 mL met water van HPLC rang. Mobiele fase A overbrengen in een schone fles en sluit deze aan het HPLC-systeem. Mobiele fase een maximaal 2 weken bij kamertemperatuur worden opgeslagen.
- Voorbereiden van de mobiele fase HPLC-B. Transfer-kwaliteit absoluut methanol in een schone fles en sluit deze aan het HPLC-systeem.
- Gebruik absolute methanol als de naald wassen oplosmiddel en de bijbehorende buis verbinden met de glazen fles met mobiele fase B.
- Het genereren van het zegel en purge oplosmiddel van methanol-water-mierenzuur zuur (7:92.9:0.1, v/v/v). Prefill een maatkolf van 1000 mL met ongeveer 500 mL gedestilleerd water, absolute methanol, 1 mL mierenzuur, 70 mL en voeg toe gedestilleerd water tot 1000 mL. Het oplosmiddel overbrengen in een schone fles en sluit deze met de HPLC-systeem.
Opmerking: Diverse autosampler systemen gebruiken zowel een sterke en een zwakke naald wassen oplosmiddel. In een dergelijk geval, bereiden de wash oplossingen volgens de aanbevelingen van de fabrikant. Bijvoorbeeld, doen de sterke wassen met methanol-water-isopropylic alcohol (70:20:10, v/v/v) en de zwakke wassen met water-methanol (95:5, v/v).
5. instrument Tuning
Opmerking: Deze stap wordt uitgevoerd voor de opzet van de methode op een specifieke massaspectrometer.
- Verdun de analyt keurige 1000 mg/L en de interne standaard oplossingen 1:10 of 1:100 in een mengsel van mobiele fase A en B (50:50, v/v), afhankelijk van de detector signaal intensiteit. Afstemmen van de massaspectrometer met de autotune functie of doen een handmatige afstemming voor de volgende bovenliggende-naar-dochter ionen overgangen14: cefepime (481.0 > 167.0/395.7), cefepime -13C12D3 (485.1 > 167,1 / 400.0), meropenem (384.1 > 114.0/141.0), meropenem-D6 (390.1 > 114.0/147.2), ciprofloxacine (332.0 > 231.0/245.0), ciprofloxacine-D8 (340.1 > 235.1/249.3), moxifloxacin (402.0 > 261.0/383.9), moxifloxacin-13 C,1D3 (406,1 > 265.1/388.0), linezolid (338.0 > 235.0/296.0), linezolid-D3 (341.1 > 235.1/297.1), piperacillin (518.0 > 143.0/358.9), en piperacillin-D5 (523.1 > 142.8/364.1).
- Voor instrumenten met autotuning de functie autotune automatisch aan te passen de spanning en de instellingen van de inlaat van de MS door middel van de detectoren.
- Voor instrumenten met handmatig afstemmen, de instellingen aanpassen (bijvoorbeeld, botsing spanning en botsing energie) tot de optimale (meestal de maximale) wordt signaalsterkte verkregen op de detector voor elke moeder- en dochter-ion. Bijvoorbeeld, sluit een mengen tee, leveren mobiele fase A en B (50:50, v/v) bij 0,5 mL/min, en voortdurend de infusie van de nette antibiotica of interne standaard met een debiet van 0,1 mL/min.
6. HPLC-MS/MS Set-up
Opmerking: Functies van de massa spectrometer, HPLC stelsel (met inbegrip van de autosampler) en de bijbehorende software zijn afhankelijk van de fabrikant. Passen de massaspectrometer parameters en de procedure wassen volgens de aanbevelingen van de fabrikant.
- De massaspectrometer parameters worden opgeslagen in een overeenkomstige 'MS tune bestand '. Electrospray ionisatie in de positieve mode (ESI +) gebruiken voor alle analyten. Passen de ion bron instellingen voor het instrument gebruikt (bijvoorbeeld, een capillaire spanning van 1,5 kV, een bron temperatuur van 120 ° C, de temperatuur van een desolvation van 400 ° C, de gasstroom van een desolvation van 600 L/h, een RF lens spanning van 0,1 V en een Nadruktijd van 80 ms).
- Opgeven van de analyt en de interne standaarden tune parameters (bijvoorbeeld, capillaire spanning, botsing energie) in een 'MS-bestand '.
- Voorwaarden voor de autosampler als volgt in het 'inlaat bestand ': de temperatuur van het monster bij 10 ° C met een limiet van ± 5 ° C; de volgorde van de wassen op 1 x purge-wassen-purge met een 600 µL purge volume vervanging.
- In de bovengenoemde 'inlaat bestand ', stel de stroom stem op 0,4 of 0,5 mL/min, de bewerkingstijd op 4 min, de druk van hoge limiet naar 345 bar, en de kolomtemperatuur tot 30 ° C met een limiet van ± 5 ° C. Toevoegen van de oplosmiddelen naam van mobiele fasen A en B en stel ze op 7% B/93% A, respectievelijk.
- Program van het chromatografische verloop in de 'inlaat bestand ' als volgt: 0,00 – 0.10 min met 7% mobiele fase B/93% A, 0.11 – 0,60 min met 65% mobiele fase B/35% A, 0.61-2.10 min met 95% mobiele fase B/5% A, 2.11-4,00 min met 7% mobiele fase B/93% A.
Opmerking: Berekening van de extra-kolom volume, het volume van de hold-up voor de instrumentale platform, en de analyt retentie factoren zoals beschreven in de USP < 621 > chromatografie richtsnoer16.
7. voorbeeld meting Master bestand
Opmerking: Met de 'monster meting hoofdbestand ', de patiënt monsters zijn opgegeven, de HPLC-MS/MS-analyse wordt gestart en de evaluatie van de gegevens wordt uitgevoerd. Twee aparte sjabloonbestanden, met inbegrip van een paar lage - en hoge-kwaliteit controle worden gegenereerd; een sjabloon bevat QC paar A en C, de andere een QC paar B en D.
- Maak een nieuwe "monster meting hoofdbestand '. Selecteer de bovengenoemde 'MS tune bestand ', 'MS-bestand ', en de 'inlaat bestand' (punt 6), voegt u hen in elke voorbeeldlijn en geeft het geïnjecteerde volume met 15 µL.
- In oplopende volgorde, voeg de "voorbeeldtekst" voor kalibratoren 0 – 7 en kwaliteitscontrole (QC) paar netvoeding of QC paar B/D.
- Geef het type monster. Selecteer het type van de steekproef "norm" voor de kalibratoren en "QC" voor de kwaliteitscontrole paren.
- Geef de concentratie van elke antibiotica stof voor de overeenkomstige kalibratoren en kwaliteitscontroles (Zie het werkblad, concentratie [µg/mL] Cal 7-Cal 0, QC netvoeding of B/D,).
- Programma de 'gegevens evaluatiemethode '. Gebruik de overgangen die werden geoptimaliseerd tijdens het instrument tuning (sectie 5). Overeenkomen met elke antibioticum met de overeenkomstige isotoop-label standaard (b.v., meropenem - meropenem-D6).
8. voorbeeld van de Cleanup and HPLC-MS/MS analyse
Opmerking: Voor elke partij monster een gepaarde kwaliteitscontrole instellen met een lage en hoge antibiotica concentratie (QC netvoeding of QC B/D) is verwerkt en geanalyseerd. Tussen de verschillende partijen, de gepaarde QC-monsters worden gebruikt in een alternatieve volgorde (bijvoorbeeldop dag 1, selecteert u de 'monster meting hoofdbestand ' inclusief QC koppelen netvoeding; op dag 2, selecteer het één inclusief QC paar B/D. De verwerking van de serummonsters wordt geïllustreerd in Figuur 1.
- Voorbereiden van de neerslag agent 10% methyl -tert-butylether in methanol (10:90, v/v) (b.v., prefill een 25 mL maatkolf met 2,5 mL methyl -tert-butylether en vul het tot 25 mL met absolute methanol).
- Plaats de C8 omgekeerde fase in de kolom kamer. Verbinden met het HPCL-samenstelling en massaspectrometer in de richting van de stroom.
- Het genereren van de lijst van het monster. Open de bijbehorende 'monster meting hoofdbestand ' sjabloon en de patiënt monsters bedoeld om te worden verwerkt aan de lijst toe te voegen. Genereren van groepen van maximaal 20 patiënten monsters en hen met de bijbehorende kwaliteitscontrole paar flank.
- NAT-prime de HPCL systeem met behulp van de 'inlaat bestand ' controle software: de "natte prime" functie ingesteld op 50% mobiele fase A/50% B en NAT-prime gedurende 2 minuten met een debiet van 1 mL/min.
- Het vernieuwen van de spuit. Om dit te doen, voert u 6 lijnen van 600 µL in de besturingssoftware.
- De omgekeerde C8-fasekolom equilibreer. Met behulp van de software, inschakelen van de stroom in de 'inlaat bestand ' en spoel het met 7% mobiele fase B/93% A voor een minimum van 5 min, met een debiet van 0,5 mL/min. controleren de kolomtemperatuur van 30 ° C.
- Ontdooi de patiënt monsters, een aliquoot gedeelte van het kalibratoren 0 – 7, en een paar van de kwaliteitscontrole (A / B of C/D).
- Toevoegen repetitieve Pipetteer 25 µL van de interne standaard mix aan de 100 µL kalibrator, QC monster of serum van de patiënt in een 1,5 mL polypropyleen buis, en vortex de buis gedurende een paar seconden.
- Incubeer het mengsel gedurende 5 minuten bij kamertemperatuur op een benchtop shaker (b.v.bij 1.200 rpm).
- Voeg 150 µL van een reagens neerslag aan de monster-interne standaard mix met repetitieve Pipetteer.
- Nogmaals, vortex de buis voor een paar seconden en Incubeer het gedurende 5 minuten bij kamertemperatuur op een benchtop shaker (b.v.bij 1.200 rpm).
- Centrifugeren van de suspensie op 20.000 x g in een tafelblad centrifuge voor 10 min bij 4 ° C.
- Verdun het supernatans 1:3 met HPLC rang water met behulp van een glazen ampul met een micro-insert en laden als verwerkte monsters aan de autosampler.
- De HPLC-MS/MS-analyse handmatig te starten de 'meting controle voorbeeldbestand '.
Opmerking: Voor langdurige opslag, spoel de analytische kolom volgens de aanbevelingen van de fabrikant [bijvoorbeeld0,5 mL/min methanol / water (50:50, v/v)] om te voorkomen dat instorting van de fase.

Figuur 1: schematische weergave van het monster opruimen. Eiwit neerslag op de hoge middelpuntvliedende kracht geeft een dichte pellet en duidelijk supernatant, die u erop wijst dat eiwit neerslag was compleet. De gehele verwerkingstijd is ongeveer 30 minuten, met inbegrip van het opruimen van het monster, de chromatografische scheiding en de MS/MS-analyse. Klik hier voor een grotere versie van dit cijfer.
9. de kwaliteitsbeoordeling en kwantificering
- Voor het verwerken van de monsters, open de bijbehorende 'meting controle voorbeeldbestand ', de kalibratoren, kwaliteitscontroles en patiënt monsters selecteren en evalueren met de 'antibiotica kwantificering methode '.
- Controleer of de toppen voor een specifieke analyt naar behoren zijn geïntegreerd. Controleer de pieken voor elke kalibrator, QC, en de patiënt monster, en handmatig te herintegreren op de basislijn indien nodig.
- Studie van de kalibratiekromme en nagaan of het de volgende kwaliteitscriteria voldoet: a) de lineariteit over het gehele kalibratietraject, b) een kalibratie coëfficiënt r2 > 0.995, c) de afwijking van elke ijkstandaard binnen ± 15% van de nominale waarde, met uitzondering van de ondergrens van kwantificering (Ondergrens), waar ± 20% vereist is.
- Het verwerpen van een ijkstandaard niet aan de bovengenoemde criteria voldoen en de kalibratiekromme, met inbegrip van de regressie-analyse opnieuw te evalueren.
- De kwaliteitscontroles bestuderen en nagaan of de afwijkingen binnen ± 15% van de nominale waarde zijn.
- Als de concentratie van een patiënt monster groter is dan de concentratie van de hoogste kalibrator, Verdun met gedestilleerd water, maximaal tot 1:5 (bijvoorbeeld, 100 µL van de serum plus 400 µL van gedistilleerd water) voor het opruimen van de steekproef. Reperform stappen 8,8-8.14 voor dat specifieke monster en het opnieuw verwerken.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Met behulp van de beschreven protocol, is een typische chromatogram afgebeeld in Figuur 2. Volgens de Amerikaanse Farmacopee (USP) chromatografie richtsnoeren16, werd het dode volume van de kolom in het huidige systeem bepaald met ~0.22 mL en het volume van de extra-kolom (met inbegrip van de injector, leidingen en aansluitingen) met ~0.08 mL, geven een hold-up volume van ~0.30 mL. De berekende retentie factoren voor alle analyten waren 2.8 (voor cefepime) - 4.2 (voor piperacillin).
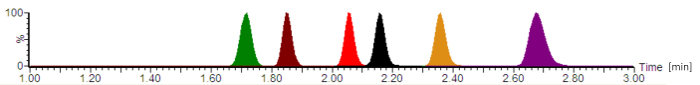
Figuur 2: typische analytische chromatografische met genormaliseerde signaal intensiteiten. De antibiotica zijn eluerende in de volgende volgorde: cefepime (groen), meropenem (bruin), ciprofloxacine (rood), moxifloxacin (zwart), linezolid (oranje), en piperacillin (paars). De retentietijden, die zijn gegeven in minuten en de analyt piek symmetrieën variëren, afhankelijk van de exacte samenstelling van de mobiele fasen, het debiet, de buis van chromatografie en de analytische kolom leeftijd. Klik hier voor een grotere versie van dit cijfer.
Figuur 3A bevat een lijst van de grafiek van monster voor de verwerkte monsters, met inbegrip van de kalibratoren 0 - 7 ("Kalibrator 0" - "Kalibrator 7"), kwaliteitscontroles, en geduldige sera, die worden aangeduid met het nummer van de injectie (#); de voorbeeldtekst voor identificatie (Voorbeeldtekst); de gemeten concentratie in mg/liter (Conc.); het type van de monster dat is een lege, standaard, kwaliteitscontrole, of een patiënt monster (Type); de nominale concentratie van de kalibratoren in mg/liter (Std. Conc); de analytische retentietijd (RT); het antwoord dat is de verhouding van de ruimte van de piek van de analyt/piekoppervlakte IS (reactie); de afwijking van de waarde van de nominale concentratie (% Dev); de positie van flesje (Vial); en de Acquisitietijd (Acq.Time). De belangrijkste parameter die wordt gebruikt voor de kwantificering is het antwoord, geleidelijk met de concentratie van de analyt, vanwege de constante hoeveelheid toegevoegde isotoop gelabelde interne standaard.
Figuur 3B toont de kalibratiekromme. Regressie moet de variatiecoëfficiënt voor bepaling r2 > 0.995. Het volgende model van de kalibratie wordt gebruikt voor alle analyten beschreven in deze methode: kromme type = linear; oorsprong = begrepen; weging = 1 / x; as transformatie = geen. In het gegeven voorbeeld, de kalibratiekromme en de kwaliteitscontroles voldoen aan alle kwaliteitscriteria: r2 > 0.995 voor de kalibratiekromme en de afwijking van de kalibratoren (met inbegrip van de Ondergrens) en de QC-monsters is binnen ± 15% van de nominale waarde.
De overgangen gemeten bovenliggende-naar-dochter ion (MRM) zijn afgebeeld in Figuur 3 c, vier pieken tonen tegelijkertijd de retentie: de twee bovenste bergtoppen verbeelden twee overgangen die zijn gemeten voor de analyt van belang, de onderste twee bergtoppen vertegenwoordigen de overgangen voor de overeenkomstige isotoop gelabelde interne standaard. Voor de kwaliteitsbeoordeling, zijn de pieken van de analyt in de respectieve retentie tijd windows visueel gecontroleerd en handmatig herintegratie op de basislijn, wanneer dat nodig is.
De minimaal remmende concentratie (MIC) is het centrale onderdeel van de antimicrobiële TDM, definiëren de farmacokinetische blootstelling die vereist is voor het bereiken van een doel farmacodynamische/farmacokinetische (PK/KD) verhouding13,17. Bijgevolg zijn de streefwaarden voor concentratie van antibiotica TDM uitgedruct in verhouding tot de microfoon van de causatieve pathogenen. Gezien het feit dat het optreden van de bèta-lactam antibiotica afhankelijk van de tijd is, hun werkzaamheid wordt gemaximaliseerd door de verwezenlijking van de therapeutische concentraties die hoger zijn dan de MIC-4 x 5 x (fT > 4-5 x MIC). Wanneer geconfronteerd met onbekende infectieziekten pathogenen, daarom het doelbereik van de trog concentratie van vrij (ongebonden-eiwit) piperacillin 64 mg/L, overeenkomt met ongeveer 90 mg/L totale piperacillin18.
De eerste patiënt (voorbeeld #11) heeft een bevredigende hoog serum trog niveau van 83.4 mg/L piperacillin dat ook voldoende is voor probleem ziekteverwekkers, zoals Pseudomonas aeruginosa. De tweede patiënt (voorbeeld #12) heeft een concentratie van ongeveer 0,2 mg/L, hetgeen lager dan de laagste kalibrator (Ondergrens is). Misschien de patiënt is hersteld, en het beheer van piperacillin werd gestaakt. Het resultaat "< 0,5 mg / L" is, dus in het ziekenhuis informatiesysteem gemeld. De derde patiënt (voorbeeld #13) heeft een lage piperacillin trog concentratie van alleen 5.3 mg/L dat is niet voldoende voor de duidelijke meerderheid van ziekteverwekkers. Voor effectieve antimicrobiële chemotherapie, moet de dosering worden verhoogd door de arts.
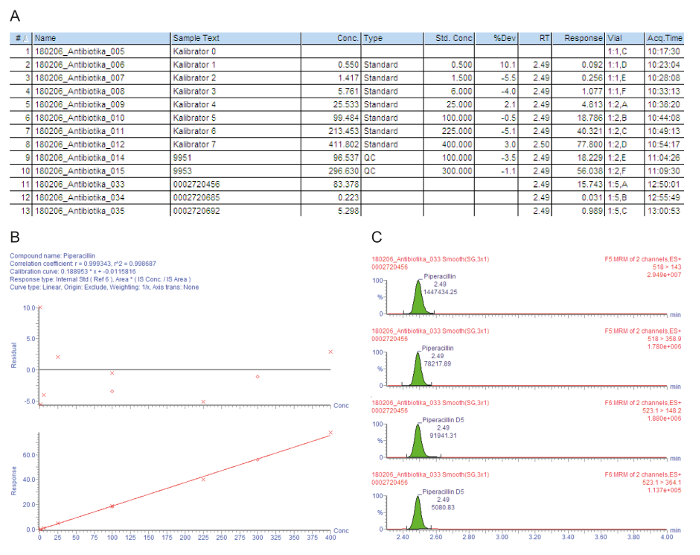
Figuur 3: beoordeling van de voorbeeldige kwaliteit en kwantificering van de analyt piperacillin. Deze panelen vertegenwoordigen de massaspectrometrie data-analyse. (A) dit paneel toont de lijst van de steekproef, met inbegrip van de kalibratoren (standaard, monsters #1 - #8), de kwaliteitscontrole (QC, monsters #9 en #10), en de patiënt sera (monsters #11 - #13). Kalibrator 0 verwijst naar de blanco zonder analyt, maar met de toevoeging van een interne standaard. 9951 vertegenwoordigt QC B, 9953 vertegenwoordigt QC D. (B) dit paneel toont de kalibratiekromme voor piperacillin. Het percentage afwijkingen van de nominale kalibrator concentraties worden gegeven in de bovenste grafiek (y-as: residuele), de onderste grafiek toont de lineaire kalibratietraject. (C) dit paneel toont de meerdere reactietijd toezicht (MRM) voor piperacillin en de corresponderende interne standaard piperacillin-D5 voor patiënt serummonster #12. Twee bovenliggende-naar-dochter ion overgangen worden gepresenteerd met hun retentietijd en de respectieve signaal intensiteit. Klik hier voor een grotere versie van dit cijfer.
Aanvullende bestand. Klik hier om dit bestand te downloaden.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In dit manuscript, rapporteren we het protocol voor een eenvoudige en robuuste tandem massa spectrometrie gebaseerde methode voor de kwantificering van vaak gebruikte antibiotica in ICU19, namelijk cefepime, meropenem, ciprofloxacine, moxifloxacin, linezolid, en piperacillin14. Een werkblad begeleidt het manuscript voor de bereiding van antibiotica stamoplossingen, kalibratoren en kwaliteitscontroles, rekening houdend met de zuiverheid van de antibiotica en het molecuulgewicht van hun counterions. Gezien het feit dat de concentraties van de antibiotica vrij hoog zijn, moet hun kwantificering geen bijzondere uitdaging vanuit een analytisch perspectief. Daarom zijn wij ervan overtuigd dat dit protocol is van toepassing op verschillende MS instrumentale platformen. Voor de overdracht van een methode, gebruikers worden aangemoedigd om te kwantificeren van het volume van de extra-kolom en hold-up volume van hun chromatografische systeem en aan te passen van de kleurovergang start tijd dienovereenkomstig16. Tijdens de opbouw van de methode, het systeem moet ook worden geëvalueerd voor de overdracht en, indien nodig, een blancomonster moet worden geïnjecteerd na de hoogste kalibrator en patiënt monsters met hoge concentraties van antibiotica. Gebruikers moeten ook overwegen van detector verzadiging die optreedt wanneer te veel ionen een massaspectrometer tandem invoert. Relevante detector verzadiging kan worden geëlimineerd met een kleinere omvang van de injectie, een hogere verdunning van de analyt tijdens het opruimen van het monster, en/of een verstemming van een doelanalyt (bijvoorbeelddowngraden van de optimale spanning instellingen).
In tegenstelling tot andere methoden kunt het kalibratietraject beide een kwantificering van concentraties dicht bij de microfoon van voor de ziekte vatbare ziekteverwekkers, evenals piekconcentraties (cmax) die worden verkregen met een bolus toediening. De hoogste Cmax-waarden voor volwassenen worden gemeld in de overeenkomstige informatie voor professionals-bladen op de FDA drug databank als volgt: 163.9 mg/L voor cefepime20, 112 mg/L voor meropenem21, 4,6 mg/L voor ciprofloxacine22 , 4.1 mg/L voor moxifloxacin23, 21.2 mg/L voor linezolid24en 298 mg/L voor piperacillin25. Een dosisaanpassing tot de gevoeligheid van de betrokken ziekteverwekkers antibioticum concentratie toezicht in omloop van het bloed van de patiënt staat, maar ook de farmacokinetische gebied onder de curve verkregen kan worden door meerdere bloedmonsters met de gegeven Protocol.
Veel antibiotica (vooral bèta-lactam-antibioticum meropenem) zijn chemisch onstabiele eens ontbonden. De meest kritische stap in dit protocol is, daarom, de voorbereiding van de stamoplossingen, kalibratoren en kwaliteitscontroles onder koude omstandigheden26,27. In dat opzicht is het ook essentieel om te bevriezen patiënt monsters zo spoedig mogelijk. Hoewel serum opslag bij-80 ° C wordt aanbevolen26, onze stabiliteit experimenten tonen aan dat de monsters ook kan maximaal 3 dagen opgeslagen bij-20 ° C zonder een significante daling van antibiotica concentraties (zelfs op de trog niveaus).
Het is raadzaam voor het uitvoeren van een geschiktheidstest systeem vóór elke analyse van de HPLC-MS/MS patiënt monsters (bijvmet kalibrator 3). In het algemeen wordt een geschiktheidstest systeem gebruikt om te controleren of de herhaalbaarheid van de LC-MS/MS-systeem en om te zien of het ook geschikt voor de analyse worden gedaan. Dus, bijvoorbeeld, afnemende signaal intensiteit worden veroorzaakt door een besmetting van de MS sweep kegel, waarvoor, vervolgens het schoonmaken met een oplosmiddel. Om de MS-bron schoon te houden, kan een klep Doorschakelen na de chromatografie kolom, regie "analyt-free" gedeelten van de mobiele fase om de afvalstoffen voordat ze de massaspectrometer bereiken worden ingevoerd. Aan de andere kant, kan een totale stijging van de druk duiden op kolom na verloop van tijd verstopt. Om de kolom is levensduur gebruik van een rendabele precolumn filter aan te bevelen. Als de druk nog steeds een probleem, kan een debiet van 0.4 mL/min ook worden gebruikt met het chromatografische verloop in dit protocol.
Een kleine beperking van deze techniek is dat het drie aparte handmatige stappen vereist voor monster-opschonen, wat resulteert in een totale doorlooptijd van ongeveer 30 min. de isotoop gelabelde interne standaarden toe te voegen aan de agent van de neerslag kan besparen sommige verwerkingstijd. Echter, dit alleen gedaan moet worden voor hoge bemonsteringsfrequenties van de doorvoer en met de neerslag agent worden opgeslagen in de kou (bvbij-20 ° C), als de interne standaarden ook degraderen in vitro bij verhoogde temperaturen.
De beschreven protocol heeft ontwikkeld voor verwerking in polypropyleen tubes standaard 1,5 mL monster. Een hogere doorvoersnelheid voor moet worden antibiotica TDM, kan de procedure worden opgewaardeerd tot de multi goed plaat-formaat met behulp van adequate centrifuge inzetstukken of filter platen met een vacuüm variëteit.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
De auteurs Dr. Schütze bedanken voor zijn hulp met de oprichting van de onderhavige methode en Dr. Zoller voor de waardevolle inbreng met betrekking tot de juiste kalibratietraject. De auteurs erkennen ook de technische staf van de Spectrometrie van de massa-faciliteit.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



