Summary
Hier präsentieren wir ein Tandem Massenspektrometrie-basierte Protokoll für die Quantifizierung von häufig verwendeten Antibiotika auf Intensivstationen, nämlich Hemmhof, Meropenem, Ciprofloxacin, Moxifloxacin, Linezolid und Piperacillin.
Abstract
Es gibt eine steigende Nachfrage für das therapeutisches Drug monitoring von Antibiotika in vielen klinischen Einrichtungen, insbesondere im Hinblick auf die Umsetzung des Krankenhaus Antibiotika Stewardship-Programme.
Bei den laufenden Arbeiten präsentieren wir ein Multiplex-leistungsstarke flüssige Chromatographie-Tandem-Massenspektrometrie (HPLC-MS/MS)-Protokoll für die Quantifizierung der Hemmhof, Meropenem, Ciprofloxacin, Moxifloxacin, Linezolid und Piperacillin, häufig verwendet Antibiotika auf Intensivstationen. Die Methode wurde bereits umfassend nach der Richtlinie der Europäischen Arzneimittel-Agentur überprüft.
Nach einer rasanten Probe Bereinigung Analyten getrennt auf einem C8-Reverse-Phase-HPLC-Säule innerhalb von 4 Minuten und mit der entsprechenden stabilen Isotopen-Label internen Standards in der Elektrospray-Ionisation (ESI +) Massenspektrometrie in mehreren Reaktion quantifiziert Zeit mit der Überwachung (MRM). Die vorgestellte Methode verwendet eine einfache Instrumentierung mit einheitlicher chromatographische Bedingungen einstellen, so dass für das tägliche und robuste Antibiotika therapeutisches Medikament monitoring in klinischen Labors. Die Eichkurve erstreckt sich über die pharmakokinetischen Konzentrationsbereich, damit einschließlich Antibiotika Beträge in der Nähe der minimalen inhibitorischen Konzentration (MIC) der Bakterien anfällig und Konzentrationen (Cmax), die mit Bolus abgerufen werden Verwaltung-Schemata. Ohne die Notwendigkeit der Serum-Verdünnung vor der Probe-Bereinigung erhalten Sie durch mehrere Messungen der Fläche unter der Kurve für ein Antibiotikum verabreicht.
Introduction
Obwohl Antibiotika die medizinische Praxis revolutioniert haben, bleiben schwere bakterielle Infektionen eine der Hauptursachen für Morbidität und Mortalität bei kritischen Krankheiten1. In diesem Zusammenhang ist die schnelle Verwaltung der einen passenden Antiinfektiva in ein ausreichender Dosierung von größter Bedeutung für Disease Control2.
Eine wachsende Zahl von beweisen zeigt, dass die empirische Behandlung mit Breitbandantibiotika mit der Komplexität der Patientenpopulationen zunehmend problematisch wird. Dies gilt insbesondere für die Intensivstation (ICU), wo eine große interindividuelle Variabilität der Schlüsselparameter pharmakokinetischen (PK) häufig beobachtet wird,3,4. Dementsprechend sind Intensivpatienten drohende Gefahr Sub therapeutischen Spiegel mit der Gefahr einer unzureichenden Therapieerfolg5,6. Dann wieder sind Patienten unnötig zu hohe antibiotische Konzentrationen ausgesetzt, die zu schwerwiegenden unerwünschten Ereignisse mit keine klinischen Vorteile7führen kann. Die Antibiotika Missbrauch und die unzureichende Dosierung haben auch die Verbreitung von Antibiotika-Resistenzen, angeheizt werdenden eine wachsende Bedrohung für die öffentliche Gesundheit8.
Um den Einsatz von Antibiotika zu verbessern und ihre Effectivenessas zu bewahren hat lange wie möglich, der World Health Organization einen globalen Aktionsplan zur Antibiotikaresistenz in 20159ins Leben gerufen. Antibiotikum Stewardship-Programme sind einen wesentlichen Eckpfeiler des umsichtigen antimikrobielle Einsatz in national Public Health Strategien10helfen Kliniker, die Qualität der Patientenversorgung11 und zur gleichen Zeit erheblich zu verbessern Reduktion der Antibiotika-Resistenz-12. Antimikrobiellen Dosierung bei einzelnen Patienten durch die Anwendung von therapeutischen Drug monitoring (TDM) ist ein zentrales Instrument in diesem Zusammenhang13.
Bis heute im Handel erhältlichen TDM sind Tests nur für Glycopeptide Antibiotika und Aminoglykoside. Die Quantifizierung von Substanzen aus anderen Klassen erfordert häufig eine Hausmethode Entwicklung oder Validierung, die umständlich sein kann. Daher präsentieren wir, im Detail das Protokoll für eine robuste Massenspektrometrie-basierte Test, die für die Quantifizierung der wichtigsten Antibiotika auf der Intensivstation innerhalb ihrer klinischen relevanten Konzentration reicht14verwendet werden kann. Die Methode wurde vor kurzem in unserem Massenspektrometrie gegründet und gilt seitdem für die Routine TDM auf der Intensivstation. Das Verfahren nutzt eine unkomplizierte und einfache analytische Einstellung mit einem einheitlichen Muster-Bereinigung, ermöglicht die schnelle Umsetzung von Antibiotika TDM in vielen Einrichtungen mit Massenspektrometrie-Funktionen.
Das hier beschriebene Protokoll wurde optimiert für die Quantifizierung der Hemmhof, Meropenem, Ciprofloxacin, Moxifloxacin, Linezolid und Piperacillin in humanem Serum mit Isotop Verdünnung Flüssigchromatographie (LC) in Kombination mit einem Tandem Mass Massenspektrometrie (MS/MS). Für das Isotop Verdünnung LC-MS/MS-Methode sind stabile Isotopen-markierte Verbindungen auf eine Stichprobe von Interesse mit einer bestimmten Matrix (z.B. Serum) hinzugefügt. Isotopen-markierte Normen können von ihren unbeschriftete Gegenstück, nämlich der Analyten von Interesse, durch verschiedene Molekulargewichte natürliches Molekül und deren Fragmentierung Produkte, bezeichnet einen übergeordneten Ion, Tochter Ion Übergang unterschieden werden. Isotopen-markierte Verbindungen eine fast identische insgesamt physikalisch-chemischen Verhalten im Vergleich zu ihren unbeschriftete Gegenstück haben, sind sie ideale interne Standards für MS/MS, ermöglicht eine nahezu Matrix-unabhängige Analyten Quantifizierung mit einem hohen Maß an Genauigkeit-15. Heutzutage sind viele stabile Isotopen-Label interne Standards, die für die kleinen-Molekül Quantifizierung, einschließlich der TDM von Antibiotika, einsetzbar im Handel erhältlich.
Die chromatographische Trennung der Antibiotika Analyten in der beschriebenen Protokoll erfolgt mit einem C8 Alkyl-Kettenlänge Reverse-Phase Trennsäule (100 mm x 2,1 mm, 3 µm-Partikelgröße). Während der Methodenentwicklung war der interne standard normalisierten Matrix Faktoren für alle Analyte 94,6 % bis 105,4 %, mit einem Variationskoeffizienten von ≤8.3 %14.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Hinweis: Es wird empfohlen, in einer Dampfhaube zu arbeiten, beim Umgang mit organischen Lösungsmitteln wie Methanol. Alle Puffer und mobilen Phasen in volumetrischen Fläschchen vorzubereiten. Wenn nicht anders angegeben, können die Lösungen für bis zu 1 Monat nach der Zubereitung bei Zimmertemperatur gespeichert werden.
1. Vorbereitung der Kalibratoren und Qualitätskontrolle Proben
Hinweis: Eine entsprechende Analyse-Datenblatt für die Zubereitung von Lager und Spike-Lösungen ist die Zusätzliche Dateientnehmen. Fügen Sie aus Gründen der Rückverfolgbarkeit Hersteller, Katalog-Nummer und eine Losnummer jedes Antibiotikum in den entsprechenden Spalten ein. Lösen Sie alle Antibiotika im Kühlraum bei 4 ° C und halten Sie die Arbeitszeit so kurz wie möglich zu.
- 100 mL 25 % Methanol in Wasser vorbereiten: Vorausfüllen eine Volumetrische 100 mL-Flasche mit 25 mL absolute Methanol und bis zu 100 mL mit destilliertem Wasser füllen.
- 10 mL 200 mM Essigsäure in Wasser vorbereiten: Vorausfüllen eine Volumetrische 10 mL-Fläschchen mit 9 mL HPLC Grade Wasser, 115 µL Eisessig (99,5 % Reinheit, 17,4 M) hinzufügen und fügen Sie destilliertes Wasser bis zu 10 mL.
- 25 mL 25 % Methanol in Wasser mit 20 mM Essigsäure vorbereiten: Vorausfüllen eine Volumetrische 25 mL-Fläschchen mit 2,5 mL der wässrigen 200 mM-Essigsäure-Lösung, 6,25 mL absolute Methanol hinzugeben und die Flasche 25 ml mit destilliertem Wasser auffüllen.
- Verwenden Sie eine Präzisionswaage, um die richtigen Mengen an Antibiotika in 15 mL konische Röhrchen zu wiegen, wie beschrieben in die Zusätzliche Datei in der Spalte Ausgangsgewicht.
- Bereiten Sie Stammlösungen der Fluorchinolone Ciprofloxacin und Moxifloxacin in 25 % Methanol-Wasser einschließlich 20 mM Essigsäure. Um dies zu tun, fügen Sie das entsprechende Volumen die gewichteten Mengen wie in die Zusätzliche Datei in der Spalte "letzte Band" beschrieben hinzu. Schnell lösen sich die Fluorchinolon-Antibiotika in einem Ultraschallbad für 2 min und durch intensive aufschütteln.
- Stammlösungen Hemmhof, Meropenem, Linezolid und Piperacillin in 25 % Methanol-Wasser vorzubereiten. Um dies zu tun, die gewichteten Mengen fügen Sie das entsprechende Volumen hinzu, wie in der Ergänzenden Datei in der Spalte Endvolumen beschrieben und lösen Sie schnell der Antibiotika durch intensive aufschütteln auf. Meropenem wie der letzte Stoff auflösen.
- Kombinieren Sie die Stammlösungen aller Antibiotika, wie beschrieben in das entsprechende Volumen der Stammlösung Diagramm in die Zusätzliche Datei um das Zehnfache konzentrierten Spike-Lösungen liefern.
- Neun Bände der drogenfreien Serum mit einem Volumen von verzehnfacht konzentrierte Spike-Lösungen zu den Serum-Kalibratoren 0 – 7 Spike und Qualität kontrolliert (QC) A – D. Zum Beispiel 4,5 mL Serum in einem 10-mL-Polypropylen-Rohr 0,5 mL Spike-Lösung hinzu und 15 min im Kühlraum bei 4 ° C auf einem Roller-Mixer bei 50 u/min inkubieren.
- Verwenden Sie eine sich wiederholende Pipette 100 µL-Aliquots der Kalibratoren und QCs in 1,5 mL Polypropylenröhrchen zu generieren.
- Die Kalibratoren, Qualitätskontrollen und antibiotische Stammlösungen bei-80 ° C bis zu sechs Monate lang zu speichern.
- Bereiten Sie für jedes Antibiotikum auch eine saubere Lösung mit 1.000 mg/L ein einziges Antibiotikum. Verdünnen Sie die entsprechenden Stammlösung mit einem geeigneten Verdünnungsmittel (z.B.für Ciprofloxacin, mit 25 % Methanol-Wasser einschließlich 20 mM-Essigsäure).
Hinweis: Die ordentlichen antibiotischen Lösungen sind erforderlich für das Instrument Stimmen nur.
2. Vorbereitung des internen Standards-Mix
Hinweis: Interne Standards sind Isotopen-Label Gegenstücke der Analyten von Interesse, die eine Probe während der Probe Bereinigung hinzugefügt werden. Wie die internen Standards fast identische insgesamt physikalisch-chemischen Eigenschaften unbeschriftete Pendants haben, kompensieren sie die Matrix-Effekte einer bestimmten Probe.
- Bereiten Sie 10 mL 50 % Methanol in Wasser durch Zugabe von 5 mL absolute Methanol, ein 10 mL-Fläschchen schütteln und füllen Sie bis zu 10 mL mit destilliertem Wasser.
- Bereiten Sie 10 mL 50 % Methanol in Wasser einschließlich 20 mM Essigsäure vor. Um dies zu tun, eine 10 mL Flasche 1 mL Essigsäure 200 mM hinzu, fügen Sie 5 mL absolute Methanol, und füllen Sie bis zu 10 mL mit destilliertem Wasser.
- Generieren Sie Stammlösungen von internen Standards (IS) mit 1.000 mg/L direkt in die Fläschchen des Herstellers. Lösen Sie Hemmhof -13C12D3 Sulfat in destilliertem Wasser, Meropenem-D6, Linezolid-D3und Piperacillin-D5 in einer 50 % Methanol-Wasser-Lösung. Ciprofloxacin-D8 in 50 % Methanol-Wasser mit 20 mM Acetat und Moxifloxacin Hydrochlorid -13C1D3 in destilliertem Wasser mit 20 mM Acetat auflösen.
- Kombinieren Sie die IS Stammlösungen in einem 1,5 mL Polypropylen-Rohr um eine fünffache konzentrierten internen standard Mischung zu erzielen. Fügen Sie 10 µL Hemmhof -13C12D3, 10 µL von Meropenem-D6, 1 µL von Ciprofloxacin-D8, 2 µL von Moxifloxacin-Hydrochlorid -13C1D3, 2 µL Linezolid-D 3, und 10 µL Piperacillin-D5 bis 965 µL 25 % Methanol-Wasser.
- Speichern der interne standard Stammlösungen und die fünffache konzentrierte IS Mischung bei-80 ° C.
(3) Patientenprobe Lagerung
Hinweis: Stellen Sie sicher, dass das Serum so schnell wie möglich erreicht wird und dass die Kühlkette von gefrorenen Proben erhalten bleibt.
- Sammeln Sie das ganze Blut in das Serum Röhrchen.
- Lassen Sie das Blutgerinnsel für 20-30 min bei Raumtemperatur.
- Trennen Sie das Serum aus dem Blut durch Zentrifugation bei 2.000 X g für 10 min.
- Übertragen Sie den überstand auf ein sauberes Polypropylen Rohr.
- Bis es untersucht, ist speichern Sie das Serum bis zu sechs Monate bei-80 ° C. Alternativ können speichern Sie die Proben bis zu 3 Tage bei-20 ° c
(4) Puffer-Vorbereitung für die Chromatographie
- Zur Vorbereitung 1 M Ammonium-Formiat im Wasser lösen Sie 6,306 g von Ammonium-Formiat in 100 mL HPLC Grade Wasser über ein 100 mL-Fläschchen schütteln auf. Die Lösung bis zu 1 Monat bei 4 ° c zu speichern
- Bereiten Sie die Mobile phase [10 mM Ammonium-Formiat im Wasser-Ameisensäure (99.9:0.1 V/V)]. Vorausfüllen Sie eine Volumetrische 1.000 mL-Flasche mit ca. 500 mL HPLC Grade Wasser, fügen Sie 1 mL Ameisensäure und 10 mL der Lösung 1 M Ammonium-Formiat und bis 1.000 mL mit HPLC Grade Wasser füllen. Übertragen Sie mobile Phase A zu, um eine saubere Glasflasche und verbinden Sie es mit der HPLC-Anlage. Lagern Sie die mobile Phase ein bis zu 2 Wochen bei Zimmertemperatur.
- Bereiten Sie die mobile Phase B. Transfer HPLC-Klasse absolute Methanol in eine saubere Flasche und verbinden Sie es mit der HPLC-Anlage.
- Absolute Methanol zu verwenden, da die Nadel Lösungsmittel waschen und schließen Sie die entsprechenden Schlauch an die Glasflasche mit mobilen Phase B.
- Generieren Sie die Dichtung und eine Säuberung das Lösungsmittel Methanol-Wasser-Ameisensäure (7:92.9:0.1, V/V/V). Vorausfüllen Sie eine Volumetrische 1.000 mL-Flasche mit ca. 500 mL destilliertem Wasser, fügen Sie 70 mL absolute Methanol, Ameisensäure, 1 mL und 1.000 mL fügen Sie destilliertem Wasser hinzu. Übertragen Sie das Lösungsmittel auf eine saubere Glasflasche und verbinden Sie es mit der HPLC-Anlage.
Hinweis: Verschiedene Autosampler Systeme verwenden eine starke und eine schwache Nadel Waschlösung. Bereiten Sie in einem solchen Fall die Waschlösungen gemäß den Empfehlungen des Herstellers. Zum Beispiel Waschen der starken waschen mit Alkohol Methanol-Wasser-Isopropylic (70:20:10, V/V/V) und die schwachen mit Wasser-Methanol (95:5, V/V).
(5) Instrument Tuning
Hinweis: Dieser Schritt ist für den Aufbau der Methode auf einen bestimmten Massen-Spektrometer durchgeführt.
- Verdünnen Sie ordentlich 1.000 mg/L Analyten und der interne standard-Lösungen 01:10 oder 1: 100 in einer Mischung aus mobilen Phase A und B (50: 50, V/V), abhängig von der Detektor Signalintensitäten. Tune das Massenspektrometer mit der Autotune-Funktion oder machen eine manuelle Abstimmung für die folgenden übergeordneten-Tochter Ionen Übergänge14: Hemmhof (481.0 > 167.0/395.7), Hemmhof -13C12D3 (485.1 > 167.1 / 400,0), Meropenem (384,1 > 114.0/141.0), Meropenem-D6 (390.1 > 114.0/147.2), Ciprofloxacin (332.0 > 231.0/245.0), Ciprofloxacin-D8 (340.1 > 235.1/249.3), Moxifloxacin (402.0 > 261.0/383.9), Moxifloxacin-13 C1D3 (406,1 > 265.1/388.0), Linezolid (338.0 > 235.0/296.0), Linezolid-D3 (341,1 > 235.1/297.1), Piperacillin (518.0 > 143.0/358.9), und Piperacillin-D5 (523.1 > 142.8/364.1).
- Verwenden Sie für Instrumente mit Autotuning die Autotune-Funktion zur automatischen Anpassung der Spannung und Einstellungen von MS-Einlass durch die Detektoren.
- Für Instrumente mit Handabstimmung, passen Sie die Einstellungen (z.B., Kollision Spannung und Aufprallenergie) bis das Optimum (in der Regel das Maximum) wird am Detektor für jedes Elternteil und Tochter Ion Signalintensität gewonnen. Zum Beispiel schließen ein Mischpult t-Stück, liefern mobile Phase A und B (50: 50, V/V) mit 0,5 mL/min und kontinuierlich ziehen ordentlichen Antibiotika oder internen Standard mit einer Flussrate von 0,1 mL/min.
(6) HPLC-MS/MS-Set-up
Hinweis: Verfügt das Massenspektrometer, HPLC-System (einschließlich des Autosamplers) und die entsprechende Software richten sich nach der Hersteller. Passen Sie die Massen-Spektrometer-Parameter und das Waschen-Verfahren gemäß den Empfehlungen des Herstellers.
- Speichern Sie die Massen-Spektrometer-Parameter in ein entsprechendes "MS tune Datei '. Verwenden Sie Elektrospray-Ionisation im positiven Modus (ESI +) für alle Analyte. Passen Sie die Ionen-Quelle-Einstellungen für das Gerät verwendet (z.B., eine Kapillare Spannung von 1,5 kV, einer Quelltemperatur von 120 ° C, einer zugeführten Temperatur von 400 ° C, einer zugeführten Gas-Durchfluss von 600 L/h, ein RF Objektiv Spannung von 0,1 V und eine Verweilzeit von 80 ms).
- Geben Sie den Analyten und internen Standards tune Parameter (z.B., Kapillare Spannung, Aufprallenergie) in eine "MS Datei '.
- Die Bedingungen festlegen, Autosampler wie folgt in die "Einlass-Datei": die Temperatur der Probe bei 10 ° C mit einem Limit von ± 5 ° C; Waschen-Sequenz bei 1 X Aufräum-waschen-Säuberung mit 600 µL purge Volume Ersatz.
- In den oben erwähnten "Einlass-Datei", Set der Durchfluss um 0,4 bzw. 0,5 mL/min, die Laufzeit auf 4 min, hohe Druckgrenze bis 345 Bar, und die Spalte Temperatur auf 30 ° C mit einem Limit von ± 5 ° C. Hinzufügen der Lösungsmittel Name des mobilen Phasen A und B und sie bis 7 % B/93% A "bzw." festgelegt.
- Programmieren der chromatographischen Gradient in der "Einlass-Datei" wie folgt: 0.00 – 0,10 min mit 7 % mobilen Phase B/93% A, 0,11 – 0,60 min mit 65 % mobilen Phase B/35% A, 0,61-2.10 min mit 95 % mobilen Phase B/5% A, 2.11 – 4.00 min mit 7 % mobilen Phase B/93% A.
Hinweis: Berechnen Sie die Spalte Extra Volumen, halterlosen Volumen für die instrumentale Plattform und die Analyten Aufbewahrung Faktoren wie in der USP < 621 > Chromatographie Leitlinie16beschrieben.
7. Probe Messung Masterdatei
Hinweis: Mit der "Probe-Messung-master-Datei", der Patientenproben werden angegeben, die HPLC-MS/MS-Analyse wird gestartet, und die Datenauswertung erfolgt. Zwei separate Template-Dateien, darunter ein paar - und hochwertige Steuerung entstehen; eine Vorlage enthält QC paar A und C, der andere ein QC paar B und D.
- Erstellen Sie eine neue "Probe-Messung-master-Datei". Wählen Sie die oben genannten "MS tune Datei", "MS-Datei", und 'Einlass File' (siehe Abschnitt 6), fügen Sie sie in jeder Probe-Zeile, und geben Sie das Injektionsvolumen mit 15 µL.
- Fügen Sie in aufsteigender Reihenfolge hinzu "Beispieltext" für Kalibratoren 0 – 7 und Qualitätskontrolle (QC) Paar a/c oder QC paar b/d.
- Geben Sie die Probe. Wählen Sie die Probe "Standard" für die Kalibratoren und "QC" für die Qualitätskontrolle-Paare.
- Geben Sie die Konzentration der einzelnen antibiotische Substanz für die entsprechenden Kalibratoren und Qualitätskontrollen (siehe Tabelle, Konzentration [µg/mL] Cal 7 – Cal 0 QC a/c oder b/d,).
- Programm der "Data-Bewertung-Methode". Verwenden Sie die Übergänge, die optimiert wurden, während das Instrument tuning (Abschnitt 5). Jedes Antibiotikum mit dem entsprechenden Isotopen-Label Standard (z.B. Meropenem - Meropenem-D6) entsprechen.
(8) probieren Sie bereinigen und HPLC-MS/MS-Analyse
Hinweis: Für jede Probe Charge ist eine gekoppelte Qualitätskontrolle setzen mit einer niedrigen und hohen Antibiotika-Konzentration (QC a/c oder QC b/d) verarbeitet und analysiert. Zwischen verschiedenen Chargen der gekoppelten QC Proben werden in einer anderen Sequenz verwendet (z.B.an Tag 1, wählen Sie die "Probe-Messung-master-Datei" einschließlich QC koppeln a/c, am Tag 2, wählen Sie ein einschließlich QC paar b/d. Die Verarbeitung der Serumproben ist in Abbildung 1dargestellt.
- Vorbereiten des fällungsmittels 10 % Methyl -Tert-Butyl-Äther in Methanol (10: 90, V/V) (z.B., vorkonfigurieren einen 25-mL-volumetrischen Kolben mit 2,5 mL Methyl -Tert-Butyl-Äther und füllen Sie ihn bis 25 mL mit absoluten Methanol).
- Ort der C8 umgekehrter Phase in die Spalte-Kammer. Verbinden Sie es mit der HPLC und Massenspektrometer in die Richtung der Strömung.
- Die Liste mit den zu generieren. Öffnen Sie die entsprechende "Probe-Messung-master-Datei" Vorlage und fügen Sie die Patientenproben der Liste bearbeitet werden soll. Gruppen von bis zu 20 Patientenproben zu generieren und mit dem entsprechenden Qualitätskontrolle-paar zu flankieren.
- Nass-Prime HPLC System mit der "Einlass-Datei" Steuerungs-Software: die "nassen Prime" Funktion auf 50 % mobilen Phase A/50% B und nass-Prime für 2 min bei einer Durchflussmenge von 1 mL/min.
- Aktualisieren Sie die Spritze. Hierzu führen Sie 6 Schläge von 600 µL in der Steuerungssoftware.
- Equilibrate der Spalte C8 umgekehrter Phase. Mit der Software, schalten Sie die Strömung in der "Einlass-Datei" und spülen Sie es mit 7 % mobile Phase B/93% A für ein Minimum von 5 min, mit einer Fließgeschwindigkeit von 0,5 mL/min überprüfen die Spalte Temperatur von 30 ° C.
- Auftauen der Patientenproben, ein Aliquot der Kalibratoren 0 – 7 und eine Qualitätskontrolle-Paar (A / B oder C/D).
- Fügen Sie mit einer sich wiederholenden Pipette 25 µL des internen standard Mix zum 100 µL Kalibrator, QC Probe oder Patientenserum in einem 1,5 mL Polypropylen Röhrchen und Wirbel der Röhre für ein paar Sekunden hinzu.
- Inkubieren Sie die Mischung für 5 min bei Raumtemperatur auf einem Benchtop-Shaker (z. B.bei 1.200 u/min).
- Fügen Sie mit einer sich wiederholenden Pipette 150 µL Reagenz einen Niederschlag zu der Probe-interne standard-Mix hinzu.
- Wieder Wirbel das Rohr für ein paar Sekunden und 5 min bei Raumtemperatur auf einem Benchtop-Shaker (z. B.bei 1.200 u/min) inkubieren.
- Zentrifugieren Sie die Federung bei 20.000 X g in einer Tischplatte Zentrifuge für 10 min bei 4 ° C.
- Verdünnen Sie den überstand 1:3 mit HPLC Grade Wasser und ein Glasfläschchen mit einem Mikro-Einsatz zu und laden Sie es als Proben zu den Autosampler.
- Manuell starten die HPLC-MS/MS-Analyse der "Probe-Messung-Kontroll-Datei".
Hinweis: Bei längerer Lagerung spülen Sie gründlich die analytische Säule nach Empfehlung des Herstellers [z.B.0,5 mL/min Methanol-Wasser (50: 50, V/V)] um Phase Zusammenbruch zu verhindern.

Abbildung 1: Schematische Darstellung der Probe Bereinigung. Proteinfällung an die hohe Zentrifugalkraft gibt einen dichten Pellet und klaren überstand, angibt, dass Proteinfällung abgeschlossen war. Die gesamte Bearbeitungszeit beträgt ca. 30 Minuten, einschließlich der Probe-Bereinigung, die chromatographische Trennung und MS/MS-Analyse. Bitte klicken Sie hier für eine größere Version dieser Figur.
9. Beurteilung und Quantifizierung
- Um die Proben zu bearbeiten, öffnen Sie die entsprechende "Probe Messung Steuerdatei", wählen Sie die Kalibratoren, Kontrollen und Patientenproben und bewerten sie mit der "Antibiotika Quantifizierungsmethode".
- Überprüfen Sie, ob die Gipfel für einen bestimmten Analyten richtig integriert sind. Kontrollieren Sie die Gipfel für jeden Kalibrator, QC und Patientenprobe und reintegrieren sie manuell an der Grundlinie zu, falls erforderlich.
- Die Eichkurve zu studieren und zu prüfen, ob es die folgenden Qualitätskriterien erfüllt: (a) Linearität über die gesamte Kalibrierung Range, (b) eine Kalibrierung Koeffizienten R2 > 0.995, (c) die Abweichung jedes Kalibriernormal innerhalb von ± 15 % der Nennwert, außer für die untere Grenze der Quantifizierung (LLOQ), wo ± 20 % erforderlich ist.
- Ablehnen eines Kalibrierung Standards nicht mit den oben genannten Kriterien erfüllen und die Eichkurve, einschließlich der Regressionsanalyse neu zu bewerten.
- Untersuchen Sie die Qualitätskontrollen zu und prüfen Sie, ob die Abweichungen innerhalb von ± 15 % des Nennwertes.
- Übersteigt die Konzentration von einer Patientenprobe die Konzentration von der höchsten Kalibrator, verdünnen Sie die Probe mit destilliertem Wasser bis auf 1:5 (z.B. 100 µL Serum plus 400 µL destilliertes Wasser) vor der Probe-Bereinigung. Reperform Schritte 8,8 – 8.14 für dieses spezifische Beispiel und verarbeiten es.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Mit der beschriebenen Protokoll, ist ein typisches Chromatogramm in Abbildung 2dargestellt. Gemäß dem United States Pharmacopeia (USP) Chromatographie Leitlinien16, wurde die Spalte Totvolumen im derzeitigen System mit ~0.22 mL und die Spalte Extra Volumen (einschließlich der Injektor, Schläuche und Anschlüsse) mit ~0.08 mL bestimmt geben ein Bankraub Volumen von ~0.30 mL. Die berechneten Aufbewahrung Faktoren für alle Analyte waren 2.8 (für Hemmhof) - 4,2 (für Piperacillin).
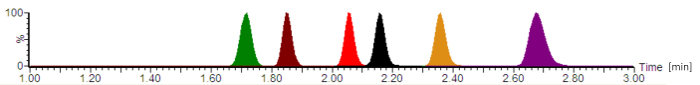
Abbildung 2: typische analytische Chromatogramm mit normalisierten Signalintensitäten. Antibiotika sind in der folgenden Reihenfolge eluierenden: Hemmhof (grün), Meropenem (braun), Ciprofloxacin (rot), Moxifloxacin (schwarz), Linezolid (Orange) und Piperacillin (lila). Die Retentionszeiten der sind in Minuten angegeben und Analyten Peak Symmetrien variieren, abhängig von der genauen Zusammensetzung der mobilen Phasen, der Volumenstrom, der Chromatographie-Schlauch, und die Trennsäule Alter. Bitte klicken Sie hier für eine größere Version dieser Figur.
Abbildung 3A enthält eine Beispielliste Diagramm für die Proben, einschließlich Kalibratoren 0 - 7 ("Kalibrator 0" - "Kalibrator 7"), Qualitätskontrollen und Patientenseren, die mit der Injektion Nummer angegeben sind (#); der Beispieltext Identifikation (Beispieltext); die gemessene Konzentration in mg/L (Konz.); der Probentyp, der ist entweder ein Leerzeichen, Standard, Qualitätskontrolle oder Patientenprobe (Typ); die geringe Konzentration von Kalibratoren in mg/L (Std. Conc); die analytische Retentionszeit (RT); die Antwort, die das Verhältnis von Peak von Analyt/Peak IS (Reaktion); die Abweichung von der sollkonzentration Wert (% Dev); die Durchstechflasche Position (Vial); und die Erfassungszeit (Acq.Time). Der entscheidende Parameter für die Quantifizierung verwendet ist die Antwort, allmählich mit der Konzentration des Analyten, aufgrund der Konstanten Menge an zusätzlichen Isotopen-Label interner Standard.
Abbildung 3 b zeigt die Kalibrierkurve. Bei der Regression sollte der Koeffizient der Entschlossenheit R2 > 0.995. Das folgende kalibrierungsmodell wird verwendet für alle Analyte, die in dieser Methode beschriebenen: Kurve Typ = linear; Herkunft = enthalten; Gewichtung = 1 / x; Achsen Transformation = none. In diesem Beispiel die Kalibrierkurve und Qualitätskontrollen zu erfüllen alle Qualitätskriterien: R2 > 0.995 für die Eichkurve und die Abweichung von der Kalibratoren (einschließlich der LLOQ) und der QC-Proben ist innerhalb von ± 15 % des Nennwertes.
Die gemessenen Elternteil-Tochter Ion Übergänge (MRM) sind in Abbildung 3, zeigen vier Gipfel bei gleichzeitiger Beibehaltung gegeben: die beiden oberen Spitzen zeigen zwei Übergänge, die für den Analyten von Interesse gemessen werden, die unteren zwei Gipfel vertreten die Übergänge für den entsprechenden Isotopen-Label internen Standard. Für die Bewertung der Qualität die Analyten Gipfeln in die jeweiligen Aufbewahrung Zeitfenster visuell geprüft und manuell an der Grundlinie, bei Bedarf wieder eingegliedert.
Die minimal inhibitorische Konzentration (MIC) ist die zentrale Komponente der antimikrobiellen TDM, definieren die pharmakokinetische Belichtung, die erforderlich sind, um ein Ziel pharmakokinetische/pharmakodynamische (PK/KD) Verhältnis13,17zu erreichen. Dementsprechend sind die Antibiotika TDM Konzentration Zielwerte in Bezug auf das Mikrofon des ursächlichen Erregers ausgedrückt. Angesichts der Tatsache, dass die Wirkung von Beta-Lactam-Antibiotika zeitabhängig ist, ist ihre Wirksamkeit durch die Erreichung der therapeutischen Konzentrationen, die das MIC 4 x-5 überschreiten maximiert X (fT > 4-5 x MIC). Bei unbekannte infektiöse Krankheitserregern konfrontiert, deshalb das Zielband Trog Konzentration des freien (Protein-ungebunden) Piperacillin, 64 mg/L, entspricht ca. 90 mg/L Gesamt Piperacillin18.
Der erste Patient (Beispiel #11) hat eine zufriedenstellende hohen Trog-Serumspiegel von 83,4 mg/L Piperacillin, die auch für Problem Krankheitserreger wie Pseudomonas Aeruginosaausreicht. Der zweite Patient (Beispiel #12) hat eine Konzentration von etwa 0,2 mg/L, die unterhalb des niedrigsten Kalibrators (LLOQ) liegt. Vielleicht hat sich der Patient erholt, und die Verwaltung von Piperacillin wurde eingestellt. Das Ergebnis "< 0,5 mg / L" ist, daher im Krankenhaus-Informations-System gemeldet. Der dritte Patient (Beispiel #13) hat eine niedrige Piperacillin Trog Konzentration von nur 5,3 mg/L, die für die klare Mehrheit der Krankheitserreger nicht ausreicht. Für eine effektive antimikrobielle Chemotherapie sollte der Arzt die Dosierung gesteigert werden.
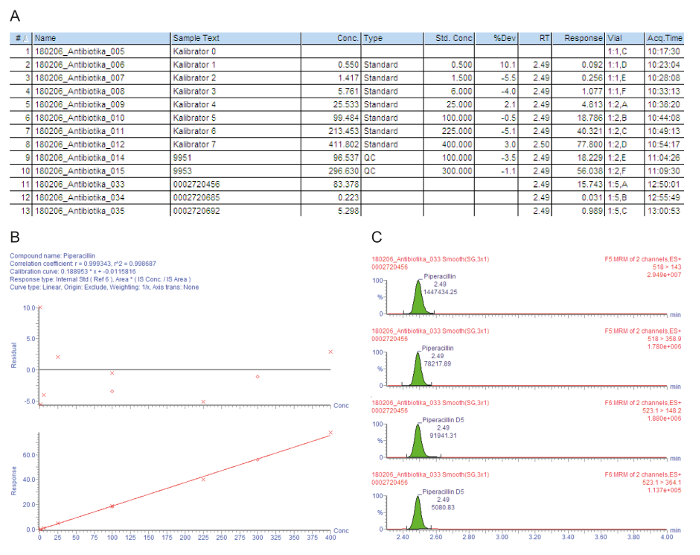
Abbildung 3: beispielhafte Qualitätsbewertung und Quantifizierung für den Analyten Piperacillin. Diese Platten sind die Massenspektrometrie-Daten-Analyse. (A) dieses Panel zeigt die Beispielliste, einschließlich Kalibratoren (Standard, Proben #1 - #8), Qualitätskontrolle (QC, Proben #9 und #10) und Patientenseren (Proben #11 - #13). Kalibrator 0 bezieht sich auf den Rohling ohne Analyt, aber mit dem Zusatz von einem internen Standard. 9951 stellt QC B 9953 stellt QC D. (B) dieses Panel zeigt die Eichkurve für Piperacillin. Die prozentualen Abweichungen von der nominalen Kalibrator-Konzentrationen sind in der oberen Grafik angegeben (y-Achse: Passives), der untere Graph zeigt die lineare Kalibrierung Bereich. (C) dieser Bereich zeigt die mehrere Reaktionszeit monitoring (MRM) für Piperacillin und den entsprechenden internen standard Piperacillin-D5 für Patienten Serumprobe #12. Zwei Eltern-Tochter Ion Übergänge werden mit ihrer Verweildauer und die jeweiligen Signalintensitäten vorgestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterladen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Wir berichten in diesem Manuskript, das Protokoll für eine einfache und robuste Tandem-Massenspektrometrie-basierte Methode zur Quantifizierung der häufig verwendeten Antibiotika in ICU19, nämlich Hemmhof, Meropenem, Ciprofloxacin, Moxifloxacin, Linezolid, und Piperacillin14. Eine Tabellenkalkulation begleitet das Manuskript für die Zubereitung von Antibiotika Stammlösungen, Kalibratoren und Qualitätskontrollen, unter Berücksichtigung der Reinheit der Antibiotika und das Molekulargewicht des ihrer gegenionen. Angesichts der Tatsache, dass die Konzentrationen der Antibiotika relativ hoch sind, sollte ihre Quantifizierung keine besondere Herausforderung aus einer analytischen Perspektive. Daher sind wir zuversichtlich, dass dieses Protokoll zu verschiedenen MS-instrumental-Plattformen anwendbar ist. Für eine Übertragung der Methode Benutzer werden ermutigt, die Spalte Extra Volumen zu quantifizieren und halterlosen Volumen ihres chromatographischen Systems und die Anpassung der Gradienten Start Zeit entsprechend16. Während des Setup Methode das System sollte auch für die Verschleppung ausgewertet werden und, falls erforderlich, muss eine leere Probe nach der höchsten Kalibrator und Patient Proben mit hohen antibiotische Konzentrationen injiziert werden. Benutzer müssen auch die Möglichkeit der Detektor Sättigung berücksichtigen, die tritt auf, wenn zu viele Ionen geben Sie ein Tandem-Massenspektrometer. Entsprechenden Detektor Sättigung kann mit kleineren Einspritzmengen, eine stärkere Verdünnung der Analyten während der Probe-Reinigung und/oder eine Verstimmung des Analyten (z.B.Herabstufung der optimale Spannungseinstellungen) Ziel beseitigt werden.
Im Gegensatz zu anderen Methoden ermöglicht die Kalibrierung sowohl eine Quantifizierung der Konzentrationen in der Nähe der MIC anfällig für Krankheitserreger sowie Konzentrationen (Cmax), die mit einem Bolus Verwaltung gewonnen werden. Die höchsten Cmax-Werte für Erwachsene in die entsprechenden professionellen Informationsblätter über die FDA Drug Safety Database wie folgt gemeldet werden: 163,9 mg/L für Hemmhof20, 112 mg/L für Meropenem21, 4,6 mg/L für Ciprofloxacin22 , 4,1 mg/L für Moxifloxacin23, 21,2 mg/L bei Linezolid24und 298 mg/L für Piperacillin25. Antibiotika-Konzentration in den Blutkreislauf des Patienten Überwachung ermöglicht eine Anpassung der Dosierung, die Anfälligkeit der beteiligten Erreger, sondern der pharmakokinetische Fläche unter der Kurve erhalten Sie ebenfalls durch mehrere Blutabnahme mit der gegebenen Protokoll.
Viele Antibiotika (vor allem Beta-Lactam Meropenem) sind chemisch instabil einmal aufgelöst. Der wichtigste Schritt in diesem Protokoll ist daher, die Vorbereitung der Stammlösungen, Kalibratoren und Qualitätskontrollen unter kalten Bedingungen26,27. In diesem Zusammenhang gilt es auch Patientenproben so schnell wie möglich einzufrieren. Serum-Lagerung bei-80 ° C26empfohlen, unsere Stabilität-Experimente, die zeigen, dass die Proben auch sein kann bis zu 3 Tage bei-20 ° C ohne eine signifikante Abnahme der Antibiotika-Konzentrationen (auch bei der Talspiegel) gelagert.
Wir empfehlen die Durchführung einer Eignungsprüfung System vor jeder HPLC-MS/MS-Analyse von Patientenproben (z. B.mit Kalibrator 3). Im Allgemeinen ist eine Eignungsprüfung System verwendet, um die Wiederholbarkeit der LC-MS/MS-System zu überprüfen und zu sehen, ob es auch ausreichend für die Analyse zu tun ist. So sind beispielsweise abnehmende Signalintensitäten durch eine Kontamination des Kegels MS Sweep voraussetzt, dann die Reinigung mit einem organischen Lösungsmittel verursacht. Um die MS-Quelle sauber zu halten, kann eine Umleitung Ventil eingeführt werden, nach der Spalte "Chromatographie" Regie "Analyt-frei" Teile der mobilen Phase mit dem Müll, bevor sie das Massenspektrometer erreichen. Auf der anderen Seite kann eine allgemeine Erhöhung des Drucks Spalte "" Verstopfung im Laufe der Zeit an. Um die Spalte zu erhöhen ist Langlebigkeit Nutzung eine kostengünstige precolumn Filter empfehlenswert. Wenn der Druck noch ein Problem sein weiterhin, kann eine Durchflussmenge von 0,4 mL/min auch mit dem chromatographischen Gradienten in diesem Protokoll verwendet werden.
Eine geringfügige Einschränkung dieser Technik ist, dass es erfordert drei separate manuelle Schritte zur Reinigung der Probe, was zu einem total Turnaround-Zeit von ca. 30 min. die fällungsmittels der Isotopen-markierte interne Standards hinzufügen sparen kann, einige Bearbeitungszeit. Aber dies sollte nur durchgeführt werden, für hohen Durchsatz Abtastraten und mit dem Niederschlag erniedrigen Agent in der Kälte (z.B.bei-20 ° C), als die internen Standards auch gespeichert werden in Vitro bei erhöhten Temperaturen.
Das beschriebene Protokoll wurde für die Verarbeitung in Polypropylenröhrchen standard 1,5 mL Probe entwickelt. Eine höhere Durchsatzrate für antibiotische TDM erforderlich sein sollte, kann das Verfahren auf die Multi-well-Plattenformat mit angemessenen Zentrifuge Einsätze oder Filterplatten mit einem Vakuum Verteiler aktualisiert werden.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Die Autoren danken Dr. Schütze für seine Hilfe bei der Einrichtung der vorgestellten Methode und Dr. Zoller für den wertvollen Input in Bezug auf die korrekte Kalibrierung-Palette. Die Autoren erkennen auch das technische Personal der Massenspektrometrie Anlage.
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



