ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Qui, presentiamo un protocollo che descrive la fabbricazione di estensibile, bicanale, dispositivi organo chip microfluidici cella cultura per ricapitolare la funzionalità a livello dell'organo in vitro.
Abstract
Un numero significativo di composti del piombo non riuscire nella pipeline farmaceutica perché gli studi sugli animali, spesso non riescono a predire le risposte cliniche in pazienti umani. Umano dell'organo-on-a-Chip (Chip organo) cella cultura dispositivi microfluidici, che forniscono una piattaforma sperimentale in vitro per valutare efficacia, tossicità e farmacocinetica (PK) profili in esseri umani, possono essere meglio predittori di efficacia terapeutica e sicurezza nella clinica rispetto a studi sugli animali. Questi dispositivi possono essere utilizzati per la funzione di praticamente qualsiasi tipo di organo di modello e possono essere collegati fluidically attraverso comuni microcanali endotelio-allineate per eseguire gli studi in vitro sulla fisiologia umana di intero corpo-livello e organo senza dover condurre esperimenti sulle persone. Questi chip di organo sono costituiti da due canali microfluidici irrorato separati da una membrana elastomerica permeabile con organo-specifiche cellule parenchimatiche su un lato ed endotelio microvascolare da altro, che possono essere allungata ciclicamente a fornire organo-specifiche meccaniche cues (ad es., movimenti nel polmone respiratori). Questo protocollo dettaglia la fabbricazione di flessibile, bicanale, Chips di organo attraverso la fusione delle parti utilizzando 3D stampato stampi, consentendo la combinazione di colata più e passaggi di post-elaborazione. Poroso poli (silossano dimetilico) membrane (PDMS) sono espressi con micrometro dimensioni fori utilizzando matrici di pilastro di silicio sotto compressione. Fabbricazione e assemblaggio di organo chip coinvolge attrezzature e passaggi che possono essere attuate di fuori di una camera bianca tradizionale. Questo protocollo fornisce ai ricercatori con accesso alla tecnologia Chip organo per in vitro studi di organo e corpo-livello nella scoperta della droga, sicurezza e prove di efficacia, come pure gli studi meccanicistici di processi biologici fondamentali.
Introduction
Qui, descriviamo la fabbricazione di doppio canale, vascolarizzati dispositivi di cultura microfluidici organo-on-a-Chip (Chip organo) utilizza un protocollo scalabile favorevole per l'utilizzo di gruppi di ricerca non hanno accesso alle camere bianche e agli strumenti tradizionali litografia soft. Questi dispositivi sono stati sviluppati per ricapitolare le funzioni a livello di organo umane per comprensione normale e fisiologia di malattia, come pure la droga le risposte in vitro1,2. Critica all'ingegneria questa funzionalità sono due canali microfluidici irrorato separati da una membrana semipermeabile (Figura 1). Questo design consente di ricreazione delle interfacce di tessuto-tessuto tra almeno due tipi di tessuti, in genere cellule parenchimali dell'organo su un lato della membrana porosa e l'endotelio vascolare da altro, come pure loro esposizione al flusso del fluido. Inoltre, poiché il polimero elastomerico, poli (silossano dimetilico) (PDMS), viene utilizzato per fabbricare il corpo organo Chip e componenti della membrana, sforzo meccanico ciclico possono essere applicati all'intero progettato tessuto-tessuto interfaccia tramite l'elastico membrana per imitare il microambiente fisico naturale di organi viventi, come respiratori mozioni nel polmone e peristalsi nell'intestino.

Figura 1: sezione trasversale organo Chip. Chips di organo è composto da due canali separati da una membrana porosa, elastica che può essere seminata con cellule su entrambi i lati. Canale superiore le sezioni trasversali sono 1 mm di larghezza x 1 mm alta, fondo canale croce sezioni sono di 1 mm di larghezza x 0,2 mm alta e vuoto canali in entrambi e parti inferiori sono 0,3 mm di larghezza, 0.5 mm di altezza e distanziati 0,3 mm dai canali fluidici. Clicca qui per visualizzare una versione più grande di questa figura.
Questi stretchable, doppio canale, organo Chips sono stati utilizzati per dimostrare l'impatto della respirazione movimento sull'assorbimento delle nanoparticelle nel polmone ed edema polmonare droga-indotto3,4; effetti di movimento peristaltico sulla differenziazione5 e crescita eccessiva batterica in intestino5,6,7; influenza delle deformazioni ciclici dovuto la pulsazione del cuore sulla differenziazione e maturazione dei Glomerulare podociti nel rene8. Inoltre, questi dispositivi di due lumi che contengono un canale vascolare endotelio-allineate, separato da una matrice extracellulare (ECM)-membrana rivestita da cellule parenchimali all'interno di un canale separatamente accessibile sono adatti per la caratterizzazione di droga PK parametri e nuova scoperta di destinazione, che è stato limitato nell'aspersione singolo canale sistemi. Inoltre, Chips di organo multiple possono essere collegate insieme tramite loro scanalature vascolari per creare efficacemente un umano corpo-on-chip, in grado di offrire una piattaforma attraente umana in vitro per terapie sviluppo9, 10. A differenza di più micro-fisiologici sistemi (MPS)11,12,13, i chip di organo contiene due canali microfluidici separati da una membrana porosa che facilita le interazioni vascolare parenchimale a ricapitolare in vivo funzione dell'organo. Questo non solo semplifica il collegamento di diversi organi insieme irrorando un mezzo comune attraverso le scanalature vascolari, ma la compartimentazione di tessuti e fluidi imita in vivo funzioni e supporta la sperimentazione farmacocinetica e modellazione così come in vitro-in vivo estrapolazione9,10 che è difficile o impossibile a canale singolo MPS14,15,16. La popolarità di PDMS in dispositivi microfluidici ha portato allo sviluppo di strumenti per superare la capacità del materiale di assorbire piccole molecole10,17. Tuttavia, i grandi numeri dei chip necessari per supportare gli studi biologici, dove l'uso di agenti microbici e PDMS-assorbendo composti fanno riutilizzare di organo chip difficile richiedono un processo di fabbricazione scalabile anche per piccoli gruppi di ricerca. Il protocollo descritto qui presenta un metodo per la fabbricazione di dispositivi adatto all'impiego in laboratori accademici, compresi quelli non hanno accesso a camere bianche e litografia soft. Questo protocollo mira a estendere l'accesso ai circuiti integrati dell'organo da una vasta gamma di ricercatori che cercano di utilizzare i dispositivi stretchable, dual-channel per esplorare i processi biologici fondamentali così come sviluppo terapeutico traslazionale.
Sfruttando consigliate dai campi micromanufacturing accoppiati con design per la produzione, è stato sviluppato un approccio robusto per fabbricare dispositivi organo Chip in grandi quantità con resa e alta riproducibilità. Il protocollo di fabbricazione descritto qui fornisce un metodo scalabile per la produzione di Chip di organo. Descriviamo l'uso di un opzionale Mold-in-Place Jig (MiP; dettagli di design in Materiali supplementari) accoppiato con le strisce di guarnizione in poliuretano per consentire la scalabilità di PDMS componenti del pezzo fuso. Il lato lucido del poliuretano strisce produrre otticamente liscia PDMS parti mentre il lato strutturato facilita la sformatura. Inoltre descriviamo l'uso di un opzionale automatizzato membrana Fabricator (AMF) che fornisce una compressione uniforme di stampi di wafer di membrana durante la polimerizzazione per fabbricare fino a 24 membrane per ogni batch. Il design è ampiamente applicabile per gli studi degli organi che sono composti di tessuti che l'esperienza di sollecitazioni meccaniche e perfusione, e questi chip possono essere prodotto con bassa variabilità di truciolo-truciolo in quantità necessaria per soddisfare le esigenze di piccole e grandi gruppi di ricerca allo stesso modo. Il flusso di lavoro è favorevole a un formato batch o linea di assemblaggio e compatibili con protocolli di valutazione di qualità per il controllo dei processi di produzione, formazione del personale e la risoluzione reattivo. Ci auguriamo che questo protocollo si espanderà l'accesso alle funzionalità di doppio canale, estensibile, patatine di organo per la ricerca di base e traslazionale.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. generale preparazione
- Per evitare residui, pulire l'area di lavoro utilizzando il nastro adesivo e strofinare l'area con una cleanroom wipe e alcool isopropilico.
- Per tutti i passaggi che richiedono PDMS, mescolare PDMS con un rapporto di 10:1 (10 g di agente, 100 g di elastomero a base di collegamento trasversale). Mescolare a mano o con un miscelatore commercialmente disponibile. Utilizzare una centrifuga planetaria qui: mescolando per 2 minuti a 2000 giri/min, poi il PDMS di degassamento per 2 minuti a 2200 giri/min.
- Pulire tutti stampi con fucile ad aria compressa per soffiare fuori i detriti prima dell'uso.
Attenzione: Non utilizzare pinze metalliche per rimuovere i detriti come danneggia la superficie degli stampi.
2. preparazione top Channel
- Pulire il lato lucido di ogni pezzo di poliuretano con salviettine di etanolo e camere bianche. Assicurarsi che tutti i residui di etanolo è asciugato dalla superficie in poliuretano.
- Posizionare il lato lucido del poliuretano sopra il lato aperto dello stampo MiP per generare una guarnizione sul lato aperto dello stampo, lasciando solo un'apertura di ben-come nella parte superiore dello stampo per colata PDMS.
Nota: Controllare che ogni stampo è coperta in modo sicuro da parte di poliuretano o il PDMS colerà dalle muffe durante versarsi. - Posizionare gli assembly muffa e poliuretano un jig di MiP, con il lato strutturato contro la fine del jig MiP. Continuare a farlo fino a quando tutti gli stampi sono stati collocati nell'attrezzatura.
- Serrare il jig MiP ruotando la maniglia con una chiave fino a quando la spaziatura di jig è di 25 mm di larghezza.
- Fare una barchetta di carta stagnola che circondano il jig MiP per impedire la colatura su superfici in eccesso PDMS.
- Versare PDMS in ciascuno degli stampi bene fino al completo.
Nota: Ogni componente superiore chip richiede circa 3 mL di PDMS. - Una volta riempito l'intero jig, posizionare la dima in un essiccatore sotto vuoto. Tirare-80 kPa per 1 h a degas PDMS a.
- Dopo 1 h, rimuovere il jig MiP dall'essiccatore e mettere in forno a 60 ° C per almeno 4 h curare PDMS.
- Smontare la dima di MiP usando una chiave, allentare il jig ruotando la maniglia in senso antiorario. Una volta che le muffe sono esenti da compressione, rimuovere muffe da jig.
- Rimuovere le strisce di poliuretano da ogni stampo e scartare.
- Accuratamente de-stampo parti PDMS da loro stampi e adagiarle caratteristica-lato verso l'alto.
- Allineare la lama del raschietto piastrella alla tacca sulla scheda fine e tagliare ogni fine di singulate i componenti migliori.
- Verifica parti per uno qualsiasi dei seguenti tipi di guasto e scartare qualsiasi parti insoddisfacente: graffi nel canale principale, grandi detriti sopra l'area del canale, grandi bolle, deformato canali vuoto.
- Conservare pezzi finiti in capsule di Petri quadrato all'interno di armadi positiva di pressione a temperatura ambiente.
3. fondo canale preparazione
- Versare circa 10,5 g di PDMS negli stampi fino a quando il PDMS raggiunge la parte superiore della cavità.
- Ispezionare lo stampo del canale di fondo per PDMS curata sul fondo dello stampo.
- Se sporco, raschiare PDMS vecchia dalla parte inferiore dello stampo poiché una superficie non uniforme sul fondo dello stampo può causare variazioni di spessore delle parti finali.
Nota: per le piccole < zone2 2 cm che sono scoperti, il fucile ad aria compressa possono essere utilizzati molto delicatamente per spostare PDMS sopra lo spazio.
- Posizionare gli stampi in un essiccatore sotto vuoto per 1 h.
- Dopo 1 h, spostare gli stampi in forno a 60 ° livello C per > 4h.
- Posto muffa tavolo in cappa a flusso laminare. Allentare PDMS da un bordo dello stampo.
- Afferrare un angolo e Sbucci delicatamente indietro il PDMS dalla superficie dello stampo.
- Quando completamente rimosso, posare sulla superficie di lavoro, in modo che funzioni dei canali sono scoperte.
- Parti tagliate lungo i bordi esterni con Tagliapiastrelle, mettendo la lama della taglierina di mattonelle in dentellato PDMS come descritto al punto 2.12.
- Accumulate i parti laterali di funzionalità su nastro per rimuovere eventuali detriti.
- Rimuovere la parte dal nastro di imballaggio. Trascinare l'estremità libera della parte attraverso la diapositiva. L'estremità libera sarà in laminato con il vetro.
Nota: È fondamentale per evitare che allunga la parte mentre stabilisce. Se la bolla è intrappolata tra parte e vetro, delicatamente sollevare la parte con il forcipe e ri-laici. - Eseguire ispezioni di controllo qualità delle parti. Verifica parti per qualsiasi modalità di guasto e scartare qualsiasi parti insoddisfacente, incluse quelle che contengono graffi nel canale principale, detriti di grandi dimensioni, grandi bolle o deforme canali vuoto.
- Coprire con nastro.
- Negozio di parti in una pressione positiva mobile a temperatura ambiente.
4. PDMS membrana preparazione
- Verifica che le cialde sono privi di PDMS sul retro.
- Posizionare ogni wafer di membrana in slot designato nei vassoi AMF.
- Utilizzare la siringa da 1 mL per posizionare al centro di ogni matrice di membrana wafer post 0,09 mL di PDMS. Lasciate PDMS riposare per un minimo di 5 min per consentire PDMS a diffondersi in tutto il post del wafer della membrana.
Nota: Non procedere al passaggio successivo fino a coprire almeno il 75% della matrice post in PDMS. La qualità delle membrane migliora il più a lungo il PDMS è permesso di stoppino in regione post in modo più lunghi tempi di attesa in questo passaggio sono comodo. - Al plasma trattare la striscia di policarbonato a 20 W per 45 s, O2 gas a 0.80 mbar in una macchina al plasma.
- Rimuovere il foglio di policarbonato dalla macchina al plasma e usare le forbici per tagliare le lastre in policarbonato in 45 x 45 mm quadrati.
Nota: Minimizzare il contatto con il plasma superficie trattata per impedire che polvere attaccare per il policarbonato. - Appoggiare delicatamente il lato del plasma trattato delle piazze sul liquido PDMS centrato sul wafer di membrana in policarbonato. Assicurarsi che il policarbonato e il PDMS sono in contatto.
Nota: Evitare sacche d'aria tra il policarbonato e il PDMS. - Posizionare il distanziale PDMS pre-tagliato al centro della piazza in policarbonato.
- Posizionare il foglio pre-tagliati in policarbonato strutturato sul blocco PDMS di mantenere il gruppo dal legame alla piastra di compressione.
- Inserire il vassoio affinché vassoio 3 è nella parte posteriore, vassoio 2 è nel mezzo e vassoio 1 è nella parte anteriore. Vassoio 1 ha una tacca per l'allineamento.
- Aprire la valvola di uscita e aprire molto lentamente la valvola di pressione di ingresso. Solo allora chiudere la valvola di pressione di uscita.
Nota: Questo è il modo che l'output 4 kg di forza gradualmente viene applicato a ogni wafer di membrana al contrario immediatamente, che può rompere il wafer. - Flip l'interruttore AMF su ON per iniziare il ciclo di vulcanizzazione. Curare la cialda meno di 4 kg (16 kPa) di compressione e un rampa ciclo di temperatura elencati nella tabella 1.
| Passo | Temperatura (° C) | Durata (min) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Tenere premuto |
Tabella 1 - membrana condizioni di reticolazione
- Chiudere la valvola di pressione di ingresso e aprire la valvola di pressione di uscita per rilasciare la pressione dai cilindri aria.
- Rimuovere i vassoi e portarli alla cappa a flusso laminare.
- Rimuovere con cautela il policarbonato strutturato e rimuovere con cautela il distanziale PDMS.
Nota: Guarda il distanziale PDMS affinché che non anche staccare il vettore in policarbonato, in questo caso inizio peeling da un angolo diverso.- Ispezionare la membrana PDMS attraverso il vettore in policarbonato per aree con fori passanti e usare un pennarello per tracciare il contorno dell'area attraverso-foro e contrassegnare tutti i fori o difetti nelle membrane.
- Con pinze di manipolazione wafer, allentare wafer dal vassoio.
- Rimuovere ogni membrana da wafer e inserire nella capsula di Petri.
Nota: La membrana PDMS sarà de-stampo dalla cialda di membrana e siano rispettata il policarbonato backing. Se PDMS inizia a distaccarsi dal vettore in policarbonato, buccia da una regione diversa. - Memorizzare le membrane e le cialde in piastre di Petri in un'armadietto a temperatura di pressione positiva.
5. montaggio e preparazione più venduti
- Utilizzando nastro opaco, pulire le membrane PDMS, come pure le parti interne di Petri per rimuovere i detriti.
- Accuratamente il nastro sul lato di funzionalità di ogni componente superiore per rimuovere i detriti.
- Posizionare canale superiore parte ("top") funzionalità lato fino nella capsula di Petri con membrana PDMS.
Nota: Tenere presente che alcune membrane possono essere utilizzate per uno o due parti superiori a seconda delle dimensioni dell'area utilizzabile. I principali canali di ogni parte superiore dovrebbero andare bene all'interno dell'area contrassegnato della membrana. - Caricare i piatti Petri in macchina al plasma.
- Al plasma trattare membrana e superiore a 20 W per 45 s, O2 gas a 0.80 mbar.
- Al termine dei cicli di incollaggio, rimuovere i piatti e stabilire le parti attivate lato caratteristica sopra la membrana e garantire parte completamente è laminato con membrana con nessun bolle.
- Mettere parti in forno a 60 ° C per almeno 2 h temprare.
- Usando un bisturi, traccia attorno al perimetro della parte superiore legato a separare top-membrana dal vettore in policarbonato.
Nota: Non tagliare il vettore. - Una volta che la parte venga tracciata, sbucciare l'assembly dal policarbonato. La membrana PDMS che è legata alla parte superiore dovrebbe sbucciare da parte del vettore.
- Utilizzando pinze punte tagliente, rimuovere la membrana dalle porte di accesso al canale inferiore e rimuovere tutti i residui o polvere con forcipe sotto uno stereoscopio.
Nota: Non lasciare qualsiasi parte della membrana che copre la porta di accesso.
6. chip Assembly
- Sono dotate di lato verso l'alto, gli assembly di ossequio al plasma con componenti inferiori utilizzando le condizioni al punto 5.5.
- Sotto un microscopio invertito, allineare l'assemblea superiore con vetrino da microscopio a fondo metà.
- Mettere in forno a 60 ° C per almeno 2 h.
- Ispezioni di controllo qualità di chip
Nota: Prestare particolare attenzione ai principali porti e canale del chip. Controllare le modalità di guasto dall'occhio e anche sotto il microscopio.- Per verificare che il chip è legato completamente, tirare leggermente su ogni angolo del chip per controllare parti delaminating.
- Guarda il canale del chip per controllare una membrana rugosa o cascante, che apparirà come un motivo ondulato o una leggera deviazione nel canale.
- Eseguire un'ispezione del microscopio per verificare la presenza di detriti nel canale principale.
Nota: Detriti nelle aree non critiche, come ad esempio i canali vuoto sono accettabili. - Con il chip ancora sul microscopio invertito, ispezionare il canale principale e canali vuoto per delaminazione.
Nota: Delaminazione in aree non critiche (ad esempio, il bordo del chip) è accettabile. - Verificare che i canali principali sono allineati a entro 50-60 µm (pori di membrana 1-2).
Nota: È fondamentale che i canali non sono sovrapposte con canali vuoto. - Controllare che la membrana tra i principali canali e i canali di ingresso e di uscita sia integra senza fori apparenti.
Nota: Qualsiasi foro nella membrana può portare a un chip che perde o la crescita delle cellule di fuori dei canali.
- Archivio i gettoni nelle capsule di Petri in un'armadietto a temperatura di pressione positiva.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Il protocollo presentato qui descrive la fabbricazione scalabile di PDMS organo Chips. Questi dispositivi consentono di cultura dei due tipi di tessuto irrorato distinti su una membrana elastica porosa (Figura 1). I canali PDMS sono espressi utilizzando stampi stampate 3D, che accelera la prototipazione di nuovi disegni (Figura 2A e 2B). Canali top sono fusi in stampi sotto compressione contro una compatibile con guarnizione in poliuretano per produrre componenti con porte modellati (Figura 2) mentre componenti canale inferiori sono espressi in vassoi e gestiti su vetrino da microscopio (Figura 2D) di supporto. Questo approccio di fabbricazione combina patterning multiscala delle parti in un unico passaggio, che consente di risparmiare tempo, migliora la riproducibilità e la tracciabilità e riduce i residui generati dalle porta punzonatura e più punti di taglio. Le membrane porose sono fondamentali per la funzione del Chip dell'organo e l'approccio di fabbricazione basato su casting contro wafer di silicio a motivi risultati in membrane di spessore costante e finitura superficiale (Figura 3). La gestione tramite vettori in policarbonato consente per deposito e più grandi lotti di produzione.
Il Chip di organo montato (Figura 4) è costituito da due canali di aspersione in un pacchetto otticamente trasparente. Nella regione sovrapposta, una membrana porosa PDMS attiva l'interazione del tessuto del tessuto di metaboliti, proteine, terapeutica, agenti patogeni e cellule di ricapitolare funzione chip dell'organo, mentre due canali paralleli su entrambi i lati vengono utilizzati per fornire meccanico ceppo mediante azionamento vuoto ciclico. La porosità del PDMS membrana biomimetically supporta il flusso di metaboliti, fattori di crescita e cellule anche tra il parenchima dell'organo e del sistema vascolare (Figura 5). La permeabilità apparente (Papp, cm/s) della membrana è stata determinata tramite la concentrazione di tintura i canali di uscita con e senza cellule intestinali Caco2. Gli strati di cellule dell'intestino chip forniscono una barriera significativamente aumentata permeabilità. Il Chip dell'organo può essere azionato usando i canali paralleli vuoto quantitativamente e riproducibile applicare deformazione ciclica di caricamento a membrana e quindi i tessuti coltivati (Figura 6). Questo ceppo ciclico Unito con aspersione media supporta la differenziazione cellulare per meglio simulare in vivo fisiologia dell'organo, quali la formazione dei villi nel Chip Gut.

Figura 2 : Fabbricazione di canale con 3D stampato stampi. Parti di organi chip sono lanciati contro ad alta risoluzione 3D stampato stampi (A e B), che consente una maggiore versatilità di progettazione e prototipazione di litografia soft tradizionale. Parti del canale superiore (C) sono curati sotto compressione eliminando la necessità per la punzonatura porti i pezzi finiti. Ogni colata in triplice copia è Spazia con un solo taglio. Parti del canale inferiore (D) sono collocati sulle lastre di vetro per facilitare la facilità di utilizzo e imaging. Barre della scala sono di circa 1 cm in tutte le immagini. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : La membrana porosa PDMS è lanciata usando wafer di silicio DRIE patterned. (A) rendering di 7 µm di diametro, µm 50 micropillars alto inciso utilizzando DRIE in un wafer di silicio. (B) PDMS è guarito su questa matrice inferiore ai 4 kg di compressione (16 kPa) per creare una membrana spessa di 50 µm con una matrice di 7 µm di diametro, se fori distanziati apart hexagonally 40 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Fotografia di un Chip di organo PDMS assemblato. Colorante rosso riempie il canale apicale più grande utilizzato per cellule parenchimatiche mentre il colorante blu mette in evidenza il canale basale in genere utilizzato per l'endotelio vascolare. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Permeabilità di inerte tracciante blu cascata attraverso la membrana PDMS microporosa. Cascata blu idrazide maleica tintura in mezzo è stata caricata nel canale superiore del Chip dell'organo ed irrorato a 60 µ l/h per misurare il flusso del colorante attraverso la membrana nella scanalatura inferiore contenente mezzo. Chip vuoto sono stati paragonati ai chip Gut cellule Caco2-BBe1 nel canale apicale e cellule endoteliali vascolari umane (HUVEC) nel canale basale coltivate per 6 giorni. Barre di errore indicano l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Applicazione del ceppo di membrana utilizzando canali laterali vuoto. Trama indica modulazione di deformazione lineare della membrana in risposta a una pressione sottovuoto. Deformazione uniassiale ciclico viene applicato uniformemente nella regione di cultura del Chip organo usando vuoto applicata ai canali laterali parallele. Il ceppo è correlata linearmente con la diminuzione della pressione di vuoto a circa 1% di deformazione per ogni cambiamento-10 kPa di pressione di vuoto (R2 = 0,992). Barre di errore indicano la deviazione standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
Materiali supplementari: Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il processo di fabbricazione si basa sulle muffe stampato 3D di alta risoluzione per modello i componenti corpo PDMS superiore e inferiore dell'organo Chip accoppiati con micromolded membrane porose di PDMS. Questo approccio critico è stato selezionato dovuta alla facilità di prototipazione combinato con rapida transizione in scalabilità fabbricazione e sostituzione degli utensili. Gli stampi di componente superiore sono progettati per porte modello in posizioni precise con profili verticali definiti durante la fase di colata. Questo non solo evita il lavoro coinvolti nella punzonatura manuale porte di accesso, ma riduce anche detriti sul posto di lavoro, consente riproducibili porta allineamento su collettori di interfaccia o strumentazione, e produce parti con controllo sopra la calzata e la sigillatura di inserito tubi o perni per collegamenti idraulici e pneumatici. Gli stampi sono impilati uno sopra l'altro in un jig di compressione, separato da lastre di poliuretano conforme per facilitare i lanci del attraverso-foro di porte. Impilando parti multiple in un singolo giga, un singolo utente può lanciare grandi quantità di componenti completano con porte in un unico passaggio. Scelta dei materiali e metodo per gli stampi di produzione sono fondamentali per fornire la funzionalità necessaria risoluzione, bassa rugosità superficiale e alto grado di planarità per assemblaggio di dispositivi e applicazioni di imaging successive. Stereolitografia può soddisfare questi requisiti, anche se materiali con temperature alta deflessione (> 80 ° C) e la compatibilità con PDMS polimerizzazione riduce la gamma di polimeri disponibili. Varie resine disponibili in commercio, tra cui le resine vetro-riempito, rispondono a questi criteri.
La membrana elastica porosa PDMS è probabilmente il componente più singolari e critico di un Chip di organo pur essendo il più complesso da fabbricare. Un ione profondo reattivo incide processo (DRIE) in outsourcing a un fornitore viene utilizzato per epossidici 50x50 mm esagonale matrici dei pilastri (7 µm di diametro, 40 µm apart, alto 50 µm, C4F8 rivestito) utilizzate per modellare i pori nella membrana PDMS. La qualità delle matrici pilastro è fondamentale per raggiungere la fusione della membrana robusta. In particolare, pilastri devono essere incisi con tolleranze molto strette con profili verticali lisci per evitare sottosquadri o rugosità sidewall eccessiva che può condurre a guasto della muffa. Cura dovrebbe essere presa per evitare "l'inerbimento" nella parte inferiore della regione acidata, che possa influenzare la membrana sformatura e collegamento delle cellule. Fabbricazione di membrana con integrazione riuscita di campitura e dispositivo del attraverso-foro è la singola sezione più complessa del protocollo. Criticamente, immissione 0,09 mL di PDMS in ogni wafer e permettendo il tempo adeguato per poter diffondere è essenziale per evitare incompleto stampaggio a foro passante. Correttamente plasma trattando il policarbonato di supporto è necessario al raggiungimento di robusto supporto della membrana per la sformatura e incollaggio passi senza rughe o stretching. Il sostegno fornisce un mezzo robusto di sformatura la membrana cast il fragile wafer di silicio.
Il carico di compressione applicato a ogni wafer è inoltre essenziale per uniforme attraverso-foro di montaggio. Sforzi precedenti utilizzando pesi ostacolavano la produzione della membrana e provocato la scarsa resa grazie alla forza non uniforme distribuzione. Per superare il collo di bottiglia di produzione, abbiamo ottimizzato la membrana precedentemente pubblicati fabbricazione protocollo18 e costruito un Fabricator membrana automatico (AMF) per parallelizzare il processo. L'AMF è costituito da 24 pistoni pneumatici supportati su una piastra calda programmabile per fornire la forza di compressione controllata in tutto un PDMS programmato processo di reticolazione. Un policarbonato supporto e la pellicola viene inserita il PDMS non polimerizzato e poi uniformemente compresso tramite pistoni pneumatici di AMF mentre viene riscaldato a polimerizzare il PDMS. Criticamente, il graduale processo descritto nei risultati del protocollo in membrane di qualità superiore rispetto a un unico passaggio alla massima temperatura, dove una sfumatura modelli risultanti da bubble sviluppo durante il processo di reticolazione di polimerizzazione processo sono stati osservati. Sebbene sia facoltativo, l'AMF aumenta il throughput significativamente di là di ciò che è possibile usare i pesi in un forno.
Risoluzione dei problemi i chip di organo risultante avviene a due livelli: durante il processo di fabbricazione e durante la coltura di organo Chip. Abbiamo sviluppato un metodo visivo per garanzia della qualità (QA) di formazione attraverso-foro nelle membrane del cast che accelera notevolmente il processo di produzione, mentre migliorando la qualità e l'affidabilità di assemblati organo Chips. Questo metodo QA consente il processo di risoluzione dei problemi, e si consiglia di tenere un registro delle condizioni di processo per consentire la fabbricazione di rilevamento problemi che possono verificarsi durante la coltura cellulare. Durante la coltura di organo Chip, inerte tracciante coloranti sono il metodo più semplice di funzione di barriera per risolvere il processo di fabbricazione e passaggi di cultura di cella di misura. Lucifero giallo è stato utilizzato storicamente per la sua piccola massa molecolare e la fluorescenza innata, ma Cascade Blue offre proprietà simili con un più ristretto spettro di emissione che ha meno probabilità di interferire con le analisi a valle. Più grandi molecole, come poli-etilenglicole (PEG)- o fluorofori destrano-coniugati sono più grandi e di conseguenza causare permeabilità inferiore nel complesso e abbassare la sensibilità. La permeabilità apparente (Papp, cm/s) di coloranti tracciante può essere utilizzata per determinare le proprietà di funzione di barriera di organi o tessuti (Figura 4). La seguente equazione può essere utilizzata per calcolare Papp tra il canale di dosaggio e il canale di ricezione ed è derivata da equazioni utilizzate principalmente per Transwell studi19,20 e corregge per la perdita di colorante tracciante causato da assorbimento in PDMS confrontando i flussi in due uscita e non basarsi su ipotesi di bilancio di massa presso il deflusso.

VR è il volume in mL di effluente di canale di ricezione dopo il tempo t; VD è il volume in mL di effluente canale dosaggio dopo il tempo t; A è l'area della regione del attraverso-foro di membrana in cm2 (0,167 cm2 per questa periferica); t è il tempo della raccolta degli effluenti in secondi; CR è il cambiamento misurato nella concentrazione del colorante tracciante nell'effluente canale ricevente; CD è la concentrazione misurata del colorante tracciante nell'effluente canale dosaggio. Chiave presupposti per questa equazione essere validi includono: 1) costante tracciante tingere dosaggio concentrazione sopra tempo t, 2) la concentrazione di Cr è piccola rispetto al Cde 3) la permeabilità del sistema è distribuita uniformemente in tutta la regione di cultura. Anche se questa equazione può essere utilizzata per sistemi statici, è necessario prestare attenzione per verificare che le ipotesi valgono. Metodi elettrici, tra cui resistenza elettrica trans-epiteliale (TEER) vengono comunemente implementate negli studi di Transwell e recentemente sono state integrate nel chip di organo PDMS per misure di funzione barriera immediata e continuativa anche21 ,22.
Le limitazioni del presente protocollo comprendono l'elasticità di PDMS, nonché il processo di colata e il montaggio manuale che limita i tassi di produzione. PDMS è un polimero versatile che ben si adatta per i chip di organo che richiedono di azionamento di sollecitazioni meccaniche, ma la sua elasticità può ostacolare la produzione. Parti possono essere difficili da gestire senza deformazione e membrane richiedono supporto film per manipolazione. Di conseguenza, automazione della produzione di Chip di organo può essere limitato. Il processo di fusione, a differenza di goffratura a caldo o stampaggio ad iniezione utilizzato per polimeri termoplastici, è basata su batch e quindi limita anche la velocità effettiva.
Chips di organo attivare studi in vitro del livello dell'organo e corpo umano funzioni in vivo irrorando un mezzo comune attraverso le scanalature vascolari. Mediante ricostituzione fisiologica del tessuto-tessuto interfacce, flusso di molecole tra compartimenti vascolari e parenchimali, spunti di meccanici e fluidico taglio e trasporto, questi dispositivi promuovono histodifferentiation e sono in grado di ricapitolare in vivo-come le funzioni degli organi sia normali e malati. La compartimentazione dei tessuti e dei fluidi in due scomparti imita le loro funzioni in vivo e gli studi di organo Chip sono favorevoli alla sperimentazione farmacocinetica risolta in tempo e modellazione nonché in vitro-in vivo estrapolazione9,10 che è difficile o impossibile a canale singolo MPS14,15,16. Le strutture di microchannel possono essere sfruttate per altre applicazioni, tra cui indagare l'impatto dell'esposizione a fumo di tabacco dinamico con bidirezionale di respirazione in epitelio umano piccolo per sviluppare nuovi biomarcatori di polmone danno23. Le posizioni definite delle membrane planari e alta chiarezza ottica dei dispositivi rendono adatto unicamente per analisi basata su immagini e l'integrazione di sensori incorporati. Lo stimolo meccanico abilitato da vuoto canali integrati e materiali elastomerici fornisce funzionalità non possibile nei sistemi di Transwell. Abbiamo dimostrato che la deformazione meccanica è essenziale per la ricapitolazione di certo in vivo funzioni fisiologiche, tra cui assorbimento delle nanoparticelle nel polmone4, edema polmonare3 e differenziazione di maturare iPS-derivato Glomerulare podociti8.
Applicazioni future del presente protocollo possono includere l'integrazione di varie modalità di rilevamento che può essere utilizzato per fornire letture in tempo reale della risposta dell'organo Chip agli stimoli, quali farmaci, tossine o radiazioni. Il protocollo presentato qui potrebbe essere esteso ai materiali non-PDMS con differenti proprietà ottiche, meccaniche e chimiche, tra cui materiali biodegradabili. Il protocollo di organo Chip presentato qui dovrebbe consentire ai ricercatori di fabbricare dispositivi che offrono un elevato grado di controllo sopra il microambiente di tessuti sani e patofisiologici e organi, che possono essere sfruttati per sviluppo terapeutico, tra cui target discovery, tossicità e farmacocinetiche valutazioni, anche per quanto riguarda la medicina personalizzata.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.e.i. è dei fondatori e detiene una quota in emulazione, Inc. e presiede il Comitato di consulenza scientifica. J.P. è attualmente un dipendente di emulazione, Inc R.N., Y.C., J.P., e d.e.i. sono inventori sulla proprietà intellettuale che ha ottenuto la licenza per emulazione, Inc.
Acknowledgments
Ringraziamo M. Rousseau e S. Kroll per aiuto con fotografia e videografia e M. Ingram, J. Nguyen, D. Shea e N. Wen per i contributi allo sviluppo del protocollo di montaggio iniziale. Questa ricerca è stata sponsorizzata dall'Istituto Wyss per biologicamente ispirato ingegneria presso l'Università di Harvard e la Defense Advanced Research Projects Agency sotto accordi di cooperativa n #W911NF-12-2-0036 e n #W911NF-16-C-0050 e FDA concedere n. HHSF223201310079C, NIH concede n #R01-EB020004 e n #UG3-HL141797-01, e Bill e Melinda Gates Foundation concede #OPP1163237 e #OPP1173198 a DEI. Le viste e le conclusioni contenute nel presente documento sono quelle degli autori e non deve essere interpretati come rappresentare le politiche ufficiali, sia espressa o implicita, della Defense Advanced Research Projects Agency, Food and Drug Administration, la Istituti nazionali di salute, o di governo degli Stati Uniti.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Numero 140 Bioingegneria organo-on-a-chip sistema microphysiological microfluidica microfabbricazione PDMS membrana porosa microchannel deformazione ciclica perfusioneErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
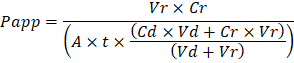
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
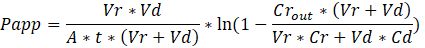
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



