ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
在这里, 我们提出了一个协议, 描述了生产的伸展, 双通道, 器官芯片微流控细胞培养装置综述器官水平功能的体外。
Abstract
大量的铅化合物在制药管道中失效, 因为动物研究往往无法预测人类患者的临床反应。人体器官-芯片 (器官芯片) 微流控细胞培养装置, 为评估人体的功效、 毒性和药代动力学 (PK) 剖面提供实验性平台, 可更好地预测治疗效果和与动物研究相比, 临床安全。这些设备可用于模拟几乎任何器官类型的功能, 并可通过常见的内皮内衬微通道装置连接, 从而在人体器官水平和全身生理层面进行体外研究, 而无需对人进行实验。这些器官芯片包括两个灌流微流体通道, 由通透性弹性膜分离, 一侧有器官特异性实质细胞, 另一边是微血管内皮, 可循环拉伸以提供器官特定的机械提示 (如肺呼吸运动)。该协议详细介绍了使用3D 打印模具进行零件铸件的柔性、双通道、器官芯片的制造, 使多个铸件和后处理步骤相结合。多孔聚二甲基硅氧烷 (PDMS) 膜在压缩下使用硅柱阵列进行微米尺寸通孔铸造。器官芯片的制造和组装涉及可在传统洁净室之外实施的设备和步骤。该协议为研究人员提供了器官芯片技术, 用于药物发现、安全性和功效测试的体外器官和身体层面研究, 以及基本生物过程的机械研究。
Introduction
在这里, 我们描述了使用可扩展协议的双通道、带血管的器官芯片 (器官芯片) 微流体培养装置, 这些设备可以使用, 而这些研究小组缺乏对洁净室和传统软光刻工具的访问。这些设备已经开发, 以概括人体器官水平功能, 以了解正常和疾病生理学, 以及药物反应的体外1,2。这一功能的关键是通过半渗透膜分离的两个灌流微流体通道 (图 1)。这种设计可以在至少两种组织之间进行组织组织界面的娱乐, 通常是多孔膜一侧的器官实质细胞和血管内皮, 以及它们对流体流动的接触。此外, 由于弹性聚合物, 聚 (二甲基硅氧烷) (PDMS), 用于制造器官芯片体和膜组件, 循环机械应变可以应用到整个工程组织组织界面通过弹性膜模拟活体器官的自然物理微环境, 如肺中的呼吸运动和肠道蠕动。

图 1: 器官芯片横断面.器官芯片由两个通道组成, 由一个多孔的弹性膜隔开, 可以用两侧的细胞进行播种。顶部通道横截面为 1 mm 宽 x 1 mm 高, 底部通道横截面为 1 mm 宽 x 0.2 mm 高, 而两个和底部的真空通道均为 0.3 mm 宽、0.5 mm 高, 距射流通道有间隔 0.3 mm。请点击这里查看这个数字的更大版本.
这些可拉伸, 双通道, 器官芯片已被用于演示呼吸运动对纳米粒子吸收在肺部和药物引起的肺水肿3,4的影响;蠕动运动对分化5和肠道细菌过度生长的影响5,6,7;心脏脉动引起的循环变形对肾小球足细胞分化和成熟的影响8。此外, 这些两流明的设备, 包括由细胞外基质 (ECM) 涂层膜分离的内皮内衬的血管通道, 从实质细胞在一个单独的可获得的通道是非常适合表征药物 PK参数和新的目标发现, 在单个灌注通道系统中受到限制。此外, 多个器官芯片可以通过他们的血管通道连接在一起, 以有效地创建一个人体上的芯片, 这可以提供一个有吸引力的人的体外治疗发展的平台9, 10。不同于大多数微生理系统 (MPS)11,12,13, 器官芯片包含两个微流控通道分离的多孔膜, 促进血管实质相互作用在体内器官功能的重述。这不仅简化了不同器官的连接, 通过灌注一个共同的媒介通过血管通道, 但组织和流体的分裂模仿体内功能, 支持药代动力学实验和建模和体外外推算 9,10是困难或不可能在单通道 MPS14,15,16。在微流控器件中, PDMS 的普及导致了工具的开发, 克服了材料固有的吸收小分子10、17的能力。然而, 需要大量的芯片来支持生物研究, 在这种情况下, 微生物剂和 PDMS 吸收化合物的使用使得器官芯片的复用变得困难, 即使对小的研究小组来说, 也必须有可扩展的制造过程。此处所述的协议提供了一种适合于学术实验室使用的设备制造方法, 包括那些缺乏洁净室和软光刻的仪器。该协议旨在扩大对器官芯片的访问, 这些研究人员寻求使用可拉伸的双通道设备来探索基本的生物过程以及转化治疗的发展。
利用 micromanufacturing 领域的最佳实践与制造设计相结合, 开发了一种在大量具有高重现性和产量的大批量生产器官芯片设备的稳健方法。此处描述的制造协议为器官芯片生产提供了一种可扩展的方法。我们描述使用一个可选的模具就地夹具 (MiP;补充材料的设计细节), 再加上聚氨酯垫片带, 以实现铸造 PDMS 组件的放大。聚氨酯带的光泽侧产生光学光滑的 PDMS 部件, 而纹理侧则有利于脱模。我们还介绍了可选的自动膜加工 (AMF), 在固化过程中提供薄膜晶片模具的均匀压缩, 每批次可制造多达24个膜。该设计广泛适用于由经历机械应变和灌注的组织组成的器官的研究, 并且这些芯片可以产生低芯片到芯片的变化量, 以满足小型和大型的需求。研究小组一样。该工作流适用于批处理或装配线格式, 并与质量评估协议兼容, 可用于控制生产流程、人员培训和响应式故障排除。我们希望, 该议定书将扩大获得双通道、可拉伸、器官芯片的能力, 以进行基础和转化研究。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 一般准备工作
- 为了避免碎屑, 使用包装胶带清洁工作区, 用洁净室擦拭和异丙醇擦拭区域。
- 对于需要 pdms 的所有步骤, 混合 pdms 以10:1 的比率 (10 g 的交联剂, 100 g 的弹性体底座)。用手或商用搅拌机混合使用。在这里使用行星离心搅拌机: 在 2000 rpm 时混合2分钟, 然后在 2200 rpm 时将 PDMS 脱气2分钟。
- 用气枪清洁所有模具, 在使用前吹碎碎屑。
注意事项:不要使用金属钳去除碎屑, 因为它会损坏模具的表面。
2. 顶部通道准备
- 用乙醇和洁净擦拭巾擦拭每个聚氨酯片的光泽面。确保所有残余乙醇都从聚氨酯表面干燥。
- 将聚氨酯的光泽面放在 MiP 模具的开边上, 在模具的开口侧创建密封件, 在模具顶部只留下一个良好的开口, 以浇注 PDMS。
注意: 检查每个模具是否安全地覆盖聚氨酯片或 PDMS 将泄漏从模具在浇注过程中。 - 将模具和聚氨酯组件放置在 mip 夹具中, 在 mip 夹具末端有纹理的一面。继续这样做, 直到所有模具都被放置在夹具。
- 使用扳手转动手柄, 直到夹具间距宽度为 25 mm 时, 拧紧 MiP 夹具。
- 在 MiP 夹具周围制造一条铝箔, 防止过量的 PDMS 泄漏到表面上。
- 将 PDMS 倒入模具中, 直至满。
注: 每个芯片顶部组件需要大约3毫升的 PDMS。 - 一旦整个夹具被填满, 把夹具放进真空干燥器。将真空度拉至-80 帕, 1 h 至德式 PDMS。
- 1小时后, 从干燥器中取出 MiP 夹具, 并在60摄氏度烤箱中放置至少4小时以治疗 PDMS。
- 使用扳手拆卸 MiP 夹具, 顺时针旋转手柄, 松开夹具。一旦模具没有压缩, 从夹具中取出模具。
- 从每个模具中取出聚氨酯条并丢弃。
- 小心地将 PDMS 零件从模具中脱模, 并将其特征端向上放置。
- 在末端制表符缺口处将瓷砖刮刀的刀片排成一行, 然后将每个端部切掉, 以单列顶端组件。
- 检查部件是否存在以下任何故障模式, 并丢弃任何不满意的部件: 主通道中的划痕、通道区域上方的大碎片、大气泡、变形的真空通道。
- 在室温下, 在压力正柜内将成品零件存放在方形培养皿中。
3. 底部通道准备
- 将大约10.5 克的 pdms 倒入模具中, 直到 pdms 到达腔顶部。
- 检查底部通道模具, 将 PDMS 固化到模具底部。
- 如果脏了, 从模具底部刮掉老的 PDMS, 因为模具底部的不平表面会导致最终零件的厚度不均匀。
注意: 对于小 < 2 厘米2区域, 被发现, 气枪可以非常轻柔地使用在空间上移动 PDMS。
- 将模具放入真空干燥器1小时。
- 1小时后, 将模具移动到60摄氏度烤箱 > 4 小时。
- 将模具放置在层流罩上的工作台上。从模具的一个边缘松开 PDMS。
- 抓住一个角落, 轻轻地从模具表面剥去 PDMS。
- 完全移除时, 请放置在工作表面上, 以便通道要素朝上。
- 使用瓷砖切割机将零件沿外边缘切割, 在步骤2.12 中将切片刀刀片置于缺口 PDMS 中。
- 在胶带上放置零件功能, 以清除任何碎屑。
- 从包装胶带中取出零件。在幻灯片上拖动零件的松散末端。松散的末端将与玻璃层压。
注意: 在放置零件时避免拉伸部件是非常重要的.如果气泡被夹在零件和玻璃之间, 用镊子轻轻抬起零件并重新铺设。 - 对零件进行质量控制检查。检查部件是否有任何故障模式, 并丢弃任何不满意的部件, 包括主通道中的划痕、大碎片、大气泡或变形的真空通道。
- 使用磁带覆盖功能。
- 在室温下将零件存放在正压柜中。
4. PDMS 膜制备
- 检查晶片背面是否没有 PDMS。
- 将每个膜晶片放置在 AMF 托盘中的指定插槽中。
- 使用1毫升注射器将0.09 毫升的 PDMS 放到每个膜晶片柱阵列的中心。让 pdms 至少坐5分钟, 让 pdms 在膜晶片的所有柱子上传播。
注意: 不要继续下一步, 直到至少75% 的 post 阵列覆盖在 PDMS 中。膜的质量提高了 PDMS 被允许灯芯进入后区的时间, 因此更长的等待时间在这一步是首选。 - 等离子处理 20 W 的聚碳酸酯带在四十五年代, O2气体在0.80 毫巴在等离子机器。
- 从等离子机中取出聚碳酸酯板材, 并使用剪刀将聚碳酸酯板材切成45毫米 x 45 毫米的正方形。
注: 尽量减少与等离子处理表面的接触, 防止灰尘粘在聚碳酸酯上。 - 将聚碳酸酯方形的等离子处理侧轻轻放置在膜晶片上的液体 PDMS 上。确保聚碳酸酯和 PDMS 接触。
注意: 避免在聚碳酸酯和 PDMS 之间的空气袋。 - 将预切割的 PDMS 垫片放置在聚碳酸酯方形的中心。
- 将预切纹理聚碳酸酯板材放在 PDMS 块上, 使装配体免受压缩板的粘合。
- 插入纸盒, 使纸盒3位于背面, 纸盒2位于中间, 纸盒1位于前部。纸盒1具有对齐的凹槽。
- 打开输出压力阀, 非常缓慢地打开输入压力阀。然后关闭输出压力阀。
注: 这是为了使输出 4 kg 的力逐渐应用到每个膜晶片, 而不是瞬间, 这可能会破坏晶片。 - 将 AMF 开关翻转到 ON 以开始固化循环。在表 1中列出的 4 kg (16 帕) 压缩和坡向温度循环的固化晶片。
| 步 | 温度 (°c) | 持续时间 (分钟) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | 举行 |
表 1-膜固化条件
- 关闭输入压力阀, 打开输出压力阀, 释放气瓶的压力。
- 卸下托盘并将其带到层流罩中。
- 小心剥离纹理聚碳酸酯, 并小心去除 PDMS 垫片。
注意: 观察 PDMS 垫片, 以确保它不会剥离聚碳酸酯载体, 如果这种情况开始从不同的角落剥离。- 通过聚碳酸酯载体检查 PDMS 膜, 用于带通孔的区域, 并使用标记跟踪通孔区域的轮廓, 并标记膜中的任何孔或缺陷。
- 使用晶片处理钳, 松开托盘中的晶片。
- 从晶片中取出每个膜并放入培养皿中。
注: PDMS 膜将从膜晶片中脱模, 并将粘附在聚碳酸酯的背衬上。如果 PDMS 开始从聚碳酸酯载体分离, 则从不同区域剥离。 - 在室温下将膜和晶片储存在正压柜中的培养皿中。
5. 顶部组装和准备
- 使用哑光胶带, 清洁 PDMS 膜以及培养皿内部, 去除碎屑。
- 将每个顶部组件的特征面完全胶带, 以去除碎屑。
- 将顶部通道部分 ("顶部") 功能侧上与 PDMS 膜培养皿。
注: 请注意, 某些膜可用于一个或两个顶部, 具体取决于可用区域的大小。每个顶部的主要通道应适合在膜的标记区域内。 - 将培养皿装入等离子机器。
- 等离子处理膜和顶部在 20 W 为四十五年代, O2气体在0.80 毫巴。
- 一旦粘合循环完成, 取出盘子, 并将激活的部件功能侧向下放置在膜上, 确保部件完全层压与无气泡膜。
- 将零件放入60摄氏度烤箱, 至少2小时进行退火。
- 使用手术刀, 在粘合顶部的周长周围进行跟踪, 以分离聚碳酸酯载体上的顶膜组件。
注: 请勿切割托架。 - 跟踪零件后, 从聚碳酸酯剥离装配体。与顶部粘合的 PDMS 膜应从载体上剥离。
- 使用锋利的针尖钳, 从进入底部通道的端口取出膜, 并在立体镜下用镊子清除任何碎屑或灰尘。
注: 请勿将膜的任何部分留在接入口。
6. 芯片组装
- 功能侧上, 等离子处理组件与底部组件使用步骤5.5 中的条件。
- 在倒置显微镜下, 将顶部组件与显微镜滑动到下半部分对齐。
- 放置在60摄氏度烤箱至少2小时。
- 芯片质量控制检查
注意: 密切注意芯片的主要端口和通道。检查故障模式的眼睛, 也在显微镜下。- 要检查芯片是否已完全粘合, 请轻轻地在芯片的每个角上进行检查分层部件。
- 查看芯片的通道, 检查是否有皱纹或下垂的膜, 这将显示为波浪图案或通道中的光偏转。
- 进行显微镜检查, 检查主通道中的碎屑。
注: 在非关键区域 (如真空通道) 中的碎屑是可接受的。 - 随着芯片仍在倒置显微镜, 检查主通道和真空通道的分层。
注: 非关键区域 (如芯片边缘) 的分层是可接受的。 - 检查主通道是否在50-60 µm (1-2 膜孔) 内对齐。
注意: 通道与真空通道不重叠是至关重要的。 - 检查主通道和进风口通道之间的膜是否完好无损, 没有任何明显的孔。
注: 膜中的任何孔都可能导致通道外漏屑或细胞生长。
- 在室温下将芯片储存在正压柜中的培养皿中。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
这里介绍的协议描述了 PDMS 器官芯片的可扩展制造。这些设备能够在弹性多孔膜上培养两种不同的灌流组织类型 (图 1)。PDMS 通道采用3D 打印模具进行铸造, 可加速新设计的原型制作 (图 2A和 2B)。顶部通道在受压的聚氨酯垫片的压缩下浇铸, 以生产带有模压端口的元件 (图 2C), 而底部通道组件在托盘中浇铸并在显微镜滑动背板上处理 (图 2D)。这种制造方法将零件的多尺度图形组合成一个单一步骤, 从而节省时间、提高重现性和可追溯能力, 并减少因口冲孔和多个切削步骤而产生的碎屑。多孔膜对器官芯片的功能至关重要, 而基于铸模硅片的制造方法会导致薄膜的厚度和表面光洁度一致 (图 3)。通过聚碳酸酯载体处理, 可实现更大的批次生产和存储。
组装的器官芯片 (图 4) 由光学透明封装中的两个灌注通道组成。在重叠区域中, 多孔 PDMS 膜使代谢物、蛋白质、治疗剂、病原体和细胞的组织组织相互作用得以重述器官芯片功能, 同时两个平行通道用于提供机械使用循环真空驱动进行应变。PDMS 膜 biomimetically 的孔隙率支持代谢物的通量, 生长因子, 甚至细胞之间的血管和器官实质 (图 5)。通过与无 Caco2 肠细胞的出口通道中的染料浓度测定膜的表观通透性 (P应用, cm/秒)。肠道芯片细胞层提供了明显增加的渗透性屏障。器官芯片可以通过平行真空通道来进行定量和可重复应用循环应变加载到膜, 因此培养组织 (图 6)。这种循环应变结合培养基灌注支持细胞分化, 以更好地模拟体内器官生理学, 如肠道内绒毛的形成。

图 2: 3D 打印模具的通道制造.器官芯片部件是针对高分辨率3D 打印模具 (A 和 B) 铸造的, 这使得设计的通用性和原型比传统的软光刻更大。顶部通道部件 (C) 在压缩下固化, 无需在成品零件中冲孔端口。每三次铸造都是单一化单切。底部通道部件 (D) 放置在玻片上, 便于使用和成像。比例尺在所有图像中约为1厘米。请点击这里查看这个数字的更大版本.

图 3: 多孔 PDMS 膜采用 DRIE 印花硅片铸造而成。(A) 渲染7µm 直径, 50 µm 高 micropillars 蚀刻使用 DRIE 成硅晶片。(B) 在 4 kg 的压缩 (16 帕) 下, PDMS 被固化, 以创建50µm 厚膜, 阵列7µm 直径, 但孔间距六边形40µm 分开。请点击这里查看这个数字的更大版本.

图 4: 组装的 PDMS 器官芯片的照片.红色染料填充用于实质细胞的较大顶端通道, 而蓝色染料则突出了通常用于血管内皮的基底通道。请点击这里查看这个数字的更大版本.

图 5: 通过微孔 PDMS 膜, 惰性示踪剂级联蓝的渗透性.培养基中的级联蓝酰肼染料被装入器官芯片的顶部通道, 并在60µL/小时灌注, 以测量膜中染料的通量, 使其进入含有培养基的底部通道。将空薯片与顶端通道 Caco2-BBe1 细胞和人血管内皮细胞 (HUVEC) 在基底通道培养6天的肠道芯片进行比较。误差线表示平均值的标准误差。请点击这里查看这个数字的更大版本.

图 6: 利用真空侧通道进行膜应变的应用.图解表示膜的线性应变调制, 以响应施加的真空压力。循环单轴应变均匀地应用于器官芯片的培养区域, 使用真空到平行侧通道。在真空压力 (R2 = 0.992) 的每-10 帕变化中, 应变与真空压力约为1% 应变时呈线性关系。误差线表示平均值的标准偏差。请点击这里查看这个数字的更大版本.
补充材料:请点击这里查看这个数字的更大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
制造过程依赖于高分辨率的3D 打印模具, 以模式的 pdms 顶部和底部器官芯片体组件加上弗龙多孔 PDMS 膜。之所以选择这种关键方法, 是因为简化了原型设计, 结合了快速过渡到扩大制造和更换工装。顶部组件模具设计用于在铸造步骤中使用定义的垂直轮廓在精确位置对端口进行图案处理。这不仅避免了人工冲压接入口所涉及的劳动力, 而且减少了工作场所的碎片, 实现了对接口歧管或仪器的可重复端口对准, 并可以控制插入件的配合和密封。用于流体和气动连接的油管或管脚。模具是堆叠在彼此的顶部, 在一个压缩夹具, 由合规聚氨酯板分离, 以方便通孔铸造的端口。通过在单个夹具中堆叠多个零件, 单个用户只需一步便可将大量组件与端口一起铸造。模具的材料选择和制造方法对于提供必要的特征分辨率、低表面粗糙度和高平整度, 用于器件装配和后续成像应用至关重要。光固化可以满足这些要求, 尽管具有高偏转温度 (> 80 摄氏度) 和与 PDMS 固化相容性的材料减少了可用的聚合物范围。各种市面上可用的树脂, 包括玻璃填充树脂, 符合这些标准。
弹性多孔 PDMS 膜是一个器官芯片最独特和最关键的组成部分, 同时也是最复杂的制造。外包给供应商的深反应离子蚀刻 (DRIE) 工艺用于 microfabricate 50 x 50 毫米六角柱阵列 (7 µm 直径、40µm、50µm 高、C4F8涂层), 用于在 PDMS 膜中进行孔型。柱阵列的质量对于实现坚固的膜铸造至关重要。特别是, 柱子必须蚀刻到紧公差与光滑的垂直轮廓, 以避免凹槽或过度的侧壁粗糙度, 可能导致模具失效。应注意避免 "植草" 在蚀刻区域的底部, 这可能影响膜脱模和细胞附着。采用成功的通孔模式和器件集成的膜制造是协议中最复杂的一节。关键的是, 在每个晶片上放置0.09 毫升的 PDMS, 并允许足够的时间来传播, 这对于避免不完整的通孔成型至关重要。正确的等离子体处理聚碳酸酯的支持, 以实现稳定的膜的脱模和粘合步骤, 不起皱或拉伸。该背衬提供了一种坚固的方法, 可从易碎硅晶片中脱模铸膜。
适用于每个晶片的压缩载荷对于均匀通孔制造也是必不可少的。早期使用重量阻碍了膜的生产, 导致由于非均匀力分布而产生的产量差。为了克服生产瓶颈, 我们优化了以前发布的膜制造协议18 , 并建立了自动化的膜加工 (AMF) 来实现流程的并行化。AMF 由可编程热板支持的24个气动活塞组成, 可在经过编程的 PDMS 固化过程中提供受控压缩力。将聚碳酸酯背膜放置在未固化的 PDMS 上, 然后使用 AMF 的气动活塞均匀压缩, 同时加热聚合 pdms。关键的是, 该协议中所述的渐进固化过程会导致高质量的膜比单步达到最高温度, 从而观察到在固化过程中气泡发展产生的羽化图案。虽然可选, AMF 增加的吞吐量大大超出了什么是可能使用在烤箱的重量。
故障诊断产生的器官芯片发生在两个级别: 在制造过程中, 在器官芯片文化。我们开发了一种可视化方法, 用于在铸造膜中形成通孔的质量保证 (QA), 大大加快了生产过程, 同时提高了组装器官芯片的质量和可靠性。此 QA 方法允许进行过程故障排除, 我们建议保留过程条件记录, 以启用在细胞培养过程中可能发生的跟踪制造问题。在器官芯片培养过程中, 惰性示踪染料是测量屏障功能的最简单方法, 用于诊断制造过程和细胞培养步骤。在历史上, 路西法黄色由于其小分子量和先天荧光而被使用, 但级联蓝提供了类似的特性, 其辐射谱较窄, 不太可能干扰下游检测。更大的分子, 如聚乙二醇 (PEG) 或葡聚糖共轭荧光基团更大, 从而导致低渗透率整体和较低的灵敏度。示踪染料的表观渗透率 (P应用, cm/秒) 可用于确定器官或组织的屏障功能特性 (图 4)。以下等式可用于计算剂量通道和接收通道之间的P应用 , 并从主要用于万士隆研究19、20的方程式派生, 并纠正示踪染料损耗通过比较两个输出流而不依赖于流出的质量平衡假设而引起的。

Vr是时间t后接收通道出水的体积;Vd是在时间t后的剂量通道流出的体积;A是膜通孔区域在 cm2 (此设备的 0.167 cm2 ) 的区域;t是在几秒钟内收集废水的时间;Cr是在接收通道出水中示踪染料浓度的测量变化;镉是在计量通道出水中测定的示踪染料浓度。此方程式有效的关键假设包括: 1) 稳态示踪剂染料加药浓度随着时间的推移t, 2) 与Cd相比, Cr的浓度较小, 3) 系统的渗透率均匀分布跨文化区域。虽然这个等式可以用于静态系统, 但必须小心检查假设是否正确。电气方法, 包括反式上皮电阻 (特尔) 通常在万士隆研究中得到实施, 最近已被纳入 PDMS 器官芯片, 用于即时和连续阻隔功能测量, 以及21 ,22。
本协议的局限性包括 PDMS 的弹性以及用于限制生产速率的手动铸造和装配过程。PDMS 是一种多功能聚合物, 非常适合需要机械应变驱动的器官芯片, 但其弹性会阻碍生产。零件在不变形的情况下难以处理, 而膜则需要用于操纵的背膜。因此, 可以限制器官芯片生产的自动化。与热压花或热塑性聚合物用注塑成型不同, 铸造工艺是基于批次的, 因此也限制了产量。
器官芯片能够通过灌注一个共同的媒介通过血管通道,体外研究人体器官和身体水平的功能. 通过重组生理组织-组织界面、血管和实质舱间的分子通量、机械线索和射流剪切和运输, 这些装置促进 histodifferentiation, 并能综述正常和病变器官的体内样功能。两个夹层中的组织和流体的分裂模仿其体内功能, 而器官芯片研究可用于时间分辨的药代动力学实验和建模以及体外体内外推9,10在单通道 MPS14,15,16是困难或不可能的。微通道结构可用于其他应用, 包括研究动态烟草烟雾暴露与双向呼吸对人小气道上皮的影响, 开发新的肺损伤生物标志物23。平面膜的定义位置和器件的高光学清晰度使其特别适用于基于图像的分析和嵌入式传感器集成。通过集成真空通道和弹性材料实现的机械刺激, 在万士隆系统中提供了不可用的功能。我们已经证明, 机械应变是必要的在体内的某些生理功能的重述, 包括在肺中的纳米颗粒吸收4, 肺水肿3和成熟的分化iPS 衍生肾小球足细胞8。
本议定书的未来应用可能包括整合各种传感方式, 可用于提供对药物、毒素或辐射等刺激物的器官芯片反应的实时读数。此处介绍的协议可扩展到具有不同光学、机械和化学特性 (包括生物降解材料) 的非 PDMS 材料。此处介绍的器官芯片协议应使研究人员能够制造出能够对健康和病理生理组织和器官的微环境进行高度控制的设备, 这些装置可用于治疗开发, 包括目标发现, 毒性和药代动力学评估, 以及个性化的药物。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. 是创始人, 持有模拟公司的股权, 并主持其科学咨询委员会。目前, 摩根大通是注册护士、Y.C.、jp 和 D.E.I. 的员工, 是知识产权的发明者, 该公司已获授权效仿。
Acknowledgments
我们感谢 m. 卢梭和罗. 罗姆帮助摄影和录像, m. 英格拉姆, j。这项研究是由哈佛大学生物启发工程研究所和国防高级研究项目机构在合作协议 #W911NF-12-2-0036 和 #W911NF-16-C-0050, 和 FDA 赠款赞助 WyssHHSF223201310079C, NIH 授予 #R01 EB020004 和 #UG3 HL141797-01, 比尔和梅琳达·盖茨基金会授予 #OPP1163237 和 #OPP1173198 工会。本文件所载的意见和结论均为作者的观点, 不应被解释为代表国防高级研究项目署、食品和药物管理局的官方政策, 无论是明示的还是默示的。国家卫生研究院或美国政府。
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
生物工程 期刊 140 片上器官 microphysiological 系统 微流控 微细加工 PDMS 多孔膜 微通道 循环应变 灌注Erratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
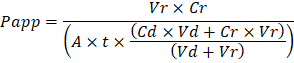
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
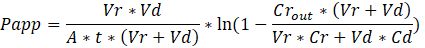
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



