ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
ここでは、伸縮性、デュアル チャネルの作製、臓器レベルの機能体外の概説のため器官チップ マイクロ細胞培養装置を記述するプロトコルを提案する.
Abstract
鉛化合物のかなりの数は、動物実験はしばしば人間の患者の臨床反応を予測する失敗するため医薬品パイプラインの失敗します。人間チップ上の器官 (器官チップ) マイクロ細胞培養装置、効果、毒性、およびヒトでの薬物動態 (PK) プロファイルを評価するための in vitro実験プラットフォームを提供する、治療効果のより良い予測因子があり、動物実験と比較してクリニックで安全。これらのデバイスは、あらゆる臓器の種類の機能をモデル化するされることがあり、しなくて人間の臓器レベルと全体の体レベルの生理学の in vitro研究を実行する一般的な内皮並んでマイクロを介して fluidically リンクすることができます。人体実験を行います。これらの器官のチップから成る臓器固有実質細胞 1 つの側面と提供するために周期的に伸ばすことができる一方で、微小血管の内皮細胞透過性弾性膜で区切られた 2 つの灌流マイクロ チャンネル臓器特異力学的手がかり (例えば肺の運動を呼吸)。このプロトコルの詳細柔軟でデュアル チャネルの作製、臓器のチップ 3 D を使用して部品の鋳造金型を印刷は、複数キャストの組み合わせを有効にしてポスト処理手順。多孔質ポリ (ジメチル シロキサン) (PDMS) 膜がマイクロ メートル サイズのキャスト スルーホール圧縮下におけるシリコン柱の配列を使用します。オルガン チップの加工及び組立設備と伝統的なクリーン ルーム外に実装できる手順が含まれます。このプロトコルは、基本的な生物学的プロセスの解明と同様、創、安全性と有効性のテストの器官と体レベル研究の in vitroのオルガン チップ技術へのアクセスを持つ研究者を提供します。
Introduction
ここでは、デュアル チャネルの製造クリーン ルームと伝統的なソフト ・ リソグラフィー ツールへのアクセスに欠けている研究グループが使用する従順なスケーラブルなプロトコルを使用して血管柄付きチップ上の器官 (器官チップ) マイクロ培養装置について述べる。これらのデバイスは、通常の理解、病気の生理学、薬物反応の in vitro1,2の人間の臓器レベル機能を要約する開発されています。この機能は、半透膜 (図 1) で区切られた 2 つの灌流マイクロ チャネル エンジニア リングに不可欠。この設計により、組織界面の組織通常多孔性膜の片側に臓器の実質細胞と、血管内皮細胞と同様、流体への暴露、少なくとも 2 種類のレクリエーションです。さらに、ので弾性ポリマー、ポリ (ジメチル シロキサン) (PDMS) オルガン チップ体を作製するために使用し、膜成分、機械的ひずみは、設計全体に適用できる組織インターフェイスを介して弾性膜呼吸肺の運動と腸内の蠕動運動などの生体の自然の物理的な微小環境を模倣します。

図 1: オルガン チップ断面します。オルガンのチップは、両側の細胞を播種できます多孔質弾性膜で区切られた 2 つのチャネルで構成されます。クロス セクションでは、最上位のチャネル 1 mm x 1 mm 高く、下部チャネル クロス セクションは、1 mm x 0.2 mm 高、真空チャンネル両方で、下の部分が 0.3 mm、幅 0.5 mm 高流路から 0.3 mm の間隔。この図の拡大版を表示するのにはここをクリックしてください。
肺と薬剤性肺水腫3,4のナノ粒子の吸収の動きを呼吸の影響を示すためこれらの伸縮、デュアル チャネル、オルガンのチップが使用されています。蠕動運動が分化5および腸5,6,7; 細菌の増殖に及ぼす影響8腎糸球体足細胞の成熟と分化に心臓の拍動による繰返し変形の影響。細胞外マトリックス (ECM) で区切られた内皮並んで血管チャネルが含まれているさらに、これらの 2 ルーメン デバイス-別途アクセス チャネル内で実質細胞からのコーティング膜は薬物 PK の評価に適していますパラメーターと 1 つの灌流に限定されている新しいターゲットの検出チャンネルのシステムを実行します。また、複数の臓器のチップはを介して互いにリンク可能性があります効果的なチップを作ること、人間体-に-、治療開発9の魅力的な人間の in vitroプラットフォームを提供できる、その血管チャネル 10。最も生理学的マイクロ システム (MPS)11,12,13, とは異なり臓器チップを含む血管実質の相互作用を容易にする多孔質膜で区切られた 2 つのマイクロ流路体内の臓器の機能を要約します。これは一緒にさまざまな臓器の血管を通じて一般的なメディアを灌によってリンク簡素化だけでなく、組織や体液の区画化体内機能を模倣し、薬物動態学的実験をサポートし、体外・体内外挿9,が困難または不可能単一チャネル MPS14,,151610だけでなく、モデリングです。PDMS マイクロ流体デバイスでの人気は、小さな分子10,17を吸収する材料の固有能力を克服するツールの開発につながっています。ただし、微生物剤と PDMS 吸収化合物の使用が困難な臓器チップの再利用をする生物学の研究をサポートするために必要なチップの大量の小規模の研究グループにもスケーラブルな製造工程を必要とします。ここで説明されているプロトコルは、クリーン ルームやソフト ・ リソグラフィーへのアクセスに欠けているものを含む、大学の研究室での使用に適したデバイス作製手法を提案します。このプロトコルは、オルガン チップに橋渡し治療の開発と同様、基本的な生物学的過程の探索に伸縮、デュアル チャネル デバイスを利用しようと研究者の広い範囲でのアクセスの拡大を目指しています。
製造のためのデザインと相まって micromanufacturing フィールドのベスト ・ プラクティスを活用し、堅牢なアプローチは、高い再現性と収量大量にオルガン チップ デバイスを製造するため開発されました。ここで説明した加工プロトコルは、オルガン チップ生産の拡張性のある方法を提供します。我々 は、オプション場所で金型治具 (MiP;補足材料の設計詳細) ポリウレタン ガスケット ストリップと相まって PDMS コンポーネントを鋳造のスケール アップを有効にするの使用をについて説明します。ポリウレタンのストリップの光沢のある側は、テクスチャ側を容易に取出し中に光学的に滑らかな PDMS 部品を生産します。使用のオプション自動膜製作者 (AMF) バッチごとの 24 の膜までを製造するため硬化時に膜ウェーハ金型の均一な圧縮を提供するについても述べる。デザインは機械的ひずみや灌流、組織から成る臓器の研究に広く適用、これらのチップは、小規模および大規模のニーズに合わせて必要な数量で変動の少ないチップ ・ ツー ・ チップを生産できます。同様の研究グループ。ワークフローは、バッチまたは流れ作業形式に従うと容易に生産プロセス、人材育成、および応答性の高いトラブルシューティングの制御のための品質評価プロトコルとの互換性です。我々 は、このプロトコルがデュアル チャネル、伸縮性、基礎やトランスレーショナル研究機関チップの機能へのアクセスを拡大することを願っています。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 一般準備
- 破片を避けるためには、梱包用テープを使用して作業領域をきれいにしクリーン ワイプとイソプロピル アルコールを拭きます。
- PDMS を必要とするすべての手順については、10:1 の比率 (架橋剤、エラストマー ベースの 100 g の 10 g) で PDMS をミックスします。手でまたは市販のミキサーをミックスします。ここで遊星遠心攪拌機を使用: 2000 rpm で 2 分のための混合し、2200 rpm で 2 分間、PDMS を脱気します。
- すべてをきれいには、使用前に破片を吹き消すのための空気砲を成形します。
注意:それは、金型の表面に損傷を与える残骸を削除するのに金属の鉗子を使用しないでください。
2. トップ チャンネル準備
- 各ポリウレタン部分の光沢のある面を下エタノール、クリーン ルーム ワイパーで拭いてください。ポリウレタンの表面からすべての残留エタノールを乾燥していることを確認します。
- ポリウレタンの光沢のある側を注ぐ PDMS の金型の上部に井戸のような穴だけを残して、金型の開いている側のシールを作成する MiP 金型の開放側にかぶせます。
注: ことを確認すべての金型はポリウレタン部分でしっかりと覆われて、PDMS 注ぐ時に金型からリークが発生します。 - MiP 治具、MiP 治具の終わりに対してテクスチャ側にカビやポリウレタンのアセンブリを配置します。すべての金型は、治具に置かれているまでこれを行うに進みます。
- MiP 治具を治具の間隔は 25 mm 幅までレンチを使用してハンドルを回して締めます。
- 周囲の余分な PDMS 表面上に漏れを防ぐために MiP 治具アルミ箔のボートを作る。
- フルまでも金型のそれぞれに PDMS を注ぐ。
注: 各チップの最上位のコンポーネントには、PDMS の約 3 mL が必要です。 - 全体の治具がいっぱい、一度真空デシケータに治具を配置します。PDMS をガス抜き 1 時間-80 kPa の真空を引きます。
- 1 時間後、デシケータから MiP 治具を取り外し、PDMS を治すため、少なくとも 4 時間のための 60 ° C のオーブンで。
- レンチを使用して MiP 治具を分解、ハンドルの回転により、治具を緩める反時計回りに。金型圧縮から解放されたら、治具から金型を削除します。
- 各金型からポリウレタンのストリップを削除し、破棄します。
- 慎重に解除金型、金型から PDMS パーツとそれら機能面を上に置きます。
- タブの切り込みでタイル スクレーパーの刃並び距離両端をカット切り出すトップ コンポーネント。
- 故障モードを次のいずれかの部分をチェックし、不十分な部分を破棄: 主なチャネル、チャネル領域、大きな気泡の上の大きい残骸の傷変形真空チャンネル。
- 常温圧力肯定的なキャビネット内で正方形のペトリ皿に完成品を格納します。
3. 下部チャネルの準備
- PDMS 空洞の上に達するまでは、PDMS の金型に約 10.5 g を注ぐ。
- 金型の下に硬化 PDMS の下部チャネル金型を点検します。
- 汚れた場合、型の底に凹凸が最終的な部分の不均一な厚さを引き起こすことができますので、金型の下から古い PDMS をこすり。
メモ: 小型の < 2 cm2エリアが発見された、エアガンはスペース上に PDMS を移動する非常に優しく使用できます。
- 1 時間真空デシケータに金型を配置します。
- 1 時間後、レベル 60 ° C のオーブンに金型を移動 > 4 h。
- 層流フードのテーブルに金型を配置します。金型の 1 つの端からの PDMS を緩めます。
- 1 つの角をつかんで優しく金型表面から PDMS 戻って皮をむきます。
- 完全に削除されるようにチャネル機能の顔を作業面に置いてください。
- タイル カッター、タイル カッター刃を配置する手順 2.12 のように切欠き PDMS で外側の縁に沿ってパーツをカットします。
- パーツ機能側に置く任意の残骸を削除するテープ。
- ガムテープから部分を削除します。一部の緩い端をスライドにドラッグします。ガラスと緩やかな終わりを薄板にします。
注:.を敷設しながら部分をストレッチを避けるために重要です。バブルが部分とガラスのトラップされた場合、注意深く鉗子で把持部分を持ち上げ、再敷設します。 - 部品の品質管理検査を実行します。任意の障害モードの部分をチェックし、メイン チャンネル、大型こみ、大泡、または変形真空チャンネルの傷が含まれているものも含めて、任意の不満足な部分を破棄します。
- テープで機能をカバーしてください。
- 正圧常温キャビネット部分を格納します。
4. PDMS 膜作製
- ウェーハが PDMS の背面に無料であることを確認します。
- AMF トレイに指定スロットに各膜ウェーハを配置します。
- 1 mL の注射器を使用すると、各膜ウェーハのポストの配列の中央に PDMS の 0.09 mL を配置します。PDMS 膜ウェーハの記事全体に広がる PDMS を許可するように 5 分以上座るをしましょう。
注: は、PDMS のポストの配列の少なくとも 75% が覆われるまで次の手順に続行しないでください。もはや、PDMS がのでこのステップで待機時間が長く、最寄りのポスト領域に芯を許可されて膜の品質が向上します。 - プラズマは、45 の 20 W でポリカーボネート ストリップを扱う s、O2ガス プラズマ マシンで 0.80 mbar。
- プラズマ機からポリカーボネート シートを外し、45 mm × 45 mm の正方形にポリカーボネート シートをカットするはさみを使用してください。
注: プラズマとの接触を最小限に抑えるポリカーボネートへのこだわりからほこりを防ぐために表面を処理します。 - 液体 PDMS 膜ウェーハを中心にポリカーボネートの正方形のプラズマ処理側がそっと横たわっていた。ポリカーボネートと、PDMS では、連絡先を確認します。
注: は、ポリカーボネートと、PDMS の空気ポケットを避けるため。 - ポリカーボネートの正方形の中心にカット済みの PDMS スペーサーを配置します。
- 圧縮プレートに接着からアセンブリ保持する PDMS ブロックにカット済みの織り目加工のポリカーボネート シートを配置します。
- トレイ 3 は、背面トレイ 2 は、途中で、トレイ 1 は、フロント、トレイを挿入します。トレイ 1 が位置合わせノッチです。
- 出力圧力バルブを開き、非常にゆっくりと入力圧力弁を開きます。そうして出力圧力バルブを閉じます。
注: これは出力 4 kg の力が徐々 に即座に、ウエハを壊す可能性がありますではなく各膜ウェーハに適用されるようです。 - 硬化サイクルを開始するに AMF のスイッチを入れます。ウェハ圧縮の下で 4 kg (16 kPa)、表 1に示すランプ温度サイクルを治します。
| ステップ | 温度 (° C) | 時間 (分) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | ホールド |
表 1 - 膜養生条件
- 入力圧力弁を閉じ、空気シリンダーからの圧力を解放する出力圧力バルブを開きます。
- トレイを削除、層流フードを持参してください。
- 織り目加工のポリカーボネートを慎重にはがし、PDMS スペーサーを慎重に取り外します。
注意: 別の隅から同じ作業のやり直しが発生した場合それも剥がれることがありませんポリカーボネート キャリアを確実に PDMS スペーサー。- スルーホールとの区域のキャリアのポリカーボネート PDMS 膜を検査し、マーカーを使用して貫通穴領域のアウトラインをトレースし、任意の穴または膜の欠陥をマークします。
- ウエーハ用鉗子を使用すると、トレイからウェーハを緩めます。
- ウェハから各膜を除去し、シャーレに置き。
注: PDMS 膜膜ウェーハから金型が解除とバックアップ ポリカーボネートに付着します。PDMS は、ポリカーボネートのキャリアからデタッチを起動する場合は、別の地域からはがしてください。 - 室温でキャビネットの肯定的な圧力でペトリ皿に膜、ウェハを格納します。
5. トップ アセンブリと準備
- マットのテープを使用して、きれいに PDMS 膜としてのがれき撤去をシャーレの中身。
- 徹底的にテープの残骸を削除する各最上位コンポーネントの機能面。
- PDMS 膜をペトリ皿に最上位チャネル部分 (「上」) 機能面を上を配置します。
注: は、1 つまたは 2 つのトップ部分のサイズによって使用可能な領域のいくつかの膜が使える可能性があります注意してください。各上部のメイン チャンネルは膜のマークされた領域内に収まる必要があります。 - プラズマ機にペトリ皿をロードします。
- プラズマ治療膜と上部 20 W 45 s、O2ガス 0.80 mbar。
- ボンディング サイクルが終わったら、食器を片づけると横たわり活性化部分機能側膜上に、一部完全にない泡膜を積層したことを確認します。
- 60 ° C のオーブン アニールする少なくとも 2 時間に部品を配置します。
- メスを使用すると、ポリカーボネート キャリアから上部膜アセンブリを分離する結合の上部の周囲をトレースします。
注: は、キャリアをカットしないでください。 - 部分をトレースすると、一度は、ポリカーボネートからアセンブリをはがします。PDMS 膜上に結合されているキャリアから皮をむく必要があります。
- 鋭い先端の鉗子を使用して、下部チャネルにアクセス ポートから膜を削除し、堅実下鉗子での破片やほこりを削除します。
注: は、アクセス ポートを覆う膜の任意の部分を残してはいけない。
6 チップ
- 5.5 のステップに条件を使用して下部コンポーネントとサイドアップ、プラズマ治療アセンブリを備えてください。
- 倒立顕微鏡下半分下に顕微鏡のスライドの最上部のアセンブリを配置します。
- 少なくとも 2 時間の 60 ° C のオーブンで配置します。
- チップ品質管理検査
注: は、主要港に細心の注意とチップのチャネルを支払います。目とも顕微鏡下で故障モードを確認します。- チップの結合が完全にであることを確認するには、剥離部分をチェックするチップの各コーナーで軽く引っ張る。
- 波状のパターンまたはチャネルの光偏向として表示されますしわやたるみ膜をチェックするチップのチャンネルを見てください。
- メイン チャンネルの残骸を検査する顕微鏡検査を実行します。
注: 真空のチャンネルなどの非重要な領域の残骸は許容です。 - 倒立顕微鏡上まだチップでメイン チャネルと層間はく離真空チャネルを調べます。
注: 非重要な分野 (例えばチップのエッジ) で剥離は許容されます。 - メイン チャンネルは 50-60 μ m (1-2 膜孔) 内に配置できるを確認します。
注: 真空チャンネル チャンネルが重複していないことが重要です。 - メイン チャンネルと入口と出口チャネルの膜が明白な穴なしそのまま確認してください。
注: 膜内の任意の穴は漏れチップまたはチャンネル以外で細胞の成長につながることができます。
- ストアは、室温でキャビネットの肯定的な圧力でペトリ皿のチップします。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ここで提示されたプロトコルでは、オルガンの PDMS チップのスケーラブルな作製について説明します。これらのデバイスは、弾性多孔質膜 (図 1) 2 つの明瞭な灌流組織タイプの文化を有効にします。PDMS チャンネルは、(図 2 aおよび 2 b) の新しいデザインのプロトタイピングを加速する 3 D 印刷された金型を使用してキャストされます。トップ チャンネルは、下部チャネル コンポーネントをトレイにキャストして、顕微鏡スライド (図 2 D) をバックアップの処理中に成形ポート (図 2) を持つコンポーネントを生成するための準拠ポリウレタン ガスケットに対する圧縮の下で金型にキャストされます。この製作方法は、時間の節約、再現性とトレーサビリ ティー向上とデブリ放出ポートを打つことによって 1 つのステップと複数の切断手順に部品のマルチ スケール パターンを組み合わせたものです。多孔質膜器官チップの機能に重要なと作製方法が鋳造パターン シリコンウェハーに対して一貫性のある厚さの膜の結果に基づいて、表面仕上げ (図 3)。大きなバッチ生産やストレージ ポリカーボネート キャリア経由での処理ができます。
組み立てられた器官チップ (図 4) は、光学的に透明なパッケージに 2 つの灌流チャネルで構成されます。重複した領域で多孔性 PDMS 膜により代謝産物やタンパク質、治療、病原体、機械を提供するいずれかの側に 2 つの平行チャネルが使用されて臓器チップ機能を要約する細胞組織との相互作用ひずみ繰返し真空作動を使用します。PDMS 膜バイオミメティックの気孔率は、代謝、成長因子、血管および臓器実質内 (図 5) の間も細胞の束をサポートしています。膜の明白な透 (Pアプリcm/s) は、コンセント チャンネル Caco2 腸細胞と色素の濃度を使用して決定しました。腸チップ細胞層は、透磁率を大幅に増加したバリアを提供します。オルガンのチップは、定量的かつ再現性をもって適用膜とその培養組織 (図 6) して繰返しひずみする並列真空チャネルを使用して作動することができます。灌流と組み合わせてこの繰返しひずみより体内器官生理学の腸チップで絨毛の形成などを模倣するように細胞の分化をサポートします。

図 2: 3 d チャネル作製印刷金型。高解像度 3 D プリント菌に対する (A および B)、大きいデザインの多様性と伝統的なソフト ・ リソグラフィーより試作を可能にする器官のチップ部品がキャストされます。最上位チャネル部分 (C) はパンチング完成部品上にポートの必要性を排除する圧縮の下で硬化させます。各帳票の鋳造は、シングル カットで singulated です。下部チャネル部分 (D) は、使いやすさと画像処理を容易にするスライド ガラスに置かれます。スケール バーは、すべての画像では 1 cm 程度です。この図の拡大版を表示するのにはここをクリックしてください。

図 3: パターン DRIE シリコンウェーハを使用して多孔質の PDMS 膜をキャストします。(A) 7 μ、50 μ m の背の高いマイクロピラー エッチング シリコン ・ ウエハに DRIE を使用してのレンダリングします。(B) PDMS、穴間隔六角 40 μ m 離れても 7 μ m 径の配列が 50 μ m の厚膜を作成するこの配列圧縮 (16 kPa) の 4 kg 以下で硬化させます。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 組み立ての PDMS オルガン チップの写真。赤い色素は、青い色素を血管内皮細胞に通常使用される基底チャンネルを強調表示に実質細胞に使用する大きい頂チャネルを塗りつぶします。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 多孔性 PDMS 膜を介してカスケード ブルー不活性のトレーサーの透過性。カスケード ブルー ヒドラジド染料中は臓器チップのトップのチャンネルに読み込まれた、媒体を含んでいる最下位チャネルに、膜色素のフラックスを測定する 60 μ L/h で潅流します。空のチップは、頂管内 BBe1 Caco2 細胞と基底のチャネル 6 日間培養ひと血管内皮細胞 (株) 腸チップと比較しました。誤差範囲は、平均値の標準誤差を示します。この図の拡大版を表示するのにはここをクリックしてください。

図 6: 真空側チャネルを使用して膜ひずみのアプリケーション。プロットは、真空の圧力への応答における膜の線形ひずみ変調を示します。繰返し一軸ひずみは、並列側のチャネルに応用真空を用いた臓器チップの文化地域に均一に適用されます。ひずみは真空圧が-10 kPa 変わるたびに約 1% ひずみ時真空圧力の低下とともに直線的相関 (R2 = 0.992)。誤差範囲は、平均値の標準偏差を示します。この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
製造プロセスは、高解像度 3 D プリント金型 PDMS 上部と下部臓器チップの車体部品と相まって micromolded 多孔質 PDMS 膜パターンに依存します。この重要なアプローチは、ラピッドプロトタイピング用のスケール アップ製造と金型の交換への急速な移行と組み合わせるを容易にするために選ばれました。最上位のコンポーネント型は鋳造の段階パターン ポートは定義された垂直プロファイルで正確な位置に設計されています。手動でアクセス ポートをパンチで労力を回避できるだけでなく、職場により再現可能なポート配置インターフェイス マニホールドや計装の残骸も削減するこれとフィットのシーリングをコントロールして作り出す部品挿入チューブまたは流体と空気圧接続用ピン。金型は、ポートの穴を通してキャストを容易にする対応のポリウレタン シートで区切られた圧縮治具で互いの上に積み重ねられています。単一の治具で複数の部品を積層することによりシングル ユーザーは、大量のコンポーネントを 1 つの手順でポートの完了をキャストできます。材料の選定、金型の製法は、必要機能解像度、低面粗度デバイス アセンブリとその後の画像処理アプリケーションの平坦度の高度を提供するために重要です。光造形は、PDMS 硬化との互換性と高たわみ用 (> 80 ° C) 温度の材料使用可能なポリマーの範囲が減少しますが、これらの要件を満たすことができます。ガラス充填樹脂をはじめ、各種の市販樹脂は、これらの条件を満たします。
多孔質弾性 PDMS 膜は間違いなく作製する最も複雑なながらオルガン チップの最もユニークで重要なコンポーネントであります。深い反応イオン エッチング (DRIE) プロセスのベンダーに委託脆い 50 × 50 mm 六角形の配列に柱 (7 μ m 径 40 μ m 離れて 50 μ m 背の高い, コーティング C4F8 ) PDMS 膜で毛穴をパターンに使用するために使用します。柱配列の品質は、堅牢な膜鋳造を達成するために重要です。特に、柱は、アンダー カットや金型の障害につながることができます過度の側壁の粗さを避けるために滑らかな鉛直分布とタイトな公差にエッチングする必要があります。""離型膜に影響を与えることができますエッチングの領域と細胞接着の下部に排列を避けるために注意する必要があります。貫通穴のパターン形成とデバイス統合の成功による膜作製は、プロトコルの単一の最も複雑な部分です。批判的に、各ウエハに PDMS の 0.09 mL を配置し、普及に十分な時間を許可する不完全な貫通穴成形を避けるために不可欠です。正しくプラズマ処理バックアップ ポリカーボネートが離型・しわやストレッチなしの手順を接合膜の堅牢なバックアップを達成するために必要です。バッキングは、壊れやすいシリコンウェーハからキャスト膜を取出しの堅牢な手段を提供します。
それぞれのウェハに適用される圧縮荷重も制服の貫通穴加工のため不可欠です。重みを使用して以前の努力は、膜生産を阻害し、不均一力分布による利回りの低下で起因しました。生産のボトルネックを克服するためには、以前に発行された膜作製プロトコル18の最適化し、プロセスを並列化する自動膜製作者 (AMF) を構築します。AMF は、硬化プロセス プログラム PDMS 全体制御の圧縮力を提供するプログラミング可能なホット プレートでサポート 24 空圧ピストンで構成されています。フイルム裏貼りポリカーボネートは未硬化の PDMS に配置され、加熱中に AMF の空圧ピストンを使用して、PDMS を重合すると均一に圧縮されます。批判的に、硬化プロセス起因のぼかしパターンが硬化時に開発をバブル、最大温度に 1 つのステップよりも高品質の膜のプロトコルの結果に記載されている段階的なプロセスが認められました。任意ですが、AMF は大幅を超えて何ができるオーブンで重みを使用してスループットを向上します。
2 つのレベルで起こる結果臓器チップのトラブルシューティング: 作製プロセス中および器官チップ文化。オルガン チップを組み立て品質と信頼性を向上させる一方、生産工程を大幅に短縮するキャスト膜貫通穴形成の品質保証 (QA) のための視覚的な方法を開発しました。この QA 手法によりプロセスのトラブルシューティング、され追跡作製を有効にするプロセス条件の記録の保存をお勧めします中に発生する問題の細胞培養。オルガン チップ文化の中に不活性トレーサー染料は作製プロセスのトラブルシューティングと文化の手順を細胞のバリア機能を測定する最も簡単な方法です。ルシファー黄色使用されている歴史的に生得的な蛍光性小分子固まりが、カスケード ブルーは下流のアッセイに干渉しにくく狭い発光スペクトルと同じような特性を提供しています。ポリ-エチレング リコール (PEG) などの大きい分子-デキストラン共役 fluorophores が付いて、大きくその結果で全体的に低い透磁率の結果、感度を下げるか。トレーサー染料の明白な透 (Pアプリcm/s) は、臓器や組織 (図 4) の障壁関数プロパティを決定する使用できます。次方程式投与チャネルと受信チャネルの間Pアプリを計算する使用ことができます Transwell 研究19,20に主に使用される方程式から派生したし、トレーサー染料損失を補正比較する 2 つの出力フローと流出にマスバランス前提に依存していない PDMS への吸収によって引き起こされます。

Vrは時間tの後排水チャネルを受信の mL にボリュームVdは時間t後投与のチャネル排水の mL にボリュームAは cm2 (0.167 cm2このデバイス用); の膜貫通領域のtは秒単位で流出コレクションの時間Crは受信側のチャネル排水; にトレーサー染料の濃度の測定の変更Cd投与チャネル排水中のトレーサー染料の測定濃度であります。キーの有効なこの方程式の仮定が含まれます: 1) 安定したトレーサー染料注入濃度時間t以上、2) Crの濃度はCdに比べて小さい、3) システムの透過性は一様に分布文化地域。この式は静的なシステムを使用できますが、前提条件が当てはまることを確認する注意が必要です。電気的手法、トランス上皮電気抵抗 (TEER) を含む Transwell 研究で一般的実装し、最近 PDMS インスタントかつ継続的なバリア機能測定だけでなく臓器のチップ21 に組み込まれています。 ,22。
このプロトコルの制限、生産量を制限する手動の鋳造およびアセンブリ プロセスと同様、PDMS の弾力性があります。PDMS は機械的ひずみ作動を必要とする臓器チップに適して汎用性高分子が、その弾力性は、生産を妨げることができます。パーツは変形せずに処理することは困難ことができ、膜は、バックアップ操作のためのフィルムを必要とします。その結果、臓器チップ生産の自動化は、制限があります。ホットエンボスや射出成形熱可塑性ポリマーの使用とは異なり、鋳造プロセスはバッチ ベースであり、したがってまたスループットを制限します。
オルガン チップは、血管を通じて一般的なメディアを灌によって人間の器官と体レベル関数の生体内での in vitro研究を有効にします。生理学的組織インターフェイス、血管および実質のコンパートメント、力学的手がかりと流体せん断輸送と分子のフラックスを再構成することによってこれらのデバイス histodifferentiation とさたことができます。生体内での正常と病気の臓器の機能のように。組織および 2 つのコンパートメント内の流体の区分はその生体内機能を模倣し、臓器チップ研究、薬物動態学的実験の時間分解モデリングと体外・体内の影響を受けやすい外挿9,10困難またはシングル チャネル MPS14,,1516で不可能であります。マイクロ チャネル構造体は、呼吸肺損傷23の新規バイオ マーカーを開発するヒト小気道上皮で双方向で動的なタバコ煙曝露の影響の調査を含む他のアプリケーションに活用できます。平面膜の定義された位置およびデバイスの光学的透明度高い画像ベースの解析と埋め込まれたセンサーの統合のために適したように。機械的刺激により統合真空チャンネル、エラストマー材料は、Transwell システムで可能ではない機能を提供します。機械的ひずみが一定体内生理機能、肺4肺浮腫の3分化成熟したナノ粒子の吸収などの反復のため不可欠であることを示しましたiPS 由来糸球体足細胞8。
このプロトコルの将来のアプリケーションは、刺激薬、毒素や放射線など器官チップ応答のリアルタイムの読み出しを提供するために使用できるさまざまなセンシング モダリティの統合を含めることができます。ここで提示されたプロトコルは、生分解性材料を含む、異なる光学的、機械的、および化学特性を持つ非 PDMS 材料を拡張できます。ここで提示されたオルガン チップ プロトコル必要があります健康と病態生理学的組織や治療開発のため、活用できる臓器の微小環境の制御の高度を提供するデバイスを作製する研究者を有効にするを含むターゲットの検出、毒性、薬物動態学的評価、同様お好みの薬に関しては。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. の創設者は、エミュレート、株式持分を保持し、その科学的な諮問委員会の議長を務めます。J. p. は現在エミュレート、株式会社 r. n.、エンライテンメント、j. p. の従業員、D.E.I. エミュレート株式会社にライセンスされている知的財産に関する発明
Acknowledgments
初期加工プロトコルの開発への貢献のための写真とビデオ撮影と m ・ イングラム、j. グエン、+ シアバター直温とヘルプ、M. ルソーと米 Kroll に感謝します。この研究は生物学的影響を与えた工学ハーバード大学と共同契約 #W911NF-12-2-0036 と #W911NF-16-C-0050、防衛先端研究プロジェクト庁でウィス研究所が主催した、FDA 許可 #HHSF223201310079C、NIH R01-EB020004 #、#UG3-HL141797-01 とビル ・ アンド ・ メリンダ ・ ゲイツ財団を付与 #OPP1163237 と #OPP1173198 デイに。これらの者は、ビューおよび結論はこのドキュメントに含まれているし、明示または黙示にかかわらず、国防高等研究計画庁、食品医薬品局の公式のポリシーを表すと解釈すべきではない、国立衛生研究所や米国政府。
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
バイオ エンジニア リング、問題 140、チップ上の器官、microphysiological システム、マイクロ、微細加工、PDMS、多孔質膜、マイクロ、繰返しひずみ、灌流Erratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
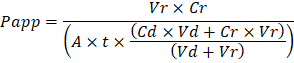
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
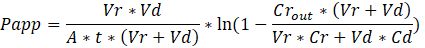
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



