ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Aqui, apresentamos um protocolo que descreve a fabricação do stretchable, dual channel, dispositivos de cultura de célula órgão microplaqueta microfluidic para recapitulando a funcionalidade de nível de órgão em vitro.
Abstract
Um número significativo de compostos de chumbo falha no pipeline de farmacêutica, pois estudos em animais, muitas vezes, não conseguem prever respostas clínicas em pacientes humanos. Órgão-em-um-microplaqueta (órgão Chip) microfluidic celular cultura dispositivos humana, que fornecem uma plataforma experimental em vitro para avaliar a eficácia, toxicidade e farmacocinéticos (PK) perfis em seres humanos, podem ser melhores preditores de eficácia terapêutica e segurança na clínica comparada com estudos em animais. Estes dispositivos podem ser usados para modelar a função de praticamente qualquer tipo de órgão e podem ser fluidically através de microcanais comum de endotélio-alinhado para realizar estudos em vitro na fisiologia humana de órgãos-nível e de todo corpo sem ter que realizar experiências com as pessoas. Esses Chips de órgão consistem em dois canais microfluídicos perfundidos, separados por uma membrana polimérica permeável com células parenquimais órgão específico, de um lado e endotélio microvascular do outro, que pode ser esticado ciclicamente para fornecer órgão específico pistas mecânicas (por exemplo, respiração movimentos no pulmão). Este protocolo detalha a fabricação de flexível, dual channel, Chips de órgãos através de fundição de peças usando 3D impresso moldes, permitindo a combinação de vários casting e pós-processamento em etapas. Porosa poli (dimetil siloxano) membranas (PDMS) são expressos com micrômetro de tamanho usando matrizes de pilar silício sob compressão através de buracos. Fabricação e montagem de Chips de órgãos envolve equipamentos e etapas que podem ser implementadas fora de uma sala de limpeza tradicional. Este protocolo fornece aos pesquisadores acesso a tecnologia de Chip de órgão para em vitro estudos de nível de órgão e corpo na descoberta da droga, segurança e testes de eficácia, bem como estudos mecanicistas dos processos biológicos fundamentais.
Introduction
Aqui, descrevemos a fabricação de canal duplo, vascularizado órgão-em-um-microplaqueta (órgão Chip) microfluidic cultura dispositivos que utilizam um protocolo escalável favorável para uso por grupos de pesquisa, falta de acesso a salas limpas e ferramentas tradicionais litografia macia. Estes dispositivos foram desenvolvidos para recapitular as funções de nível de órgão humano para compreensão normal e fisiologia da doença, bem como drogas respostas em vitro1,2. Crítica à engenharia essa funcionalidade são dois canais microfluídicos perfundidos, separados por uma membrana semi-permeável (Figura 1). Este projeto permite a recriação de interfaces de tecido-tecido entre pelo menos dois tipos de tecidos, geralmente células parenquimais do órgão em um lado da membrana porosa e endotélio vascular do outro, bem como sua exposição ao fluxo do fluido. Além disso, porque o polímero elastomérico, poli (dimetil siloxano) (PDMS), é usado para fabricar o corpo do órgão Chip e componentes de membrana, esforços mecânicos cíclicos podem ser aplicados a engenharia de todo o tecido-tecido da interface através do elástico membrana para imitar o microambiente física natural de órgãos vivos, tais como respiração movimentos no pulmão e peristaltismo no intestino.

Figura 1: seção transversal de órgão Chip. Chips de órgão consistem em dois canais separados por uma membrana porosa, elástica que pode ser inoculada com células de ambos os lados. Canal superior seções transversais são 1 mm de largura x altura, inferior 1 mm canal Cruz seções são 1 mm de largura x canais de alta e vácuo de 0,2 mm em ambos e partes de baixo são de 0,3 mm de largura, 0.5 mm alto e espaçados 0,3 mm dos canais fluídico. Clique aqui para ver uma versão maior desta figura.
Estes stretchable, duplo canal, órgão Chips têm sido utilizados para demonstrar o impacto da respiração movimento na absorção de nanopartículas no pulmão e edema pulmonar induzido3,4; efeitos de movimento peristáltico na diferenciação5 e supercrescimento bacteriano no intestino5,6,7; e influência de deformações cíclicas devido a pulsação do coração na diferenciação e maturação de podócitos glomerulares no rim8. Além disso, estes dispositivos de dois lumens que contêm um canal vascular endotélio-alinhado, separado por uma matriz extracelular (ECM)-revestido de membrana de células parenquimais dentro de um canal separadamente acessível são adequados para caracterização de droga PK parâmetros e nova descoberta de alvo, que tem sido limitada em perfusão única canal de sistemas. Além disso, vários Chips de órgão pode ser ligados entre si através de seus canais vasculares para efetivamente criar um humano corpo em chips, que poderiam oferecer uma plataforma atraente humana em vitro para terapêutica desenvolvimento9, 10. Ao contrário de mais fisiológica de micro sistemas (MPS)11,12,13, os Chips de órgão contêm dois canais microfluídicos, separados por uma membrana porosa que facilita interações vascular parenquimatosa para recapitular a função de órgão in vivo . Isso não apenas simplifica a ligação dos diferentes órgãos juntos por perfusing um meio comum através dos canais vasculares, mas a compartimentação dos tecidos e fluidos imita funções na vivo e suporta experimentação farmacocinética e modelagem, bem como em vitro-no vivo extrapolação9,10 que é difícil ou impossível em um único canal MPS14,15,16. A popularidade de PDMS em dispositivos microfluídicos tem levado ao desenvolvimento de ferramentas para superar a capacidade inerente do material para absorver pequenas moléculas10,17. No entanto, o grande número de chips necessários para apoiar estudos biológicos, onde o uso de agentes microbianos e compostos de absorção de PDMS fazer reutilização de órgão Chips difícil exige um processo de fabricação escalável até para grupos de pesquisa pequena. O protocolo descrito aqui apresenta um método para a fabricação de dispositivo apropriado para o uso em laboratórios acadêmicos, incluindo aqueles que faltam o acesso às salas limpas e litografia macia. Este protocolo visa alargar o acesso às fichas de órgão por uma vasta gama de investigadores que pretendam usar os dispositivos stretchable, dual-channel para explorar processos biológicos básicos, bem como desenvolvimento de terapêutico translacional.
Uma abordagem robusta utilizando práticas recomendadas pela micromanufacturing campos juntamente com o projeto para fabricação, foi desenvolvida para a fabricação de dispositivos de órgão Chip em grandes quantidades com rendimento e alta reprodutibilidade. O protocolo de fabricação descrito aqui fornece um método dimensionável para produção de Chip de órgão. Nós descrevemos o uso de um opcional molde-em-lugar Jig (MiP; detalhes de design em Materiais suplementares) juntamente com tiras de poliuretano gaxeta para permitir a ampliação de fundição componentes PDMS. O lado brilhante das tiras de poliuretano produzir peças PDMS opticamente suaves enquanto o lado texturizado facilita a desmoldagem. Descrevemos também o uso de um opcional Automated membrana Fabricator (AMF) que proporciona compressão uniforme de moldes de wafer de membrana durante a cura para até 24 membranas por lote de fabricação. O projeto é amplamente aplicável para estudos de órgãos que são compostos de tecidos que experimentam a esforços mecânicos e perfusão, e esses chips podem ser produzidos com baixa variabilidade de chip-a-chip em quantidades necessárias para atender às necessidades de pequenas e grandes grupos de pesquisa parecidos. O fluxo de trabalho é favorável a um formato de lote ou linha de montagem e prontamente compatível com os protocolos de avaliação de qualidade para controle de processos de produção, treinamento de pessoal e responsivo a solução de problemas. Esperamos que este protocolo vai expandir o acesso para os recursos do canal duplo, stretchable, Chips de órgão de investigação básica e de translação.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. preparação geral
- Para evitar detritos, limpe a área de trabalho usando fita adesiva e limpe a área com uma limpeza de salas limpas e álcool isopropílico.
- Para todas as etapas que exigem PDMS, misture PDMS na proporção de 10:1 (10 g de cruz ligando agente, 100 g de elastômero base). Misture com a mão ou com um misturador comercialmente disponível. Use um misturador planetário centrífugo aqui: mistura por 2 minutos a 2000 rpm e, em seguida, o PDMS de desgasificação por 2 minutos em 2200 rpm.
- Limpar tudo molda com pistola de ar para explodir fora detritos antes de usar.
Atenção: Não use pinça de metal para remover detritos, pois danificará a superfície dos moldes.
2. preparação do canal top
- Limpe o lado brilhante de cada peça de poliuretano com toalhitas de etanol e salas limpas. Certifique-se de todos os etanol residual é secado da superfície de poliuretano.
- Coloque o lado brilhante do poliuretano sobre o lado aberto do molde para criar um selo no lado aberto do molde, deixando apenas uma abertura bem como na parte superior do molde para PDMS derramando MiP.
Nota: Verifique se cada molde é coberto com segurança por peça de poliuretano ou o PDMS irá vazar de moldes durante o vazamento. - Coloque os molde e poliuretano os assemblies em um gabarito de MiP, com o lado texturizado contra o fim do gabarito MiP. Continue a fazer isto até que todos os moldes foram colocados no jig.
- Aperte o jig MiP girando o identificador usando uma chave inglesa até que o espaçamento do gabarito é de 25 mm de largura.
- Fazer um barco de papel de alumínio que cercam o gabarito de MiP para evitar excesso PDMS vazem nas superfícies.
- Despeje PDMS em cada um dos moldes bem até completamente.
Nota: Cada componente superior chip requer cerca de 3 mL de PDMS. - Uma vez que a rapaziada toda é preenchida, coloque o gabarito em dessecador a vácuo. Puxe vácuo em kPa-80 para 1 h desgaseificar PDMS.
- Depois de 1 h, remova o gabarito de MiP exsicador e coloque no forno de 60 ° C durante pelo menos 4 h curar PDMS.
- Desmonte o gabarito de MiP, usando uma chave inglesa, soltar o jig girando o punho no sentido horário. Uma vez que os moldes são livres de compressão, remova os moldes do gabarito.
- Remova as tiras de poliuretano de cada molde e descarte.
- Cuidadosamente de moldar peças PDMS de seus moldes e colocá-los lado do recurso acima.
- Alinhar a lâmina do raspador de telha no entalhe de tabulação final e cortar cada extremidade para singulate os componentes principais.
- Verifique as peças para qualquer um dos seguintes modos de falha e descartar quaisquer peças insatisfatórias: arranhões no canal principal, grandes destroços acima da área do canal, grandes bolhas, deformado canais de vácuo.
- Armazene peças acabadas em pratos de Petri quadrados dentro de armários positivo de pressão, à temperatura ambiente.
3. preparação do canal inferior
- Despeje cerca de 10,5 g de PDMS em moldes até o PDMS atinge o topo da cavidade.
- Inspecione o molde do canal inferior para PDMS curado no fundo do molde.
- Se suja, raspe velho PDMS da parte inferior do molde como uma superfície irregular na parte inferior do molde pode causar a espessura desigual das peças finais.
Observação: para pequenas < 2 cm2 áreas que são descobertas, a arma de ar podem ser usadas muito suavemente para mover PDMS no espaço.
- Coloque moldes no exsicador de vácuo por 1h.
- Depois de 1 h, mova os moldes em um forno de nível 60 ° C para > 4h.
- Coloque o molde na tabela no capô de fluxo laminar. Desaperte o PDMS de uma borda do molde.
- Agarre um canto e descole delicadamente o PDMS da superfície do molde.
- Quando totalmente removido, colocar na superfície de trabalho, para que canal características são o rosto acima.
- Corte as peças ao longo de bordas externas com cortadores de azulejo, colocação de lâmina de corte de azulejo em PDMS entalhado como na etapa 2.12.
- Deite as peças lado recurso nas fita para remover os detritos.
- Retire parte da fita de embalagem. Arraste a extremidade solta da parte do slide. A ponta solta será laminado com o vidro.
Nota: É fundamental para evitar que a parte de alongamento enquanto ela estabelece. Se a bolha está preso entre a parte e vidro, delicadamente levante a parte com a pinça e re-colocar. - Execute inspeção de controle de qualidade das peças. Verifique as peças para qualquer modos de falha e descartar quaisquer peças insatisfatórias, incluindo aqueles que contêm arranhões no canal principal, detritos grandes, grandes bolhas ou canais de vácuo deformados.
- Recursos com fita de cobre.
- Armazenar as peças em uma armário à temperatura ambiente de pressão positiva.
4. preparação de membrana PDMS
- Verificar que as bolachas estão livres de PDMS na parte de trás.
- Coloque cada bolacha de membrana nas ranhuras designadas nas bandejas AMF.
- Use a seringa de 1 mL para colocar 0,09 mL de PDMS para o centro de cada matriz de post de bolacha de membrana. Deixe o PDMS sentar durante um período mínimo de 5 min para permitir PDMS a espalhar os posts de bolacha a membrana.
Nota: Não prossiga para a próxima etapa até pelo menos 75% da matriz de post é coberto de PDMS. A qualidade das membranas melhora quanto mais o PDMS é permitido para pavio em região do post para que mais longos tempos de espera nesta etapa são preferidos. - Plasma tratar faixa de policarbonato de 20 W para 45 s, gás de2 O a 0,80 mbar em uma máquina de plasma.
- Retire a folha do policarbonato da máquina plasma e use uma tesoura para cortar as folhas de policarbonato em quadrados de 45 x 45 mm.
Nota: Minimizar o contato com o plasma superfície tratada para evitar a poeira de degola para o policarbonato. - Gentilmente colocar do lado do plasma Tratado das praças para o líquido PDMS centrado sobre a bolacha de membrana em policarbonato. Certifique-se de que o policarbonato e o PDMS estão em contato.
Nota: Evite bolsões de ar entre o policarbonato e o PDMS. - Coloque o espaçador PDMS pré-cortados no centro da Praça de policarbonato.
- Coloque a folha de policarbonato texturizado pré-cortados no bloco de PDMS para manter o conjunto de ligação para a placa de compressão.
- Colocar bandeja bandeja 3 é na parte de trás, bandeja 2 está no meio, e a bandeja 1 é na frente. Bandeja 1 tem um entalhe para o alinhamento.
- Abra a válvula de pressão de saída e abra lentamente a válvula de pressão de entrada. Só então feche a válvula de pressão de saída.
Nota: Isto é para que a saída de 4 kg de força gradualmente é aplicada para cada wafer de membrana em oposição instantaneamente, que pode quebrar as bolachas. - Ligue o interruptor de fungos de micorrizas Arbusculares para ON para começar o ciclo de polimerização. Cura da bolacha abaixo dos 4 kg (16 kPa) de compressão e um ciclo de temperatura rampa listados na tabela 1.
| Passo | Temperatura (° C) | Duração (min) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Segure |
Tabela 1 - membrana condições de cura
- Feche a válvula de pressão de entrada e abra a válvula de pressão de saída para libertar a pressão dos cilindros de ar.
- Remova as bandejas e trazê-los para o capô do fluxo laminar.
- Cuidadosamente Retire o policarbonato texturizado e cuidadosamente remova o espaçador PDMS.
Nota: Cuidado com o espaçador PDMS para garantir que também não descascar fora o transportador de policarbonato, se isso ocorrer início descascando um canto diferente.- Inspecionar a membrana PDMS através do portador de policarbonato para áreas com através de furos e use um marcador para traçar o contorno da área do através de-furo e marcar todos os furos ou defeitos nas membranas.
- Usando bolacha manipulação fórceps, solte da bandeja de discos (wafers).
- Remova cada membrana a bolacha e coloque no prato de Petri.
Nota: A membrana PDMS moldará a partir a hóstia de membrana e vai respeitar o policarbonato de apoio. Se PDMS começa a desanexação do compartimento de policarbonato, casca de uma região diferente. - Armazenar as membranas e bolachas em placas de Petri em uma pressão positiva do armário à temperatura ambiente.
5. top de montagem e preparação
- Usando fita fosca, limpe as membranas do PDMS, bem como no interior da caixa de Petri para remover os resíduos.
- Completamente a fita do lado da característica de cada componente superior para remover os resíduos.
- Coloque o canal superior parte ("parte superior") característica para cima em placa de Petri com membrana PDMS.
Nota: Esteja ciente de que algumas membranas podem ser utilizadas para uma ou duas peças superiores dependendo do tamanho da área utilizável. Os principais canais de cada parte superior devem caber dentro da área marcada da membrana. - Carrega os pratos de Petri para a máquina de plasma.
- Plasma tratar membrana e superior a 20 W para 45 s, gás de2 O a 0,80 mbar.
- Uma vez os ciclos de ligação terminou, retire os pratos e fixar as peças ativadas lado recurso em cima da membrana e certifique-se de parte é totalmente laminada com membrana com nenhuma bolha.
- Coloque as peças no forno de 60 ° C durante pelo menos 2 h recozer.
- Usando um bisturi, traço em torno do perímetro do top ligado para separar o conjunto top-membrana do compartimento de policarbonato.
Nota: Não corte a transportadora. - Uma vez que a parte é traçada, descasque o assembly do que o policarbonato. A membrana PDMS ligada ao topo deve descascar do porta-aviões.
- Usando a pinça com ponta afiada, retire as portas que acessar o canal inferior a membrana e remover quaisquer detritos ou pó com pinça sob um estereoscópio.
Nota: Não deixe nenhuma parte da membrana cobrindo a porta de acesso.
6. chip Assembly
- Recurso para cima, assemblies de deleite de plasma com componentes inferiores, usando as condições na etapa 5.5.
- Sob um microscópio invertido, alinhe o conjunto superior com lâmina de microscópio ao fundo metade.
- Coloque no forno de 60 ° C durante pelo menos 2 h.
- Inspeção de controle de qualidade do chip
Nota: Preste muita atenção aos principais portos e canal do chip. Seleção de modos de falha pelo olho e também sob o microscópio.- Para verificar que o chip é ligado totalmente, puxe levemente a cada canto do chip para verificar se há partes descolar.
- Veja o canal do chip para verificar se há uma membrana enrugada ou flacidez, que aparecerá como um padrão ondulado ou um leve desvio no canal.
- Realize uma inspeção de microscópio para inspecionar para detritos no canal principal.
Nota: Os detritos em áreas não-críticas, como os canais de vácuo é aceitável. - Com o chip ainda no microscópio invertido, inspecione o canal principal e os canais de vácuo de delaminação.
Nota: Delaminação em áreas não-críticas (por exemplo, a borda do chip) é aceitável. - Verifique os principais canais estão alinhados para dentro de 50-60 µm (poros de membrana de 1-2).
Nota: É fundamental que os canais não se sobrepõem com canais de vácuo. - Verifique se está intacta, sem qualquer aparentes buracos a membrana entre os principais canais e os canais de entrada e saída.
Nota: Qualquer buraco na membrana pode levar a um chip com vazamento ou crescimento celular fora dos canais.
- Loja de chips em placas de Petri em uma armário à temperatura ambiente de pressão positiva.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
O protocolo aqui apresentado descreve a fabricação escalável de PDMS órgão Chips. Estes dispositivos permitem a cultura de dois tipos de tecidos perfundidos distintos em uma membrana elástica porosa (Figura 1). Os canais PDMS são expressos usando 3D moldes impressos, que acelera a prototipagem de novos projetos (Figura 2A e 2B). Top canais são moldadas em moldes sob compressão contra uma vedação compatível com poliuretano para produzir componentes com portas moldadas (Figura 2), enquanto componentes do canal inferior são expressos em bandejas e manipulados em microscópio de apoio (Figura 2D). Esta abordagem de fabricação combina modelação multi-escala das partes em uma única etapa, o que economiza tempo, melhora a reprodutibilidade e a rastreabilidade e reduz os resíduos gerados pelo porto de perfuração e várias etapas de corte. As membranas porosas são essenciais para a função do órgão Chip e a abordagem de fabricação baseada na carcaça contra wafers de silício padronizada resulta em membranas de espessura consistente e revestimento de superfície (Figura 3). Tratamento através de transportadoras de policarbonato permite armazenamento e produção de lotes maior.
O Chip de órgão montada (Figura 4) consiste de dois canais de perfusão em um pacote opticamente transparente. Na região de sobreposição, uma membrana porosa de PDMS permite a interação de tecido-tecido de metabolitos, proteínas, terapêutica, patógenos e células para recapitular a função do órgão chip enquanto dois canais paralelos de ambos os lados são usados para fornecer mecânica estirpe usando atuação cíclica de vácuo. A porosidade do biomimetically de membrana PDMS oferece suporte o fluxo de metabólitos, fatores de crescimento e até mesmo células entre o parênquima vasculatura e órgão (Figura 5). A permeabilidade aparente (Papp, cm/s) da membrana foi determinada utilizando a concentração de corante nos canais de saída com e sem células do intestino Caco2. As camadas de célula do intestino microplaqueta fornecem uma barreira significativamente aumentada de permeabilidade. O Chip de órgão pode ser activado usando os canais paralelos de vácuo quantitativamente e reproducibly aplicar tensão cíclica de carregamento para a membrana e, portanto, os tecidos cultivados (Figura 6). Esta tensão cíclica combinada com perfusão de mídia oferece suporte a diferenciação celular para melhor imitar na vivo fisiologia de órgãos, tais como formação das vilosidades no intestino Chip.

Figura 2 : Fabricação de canal com 3D impresso moldes. Peças de microplaqueta do órgão são lançadas contra alta resolução 3D impresso moldes (A e B), que permite maior versatilidade de design e prototipagem de litografia macia tradicional. Partes do canal superior (C) são curadas sob compressão, eliminando a necessidade de perfuração portos as peças acabadas. Cada carcaça triplicada é singulated com um único corte. Peças de canal inferior (D) são colocadas em lâminas de vidro para facilitar a facilidade de uso e imagem. Barras de escala são aproximadamente 1 cm em todas as imagens. Clique aqui para ver uma versão maior desta figura.

Figura 3 : A membrana porosa de PDMS é convertida usando wafers de silício DRIE estampado. (A) processamento de 7 µm de diâmetro, micropillars de altura 50 µm gravados usando DRIE em um wafer de silício. (B) PDMS é curado neste array abaixo dos 4 kg de compressão (16 kPa) para criar uma membrana de espessura 50 µm com uma matriz de 7 µm de diâmetro, embora furos espaçados distante hexagonalmente 40 µm. Clique aqui para ver uma versão maior desta figura.

Figura 4 : Fotografia de um Chip de órgão montado PDMS. Corante vermelho preenche o canal apical maior usado para células parenquimais enquanto o corante azul destaca o canal basal normalmente usado por endotélio vascular. Clique aqui para ver uma versão maior desta figura.

Figura 5 : Permeabilidade do tracer inerte cascata azul através da membrana PDMS microporous. Corante de azul maleica cascata no meio foi carregado para o canal superior do órgão Chip e pintadas a 60 µ l/h para medir o fluxo do corante através da membrana para o canal de fundo contendo meio. Fichas vazias foram comparadas com Chips de intestino com células Caco2-BBe1 no canal apical e humano vascular em células endoteliais (HUVEC) no canal basal cultivadas por 6 dias. Barras de erro indicam o erro padrão da média. Clique aqui para ver uma versão maior desta figura.

Figura 6 : Aplicação da tensão de membrana usando canais de vácuo lado. Sinopse indica modulação linear da tensão de membrana em resposta a uma pressão de vácuo aplicada. Tensão uniaxial cíclica é aplicado uniformemente a região da cultura do órgão Chip usando vácuo aplicado a canais paralelos de lado. A estirpe correlaciona linearmente com a diminuição de pressão do vácuo em aproximadamente 1% de tensão para cada-10 kPa a mudança na pressão do vácuo (R2 = 0.992). Barras de erro indicam o desvio padrão da média. Clique aqui para ver uma versão maior desta figura.
Materiais complementares: Clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
O processo de fabricação baseia-se em moldes impressos 3D de alta resolução padrão os PDMS superior e inferior órgão Chip componentes do corpo juntamente com micromolded membranas porosas de PDMS. Esta abordagem crítica foi selecionada devido à facilidade de prototipagem, combinada com uma rápida transição para dimensionado para fabricação e substituição de ferramentas. Os moldes do componente superior destinam-se às portas padrão em locais precisos com perfis verticais definidos durante a etapa de fundição. Isto não só evita o trabalho envolvido na perfuração manualmente portas de acesso, mas também reduz os restos no local de trabalho, permite alinhamento de Porto reprodutíveis para colectores de interface ou instrumentação, e produz peças com controle sobre o ajuste e selagem de inserido tubulação ou pinos para conexões fluídico e pneumáticos. Os moldes são empilhados uns sobre os outros em um gabarito de compressão, separado por compatível com folhas de poliuretano para facilitar a fundição do através de-furo de portas. Pelo empilhamento de várias peças em um único gabarito, um único usuário pode converter grandes quantidades de componentes completas com portas em uma única etapa. Seleção de materiais e fabricação de método para os moldes são essenciais para fornecer a resolução de recurso necessário, baixa rugosidade da superfície e elevado grau de nivelamento para a montagem de dispositivo e aplicativos de imagem subsequentes. Estereolitografia pode atender a esses requisitos, apesar de materiais com temperaturas alta deflexão (> 80 ° C) e compatibilidade com PDMS cura reduzem a gama disponível de polímero. Várias resinas comercialmente disponíveis, incluindo resinas vidro-enchido, atendem a esses critérios.
A membrana elástica de PDMS porosa é sem dúvida o componente mais crítico e único de um Chip de órgão ao ser o mais complexo para fabricar. Um íon reativo no fundo gravura em àgua forte processo (DRIE) terceirizado para um vendedor é usado para microfabricate 50x50 mm sextavado matrizes dos pilares (7 µm de diâmetro, separados de 40 µm, alto 50 µm, C4F8 revestido) que são usados para padrão de poros na membrana PDMS. A qualidade das matrizes de pilar é fundamental para alcançar a carcaça robusta de membrana. Em particular, os pilares devem ser entalhados com tolerâncias apertadas com perfis verticais suaves para evitar áreas retentivas ou aspereza excessiva do sidewall que pode levar ao fracasso do molde. Deve ter cuidado para evitar a "delação" na parte inferior da região gravado, que pode afetar a membrana desmoldagem e acessório de celular. Fabricação de membrana com integração de modelação e dispositivo do através de-furo bem sucedida é a única seção mais complexa do protocolo. Criticamente, colocando 0,09 mL de PDMS em cada bolacha e permitindo tempo suficiente para ele se espalhar são essencial para evitar moldagem incompleta do através de-furo. Corretamente plasma tratando o policarbonato de apoio é necessário para alcançar apoio robusto da membrana para desmoldagem e passos de ligação sem rugas ou alongamento. O revestimento protetor fornece um robusto de desmoldagem da membrana do elenco do wafer de silício frágeis.
A carga compressiva aplicada para cada wafer é indispensável para a fabricação uniforme do através de-furo. Esforços anteriores usando pesos impedido produção de membrana e resultaram em rendimentos pobres devido à distribuição não uniforme de força. Para superar o gargalo de produção, nós otimizado a fabricação de membrana previamente publicado protocolo18 e construiu uma maquinação de membrana automatizado (AMF) para paralelizar o processo. A AMF é composto por 24 pistões pneumáticos, apoiados sobre uma chapa quente programável para fornecer a força compressiva controlada durante um programado PDMS processo de cura. Um filme de apoio de policarbonato é colocado sobre o PDMS não polimerizada e então uniformemente comprimidos usando pistões pneumáticos da AMF enquanto sendo aquecido para polimerizar o PDMS. Criticamente, o processo descrito nos resultados do protocolo em membranas de qualidade mais elevados do que um único passo para a temperatura máxima, onde a difusão padrões resultantes de bolha desenvolvimento durante a cura de cura gradual processo foram observados. Enquanto opcional, os fungos de micorrizas Arbusculares aumenta a taxa de transferência significativamente além da qual é possível usando pesos em um forno.
Os Chips resultante do órgão de solução de problemas ocorre em dois níveis: durante o processo de fabricação e cultura órgão Chip. Nós desenvolvemos um método visual para garantia de qualidade (QA) de formação do através de-furo nas membranas elenco que acelera consideravelmente o processo de produção enquanto melhorando a qualidade e a confiabilidade de montada Chips de órgão. Este método de controle de qualidade permite o processo de solução de problemas, e é recomendável manter um registro das condições do processo para habilitar rastreamento fabricação problemas que podem ocorrer durante a cultura de células. Durante a cultura do órgão Chip, traçador inerte corantes são o método mais simples de medir a função de barreira para solucionar problemas do processo de fabricação e as etapas de cultura de células. Amarelo de Lúcifer foi usado historicamente devido à sua pequena massa molecular e fluorescência inata, mas azul cascata oferece propriedades semelhantes com um espectro de emissão mais estreito que seja menos provável a interferir com os ensaios a jusante. Moléculas maiores, como poli-etilenoglicol (PEG)- ou fluorophores dextran-conjugados são maiores e, consequentemente, resultar em baixa permeabilidade total e reduz a sensibilidade. A permeabilidade aparente (Papp, cm/s) de corantes de rastreamento pode ser usada para determinar propriedades de função de barreira de órgãos ou tecidos (Figura 4). A seguinte equação pode ser usada para calcular Papp entre a dosagem de canal e canal de recebimento e é derivada de equações usadas principalmente para Transwell estudos19,20 e corrige a perda de corante marcador causada por absorção em PDMS, comparando os fluxos de dois saída e não depender de pressupostos de balanço de massa para a saída.

VR é o volume em mL de receber efluentes de canal após o tempo t; VD é o volume em mL de efluente da dosagem do canal após o tempo t; A é a área da membrana do através de-furo na região de cm2 (0,167 cm2 para este dispositivo); t é o tempo de coleta de efluentes em segundos; CR é a mudança medida na concentração do traçador corante no efluente canal receptor; CD é a concentração do traçador corante no efluente canal dosagem. Pressupostos para esta equação seja válida-chave incluem: tracer 1) constante tingir dosagem de concentração ao longo do tempo t, 2) a concentração de Cr é pequena comparado ao Cd, e 3) a permeabilidade do sistema é uniformemente distribuída em toda a região de cultura. Embora esta equação pode ser usada para sistemas estáticos, deve ter cuidado para verificar que os pressupostos prendem verdadeiros. Métodos elétricos, incluindo resistência elétrica trans-epitelial (TEER) são comumente implementados em estudos Transwell e recentemente foram incorporados no PDMS órgão Chips para medições de função barreira contínua e instantânea também21 ,22.
Limitações do presente protocolo incluem a elasticidade do PDMS, bem como o processo de fundição e montagem manual que limita as taxas de produção. PDMS é um polímero versátil que é well-suited para Chips de órgãos que exigem a atuação de esforços mecânicos, mas sua elasticidade pode dificultar a produção. As peças podem ser difíceis de manipular sem deformação e membranas requerem apoio filmes para manipulação. Como resultado, a automação da produção de Chip de órgão pode ser limitada. O processo de fundição, ao contrário de estampagem quente ou moldagem por injeção usada para polímeros termoplásticos, baseia-se em lote e, portanto, também limita a taxa de transferência.
Órgão Chips permitem em vitro estudos do órgão - e corpo-nível humano funções na vivo por perfusing um meio comum através dos canais vasculares. Pela reorganização fisiológica do tecido-tecido interfaces, fluxo de moléculas entre os compartimentos vasculares e parenquimatosos, pistas mecânicas e cisalhamento fluídico e transporte, estes dispositivos promovem histodifferentiation e são capazes de recapitulando na vivo-como funções de órgãos normais e doentes. Compartimentação dos tecidos e fluidos em dois compartimentos imita as suas funções na vivo , e estudos de órgão Chip são passíveis de experimentação farmacocinética tempo-resolvido e modelagem, bem como em vitro-em vivo extrapolação de9,10 que é difícil ou impossível em um único canal MPS14,15,16. As estruturas de microchannel podem ser aproveitadas para outras aplicações, incluindo a investigar o impacto da exposição dinâmica de fumo do tabaco com bidirecional respirando no epitélio humano vias aéreas pequenas para desenvolver novos biomarcadores de danos de pulmão23. As posições definidas das membranas planares e alta claridade ótica dos dispositivos fazem excepcionalmente adequado para análises baseadas em imagem e integração de sensores incorporados. A estimulação mecânica habilitada por integrado canais de vácuo e materiais elastoméricos fornece funcionalidades não é possíveis em sistemas Transwell. Nós demonstramos que esforços mecânicos é essencial para recapitulação de certos na vivo funções fisiológicas, incluindo a absorção de nanopartículas no pulmão4, edema pulmonar3 e diferenciação de madura iPS-derivado de podócitos glomerulares8.
Aplicações futuras do presente protocolo podem incluir a integração de diversas modalidades de detecção que pode ser usado para fornecer leituras em tempo real da resposta do órgão Chip a estímulos como radiação, toxinas ou drogas. O protocolo apresentado aqui pode ser estendido para materiais não-PDMS com diferentes propriedades ópticas, mecânicas e químicas, incluindo materiais biodegradáveis. O protocolo do órgão Chip aqui apresentado deve permitir aos investigadores fabricar dispositivos que oferecem um alto grau de controle sobre o microambiente de saudáveis e fisiopatológicas tecidos e órgãos, que podem ser aproveitados para o desenvolvimento de terapêutico, incluindo alvo de descoberta, toxicidade e farmacocinéticas avaliações, bem como quanto a medicina personalizada.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. é dos fundadores e detém participações em emular, Inc. e preside o Conselho Consultivo Científico. J.P. atualmente é funcionário da R.N. emular, Inc., Y.C., J.P., e D.E.I. são inventores em propriedade intelectual que foi licenciado para emular, Inc.
Acknowledgments
Agradecemos a M. Rousseau e S. Kroll para ajudar com fotografia e videografia e M. Ingram, J. Nguyen, Shea D. e s. Wen de contribuições para o desenvolvimento do protocolo de fabricação inicial. Esta pesquisa foi patrocinada pelo Instituto Wyss biologicamente inspirados engenharia na Universidade de Harvard e o Defense Advanced Research Projects Agency sob contratos cooperativo #W911NF-12-2-0036 e #W911NF-16-C-0050 e FDA conceder # HHSF223201310079C, NIH concede #R01-EB020004 e #UG3-HL141797-01, e Fundação Bill e Melinda Gates concede #OPP1163237 e #OPP1173198 que o DEI. As opiniões e conclusões contidas neste documento são as dos autores e não deve ser interpretadas como representando as políticas oficiais, expressa ou implícita, do Defense Advanced Research Projects Agency, Food e Drug Administration, o Institutos nacionais de saúde, ou o governo dos EUA.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Bioengenharia questão 140 órgão-em-um-microplaqueta sistema microphysiological microfluídicos microfabrication PDMS membrana porosa microchannel cíclico uma perfusãoErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
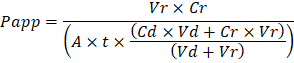
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
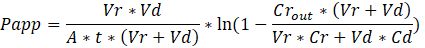
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



