ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
여기, 우리 stretchable, 듀얼 채널의 제작, 기관 수준 기능 체 외업과 위한 기관 칩 미세 세포 문화 장치를 설명 하는 프로토콜을 제시.
Abstract
동물 연구는 종종 인간 환자에 임상 응답 예측을 실패 하기 때문에 납 화합물의 상당수 제약 파이프라인에서 실패 합니다. 인간의 기관-에-한-칩 (기관 칩) 미세 세포 문화 장치, 효능, 독성, 그리고 인 간에 있는 pharmacokinetic (PK) 프로필을 평가 하기 위해 실험 체 외에 플랫폼을 제공 하는 치료 효 험의 더 나은 예언자를 있을 수 있습니다, 동물 연구에 비해 병원에 안전입니다. 이 소자는 거의 모든 기관 형식의 기능을 모델링 하는 데 사용할 수 있습니다 하 고 fluidically 필요 없이 인간의 기관 수준 및 전체 몸 수준 생리학에 생체 외에서 연구를 수행 하기 위해 일반적인 endothelium 늘어선 microchannels 통해 연결 될 수 있다 사람에 대 한 실험을 실시 합니다. 이러한 기관 칩 1 개의 측에 기관 특정 parenchymal 세포와 제공 하기 위해 주기적으로 기지개 할 수 있는 다른, microvascular 내 피 투과성 탄성 막으로 구분 된 두 개의 끼얹는다 미세 채널의 구성 기관 특정 기계 단서 (예를 들어, 폐에서 동작을 호흡). 이 프로토콜 세부 유연 하 고, 듀얼 채널의 제작, 여러 캐스팅의 조합 및 후 처리 단계 기관 칩을 통해 3D를 사용 하 여 부품의 주조 금형, 인쇄. 다공성 폴 리 (디 메 틸 실록 산) (PDMS) 막 마이크로미터 크기와 함께 캐스팅은 실리콘 기둥 배열에서 압축을 사용 하 여 구멍을 통해. 제조 및 기관 칩 장비 및 전통적인 클린 룸 밖에 서 구현할 수 있는 단계를 포함 한다. 이 프로토콜 연구를 기관 및 몸 수준 연구 약물 발견, 안전 및 효능 시험, 생체 외에서 뿐만 아니라 기본적인 생물학 과정의 기계 론 적인 연구 기관 칩 기술에 대 한 액세스를 제공 합니다.
Introduction
여기, 우리가 vascularized 기관-에-한-칩 (기관 칩) 미세 문화 장치 cleanrooms 전통적인 소프트 리소 그래피 도구에 대 한 액세스를 부족 한 연구 그룹에 의해 사용 하기 위해 의무가 확장 가능한 프로토콜을 사용 하 여 듀얼 채널의 제조를 설명 합니다. 이 소자 들은 마약 응답 생체 외에서1,2뿐 아니라 이해 일반 질병 생리학, 인간의 기관 수준 기능 정리를 개발 되었습니다. 공학에 중요 한이 기능은 반 투과성 막 (그림 1)으로 구분 된 두 개의 끼얹는다 미세 채널입니다. 이 디자인에는 적어도 두 종류의 조직, 일반적으로 다공성 막의 1 개의 측에 기관 parenchymal 세포와 다른 혈관 피 유체 흐름에 그들의 노출 사이의 조직-조직 인터페이스의 오락 수 있습니다. 또한, 때문에 탄성 중합체, 폴 리 (디 메 틸 실록 산) (PDMS), 기관 칩 신체를 조작 하는 데 사용 됩니다 및 순환 기계 긴장 막 구성 요소 설계 전체에 적용할 수 있습니다 통해 탄성 조직-조직 인터페이스 살아있는 장기 호흡 폐에 동작과 소장에서 연동 등의 자연 물리 microenvironment를 모방 하는 막.

그림 1: 기관 칩 횡단면. 양쪽에 셀 시드할 수 있습니다 다공성, 탄성 막으로 분리 된 2 개의 채널 기관 칩에 의하여 이루어져 있다. 최고 채널 횡단면은 1 m m x 1 m m, 바닥 폭 채널 크로스 섹션은 0.2 m m 높은, 및 진공 채널 둘 다에 및 아래쪽 부품 x 세로 1 m m 0.3 m m, 폭 0.5 m m, 높이 유체 채널에서 0.3 m m 간격. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
이러한 stretchable, 듀얼 채널, 기관 칩 호흡 폐에 폐 부 증 약물 유발3,4; 나노 흡수에 동작의 영향을 보여주는 사용 되었습니다. 차별화5 및 세균성 무성 내장5,,67;에 연동 운동의 효과 그리고 순환 개 악 때문에 차별화에 심장의 맥 동에의 영향 및 신장8사 podocytes의 성숙. 또한, 포함 한 endothelium 늘어선 혈관 채널은 세포 외 기질 (ECM)을 구분 하는이 두 루멘 장치-parenchymal 세포 별도로 액세스할 수 채널 내에서 코팅된 막은 마약 PK의 특성에 적합 하다 매개 변수 및 새 대상 검색, 단일 관류에 제한 된 채널 시스템. 또한, 여러 기관 칩 연결 될 수 있습니다 함께 통해 효과적으로 만들는 인간의 시체-에-칩, 치료제 개발9매력적인 인간 생체 외에서 플랫폼을 제공할 수 있는, 그들의 혈관 채널 10. 마이크로 생리 시스템 (MPS)11,,1213, 달리 기관 칩 혈관 parenchymal 상호 작용을 용이 하 게 하는 다공성 막으로 구분 된 두 개의 미세 채널 포함 vivo에서 장기의 기능 정리 이 뿐만 아니라 perfusing 관 채널을 통해 일반적인 매체에 의해 함께 다른 기관의 연결을 간소화 하지만 조직과 체액의 구획 vivo에서 기능을 모방한 pharmacokinetic 실험을 지원 하 고 생체 외에서-vivo에서 추정9,은 어렵거나 불가능 한 단일 채널 MP14,,151610 뿐만 아니라 모델링. 미세 소자에서 PDMS의 인기 작은 분자10,17를 흡수 하는 재료의 고유의 능력을 극복 하기 위해 도구의 개발을 이끌어 냈다. 그러나, 생물학 연구 어디 미생물 대리인 및 PDMS 흡수 화합물을 사용 하 여 만들기 어려운 기관 칩의 재사용을 지 원하는 데 필요한 칩의 큰 숫자도 작은 연구 그룹에 대 한 확장 가능한 제조 프로세스를 필요로 합니다. 여기에 설명 된 프로토콜 장치 제조 cleanrooms 및 소프트 리소 그래피에 대 한 액세스를 부족 한 그들을 포함 하 여 대학 실험실에서 사용 하기에 적합 한 메서드를 제공 합니다. 이 프로토콜 stretchable, 듀얼 채널 디바이스를 사용 하 여 변환 치료 개발 뿐 아니라 기본적인 생물학 과정을 탐험 하고자 하는 연구의 광범위 한 범위에 의해 기관 칩에 대 한 액세스를 확대 하는 것을 목표로.
제조를 위한 디자인으로 결합 된 micromanufacturing 필드에서 모범 사례를 활용 하 여, 강력한 접근 높은 재현성 및 수율 대량에서 기관 칩 장치 조작에 대 한 개발 되었다. 여기에 설명 된 제조 프로토콜 기관 칩 생산을 위한 확장 가능한 방법을 제공 합니다. 우리는 옵션 형 내부 지 그 (MiP, 보충 자료세부 사항 디자인) 폴리우레탄 가스 켓 스트립 함께 스케일 업 PDMS 구성 요소를 주조의 사용을 사용을 설명 합니다. 폴리우레탄 스트립의 광택 면 질감된 측면 demolding 용이 하 게 하는 동안 광학 부드러운 PDMS 부품 생산. 우리 또한 사용의는 선택적 자동 막 Fabricator (AMF) 일괄 처리 당 24 막까지 날조를 위한 치료 하는 동안 막 웨이퍼 금형의 균일 한 압축을 제공 하는 설명. 디자인은 기계적인 긴장 및 관류, 경험 하는 조직으로 구성 된 장기의 연구에 대 한 광범위 하 게 적용 하 고 소형 및 대형의 요구를 충족 하는 데 필요한 수량에 낮은 칩 가변성 이러한 칩을 생산할 수 있습니다. 모두 연구 그룹입니다. 이 워크플로 일괄 처리 또는 조립 라인 형식으로 순종 하 고 쉽게 제어 생산 프로세스, 인력 훈련, 및 응답 문제 해결에 대 한 품질 평가 프로토콜 호환. 우리는이 프로토콜 듀얼 채널, stretchable, 기본 및 변환 연구를 위한 기관 칩의 기능에 대 한 액세스를 확장 됩니다 바랍니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 일반 준비
- 파편을 피하기 위해, 패킹 테이프를 사용 하 여 작업 영역을 깨끗 하 고 청정 지우기와 이소프로필 알코올을 닦아.
- PDMS를 필요로 하는 모든 단계, PDMS 교차 하는 연결 하는 에이전트, 탄성 기지의 100 g의 (10 g) 10:1 비율로 섞는다. 손으로 또는 상업적으로 사용할 수 있는 믹서 혼합. 여기 행성 원심 믹서를 사용 하 여: 2000 rpm에서 2 분간 믹싱 후는 PDMS 2200 rpm에서 2 분간 기체 제거.
- 깨끗 한 모든 파편을 사용 하기 전에 타격을 공기 총으로 주조한 다.
주의: 그것은 금형의 표면 손상 것으로 파편을 제거 하는 금속 집게를 사용 하지 마십시오.
2. 상단 채널 준비
- 에탄올과 각 폴리우레탄의 광택 면 닦 고 클린 물티슈. 모든 잔여 에탄올 폴리우레탄 표면에서 건조 있는지 확인 합니다.
- 붓는 PDMS는 금형의 상단에만 잘 같은 오프닝 떠나는 형의 오픈에 인감을 만들려고 밉 금형의 오픈 사이드는 폴리우레탄의 광택 면에 배치.
참고: 모든 형 폴리우레탄 조각에 의해 안전 하 게 덮여 또는 PDMS 붓는 동안 금형에서 누출 됩니다 확인 하십시오. - 금형 및 폴리우레탄 어셈블리 밉 지 말에 대 한 질감 면 밉 지 그를 놓습니다. 모든 금형 지 그에 배치 되었습니다 때까지이 일을 계속.
- 지 그 간격 폭에서 25 m m까지 렌치를 사용 하 여 핸들을 설정 하 여 밉 지 그를 조입니다.
- 알루미늄 호 일 초과 PDMS 표면에 유출 하지 않도록 밉 지 그를 둘러싼의 보트를 확인 합니다.
- 붓고 PDMS 금형의 각 전체까지 잘.
참고: 각 칩 상위 구성 요소는 PDMS의 약 3 mL 필요합니다. - 전체 지 그 채워집니다 일단 진공 desiccator에 지 그 장소. PDMS 드를 1 h-80 kPa에 진공을 당겨.
- 1 시간 후는 desiccator에서 밉 지 그를 제거 하 고 적어도 4 h PDMS를 치료를 위한 60 ° C 오븐에.
- 렌치를 사용 하 여 밉 지 그를 분해, 핸들을 설정 하 여 지 그를 풀고 시계 반대 방향으로. 금형은 압축에서 무료, 금형 지 그에서 제거.
- 각 금형에서 폴리우레탄 스트립을 제거 하 고 삭제.
- 신중 하 게 드 그들의 금형에서 PDMS 부품을 주조 하 고 그들에 게 기능-쪽을 하다.
- 끝 탭 노치에서 타일 스 크레이 퍼의 블레이드를 라인을 버려야 각 끝 singulate을 최고의 부품 합니다.
- 다음 실패 모드에 대 한 부분을 확인 하 고 어떤 불만족 부분 삭제: 메인 채널, 채널 영역, 큰 거품 위에 큰 파편에에서 흠집 변형 진공 채널.
- 실 온에서 압력 긍정적인 캐비닛 안에 사각형 접시에 완성 된 부분을 저장 합니다.
3. 하단 채널 준비
- PDMS에 구멍의 상단을 도달할 때까지 약 10.5 g PDMS의 금형에 부 어.
- PDMS 몰드의 하단에 치료에 대 한 하단 채널 형을 검사 합니다.
- 경우, 긁어 금형의 바닥에서 오래 된 PDMS 금형의 하단에는 고르지 못한 표면 최종 부품의 고르지 않은 두께 일으킬 수 있기 때문.
참고: 작은 대 한 < 2 cm2 영역 커버, 하지 않은 공기 총 PDMS 공간 이동에 매우 부드럽게 사용할 수 있습니다.
- 1 시간에 대 한 진공 desiccator로 금형을 놓습니다.
- 1 시간 후에 레벨 60 ° C 오븐에 금형을 이동 > 4 h.
- 형 층 류 두건에 테이블에 놓습니다. 금형의 한 가장자리에서 PDMS를 풉니다.
- 한 모서리를 부드럽게 PDMS 몰드 표면에서 다시 껍질.
- 채널 기능 얼굴을 완전히 제거, 작업 표면에 누워.
- 타일 절단기, 타일 커터 블레이드 단계 2.12에서 노치 PDMS에 배치와 외부 가장자리 부분을 잘라.
- 부품 기능 측면에 누워 어떤 파편 든 지 제거 하는 테이프.
- 포장 테이프에서 부분을 제거 합니다. 슬라이드에 걸쳐 부품의 느슨한 끝을 끕니다. 느슨한 끝 유리 라미네이트 됩니다.
참고: 그것은. 내려 놓고 있는 동안 부분 스트레칭 피하기 위해 중요 한 거품 부분과 유리 사이 갇혀 있다는 집게와 부분을 해제 하 고 다시 누워 부드럽게. - 부품의 품질 관리 검사를 수행 합니다. 어떤 실패 모드에 대 한 부분을 확인 하 고 메인 채널, 큰 파편, 큰 거품, 또는 변형된 진공 채널에 긁힌 자국을 포함 하는 것 들을 포함 하 여 어떤 불만족 부분 삭제.
- 커버 테이프와 기능.
- 실 온에서 캐비닛 긍정적인 압력에 부품을 저장 합니다.
4. PDMS 막 준비
- 웨이퍼 뒷면에 PDMS의 무료 되는지 확인 합니다.
- 각 막 웨이퍼를 AMF 쟁반에 있는 지정 된 슬롯에 놓습니다.
- 1 mL 주사기를 사용 하 여 각 막 웨이퍼 게시물 배열 중심에 PDMS의 0.09 mL를. PDMS 최소 PDMS 막 웨이퍼의 게시물에 걸쳐 확산 수 있도록 5 분 동안 앉아 보자.
참고: 게시물 배열의 적어도 75%는 PDMS에 덮여 때까지 다음 단계로 진행 하지 마십시오. 막의 품질은 PDMS는이 단계에서 더 긴 대기 시간이 선호 되므로 게시물 지역으로 심지 수 더 이상 향상 됩니다. - 플라즈마 처리 폴 리 카보 네이트 스트립 20 W 45 s, O2 가스 플라즈마 기계에 0.80 mbar.
- 플라즈마 시스템에서 폴 리 카보 네이트 시트를 제거 하 고가 위를 사용 하 여 사각형 45 m m x 45 m m 폴 리 카보 네이트 시트를 잘라.
참고: 플라스마와의 접촉을 최소화 먼지는 폴 리 카보 네이트를 고집 하지 못하도록 처리 표면. - 부드럽게 액체 PDMS 막 웨이퍼에 중심에 폴 리 카보 네이트의 플라즈마 처리 측을 하다. 접촉에서에 폴 리 카보 네이트와는 PDMS 인지 확인 합니다.
참고: 공기 주머니는 폴 리 카보 네이트와는 PDMS를 피하십시오. - 폴 리 카보 네이트 광장의 중심에 미리 잘라 PDMS 스페이서를 놓습니다.
- 계속 압축 플레이트에 결합에서 어셈블리 PDMS 블록에 미리 잘라 질감된 폴 리 카보 네이트 시트를 놓습니다.
- 트레이 3 뒷면에 용지함 2는 중간에는 이며, 트레이 1 앞에는 트레이 삽입. 용지함 1 맞춤 노치가 있다.
- 출력 압력 밸브를 열고 매우 느리게 입력된 압력 밸브를 엽니다. 그런 다음 출력 압력 밸브를 닫습니다.
참고:이 출력 4 킬로그램 힘의 즉시, 웨이퍼를 깨뜨릴 수는 반대로 각 막 웨이퍼에 점차적으로 적용 됩니다. - 치료 주기를 시작 하려면 ON으로 AMF 스위치를 플립. 웨이퍼에서 4 k g (16 kPa)의 압축 및 표 1에 나열 된 램프 온도 주기 치료.
| 단계 | 온도 (° C) | 기간 (분) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | 보류 |
표 1-막 경화 조건
- 입력된 압력 밸브 닫고 공기 실린더에서 압력을 풀어 출력 압력 밸브를 엽니다.
- 트레이 제거 하 고 층 류 두건에 갖다.
- 질감된의 폴 리 카보 네이트 떨어져 껍질을 조심 스럽게 그리고 조심 스럽게 PDMS 스페이서를 제거.
참고:이 다른 코너에서 박 리 시작 경우 폴 리카 보 네이트 캐리어에서 또한 껍질 하지 않습니다 있도록 PDMS 스페이서 시계.- 구멍을 통해 영역에 대 한 폴 리카 보 네이트 캐리어 통해 PDMS 막 검사 하 고 구멍을 통해 영역의 윤곽선을 추적 하 고 어떤 구멍 또는 세포 막에 결함을 표시 하는 표시기를 사용 하 여.
- 웨이퍼 처리 집게를 사용 하 여 용지함에서 웨이퍼를 풉니다.
- 웨이퍼에서 각 막 제거 하 고 페 트리 접시에 놓습니다.
참고: PDMS 막 막 웨이퍼에서 금형 취소 됩니다 및 백업 폴 리 카보 네이트를 준수 것입니다. PDMS 시작 되 면 폴 리카 보 네이트 캐리어에서 분리, 다른 지역에서 껍질. - 긍정적인 압력 실 온에서 캐비닛에 접시에 막과 웨이퍼를 저장 합니다.
5. 톱 어셈블리 및 준비
- 매트 테이프를 사용 하 여, PDMS 막으로 파편을 제거 하는 페 트리 접시의 내부 청소.
- 철저 하 게 파편을 제거 하려면 각 상위 컴포넌트의 기능 사이드 테이프.
- 최고 채널 부분 ("탑") 기능 쪽을 PDMS 막 페 트리 접시에 놓습니다.
참고: 일부 막 하나 또는 두 개의 상단 부분의 크기에 따라 사용 가능한 영역에 대 한 사용할 수 있습니다 다는 것을 유의 하십시오. 각 윗부분의 주요 채널 막의 표시 영역 안에 맞게 해야 합니다. - 플라스마 기계를 페 트리 접시를 로드 합니다.
- 플라즈마 치료 막 최고 20 W 45 s, 0.80 mbar에서 O2 가스.
- 결합 주기 완료 되 면, 요리를 제거 고 누워 활성화 된 부품 기능 사이드 막 위에 부분 완전히 없는 거품으로 막 적 층 보장.
- 적어도 2 h anneal를 위한 60 ° C 오븐에 부품을 놓습니다.
- 메스를 사용 하 여 폴 리카 보 네이트 캐리어에서 상단 멤브레인 어셈블리를 분리 하는 보 세의 둘레의 주위에 추적.
참고: 이동 통신사를 자르지 않는다. - 부품을 추적 하는 일단 껍질은 폴 리카 보 네이트에서 어셈블리. 상단에는 보 세는 PDMS 막 캐리어에서 껍질 해야 합니다.
- 날카로운 흘린된 집게를 사용 하 여 맨 아래 채널에 액세스 하는 포트에서 막 제거 하 고 집게는 stereoscope 아래와 모든 파편이 나 먼지를 제거.
참고: 액세스 포트를 덮고 막의 일부를 두지 마십시오.
6. 칩 어셈블리
- 쪽, 플라즈마 치료 어셈블리 단계 5.5에서에서 조건을 사용 하 여 아래 구성 요소와 기능.
- 거꾸로 현미경 현미경 슬라이드 하단에와 톱 어셈블리를 절반으로 맞춥니다.
- 적어도 2 시간에 대 한 60 ° C 오븐에 넣습니다.
- 품질 관리 검사
참고: 주요 포트와 칩의 채널에 가까운 관심을 지불. 눈으로 하 고 또한 현미경의 밑에 실패 모드에 대 한 확인 하십시오.- 확인 하려면 칩 완전히 보 세, 벗겨지거나 부분 확인 칩의 각 모서리에 가볍게 잡아당김.
- 물결 패턴 또는 채널에 가벼운 편향으로 나타납니다 주름이 나 처지 멤브레인에 대 한 확인을 칩의 채널을 봐.
- 주요 채널에서 파편을 검사 하는 현미경 검사를 수행 합니다.
참고: 진공 채널 등의 중요 하지 않은 영역에서 파편은 허용. - 거꾸로 현미경에 아직도 칩, 주요 채널 및 박 리에 대 한 진공 채널을 검사 합니다.
참고: 비-중요 한 분야 (예를 들면, 칩의 가장자리)에 박은 허용. - 50-60 µ m (1-2 막 숨 구멍) 내 주요 채널을 정렬 됩니다 확인 하십시오.
참고: 채널 진공 채널 중복 하지는 결정적 이다.입니다. - 주요 채널 및 입구와 출구 채널 사이의 막 어떤 명백한 구멍 없이 그대로 인지 확인 합니다.
참고: 막에서 어떤 구멍 새 칩 또는 채널 외부 세포 성장에 발생할 수 있습니다.
- 스토어 실 온에서 캐비닛 긍정적인 압력에 접시에 칩.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
여기에 제시 된 프로토콜 PDMS 기관 칩의 확장 가능한 제작을 설명 합니다. 이 소자 들은 탄성 다공성 멤브레인 (그림 1)에 두 개의 뚜렷한 끼얹는다 조직 유형의 문화 활성화. PDMS 채널 3D 인쇄 된 금형을 사용 하는 가속 (그림 2A 와 2B) 새로운 디자인의 프로토 타입 캐스팅 됩니다. 최고 채널 하단 채널 구성 요소 트레이 현미경 슬라이드 (그림 2D) 백업에 처리 동안 성형 포트 (그림 2C) 구성 요소를 생산 하기 위해 준수 폴리우레탄 가스 켓에 대 한 압축에서 금형에 캐스팅 됩니다. 이 제조 방법은 단일 단계는 시간을 절약, 재현성 및 추적, 향상 및 포트 펀치에 의해 생성 된 파편을 감소 시킨다 고 여러 가공 단계에는 부품의 다중 스케일 패턴화를 결합 합니다. 다공성 멤브레인은 기관 칩의 기능에 중요 한 제조 방법은 주조 꽃무늬 실리콘 웨이퍼에 대 한 일관 된 두께의 세포 막에서 결과에 따라 고 표면 마무리 (그림 3). 폴 리카 보 네이트 캐리어 통해 처리 더 큰 배치 생산 및 저장 수 있습니다.
광학 투명 패키지에 두 개의 관류 채널 조립된 기관 칩 (그림 4)에 의하여 이루어져 있다. 겹치는 영역에서 다공성 PDMS 막 하면 조직-조직 상호 대사, 단백질, 치료제, 병원 균, 그리고 양쪽에 두 개의 병렬 채널 기계를 제공 하는 데 사용 되는 동안 장기 칩의 기능을 정리 하는 셀의 수 스트레인 주기적 진공 개폐를 사용 하 여입니다. PDMS 막 biomimetically의 다공성 대사 산물, 성장 요인, 그리고 맥 관 구조 및 기관 실질 (그림 5) 사이도 셀의 플럭스를 지원합니다. 막의 명백한 침투성 (P응용 프로그램, cm/s)와 Caco2 창 자 세포 없이 콘센트 채널에서 염료 농도 사용 하 여 결정 했다. 창 자 칩 셀 레이어 침투성을 크게 증가 장벽을 제공합니다. 기관 칩 적용할 양적 그리고 reproducibly 주기적 긴장 막와 따라서 교양된 조직 (그림 6)에 로드 병렬 진공 채널을 사용 하 여 작동 될 수 있습니다. 미디어 관류와 결합이 순환 긴장 vivo에서 기관 생리학, 창 자 칩에서 villi의 형성 등 더 나은 모방 세포 분화를 지원 합니다.

그림 2 : 3d 채널 제작 인쇄 금형. 기관 칩 부품 고해상도 3D 인쇄 형 (A와 B), 전통적인 소프트 리소 그래피 보다 더 큰 디자인 다양성 및 허용에 대 한 캐스팅 됩니다. 최고 채널 부분 (C) 펀칭 완료 부분에 포트에 대 한 필요성을 제거 하는 압축에서 치료 된다. 각 triplicate 캐스팅은 단일 컷으로 singulated. 아래 채널 부분 (D) 이미징 및 사용의 용이성을 촉진 하기 위하여 유리 슬라이드에 배치 됩니다. 스케일 바는 모든 이미지에 약 1 cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 다공성 PDMS 막 DRIE 꽃무늬 실리콘 웨이퍼를 사용 하 여 캐스팅 이다. (A) 지름의 7 µ m, 50 µ m 키 큰 micropillars DRIE를 사용 하 여 실리콘 웨이퍼에 에칭 렌더링입니다. (B) PDMS은 비록 구멍 간격 hexagonally 40 µ m 떨어져 7 µ m 직경의 배열과 50 µ m 두께 멤브레인을 만들려고이 배열 압축 (16 kPa)의 아래 4 kg에 치료 된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : 조립된 PDMS 기관 칩의 사진. 붉은 염료 parenchymal 세포 파란색 염료 하이라이트 기저 채널 일반적으로 혈관 내 피에 사용 하는 동안 사용 되는 큰 꼭대기 채널을 채웁니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5 : 미소 한 구멍이 있는 PDMS 막 통해 캐스케이드 블루 불활성 추적 프로그램의 침투성. 캐스케이드 파란 hydrazide 염료 중간에 장기 칩의 맨 위 채널에 로드 되었고 60 µ L/h를 하단 채널 매체를 포함 하는 막에 걸쳐 염료의 유량 측정에 끼얹는다. 빈 칩 직감 칩 꼭대기 채널에 Caco2 BBe1 세포와 인간의 혈관 내 피 세포 (HUVEC) 6 일에 대 한 교양 기초 채널에 비교 되었다. 오차 막대는 뜻의 표준 오류를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6 : 막 스트레인 진공 쪽 채널을 사용 하 여 응용 프로그램. 줄거리는 적용 되는 진공 압력에 대 한 응답에 막의 선형 긴장 변조를 나타냅니다. 주기적 단축 긴장은 병렬 사이드 채널에 적용 된 진공을 사용 하 여 장기 칩의 문화 영역에 균일 하 게 적용 됩니다. 긴장 선형으로 감소 하는 모든-10 kPa 변화 진공 압력에 대 한 약 1% 긴장에 진공 압력 상관 (R2 = 0.992). 오차 막대는 뜻의 표준 편차를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
제조 공정 고해상도 3D 인쇄 금형 PDMS 위쪽 및 아래쪽 기관 칩 신체 구성 요소 micromolded 다공성 PDMS 멤브레인과 결합 하는 패턴에 의존 합니다. 중요 한 이렇게 프로토 타입을 축소 제작 및 금형의 교체로 빠른 전환을 결합의 용이성으로 인해 선정 됐다. 상위 구성 요소 금형 주조 단계 패턴 포트 정의 수직 단면도로 정확한 위치에 설계 되었습니다. 이 뿐만 아니라 수동으로 액세스 포트 펀칭에 관련 된 노동을 피할 수 있지만 또한 직장에서 가능 하 게 재현할 수 포트 맞춤 인터페이스 매니폴드 또는 계측, 파편을 감소 및 맞춤 및 씰링의 제어와 생산 부품 삽입 튜브 또는 유체 및 공기 연결에 대 한 핀입니다. 금형은 서로 구분 하 여 포트의 구멍을 통해 캐스팅을 촉진 하기 위하여 준수 폴리우레탄 시트 압축 지 그에 쌓입니다. 여러 부분에서 단일 지 그를 스태킹 하 여 단일 사용자의 구성 요소는 단일 단계에서 포트와 완전 한 캐스팅 수 있습니다. 소재 선택과 제조 방법 금형에 대 한 필요한 기능 해상도, 낮은 표면 거칠기 및 장치 어셈블리 및 후속 이미징 응용 프로그램에 대 한 평탄도의 높은 학위를 제공 하는 중요 한 있습니다. 비록 높은 편향도 온도 (> 80 ° C)를 가진 재료와 치료 PDMS와 호환성 감소 사용 가능한 폴리머 범위 스테레오 리소 그래피 이러한 요구 사항을 충족할 수 있습니다. 다양 한 상용 수 지, 유리에 의하여 채워진 수 지를 포함 하 여 이러한 기준을 충족.
탄성 다공성 PDMS 막 조작 하는 가장 복잡 한 되는 동안 오르간 칩의 가장 독특하고 중요 한 구성 요소는. 깊은 반응성 이온 파 놓 았 (DRIE) 프로세스 공급 업체를 아웃소싱 microfabricate 50 x 50 m m 6 각형 배열에 기둥 (7 µ m 직경, 떨어져 40 µ m, 50 µ m 높이, C4F8 코팅)의 PDMS 막에 있는 숨 구멍을 패턴 하는 데 사용 되는 사용 됩니다. 기둥 배열 품질이 강력한 막 캐스팅을 달성 하는 데 중요 합니다. 특히, 기둥 언더컷을 또는 실패 형으로 이어질 수 있는 과도 한 측 벽 조도 피하기 위해 부드러운 수직 프로필 엄격한 공차에 새겨져 있어야 합니다. "소중" 막 demolding에 영향을 미칠 수 있는 에칭된 지역 및 셀 첨부 파일의 아래쪽에 않도록 주의 해야 합니다. 멤브레인 제조 성공 통해 구멍 패턴 및 장치 통합은 프로토콜의 단일 가장 복잡 한 섹션 이다. 비판적으로, PDMS의 0.09 mL 각 웨이퍼에 배치 하 고 확산 하는 그것에 대 한 충분 한 시간을 불완전 한 구멍을 통해 성형을 피하기 위해 필수적입니다. 제대로 플라즈마 치료 지지 하는 폴 리 카보 네이트는 demolding 및 주름 또는 스트레칭 없이 단계를 결합에 대 한 막의 강력한 지지를 달성 하는 데 필요 합니다. 지지는 연약한 실리콘 웨이퍼에서 캐스트 막 demolding의 강력한 수단을 제공 합니다.
강한 부하 각 웨이퍼에 적용도 균일 한 구멍을 통해 제작을 위해 필수적 이다. 가중치를 사용 하 여 이전 노력 멤브레인 생산을 방해 하 고 가난한 수율 비균일 힘 분배 때문에 결과. 극복 하기 위해 생산 병목, 우리18 이전 게시 된 멤브레인 제조 프로토콜 최적화 하 고 내장 한 자동 막 Fabricator (AMF) 프로세스를 병렬화 하는 것. 프로그래밍 된 PDMS 치료 과정 동안 통제 압축 힘을 제공 하는 프로그래밍 가능한 핫 플레이트에서 지원 24 공 압 피스톤 AMF에 의하여 이루어져 있다. 영화를 지지 하는 폴 리 탄산염 uncured PDMS에 배치 되 고 균일 하 게가 열 되 고 있는 동안 유해는 PDMS를 AMF의 공 압 피스톤을 사용 하 여 압축. 비판적으로, 치료 보다 최대 온도, 어디 깃털 패턴에서 발생 하는 거품 경화 하는 동안 개발을 한 단계 높은 품질 막에 프로토콜 결과에 설명 된 프로세스는 점진적 과정 관찰 되었다. 동안, AMF 크게 넘어 무슨 오븐에 무게를 사용 하 여 처리량을 증가 시킵니다.
두 가지 수준에서 수행 결과 기관 칩 문제 해결: 제조 과정 및 기관 칩 문화 중. 기관 칩 조립 품질 및 안정성을 개선 하는 동안 크게 생산 과정을 가속 캐스트 세포 막에 구멍을 통해 형성의 품질 보증 (QA)에 대 한 시각적 방법을 개발 했습니다. 프로세스 문제 해결을 위해이 QA 메서드를 사용 하면 및 추적 제조 수 있도록 프로세스 조건의 기록을 유지 하는 것이 좋습니다 동안 발생할 수 있는 문제 세포 배양. 기관 칩 문화 중 불활성 추적 염료 제조 공정 문제 해결 및 문화 단계 세포 장벽 기능을 측정 하는 가장 간단한 방법은 있습니다. 루시퍼 노란색 사용 되었습니다 역사적으로 작은 분자 질량 및 타고 난 형광, 하지만 캐스케이드 블루 다운스트림 분석을 방해 하는 좁은 방출 스펙트럼과 유사한 속성을 제공 합니다. 폴 리-ethyleneglycol (PEG)와 같은 더 큰 분자-dextran 활용 fluorophores 큰 따라서 전반적으로 낮은 침투성에 결과 및 낮은 감도 또는. 장기 또는 조직 (그림 4)의 장벽 기능 속성을 결정 하 추적 염료의 명백한 침투성 (P응용 프로그램, cm/s)를 사용할 수 있습니다. 다음 방정식 투약 채널 및 수신 채널 사이의 P애플 리 케이 션 을 계산 하기 위해 사용할 수 있습니다 Transwell 연구19,20 주로 사용 하는 방정식에서 파생 되 고 추적 염료 손실에 대 한 수정 두 개의 출력 흐름을 비교 하 고 유출에서 질량 균형 가정에 의존 하지 의해 PDMS에 흡수에 의해 발생 합니다.

Vr 은 시간 t; 후 채널 유출 수신의 mL에 볼륨 Vd 는 시간 t; 후 투약 채널 유출의 mL에 볼륨 A c m2 (0.167 cm2 이 장치에 대 한);에 막 구멍을 통해 지역의 영역입니다 t 는 초; 유출 컬렉션의 시간 Cr 은 수신 채널 유출;에서 추적 염료의 농도 측정된 변화 Cd 에서 투약 채널 유출 추적 염료의 측정된 농도 이다. 키 유효이 방정식에 대 한 가정을 포함: 1) 꾸준한 추적 시간 t동안 투약 농도 염색, 2) Cr 의 농도에 비해 작습니다 Cd및 3) 시스템의 침투성은 균일 하 게 분산 맞은편 문화 지역. 이 방정식은 정적 시스템에 사용할 수 있습니다, 하지만 해야 합니다 주의 가정 사실이 확인 하기. 전기, 트랜스 상피 전기 저항 (TEER)를 포함 한 Transwell 연구에서 일반적으로 구현 됩니다 방법과 최근 인스턴트 및 지속적인 방 벽 기능 측정 뿐만 PDMS 기관 칩21에 통합 되었습니다. ,22.
이 프로토콜의 한계 생산 속도 제한 수동 주조 및 조립 프로세스 및 PDMS의 신축성을 포함 합니다. PDMS는 적합 기관 칩 기계적 변형 발동을 요구 하는 다양 한 폴리머 하지만 그것의 신축성 생산을 방해할 수 있습니다. 부분 변형 없이 처리 하기 어려울 수 있습니다 고 막 필요 백업 조작에 대 한 영화. 그 결과, 기관 칩 생산의 자동화는 제한 될 수 있습니다. 핫 엠보싱 또는 열가 소성 고분자에 사용 되는 사출 성형과는 달리 캐스팅 과정 배치 기반 이며 따라서 처리량 제한.
기관 칩 perfusing 관 채널을 통해 일반적인 매체에 의해 생체 외에서 인간 기관 및 몸 수준 기능에서 vivo에서 의 연구를 사용 합니다. 생리 적 조직-조직 인터페이스, 혈관과 parenchymal 구획, 기계적인 신호 및 유체 전단 및 전송, 사이 분자의 플럭스를 재구성 하 여이 장치 histodifferentiation를 홍보 하 고 업과의 할 수 있다 vivo에서-정상과 병 장기의 기능 처럼. 조직 및 2 개의 구획에 체액의 구획 vivo에서 기능, 모방 및 기관 칩 연구는 생체 외에서-vivo에서 뿐만 아니라 pharmacokinetic 실험 시간 확인 및 모델링 의무가 단일 채널 MP14,,1516에 어렵거나 그건 추정9,10 . 아닌 구조 폐 손상23의 새로운 바이오 마커를 개발 하기 위해 인간의 작은 기도 상피에서 호흡 하는 양방향으로 동적 담배 연기 노출의 영향을 조사를 포함 하 여 다른 응용 프로그램에 대 한 활용 될 수 있습니다. 평면 세포 막의 정의 위치와 소자의 높은 광학 선명도 고유 이미지 기반 분석 및 임베디드 센서의 통합을 위한 적합 한 그들을 확인 합니다. 기계적 자극 하 여 활성화 통합 진공 채널 고 탄성 재료 Transwell 시스템에서 불가능 기능을 제공 한다. 우리는 기계적인 긴장 특정 생체 내에서 생리 기능, 폐4, 폐 부 종3 에 성숙의 나노 흡수 등의 재현 부에 대 한 필수적입니다 증명 하고있다 iPS 파생 사 podocytes8.
이 프로토콜의 미래 응용 프로그램 기관 칩 반응 자극 약물, 독 소, 방사선 등의 실시간 정보를 제공 하는 데 사용할 수 있는 다양 한 감지 modalities의 통합을 포함할 수 있습니다. 여기에 제시 된 프로토콜 생 분해성 재료를 포함 하 여 다른 광학, 기계, 및 화학 특성을 가진 비 PDMS 자료 연장 될 수 있습니다. 여기에 제시 된 기관 칩 프로토콜 제어의 건강 하 고 pathophysiologic 조직 및 장기 치료 개발에 대 한 활용 될 수 있다, microenvironment의 높은 학위를 제공 하는 장치를 조작 하는 연구원 사용 해야 포함 검색, 독성 및 pharmacokinetic 평가 대상 맞춤된 의학에 관해서는.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I.는 설립자입니다 에뮬레이션, 주식 회사, 주식을 보유 하 고의 과학 자문 위원회의 자. 일본은 현재 에뮬레이션, Inc. 치료, Y.C., jp 모 간의 직원 그리고 D.E.I. 에뮬레이션, i n c.에 허가 된 지적 재산권에 발명가
Acknowledgments
우리에 대 한 사진 videography M. 잉 그램, 제이 구 엔, D. 쉬 어, 그리고 북 아 일 원자바오 공헌 초기 제작 프로토콜 개발에 대 한 M. 루소와 S. Kroll 감사합니다. 이 연구는 생물학적 영감 공학 하버드 대학과 협력 계약 #W911NF-12-2-0036 및 #W911NF-16-C-0050, 방위 고급 연구 프로젝트 기관에서 Wyss 연구소에 의해 후원 되었다 및 FDA 부여 # HHSF223201310079C, NIH R01-EB020004 # 및 #UG3-HL141797-01, 부여 고 빌과 멜 린다 게이츠 재단 #OPP1163237 및 #OPP1173198 데이를 부여 합니다. 보기 및이 문서에 포함 된 결론 들 저자와 하나 명시적 또는 묵시적, 방위 고 등 연구 계획국, 식품 및 의약품 안전 청의 공식 정책을 나타내는으로 해석 해서는 안 된 국립 보건원, 또는 미국 정부.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
생명 공학 문제 140 장기-내장 microphysiological 시스템 미세 뒤틀림 PDMS 다공성 막 아닌 주기적 스트레인 관류Erratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
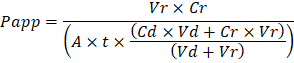
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
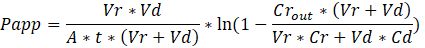
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



