ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Здесь мы представляем протокол, который описывает изготовление растягивается, двойной канал, орган чип microfluidic клетки культуры устройства для изложив орган уровень функциональности в пробирке.
Abstract
Значительное количество соединений свинца не в конвейере фармацевтической, потому что исследования на животных, часто не предсказать клинической реакции человека пациентов. Человеческий орган на чипе (орган чип) microfluidic клеток культуры устройства, которые обеспечивают платформу экспериментальный в vitro оценить эффективность, токсичности и Фармакокинетические профили (PK) в организме человека, может быть лучше предикторы терапевтической эффективности и безопасность в клинике, по сравнению с исследования на животных. Эти устройства могут быть использованы для моделирования функцию практически любой орган типа и может быть fluidically связан через общие эндотелий выстроились микроканалов выполнять в vitro исследования по физиологии человека всего тела уровня и орган без необходимости проведение экспериментов на людях. Эти чипы органа состоят из двух каналов перфузии microfluidic, разделенных проницаемых эластомерных мембраны с органоспецифическая Паренхиматозный клетки на одной стороне и микрососудистой эндотелия с другой стороны, которая может циклически растягивается предоставлять органоспецифическая механические сигналы (например, дыхательные движения в легких). Этот протокол подробности изготовления гибких, двойной канал, орган чипов путем литья деталей с использованием 3D печатных форм, позволяет сочетание нескольких литья и постобработки шагов. Пористые поли (диметил силоксановых) мембраны (PDMS) отливаются с микрометра размера через отверстия с помощью кремния столба массивы под сжатие. Изготовление и монтаж чипов орган включает в себя оборудование и шаги, которые могут быть реализованы за пределами традиционной чистых помещений. Этот протокол обеспечивает исследователям доступ к технологии чипа орган в vitro исследования уровне органа и тела в лекарственных препаратах, безопасность и эффективность тестирования, а также механистический исследования основных биологических процессов.
Introduction
Здесь мы описываем изготовление двухканальной, васкуляризированной орган на чипе (орган чип) microfluidic культуры устройства с помощью поддаются масштабируемый протокол для использования исследовательских групп, не имеющих доступа к чистые помещения и средства традиционной мягкой литографии. Эти устройства были разработаны для пилки человеческих функций органа уровне для понимания нормальных и физиологии заболевания, а также наркотиков ответы в пробирке1,2. Решающее значение для инженерных эта функциональность являются два перфузии microfluidic каналы, разделенных полупроницаемой мембраны (рис. 1). Эта конструкция позволяет отдыха ткани ткани интерфейсов между по крайней мере двух видов тканей, обычно орган Паренхиматозный клетки на одной стороне пористые мембраны и эндотелия с другой, а также их подверженности потока жидкости. Кроме того потому что эластомерных полимера, поли (диметил силоксановых) (PDMS), используется для изготовления чипа орган тела и мембранных компонентов, циклические механические деформации могут быть применены к весь инженерии ткани ткани интерфейса через резинку Мембрана для имитации природных физических микроокружения живых органов, таких как дыхание движений в легких и перистальтику кишечника.

Рисунок 1: орган чип сечение. Орган чипы состоят из двух каналов, разделенных пористой, эластичная мембрана, которая может быть заполнена с клетки с обеих сторон. Верхний канал, сечений, 1 мм x 1 мм высокий, дно канала крест, разделы являются 1 мм в ширину x 0,2 мм высокий и вакуумных каналов в обоих и нижней части – 0,3 мм, 0,5 мм высоко и на расстоянии 0,3 мм от аэрогидродинамических каналов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Эти растягивается, двойной канал, орган чипы были использованы для демонстрации воздействия дыхательные движения на поглощение наночастиц в легких и лекарственно индуцированные отек легких3,4; эффекты перистальтические движения на дифференциации5 и бактериальных разрастание в кишечнике5,6,7; и влияние циклических деформаций благодаря пульсации сердца на дифференцировки и созревания клубочковых podocytes в почках8. Кроме того, эти устройства двух люмен, которые содержат выстроились эндотелия сосудов канала, разделенных внеклеточного матрикса (ECM)-покрытием мембраны из Паренхиматозный клеток внутри отдельно доступных каналов хорошо подходят для характеристики препарата PK параметры и новых открытий в целевой, который был ограничен в одном перфузии канал систем. Кроме того, несколько фишек орган могут быть связаны между собой через их сосудистой каналы для эффективного создания человеческого тела на чипов, которые может предложить привлекательные человека в vitro платформы для терапии развития9, 10. В отличие от наиболее микро физиологические системы (MPS)11,12,13орган фишки содержат два microfluidic каналы, разделенных пористые мембраны, которая облегчает сосудистой Паренхиматозный взаимодействия для пилки в естественных условиях функции органа. Это не только упрощает увязки различных органов вместе с perfusing общего среднего каналам сосудистой, но разделение тканей и жидкостей имитирует в естественных условиях функции и поддерживает фармакокинетические эксперименты и моделирование, а также в vitro-в vivo экстраполяции9,10 , что трудно или невозможно в один канал м/с14,,1516. Популярность PDMS в microfluidic приборы привела к разработке инструментов для преодоления присущие способность материала поглощать малых молекул10,17. Однако большое количество фишек, необходимых для поддержки биологических исследований, где использование микробиологических агентов и соединений поглощающих PDMS сделать повторное использование сложных обломоков орган требует масштабируемой производственный процесс даже для небольших исследовательских групп. Протокол, описанные здесь представляет метод для изготовления устройства, пригодные для использования в научных лабораториях, включая тех, кто не имеет доступа к чистых и мягкие литографии. Этот протокол направлен на расширение доступа к орган чипов широкого круга исследователей, стремящихся использовать растягивается, двухканальные устройства для изучения основных биологических процессов, а также поступательного развития терапевтических.
Используя лучшие практики от Микропроизводственные поля в сочетании с дизайн для производства, надежный подход был разработан для изготовления устройств орган чип в больших количествах с высокой воспроизводимостью и урожайность. Протокол изготовления, описанный здесь предоставляет масштабируемый метод для органа чип производства. Мы описывают использование факультативного плесень на месте Jig (MiP; дизайн детали в Дополнительных материалов) в сочетании с прокладками полиуретановой прокладкой для включения масштабирования литья PDMS компонентов. Глянцевая сторона Полиуретановые прокладки производить оптически гладкой PDMS частей в то время как текстурированные Сторона облегчает распалубка. Мы также описывают использование из Факультативного автоматизированной мембраны Fabricator (АВФ), обеспечивает равномерное сжатие во время отверждения мембраны вафельных форм для изготовления до 24 мембраны в пакете. Дизайн широко применяется для исследования органов, которые состоят из тканей, которые испытывают механические деформации и перфузии, и эти чипы могут быть изготовлены с низкой чип на чипе изменчивости в количествах, необходимых для удовлетворения потребностей малых и больших исследовательские группы так. Рабочий процесс поддается формат пакета или сборочной линии и легко совместим с протоколами оценки качества для контроля производственных процессов, обучение персонала и отзывчивым устранение неполадок. Мы надеемся, что этот протокол будет расширяться доступ к возможностям двойной канал, растягивается, орган чипы для базовых и трансляционная исследований.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Общая подготовка
- Чтобы избежать мусора, очистки рабочей области с помощью упаковочной ленты и уничтожить вниз с чистых протрите и изопропиловый спирт.
- Для всех шагов, требующих PDMS смесь PDMS в соотношении 10:1 (10 g перекрестных ссылок агент, 100 г эластомера базовый). Смешайте вручную или с смесителем коммерчески доступных. Здесь используют планетарный смеситель центробежные: смешивания 2 минут при 2000 об/мин, а затем дегазации PDMS для 2 минут при 2200 об/мин.
- Все чистые формы с пневматический пистолет удар мусора перед использованием.
ОСТОРОЖНОСТЬЮ: Не используйте металлические щипцы для удаления мусора, как это может повредить поверхности формы.
2. top Channel подготовка
- Протрите глянцевой стороне каждого из полиуретана кусок с этанолом и чистых салфеток. Убедитесь, что все остаточные этанола высушивается от Полиуретановые поверхности.
- Место глянцевой стороне полиуретана на открытой стороне плесень MiP для создания печать на открытой стороне формы, оставив только хорошо как открытие в верхней части формы для заливки PDMS.
Примечание: Убедитесь, что каждый плесень надежно покрывается полиуретановой кусок или PDMS будет вытекать из формы во время заливки. - Место плесень и полиуретана сборок в MiP jig, с текстурированной стороной против конца MiP джиг. Продолжать делать это до тех пор, пока все формы были помещены в джиг.
- Затяните MiP джиг, повернув рукоятку с помощью гаечного ключа до тех пор, пока расстояние джиг-25 мм в ширину.
- Сделайте лодку вокруг джиг MiP для предотвращения избыточного PDMS от утечки на поверхности алюминиевой фольги.
- Налейте PDMS каждой из форм хорошо до полного.
Примечание: Каждый чип Топ компонент требует около 3 мл PDMS. - После того, как заполнены все джиг, место джиг в вакуум-сушильный шкаф. Вытяните вакуум-80 кПа за 1 ч до Дега PDMS.
- Через 1 ч удалите джиг MiP из эксикаторе и место в 60 ° C духовке в течение по крайней мере 4 h вылечить PDMS.
- Разбирать джиг MiP, используя гаечный ключ, ослабьте джиг, повернув ручку против часовой стрелки. После того, как формы свободны от сжатия, удалите формы с джиг.
- Удалите из каждой формы Полиуретановые прокладки и отбросить.
- Тщательно де плесень PDMS частей от их формы и заложить их особенность стороной вверх.
- Линия лезвие скребка плитки в конце вкладки паз и отрезать каждый конец к средний первоклассные компоненты.
- Проверьте детали для любого из следующих режимов сбоя и отменить любые неудовлетворительной частей: царапины в основной канал, большие мусора выше области канала, большие пузыри, деформированные вакуумные каналы.
- Магазин готовых частей в квадратных Петри в рамках позитивного давления шкафы при комнатной температуре.
3. дно канала подготовка
- Налейте примерно 10,5 г PDMS в формы, до тех пор, пока PDMS достигает верхней части полости.
- Осмотрите нижней части формы канала для PDMS вылечить в нижней части формы.
- Если грязные, скрип старых PDMS в нижней части формы поскольку неровную поверхность на нижней части плесень может вызвать Неравномерность толщины заключительной части.
Примечание: для малых < 2 см2 областей, которые будут обнаружены, пневматический пистолет может использоваться очень осторожно двигаться PDMS над пространством.
- Место формы в вакуумного эксикатора за 1 час.
- После 1 h, перемещение формы в уровне 60 ° C духовке для > 4 h.
- Место плесень на таблицы в Ламинарный шкаф. Ослабьте PDMS от одного края формы.
- Захват один угол и осторожно отогните PDMS от поверхности формы.
- Когда полностью удалены, лежал на рабочей поверхности, так что канал функции являются лицом вверх.
- Вырежьте части вдоль внешнего края с Плиткорезы, поместив плитка лезвия в зубчатый PDMS как шаг 2.12.
- Положите частей особенность стороне вверх на ленте для удаления любого мусора.
- Удалите часть из упаковочной ленты. Перетащите свободный конец части слайда. Свободный конец будет ламинат со стеклом.
Примечание: Важно, чтобы избежать растяжения части при прокладке вниз. Если пузырь ловушку между частью и стекла, осторожно поднимите часть с щипцами и повторно заложить. - Выполняйте инспекции контроля качества деталей. Проверьте детали для любого сбоя и отменить любые неудовлетворительной частей, в том числе те, которые содержат царапин в основной канал, большой мусора, большие пузыри или деформированных вакуумные каналы.
- Охватывать функции с лентой.
- Храните части в положительное давление кабинета при комнатной температуре.
4. PDMS мембраны подготовка
- Убедитесь, что пластины свободны от PDMS на спине.
- Место каждой пластины мембраны в назначенный слотов в лотки AMF.
- Используйте 1 мл шприц 0,09 мл PDMS на центр каждого массива пост вафельные мембраны. Пусть PDMS сидеть как минимум 5 минут, чтобы позволить PDMS распространиться по всему должности вафельные мембраны.
Примечание: Не переходите к следующему шагу, до тех пор, пока по меньшей мере 75% пост массива покрыта PDMS. Улучшается качество мембран, чем дольше PDMS разрешено фитиль в регион пост, тем больше ждать раз на этом этапе являются предпочтительными. - Плазмы лечить поликарбоната газа на 20 Вт для 45 s, O2 газ на 0,80 мбар в машине плазмы.
- Удалить лист поликарбоната от машины плазменной и используйте ножницы, чтобы вырезать поликарбонатных листов на квадраты, 45 x 45 мм.
Примечание: Минимизировать контакты с плазмой обрабатываемой поверхности для предотвращения пыли от прилипания к поликарбоната. - Аккуратно лежали стороне плазмы лечение поликарбоната квадратов на жидких PDMS сосредоточены на вафельные мембраны. Убедитесь, что поликарбонат и PDMS находятся в контакте.
Примечание: Избегайте воздушных карманов между поликарбоната и PDMS. - Место нарезанные PDMS прокладку на центре площади поликарбоната.
- Поместите лист нарезанные текстурированной поликарбоната на блоке PDMS держать Ассамблею от склеивания прижимную пластину.
- Вставьте лоток так, что лоток 3 находится в задней части, лоток 2 находится в середине и лоток 1 находится в передней. Лоток 1 имеет паз для выравнивания.
- Открыть выходной клапан и очень медленно откройте клапан входного давления. Только тогда закройте клапан выходного давления.
Примечание: Это так, что выход 4 кг силы постепенно применяется к каждой мембраны пластин в отличие от мгновенно, который может разорвать пластин. - Переключения AMF на ON, чтобы начать цикл отверждения. Вылечить пластин до 4 кг (16 кПа) сжатия и наращивает термоциклирование, перечисленных в таблице 1.
| Шаг | Температура (° C) | Длительность (мин) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Удерживайте |
Таблица 1 - мембраны, лечить условия
- Закройте клапан входного давления и открыть выходной клапан выпустить давление от цилиндры воздуха.
- Удаление лотки и довести их до Ламинарный шкаф.
- Осторожно отделите текстурированной поликарбоната и осторожно выньте прокладку PDMS.
Примечание: Смотрите PDMS прокладку, чтобы убедиться, что оно не также слезает поликарбоната перевозчика, если это происходит запуск пилинг из различных уголков.- Осмотрите PDMS мембраны через перевозчика поликарбоната для областей с помощью отверстия и использовать маркер для отслеживания наброски области через отверстие и Марк любого отверстия или дефекты в мембранах.
- С помощью пластин, обработке щипцы, ослабьте пластин из лотка.
- Удаление каждого мембраны из пластин и место в чашке Петри.
Примечание: PDMS мембраны де будет формировать из мембраны пластины и будут соблюдаться поликарбоната бэк. Если PDMS начинается, отсоединение от поликарбоната перевозчика, кожуру от разных регионе. - Хранить мембраны и вафель в чашках Петри в положительное давление кабинета при комнатной температуре.
5. Топ сборка и подготовка
- С помощью матовой липкой ленты, очистите PDMS мембраны, а также внутренности Петри для удаления мусора.
- Тщательно лента стороне особенность каждого Топ компонента для удаления мусора.
- Поместите верхний канал часть («сверху») функция стороной вверх в чашке Петри с PDMS мембраны.
Примечание: Учтите, что некоторые мембраны могут быть использованы для одной или двух верхние части в зависимости от размера Полезная площадь. Основные каналы каждого верхней части должны вписываться в пределах выделенной области мембраны. - Загрузите Петри в плазме машину.
- Плазмы лечения мембраны и топ 20 W 45 s, O2 газ на 0,80 мбар.
- По окончании циклов склеивание удалите блюда и сложить активированные частей особенность стороне верхней части мембраны и убедитесь, что часть полностью ламинированные мембраной без пузырей.
- Место частей в 60 ° C духовку для по крайней мере 2 ч для отжига.
- С помощью скальпеля, следов вокруг периметра кабального верхней отделить Ассамблеи Топ мембраны из поликарбоната перевозчика.
Примечание: Не рубите перевозчика. - Как только часть прослеживается, пил сборки из поликарбоната. PDMS мембраны, приклеенная к верхней следует очистить от перевозчика.
- С острым наконечником щипцы, удалить мембрану из портов, которые доступ к дно канала и удалите мусор или пыль с щипцами под стереоскоп.
Примечание: Не оставляйте любой частью мембрана, охватывающих порт доступа.
6. чип Ассамблея
- Особенность стороной вверх, плазмы лечить сборок с нижней компонентов, с помощью условий на шаге 5.5.
- Под инвертированным микроскопом Совместите Топ с микроскопа в нижней половине.
- Место в 60 ° C духовке для минимум 2 ч.
- Инспекции контроля качества чип
Примечание: Обратите пристальное внимание на главных портов и каналов чипа. Проверить для отказов на глаз, а также под микроскопом.- Чтобы проверить, что чип тычковой полностью, слегка буксир на каждом углу чипа для проверки деламинирование частей.
- Посмотрите на канале чип для проверки морщинистая или провисания мембраны, который будет отображаться как волнистым узором или легкие отклонения в канале.
- Выполните Микроскоп инспекции для проверки для мусора в основной канал.
Примечание: Мусор в некритических областях, таких как вакуумные каналы является приемлемым. - С чип-прежнему инвертированным микроскопом осмотрите главного канала и вакуумные каналы для расслоения.
Примечание: Расслоение в некритических областях (например, край чип) является приемлемым. - Проверьте, что основные каналы выровнены в в пределах 50-60 мкм (1-2 поры мембраны).
Примечание: Важно, что каналы не перекрываются с вакуумной каналами. - Убедитесь, что мембрана между основными каналами и впускных и выпускных каналов нетронутыми без каких-либо очевидной отверстий.
Примечание: Любое отверстие в мембраны может привести к вытекающей чип или рост клеток вне каналов.
- Хранилище щепы в чашках Петри в положительное давление кабинета при комнатной температуре.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Протокол, представленные здесь описывает масштабируемых изготовление PDMS орган чипов. Эти устройства позволяют культуры двух видов различных перфузии тканей на эластичные пористые мембраны (рис. 1). PDMS каналы отлиты использованием 3D печатной формы, который ускоряет прототипов новых конструкций (рис. 2A и 2B). Лучшие каналы литье в формы под давлением против совместимых Полиуретановые прокладки для производства компонентов с литой портами (рис. 2 c), в то время как дно канала компонентов в лотки и обрабатываются на микроскопа бэк (Рисунок 2D). Это изготовление подход сочетает многомасштабной патронирования частей в один шаг, который экономит время, улучшает отслеживаемость и повторяемость и уменьшает мусора, порожденных порт перфорации и несколько шагов резки. Пористые мембраны имеют решающее значение для функции органа чип и изготовление подход, основанный на кастинг против узорной кремниевых пластин результаты в мембранах постоянной толщины и отделка поверхности (рис. 3). Обработка через перевозчиков поликарбоната позволяет для большего серийного производства и хранения.
Собрал орган чип (рис. 4) состоит из двух каналов перфузии в оптически прозрачный пакет. В регионе перекрывающихся пористые PDMS мембраны позволяет взаимодействию ткани ткани метаболитов, белков, терапии, патогенных микроорганизмов и клеток резюмировать чип функции органа, в то время как два параллельных каналов на любой стороне используются для обеспечения механической Штамм с использованием циклических вакуумного привода. Пористость PDMS мембраны biomimetically поддерживает поток метаболитов, факторы роста, и даже клетки между сосудистую и органа паренхимы (рис. 5). Очевидной проницаемость мембраны (Papp, см/сек) был определен с помощью концентрации красителя в выходе каналы с и без Caco2 кишки клетки. Слои клеток кишки чип обеспечивают значительно увеличили барьер для проницаемости. Чип орган могут активироваться с помощью параллельных вакуумные каналы количественно и герметизации применять циклических штамм, погрузка мембраны и, следовательно, культурной ткани (рис. 6). Этот циклический штамм, в сочетании с массовой информации перфузии поддерживает клеточной дифференциации лучше имитировать в vivo физиологии орган, как формирование ворсинок в кишечнике чип.

Рисунок 2 : Изготовление канала с 3D печать формы. Орган чип Детали отливаются с высоким разрешением 3D печатной формы (A и B), которая позволяет для большей гибкости дизайна и прототипов, чем традиционные мягкие литографии. Верхний канал части (C), излечиваются при сжатии, устраняя необходимость для пробивки портов в готовых деталей. Каждый тройные литье является singulated с одного надреза. Нижней части канала (D) размещаются на стеклянных вставках для облегчения легкости использования и обработки изображений. Масштаб бары находятся примерно в 1 см на всех изображениях. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Пористые PDMS мембраны заклинания с помощью пластин кремния DRIE узорной. (A) рендеринг диаметром 7 мкм, 50 мкм Талль micropillars травления с помощью DRIE в кремниевой пластины. (B) PDMS лечится на этот массив до 4 кг сжатия (16 кПа) для создания мембраны толщиной 50 мкм с массивом диаметром 7 мкм, хотя отверстия на расстоянии друг от друга гексагонально 40 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Фотографии собраны чипа орган PDMS. Красная краска заполняет большие апикальной канал, используемый для Паренхиматозный клетки в то время как синий краситель подчеркивается базальной канала, обычно используется для эндотелия. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5 : Проницаемость инертного трассирующими синий Каскад через микропористый PDMS мембраны. Краситель голубой гидразида Каскад в среде была загружена в верхний канал орган чипа и увлажненную 60 мкл/ч для измерения потока краски через мембрану в нижней канал, содержащий среднего. Пустой чипов были по сравнению с кишки чипов с Caco2-BBe1 клетки апикальной канала и человеческого сосудистой эндотелиальных клеток (HUVEC) в базальной канала, культивируемых на 6 дней. Планки погрешностей указывают Среднеквадратичная ошибка среднего значения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6 : Применение мембраны штамма с использованием вакуумной боковые каналы. Участок указывает модуляции линейной деформации мембраны в ответ на прикладной вакуумного давления. Циклические одноосная деформация применяется равномерно культуры региона орган чипа, используя прикладные вакуума для параллельного боковые каналы. Штамм коррелирует линейно с уменьшением вакуумного давления на приблизительно 1% деформации для каждого-10 кПа изменения давления вакуума (R2 = 0.992). Планки погрешностей указать стандартное отклонение от среднего значения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительные материалы: Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Процесс изготовления опирается на высокое разрешение 3D печатной формы в шаблон PDMS верхней и нижней орган чип компонентов тела в сочетании с micromolded пористых PDMS мембраны. Этот критический подход был выбран из-за простоты прототипов, в сочетании с быстрым переходом в масштабируется до изготовления и замену инструмента. Компонент верхнего уровня формы предназначены для шаблон порты в точных местах с определенными вертикальных профилей на этапе литья. Это не только позволяет избежать труда участвующих в вручную кулаками порты доступа, но также уменьшает мусора на рабочем месте, выравнивание воспроизводимые порт позволяет интерфейс коллекторы или инструментария, и производит детали с контролем над fit и герметизации вставлен трубы или булавки для оптимизированных и пневматические соединения. Формы являются накладываются на друг друга в сжатия jig, разделенных совместимый полиуретановые листы для облегчения литья через отверстие портов. Путем укладки нескольких частей в одном джиг, один пользователь может привести большое количество компонентов с портами в один шаг. Выбор материала и изготовления метод для формы важно обеспечить необходимые функции резолюции, низкой шероховатости поверхности и высокую степень плоскостности для устройства Ассамблеи и последующих графических приложений. Стереолитография может удовлетворять этим требованиям, хотя материалы с высокой отклонения температуры (> 80 ° C) и совместимость с PDMS отверждения уменьшить диапазон доступных полимера. Различные коммерчески доступных смолы, включая заполненные стекло смолы, отвечают этим критериям.
Упругой пористой PDMS мембраны, вероятно самые уникальные и критический компонент чип орган во время самых сложных для изготовления. Глубоко реактивный Ион гравирует (DRIE) процесс внешнего поставщика используется для microfabricate 50 x 50 мм шестиугольная массивы столбов (7 мкм диаметром, 40 мкм друг от друга, высотой 50 мкм, C4F8 покрытием), используемые для шаблона поры в мембране PDMS. Качество массивов столба имеет решающее значение для достижения надежных мембраны литья. В частности столбов должна быть запечатленными в жестких допусков с гладких вертикальных профилей, чтобы избежать подрезов или чрезмерного боковины шероховатости, которые могут привести к плесени провал. Следует позаботиться о том, чтобы избежать «озеленения:» в нижней части травлению региона, которое может повлиять на мембраны распалубки и клеток вложение. Изготовления мембраны с успешной интеграции кучность и устройства через отверстие это один самых сложных раздел протокола. Критически размещение 0,09 мл PDMS на каждой пластины и позволяя достаточное время для его распространения важно избежать неполного через отверстие литья. Должным образом плазмы, лечении поликарбоната бэк необходим для достижения надежной поддержкой мембраны для распалубки и склеивание шаги без складок или растяжения. Минусовки предоставляет надежные средства распалубки литой мембраны из хрупких кремниевых пластин.
Сжимающая нагрузка, применяется к каждой пластины также важно для изготовления единообразных через отверстие. Прежние усилия с использованием весов препятствуют мембраны производства и привели к плохой урожай из-за силы неоднородного распределения. Для преодоления узких мест производства, мы оптимизированный протокол изготовления ранее опубликованные мембраны18 и построен автоматизированной мембраны Fabricator (AMF) распараллелить этот процесс. AMF состоит из 24 пневматические поршни, поддерживается через программируемый плита для обеспечения контролируемого сжимающей силы на протяжении запрограммированных PDMS отверждения процесса. Поликарбонат, бэк фильм помещается на неотвержденных PDMS и затем равномерно сжимается с помощью пневматических поршни АИФ при нагреве для полимеризации PDMS. Критически постепенный процесс, описанный в протокол результатов в высшего качества мембраны чем один шаг до максимальной температуры, где шаблоны оперение, вытекающие из пузыря развития во время отверждения отверждение процесса были замечены. Хотя Факультативный, АИФ увеличивает пропускную способность значительно за то, что возможно с помощью весов в духовке.
Устранение неполадок полученный орган чипов происходит на двух уровнях: во время процесса изготовления и во время орган чип культуры. Мы разработали визуальный метод для контроля качества (QA) формирования через отверстие в литой мембраны, что значительно ускоряет процесс производства, а повышение качества и надежности собрал орган фишки. Этот метод контроля качества позволяет для устранения неполадок процесса, и мы рекомендуем сохранять запись процесса условий для включения отслеживания изготовление проблемы, которые могут возникнуть во время клеточные культуры. Во время орган чип культуры инертные трассирующими красители являются простой способ измерения барьерной функции для устранения неполадок процесса изготовления и клеточной культуры шаги. Желтый Люцифер был использован исторически из-за его небольшой молекулярной массой и врожденной флуоресценции, но синий Каскад предлагает аналогичные свойства с более узкий спектр излучения, что менее вероятно мешать течению анализов. Большие молекулы, такие как поли ЭГ (PEG)- или декстран конъюгированных флуорофоров больше и, следовательно, привести ниже проницаемости общей и снизить чувствительность. Очевидной проницаемость (Papp, см/сек) трассирующими красители может использоваться для определения свойства барьерные функции органов или тканей (рис. 4). Следующее уравнение может быть использована для вычисления Papp между дозирования канала и принимающего канала и является производным от уравнений, используемых главным образом для Transwell исследования19,20 и исправляет трассирующими краситель потери вызванные поглощение в PDMS Сравнивая два выходных потоков и не полагаясь на баланс массы предположений на отток.

VR -это объем в мл получения канала стоков после времени t; VD -объем мл дозирования жидких канала после времени t; A – площадь мембраны региона через отверстие в см2 (2 0,167 см для этого устройства); t -время сбора сточных вод в секундах; CR -измеренная изменение концентрации трассировщик красителя в принимающем сточных каналов; CD -измеренная концентрация трассировщик красителя в дозирования сточных каналов. Основные предположения для этого уравнения быть действительным включают: 1) устойчивый трассирующими красителя дозирования концентрации за время t, 2) концентрация Cr мала по сравнению с Cdи равномерно 3) проницаемость системы во всем регионе культуры. Хотя это уравнение может быть использован для статических систем, необходимо проверить, что предположения верны. Электрические методы, включая транс эпителиальных электрическое сопротивление (ТЕЕР) обычно реализуются в исследованиях Transwell и недавно были включены в PDMS орган чипы для мгновенного и непрерывной барьер функция измерения также21 ,22.
Ограничения этого протокола включают эластичность PDMS, а также процесс ручного литья и Ассамблеи, который ограничивает темпы производства. PDMS представляет собой универсальный полимер, который хорошо подходит для органа фишки, требующих механического напряжения срабатывания, но ее эластичность может затруднять производства. Части могут быть трудно справиться без деформации и мембраны требуют бэк пленки для манипуляции. В результате автоматизации производства орган чип может быть ограничено. Процесс литья, в отличие от горячего тиснения или литья для термопластичных полимеров, основан на пакете и поэтому также ограничивает пропускную способность.
Орган фишки включить в vitro исследования человеческого органа тела уровня и функций в естественных условиях , perfusing общий средний сосудистой каналам. На восстановление физиологических ткани ткани интерфейсы, поток молекул между сосудистой и Паренхиматозный отсеков, механические сигналы и оптимизированных сдвига и транспорта, эти устройства способствовать histodifferentiation и способны о перечислении в естественных условиях-как функции как обычных, так и больных органов. Изолированность тканей и жидкостей в двух отделениях имитирует их функций в естественных условиях , и орган чип исследования поддаются время решена фармакокинетические экспериментов и моделирования, а также в vitro-в естественных условиях Экстраполяция9,10 , трудно или невозможно в один канал м/с14,,1516. Микроканальные структуры могут быть использованы для других приложений, включая исследование последствий воздействия динамических табачного дыма с двунаправленной, дыхание человека малых сократимость эпителия развивать Роман биомаркеров повреждения лёгких23. Определенной позиции плоских мембран и высокая четкость оптических устройств делают их уникальными возможностями для анализа на основе изображений и интеграции встроенных датчиков. Механической стимуляции, активизируемые интегрированы вакуумные каналы и эластомерные материалы предоставляет функциональные возможности, не представляется возможным в Transwell системах. Мы продемонстрировали, что механические деформации имеет важное значение для резюме некоторых в естественных условиях физиологических функций, включая поглощение наночастиц в легких4, отек легких3 и дифференциации зрелых iPS производные клубочковых podocytes8.
Будущего применения настоящего Протокола может включать интеграцию различных зондирования методов, которые могут использоваться для обеспечения реального времени индикация орган чип реакции на раздражители, такие как наркотики, токсинов или радиации. Протокола, представленные здесь может быть продлен для не PDMS материалов с различных оптических, механических и химических свойств, включая биоразлагаемых материалов. Протокол органа чип, представленные здесь должно позволить исследователи для изготовления устройств, которые предлагают высокую степень контроля над микроокружения здоровых и патофизиологические тканей и органов, которые могут быть использованы для терапевтических развития, включая Цель открытия, токсичности и фармакокинетические оценок, а также для персонализированной медицины.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. является основателем и проводит акции в эмуляции, Inc. и возглавляет ее научно-консультативный совет. Ю.П. в настоящее время является сотрудником подражать, Inc. р.н., клуба, Ю.П., и D.E.I. являются изобретателей на интеллектуальную собственность, которая была лицензирована для эмуляции, Inc.
Acknowledgments
Мы благодарим м. Руссо и S. Kroll за помощь с фотография и видеосъемка и M. Ingram, J. Нгуен, D. Ши и N. Wen за вклад в развитие первоначальной изготовление протокол. Это исследование было организовано Wyss институт биологически вдохновил инженерии в Гарвардском университете и обороны перспективных исследований проекты агентства в рамках совместных соглашений #W911NF-12-2-0036 и #W911NF-16-C-0050, и FDA Грант # HHSF223201310079C, низ предоставляет #R01-EB020004 и UG3-HL141797-01, а Фонд Билла и Мелинды Гейтс #OPP1163237 и #OPP1173198 дей. Мнения и выводы, содержащиеся в данном документе, принадлежат авторам и не следует толковать как отражающие официальную политику, либо явно выраженных или подразумеваемых, обороны перспективных исследований проекты агентства, продовольствия и медикаментов, Национальные институты здравоохранения, или правительства США.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Биоинженерия выпуск 140 орган на чипе microphysiological системы microfluidic микротехнологий PDMS пористые мембраны microchannel циклические нагрузки перфузииErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
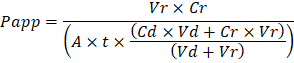
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
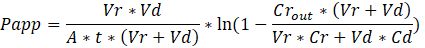
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



