ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Aquí, presentamos un protocolo que describe la fabricación de elástico, doble canal, órgano chip microfluídico célula cultura dispositivos Recapitulando a nivel órgano funcionalidad in vitro.
Abstract
Un número importante de compuestos de plomo falla en la tubería farmacéutica porque estudios en animales a menudo no logran predecir la respuesta clínica en pacientes humanos. Humanos órgano-en-un-Chip (Chip de órgano) de la célula cultura dispositivos microfluídicos, que proporcionan una plataforma experimental en vitro para evaluar la eficacia, toxicidad y perfiles farmacocinéticos (PK) en seres humanos, pueden ser mejores predictores de eficacia terapéutica y seguridad en la clínica en comparación con los estudios en animales. Estos dispositivos pueden utilizarse para modelar la función de prácticamente cualquier tipo de órgano y fluídicamente pueden vincularse a través de microcanales de revestimiento de endotelio común para llevar a cabo estudios en vitro en fisiología humana nivel de órgano y conjunto a nivel de cuerpo sin tener que realizar experimentos en la gente. Estos Chips de órgano consisten en dos canales de microfluidos perfusión separados por una membrana elastomérica permeable con células parenquimatosas de órganos específicos en un lado y el endotelio microvascular, que puede estirar cíclicamente para proporcionar órgano-específicas señales mecánicas (p. ej., respiración de movimientos en el pulmón). Este protocolo detalla la fabricación de canal dual, flexible, Chips de órgano a través de la fundición de piezas utilizando 3D impreso moldes, permitiendo la combinación de varios casting y pasos de procesamiento posterior. Polietileno poroso (siloxano dimethyl) membranas (PDMS) se echan con micrómetro de tamaño agujeros utilizando silicio Pilar bajo compresión. Fabricación y montaje de órganos consiste en equipos y medidas que pueden aplicarse fuera de una sala tradicional. Este protocolo ofrece a los investigadores acceso a tecnología de Chip de órgano en vitro estudios a nivel de órganos y cuerpo en el descubrimiento de medicamentos, seguridad y eficacia de prueba, así como estudios mecanicistas de los procesos biológicos fundamentales.
Introduction
Aquí, describimos la fabricación de doble canal, dispositivos de cultura microfluídicos de órgano-en-un-Chip (Chip de órgano) vascularizados mediante un protocolo escalable dispuesto para el uso de grupos de investigación que carecen de acceso a salas blancas y herramientas de litografía blanda tradicional. Estos dispositivos se han desarrollado para recapitular humanas funciones órgano de comprensión normal y fisiología de la enfermedad, así como droga las respuestas in vitro1,2. Crítica a la ingeniería de esta funcionalidad son dos canales de microfluidos perfundidos, separados por una membrana semipermeable (figura 1). Este diseño permite la recreación de interfaces tejido entre al menos dos tipos de tejidos, por lo general células parenquimatosas de órganos en un lado de la membrana porosa y endotelio vascular en el otro, así como su exposición al flujo de fluidos. Además, porque el polímero elastomérico, poly (siloxano dimethyl) (PDMS), se utiliza para fabricar el cuerpo del órgano Chip y componentes de la membrana, tensiones mecánicas cíclicas pueden aplicarse a toda la ingeniería del tejido interfaz vía el elástico membrana para imitar el microambiente físico natural de los órganos de la vida, como respiración movimientos en el pulmón y la peristalsis en el intestino.

Figura 1: sección de órgano Chip. Órgano Chips consisten en dos canales separados por una membrana porosa y elástica que puede ser sembrada con células en ambos lados. Canal superior las secciones transversales son 1 mm de ancho x fondo alto, 1 m m del canal transversal secciones son 1 mm de ancho x 0.2 mm alto y vacío canales ambos y partes inferiores son de 0,3 mm de ancho, 0,5 mm de altura y espaciados 0,3 mm de los canales fluídicos. Haga clic aquí para ver una versión más grande de esta figura.
Estos estirable, doble canal, órgano Chips han sido utilizados para demostrar el impacto de la respiración el movimiento en la absorción de nanopartículas en el pulmón y el edema pulmonar inducido por drogas3,4; efectos del movimiento peristáltico en diferenciación5 y sobrecrecimiento bacteriano en el intestino5,6,7; y la influencia de las deformaciones cíclicas debido a las pulsaciones del corazón en la diferenciación y maduración de los podocytes glomerulares en el riñón8. Además, estos dispositivos de dos luces que contienen un canal vascular endotelio alineado, separado por una matriz extracelular (ECM)-membrana revestida de células parenquimatosas en un canal de acceso por separado están bien adaptadas para caracterización de drogas PK parámetros y nuevo descubrimiento de blanco, que ha sido limitado en perfusión única canal de sistemas. Por otra parte, múltiples Chips de órgano puede vincularse a través de sus canales vasculares para efectivamente crear un humano cuerpo-on-chips, que podrían ofrecer una plataforma atractiva humanos en vitro para el desarrollo de la terapéutica9, 10. A diferencia de micro-fisiológico más sistemas (MPS)11,12,13, las virutas de órgano contienen dos canales de microfluidos separados por una membrana porosa que facilita interacciones vascular parénquima recapitular en vivo la función del órgano. Esto no sólo simplifica la vinculación de los diferentes órganos juntos por perfundiendo un medio común a través de los canales vasculares, pero la compartimentalización de tejidos y fluidos imita en vivo las funciones y soporta experimentación farmacocinético y modelado y en vitro-en vivo extrapolación9,10 que es difícil o imposible en solo canal MPS14,15,16. La popularidad de PDMS en dispositivos microfluídicos ha llevado al desarrollo de herramientas para superar la capacidad inherente del material para absorber moléculas pequeñas10,17. Sin embargo, el gran número de fichas necesario para los estudios biológicos, donde el uso de agentes microbianos y compuestos absorbentes de PDMS que reutilizar fichas órgano difícil requiere un proceso de fabricación escalable incluso para grupos pequeños. El protocolo descrito aquí presenta un método para la fabricación de dispositivo adecuado para el uso en laboratorios académicos, los que carecen de acceso a salas limpias y litografía blanda incluidos. Este protocolo tiene como objetivo ampliar el acceso a fichas de órgano por una amplia gama de investigadores que buscan utilizar los dispositivos elásticos, canales para explorar procesos biológicos básicos, así como desarrollo terapéutico traslacional.
Aprovechando las mejores prácticas de microfabricación campos juntados con el diseño para la fabricación, un robusto enfoque fue desarrollado para la fabricación de dispositivos de Chip de órgano en grandes cantidades con rendimiento y alta reproducibilidad. El protocolo de fabricación descrito aquí proporciona un método escalable para la producción de la viruta del órgano. Describimos el uso de un opcional molde en lugar plantilla (MiP, detalles de diseño en Materiales complementarios) juntada con las tiras de poliuretano Junta para ampliación de bastidor componentes PDMS. El lado brillante de las tiras de poliuretano produce piezas PDMS ópticamente lisas mientras que el lado texturado facilita el desmoldeo. También describimos el uso de una opcional automática membrana fabricante (AMF) que proporciona la compresión uniforme de moldes de oblea de membrana durante el curado para la fabricación de hasta 24 membranas por lote. El diseño es ampliamente aplicable para estudios de órganos que se componen de tejidos que experimentan tensiones mecánicas y la perfusión, y estos chips se pueden producir con poca variabilidad de chip a chip en cantidades necesarias para satisfacer las necesidades de pequeñas y grandes grupos de investigación por igual. El flujo de trabajo es susceptible de un formato por lotes o línea de montaje y fácilmente compatible con protocolos de evaluación de calidad para el control de procesos de producción, formación de personal y resolución de problemas capacidad de respuesta. Esperamos que este protocolo ampliará acceso a las capacidades de doble canal, estirable, Chips de órgano para la investigación básica y traslacional.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. general preparación
- Para evitar desperdicios, limpiar área de trabajo con cinta de embalaje y limpiar con trapo para salas blancas y alcohol isopropílico.
- Para todos los pasos que requieren PDMS, mezcla de PDMS en una proporción 10:1 (10 g de Cruz enlazan a agente, 100 g de elastómero base). Mezcle a mano o con un mezclador disponible en el mercado. Utilizar un mezclador planetario centrífugo aquí: mezclar durante 2 minutos a 2000 rpm, luego desgasificar el PDMS por 2 minutos a 2200 rpm.
- Limpia todos los moldes con pistola de aire para soplar antes de utilizar los desechos.
PRECAUCIÓN: No use pinzas metálicas para quitar escombros, ya que dañarán la superficie de los moldes.
2. superior canal preparación
- Limpie el lado brillante de cada pieza de poliuretano con etanol y sala limpia. Asegúrese de que todos etanol residual se seca de la superficie del poliuretano.
- Coloque el lado brillante de poliuretano sobre el lado abierto del molde para crear un sello en la parte abierta del molde, dejando sólo una apertura bien-como en la parte superior del molde para verter PDMS MiP.
Nota: Verifique que cada molde es cubierto firmemente por pieza de poliuretano o el PDMS presentarán fugas de moldes durante el vertido. - Coloque el molde y poliuretano asambleas en una plantilla del MiP, con el lado texturizado contra el extremo de la plantilla de MiP. Continuar haciendo esto hasta que los moldes se han colocado en la plantilla.
- Ajuste la plantilla de MiP girando la palanca con una llave hasta que el espacio de la plantilla es de 25 mm de ancho.
- Hacer un barco de papel de aluminio alrededor de la plantilla de MiP para evitar exceso PDMS de fugas sobre las superficies.
- Vierta PDMS en cada uno de los moldes bien hasta completa.
Nota: Cada componente superior del chip requiere aproximadamente 3 mL de PDMS. - Una vez que se llena la plantilla entera, coloque la plantilla en el desecador de vacío. Tirar al vacío a-80 kPa durante 1 h a degas PDMS.
- Después de 1 h, retire la plantilla de MiP del desecador y colocar en horno de 60 º C durante al menos 4 horas curar PDMS.
- Desmontar la plantilla de MiP con una llave, afloje la plantilla girando la manija hacia la izquierda. Una vez libres de compresión moldes, sacar moldes de plantilla.
- Retire las tiras de poliuretano de cada molde y deseche.
- Con cuidado desmoldar piezas de PDMS de sus moldes y ponen característica hacia arriba.
- Alinee la hoja de rascador de azulejo en la posición de final ficha y cortar cada extremo que separarán los componentes principales.
- Revise las partes de cualquiera de los siguientes modos de fallo y descarte cualquier parte insatisfactoria: rasguños en el canal principal, basura grande encima de la zona del canal, las burbujas grandes, deformados canales de vacío.
- Almacenar piezas acabadas en cajas Petri cuadrada dentro de armarios positivos de presión a temperatura ambiente.
3. fondo canal preparación
- Vierta aproximadamente 10,5 g de PDMS en moldes hasta que el PDMS alcanza la parte superior de la cavidad.
- Inspeccione el molde de canal inferior para PDMS curada hasta el fondo del molde.
- Si está sucio, raspar PDMS viejo desde el fondo del molde ya que una superficie irregular en la parte inferior del molde puede causar desigual espesor de las piezas finales.
Nota: para los pequeños < 2 cm2 áreas al descubierto, la pistola de aire se pueden utilizar muy suavemente a mover PDMS sobre el espacio.
- Coloque los moldes en desecador de vacío de 1 h.
- Después de 1 h, mover los moldes en un horno de nivel 60 º C durante > 4 h.
- Coloque el molde sobre la mesa en campana de flujo laminar. Afloje el PDMS de un extremo del molde.
- Agarre una esquina y retire suavemente el PDMS de la superficie del molde.
- Cuando quita completamente, coloque en la superficie de trabajo, de manera que características del canal son cara arriba.
- Piezas cortadas a lo largo de los bordes exteriores con cortadores de azulejos, colocación de azulejo de cuchilla en PDMS con muescas como en el paso 2.12.
- Haceos partes laterales de la función en la cinta para quitar cualquier residuo.
- Eliminar parte de la cinta del embalaje. Arrastre el extremo suelto de la parte a través de la diapositiva. El extremo suelto se laminado con el vidrio.
Nota: Es fundamental para evitar la parte de estiramiento mientras lo establecen. Si la burbuja está atrapada entre la parte y el vidrio, suavemente Levante la pieza con las pinzas y volver a poner. - Realizar inspección de control de calidad de piezas. Revise las partes de cualquier modo de falla y deseche cualquier parte insatisfactoria, los que contengan rayones en el canal principal, basura grande, grandes burbujas o canales de vacío deformados incluyendo.
- Cubrir funciones con cinta.
- Guarde las piezas en un gabinete a temperatura ambiente la presión positiva.
4. preparación de membranas PDMS
- Compruebe que las obleas estén libres de PDMS en la parte posterior.
- Coloque cada oblea de membrana en las ranuras en las bandejas AMF.
- Utilice la jeringa de 1 mL para colocar 0,09 mL de PDMS en el centro de cada arreglo de discos de membrana oblea post. Deje PDMS para un mínimo de 5 minutos para permitir que el PDMS difundir a lo largo de los postes de la oblea de la membrana.
Nota: No vaya al paso siguiente hasta cubrir al menos el 75% de la matriz de correos en PDMS. Mejora de la calidad de las membranas más se permite que el PDMS mecha en la región de post por lo que se prefieren los tiempos de espera más largos en este paso. - Plasma tratar la tira de policarbonato en 20 W de 45 s, O2 gas a 0.80 mbar en una máquina de plasma.
- Retire la hoja del policarbonato de la máquina de plasma y utilizar tijeras para cortar las hojas de policarbonato en 45 x 45 mm cuadrados.
Nota: Minimizar el contacto con el plasma de la superficie tratada para evitar que el polvo se pegue al policarbonato. - Suavemente Coloque el lado de plasma Tratado de los cuadrados de policarbonato en el PDMS líquido centrado en la oblea de la membrana. Asegúrese de que el policarbonato y el PDMS están en contacto.
Nota: Evitar bolsas de aire entre el policarbonato y el PDMS. - Coloque al espaciador PDMS cortado en el centro de la Plaza de policarbonato.
- Coloque la lámina de policarbonato con textura corta en el bloque PDMS para mantener a la Asamblea de la Unión a la placa de compresión.
- Inserte la bandeja para que bandeja 3 está en la parte trasera, bandeja 2 está en el centro y bandeja 1 está en la parte delantera. La bandeja 1 tiene una muesca de alineación.
- Abra la válvula de presión de salida y abrir muy lentamente la válvula de presión de entrada. Sólo entonces cerrar la válvula de presión de salida.
Nota: Esto es para que la salida de 4 kg de fuerza se aplica gradualmente a cada oblea de membrana frente al instante, que puede romper las obleas. - Llevar el interruptor de AMF en ON para comenzar el ciclo de curado. Curar la oblea debajo de 4 kg (16 kPa) de compresión y un ciclo de temperatura rampa enumerados en la tabla 1.
| Paso | Temperatura (° C) | Duración (min) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Mantenga |
Tabla 1 - membrana de curado en condiciones
- Cierre la válvula de presión de entrada y abrir la válvula de presión de salida para liberar la presión de los cilindros de aire.
- Retire las bandejas y llevarlos a la campana de flujo laminar.
- Cuidadosamente retire el policarbonato con textura y cuidadosamente retirar al espaciador de PDMS.
Nota: Ver el separador PDMS para asegurar no también pelar apagado el portador de policarbonato, en este caso comienzo peeling desde una esquina diferente.- Inspeccione la membrana PDMS, a través de la compañía de policarbonato para las áreas con orificios y use un marcador para trazar el contorno de la zona por el agujero y Marque cualquier agujeros o defectos en las membranas.
- Con oblea manejo de pinzas, afloje las obleas de la bandeja.
- Retire cada membrana de la oblea y colocar en placa de Petri.
Nota: La membrana PDMS se desmoldar de la oblea de la membrana y se adhirió al copia de seguridad de policarbonato. Si PDMS empieza a separar de la compañía de policarbonato, pele de una región diferente. - Almacenar las membranas y obleas en cajas Petri en un gabinete a temperatura ambiente la presión positiva.
5. montaje y preparación de la tapa
- Usa cinta de mate, limpiar las membranas PDMS, así como los interiores de la caja Petri para eliminar los desechos.
- Fondo de cinta al lado de la función de cada componente superior para eliminar la suciedad.
- Coloque el canal superior parte ("top") característica lado arriba en placa de Petri con membrana PDMS.
Nota: Tenga en cuenta que algunas membranas pueden utilizarse para la parte superior uno o dos dependiendo del tamaño de la superficie útil. Los canales principales de cada parte superior deben encajar dentro de la zona de la membrana. - Cargue los platos Petri en la máquina de plasma.
- Plasma tratar la membrana y la parte superior a 20 W de 45 s, O2 gas a 0.80 mbar.
- Una vez finalizado el ciclo de vinculación, retire los platos y establecer las partes activadas lado característica sobre la membrana y asegurar parte completamente laminada con membrana sin burbujas.
- Coloque las partes en el horno de 60 º C por al menos 2 h para templar.
- Con un bisturí, trace una línea alrededor del perímetro de la parte superior de servidumbre para separar el conjunto membrana arriba del portador de policarbonato.
Nota: No corte el portador. - Una vez que el artículo está trazado, pelar la Asamblea en el policarbonato. La membrana PDMS que se enlaza a la parte superior debe pelar del portador.
- Utilizando pinzas con punta afiladas, retire la membrana de los puertos que acceder al canal de la parte inferior y retire cualquier residuo o polvo con fórceps bajo un estereoscopio.
Nota: No deje ninguna parte de la membrana que cubre el puerto de acceso.
6. chip Asamblea
- Característica hacia arriba, asambleas de tratar de plasma con los componentes de la parte inferior en las condiciones de paso 5.5.
- Bajo un microscopio invertido, alinee el conjunto superior con portaobjetos en la parte inferior media.
- Colocar en horno de 60 º C durante al menos 2 h.
- Chip de Control de calidad inspección
Nota: Preste especial atención a los principales puertos y de la viruta. Busque los modos de falla por el ojo y también bajo el microscopio.- Para comprobar que el chip está totalmente consolidado, tire ligeramente en cada esquina del chip para comprobar piezas delaminating.
- Buscar en el canal del chip para comprobar si una membrana arrugada o flácida, que aparecerá como un patrón ondulado o una ligera desviación en el canal.
- Realizar una inspección de microscopio para inspeccionar la suciedad en el canal principal.
Nota: Desechos en áreas no críticas, como los canales de vacío son aceptable. - Con el chip en el microscopio invertido, inspeccione el canal principal y canales de vacío para exfoliación.
Nota: Delaminación en áreas no críticas (por ejemplo, el borde del chip) es aceptable. - Verificar que los canales principales se alinean para dentro de 50-60 μm (1-2 poros de membrana).
Nota: Es fundamental que los canales no se solapan con los canales de vacío. - Compruebe que la membrana entre los canales principales y los canales de entrada y salida está intacta sin ningún aparente agujeros.
Nota: Cualquier agujero en la membrana puede conducir a un chip con fugas o crecimiento celular fuera de los canales.
- Tienda de chips en placas de Petri en un gabinete a temperatura ambiente la presión positiva.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
El protocolo que presentamos describe la fabricación escalable de PDMS órgano Chips. Estos dispositivos permiten el cultivo de dos tipos de distintos tejidos perfundidos en una membrana porosa elástico (figura 1). Los canales PDMS son fundición utilizando moldes de impresión 3D, que acelera la creación de prototipos de nuevos diseños (figura 2A y 2B). Canales superiores se echan en los moldes por compresión contra una Junta de poliuretano compatible para producir componentes con puertos moldeados (figura 2) y componentes de canal inferior están en bandejas manejados en portaobjetos respaldo (Figura 2D). Este enfoque de fabricación combina patrones de varias escalas de las partes en un solo paso, que ahorra tiempo, mejora la trazabilidad y reproducibilidad y reduce residuos generados por la perforación del puerto y varios pasos de corte. Las membranas porosas son esenciales para la función de la viruta del órgano y el método de fabricación basado en fundición contra las obleas de silicio con resultados en las membranas de espesor constante y acabado superficial (figura 3). Manejo a través de portadores de policarbonato permite almacenamiento y producción de lotes más grande.
El Chip montado del órgano (figura 4) consiste en dos canales de la perfusión en un paquete ópticamente transparente. En la región de superposición, una membrana porosa de PDMS permite la interacción del tejido-tejido de metabolitos, proteínas, terapéutica, patógenos y células para recapitular la función del órgano chip mientras dos canales paralelos a ambos lados se utilizan para proporcionar mecánico tensión mediante actuación cíclica de vacío. La porosidad de la biomimetically de la membrana PDMS apoya el flujo de metabolitos, factores de crecimiento y células incluso entre el parénquima de la vasculatura y órgano (figura 5). La permeabilidad aparente (Papp, cm/s) de la membrana se determinó la concentración de colorante en los canales de salida con y sin células intestinales de Caco2. Las tripa chip celular capas proporcionan una barrera aumentó significativamente a la permeabilidad. El Chip del órgano se puede accionar mediante los canales de vacío paralelo cuantitativa y reproducible aplicar tensión cíclica de carga a la membrana y por lo tanto los tejidos cultivados (figura 6). Esta tensión cíclica combinada con la perfusión de los medios de comunicación apoya la diferenciación celular para mejor imitar en vivo órgano fisiología, como la formación de las vellosidades en el Chip de la tripa.

Figura 2 : Fabricación de canal 3D impreso moldes. Piezas de órgano chip se echan contra alta resolución 3D impreso moldes (A y B), que permite mayor versatilidad de diseño y prototipado de litografía blanda tradicional. Partes de la canal superior (C) se curan bajo compresión, eliminando la necesidad de puertos en la parte final de la perforación. Cada bastidor triplicado es singulated con un solo corte. Partes inferiores de canal (D) se colocan en portaobjetos para facilitar la facilidad de uso y proyección de imagen. Barras de escala son aproximadamente 1 cm en todas las imágenes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : La membrana porosa de PDMS se proyecta utilizando obleas de silicio policristalino modelado DRIE. (A) representación de 7 μm de diámetro, 50 μm microcolumnas alto grabados usando DRIE en una oblea de silicio. (B) PDMS se cura en esta matriz en 4 kg de compresión (16 kPa) para crear una membrana gruesa de 50 μm con una matriz de 7 μm de diámetro, aunque los agujeros espacian aparte hexagonal 40 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Fotografía de un Chip de órganos reunidos de PDMS. Colorante rojo llena el canal apical más grande utilizado para células parenquimatosas mientras el colorante azul destaca el canal basal utilizado normalmente para el endotelio vascular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Permeabilidad del trazador inerte cascada azul a través de la membrana PDMS microporosa. Cascada azul hidrazida tinte en medio fue cargado en el canal superior de la viruta del órgano y perfundidos en 60 μL/h para medir el flujo de la tinta a través de la membrana en el canal inferior que contiene medio. Fichas vacías se compararon con tripa Chips con células Caco2 BBe1 en el canal apical y las células endoteliales vasculares humanas (HUVEC) en el canal básico cultivados durante 6 días. Barras de error indican el error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6 : Aplicación de la tensión de la membrana utilizando canales de vacío lado. Parcela indica modulación linear de la tensión de la membrana en respuesta a una presión de vacío aplicada. Tensión uniaxial cíclica se aplica uniformemente a la región de la cultura de la viruta del órgano con vacío aplicado a canales laterales paralelos. La cepa se correlaciona linealmente con la disminución de presión del vacío en la tensión del aproximadamente 1% por cada cambio-10 kPa de presión de vacío (R2 = 0.992). Barras de error indican la desviación estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
Materiales complementarios: Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
El proceso de fabricación se basa en moldes impresos 3D de alta resolución al patrón el PDMS superior e inferior órgano cuerpo componentes junto con membranas PDMS porosas micromolded. Este enfoque crítico fue seleccionado debido a la facilidad de prototipos combinado con la rápida transición hacia mayor fabricación y sustitución de herramientas. Los moldes principales componentes están diseñados para puertos de patrón en lugares precisos con perfiles definidos durante la etapa de fundición. Esto no sólo evita la mano de obra involucrados en la perforación manualmente puertos de acceso sino que también reduce desechos en el lugar de trabajo, alineación de Puerto reproducible permite múltiples interfaz o instrumentación, y produce piezas con control sobre el ajuste y sellado de insertado tubos o pernos para conexiones hidráulicos y neumáticos. Los moldes se apilan uno encima del otro en una plantilla de compresión, separada por la obedientes hojas de poliuretano para facilitar la colada a través del agujero de puertos. Apilando múltiples partes en una sola plantilla, un usuario puede convertir grandes cantidades de componentes con puertos en un solo paso. Selección de materiales y método para los moldes de fabricación son esenciales para proporcionar la característica necesaria resolución, baja rugosidad superficial y alto grado de planitud para montaje de dispositivo y aplicaciones posteriores. Estereolitografía puede cumplir estos requisitos, aunque materiales con temperaturas de deflexión alta (> 80 ° C) y compatibilidad con PDMS curado reducen la gama de polímeros disponibles. Diversas resinas disponibles en el mercado, incluyendo resinas de relleno de vidrio, cumplen estos criterios.
La membrana porosa elástica de PDMS es posiblemente el componente más singular y crítico de un Chip de órgano mientras que la más compleja de fabricar. Un ion profundo reactivo graba proceso (DRIE) tercerizado a un proveedor se utiliza para microfabricate 50 x 50 mm hexagonal matrices de pilares (7 μm de diámetro, separados 40 μm, 50 μm de altura, C4F8 cubierto) que se utilizan para los poros en la membrana PDMS del patrón. La calidad de los arreglos de discos de Pilar es fundamental para lograr la fundición robusta membrana. En particular, pilares deben grabarse a tolerancias apretadas con perfiles verticales lisas para evitar cortes o rugosidad de pared lateral excesiva que puede conducir a fallo del molde. Debe tenerse cuidado para evitar el "pastoreo" en la parte inferior de la región al ácido, que puede afectar la membrana demolding y adjunto de la celular. Fabricación de membrana con éxito a través del agujero modela y dispositivo de la integración es la sección más compleja única del protocolo. Críticamente, colocando 0,09 mL de PDMS en cada oblea y permitiendo un tiempo adecuado para difundir son esencial para evitar incompleta del moldeo a presión por el agujero. Correctamente plasma tratar el policarbonato de copia de seguridad es necesaria para lograr respaldo sólido de la membrana para desmoldear y vinculación pasos sin arrugas o estiramiento. El respaldo proporciona un medio sólido de desmoldear la membrana del reparto de la oblea de silicio frágil.
La carga compresiva aplicada a cada oblea es también esencial para la fabricación por-agujero uniforme. Esfuerzos anteriores usando pesas obstaculizan la producción de la membrana y dio lugar a bajos rendimientos debido a la distribución de la fuerza no uniforme. Para superar el cuello de botella de producción, optimiza la fabricación de membrana previamente publicado protocolo18 y construyó un fabricante de automatizado de membrana (AMF) para paralelizar el proceso. La AMF consiste de 24 pistones neumáticos apoyados sobre una placa caliente programable para proporcionar fuerza compresiva controlada a lo largo de un programado PDMS proceso de curado. Policarbonato película del forro se coloca en el PDMS sin curar y entonces uniformemente comprimidos con pistones neumáticos de la AMF mientras que siendo heated para polimerizar el PDMS. Críticamente, el gradual proceso descrito en los resultados del protocolo en las membranas de calidad más altos que un solo paso para la temperatura máxima, donde el calado patrones resultantes de burbuja durante el curado de curado proceso fueron observados. Si bien es opcional, la AMF aumenta el rendimiento considerablemente más allá de lo que es posible mediante pesos en un horno.
Las virutas resultantes de órgano de solución de problemas lleva a cabo en dos niveles: durante el proceso de fabricación y en cultura de órgano Chip. Hemos desarrollado un método visual para la garantía de calidad (QA) de formación a través de hoyos en las membranas de fundido que acelera mucho el proceso de producción y mejorar la calidad y fiabilidad de montar Chips de órgano. Este método de control de calidad permite la solución de problemas de proceso, y se recomienda mantener un registro de las condiciones de proceso para habilitar seguimiento de fabricación de problemas que pueden ocurrir durante la cultura de la célula. En cultura de órgano Chip, trazador inerte los tintes son el método más simple de medir la función de la barrera para solucionar problemas el proceso de fabricación y medidas de la cultura de la célula. Lucifer amarillo se ha utilizado históricamente debido a su pequeña masa molecular y la fluorescencia natural y cascada azul ofrece características similares con un espectro de emisión más estrecho que es menos probable que interferir en ensayos posteriores. Moléculas más grandes, tales como poly-etilenglicol (PEG)- o fluoróforos conjugados dextrano son más grandes y por lo tanto resultan en menor permeabilidad en general y menor sensibilidad. La permeabilidad aparente (Papp, cm/s) de tintes tracer puede utilizarse para determinar las propiedades de la función de barrera de órganos o tejidos (figura 4). La siguiente ecuación puede utilizarse para calcular Papp entre los canales de dosificación y receptora y se deriva de las ecuaciones que se utilizan principalmente para Transwell estudios19,20 y corrige para la pérdida de colorante trazador causada por la absorción en PDMS comparando los flujos de salida de dos y no basarse en supuestos de balance de masa en la salida.

VR es el volumen en mL de recibir efluentes de canal después de tiempo t; Vd es el volumen en mL del efluente canal dosificación después de tiempo t; A es el área de la región de membrana a través del orificio en cm2 (0,167 cm2 para este dispositivo); t es el tiempo de colección de efluentes en segundos; CR es el cambio medido en la concentración del tinte trazador en el efluente receptora del canal; CD es la concentración medida del tinte trazador en el efluente de canal dosificación. Principales supuestos de esta ecuación sea válida incluyen: tracer 1) constante dosificación de la concentración del tinte en tiempo t, 2) la concentración de Cr es pequeña comparado con el Cd, y 3) la permeabilidad del sistema se distribuye uniformemente en toda la región de la cultura. Aunque esta ecuación puede utilizarse para sistemas estáticos, se debe tener cuidado para comprobar que la hipótesis ser verdaderas. Métodos eléctricos, incluyendo resistencia eléctrica trans epitelial (TEER) se ponen en ejecución comúnmente en Transwell estudios y recientemente se han incorporado en los Chips de órgano de PDMS para mediciones de la función barrera instantánea y continua así21 ,22.
Limitaciones de este protocolo incluyen la elasticidad de PDMS, así como el proceso de fundición y ensamblaje manual que limita las tasas de producción. PDMS es un polímero versátil que está bien preparado para órgano que requieren actuación de tensiones mecánicas, pero su elasticidad puede obstaculizar la producción. Las partes pueden ser difíciles de manejar sin la deformación y las membranas requieren apoyo para la manipulación de las películas. Como resultado, automatización de la producción de la viruta del órgano puede ser limitada. El proceso del bastidor, a diferencia de la grabación en relieve caliente o moldeo por inyección utilizados para polímeros termoplásticos, está basada en el lote y por lo tanto también limita el rendimiento.
Órgano Chips permiten estudios en vitro de nivel órganos y cuerpo humano funciones en vivo por perfundiendo un medio común a través de los canales vasculares. Reconstituyendo las interfaces fisiológica del tejido, flujo de moléculas entre los compartimientos vasculares y parenquimatosos, señales mecánicas y esquileo fluídico y transporte, estos dispositivos promoción histodifferentiation y son capaces de recapitular en vivo-como funciones de los órganos normales y enfermos. La compartimentalización de tejidos y fluidos en dos compartimientos imita sus funciones en vivo , y estudios de Chip de órgano son susceptibles de experimentación farmacocinético tiempo resuelto y modelado como in vitro-en vivo extrapolación9,10 es difícil o imposible en solo canal MPS14,15,16. Las estructuras de la MCP se pueden aprovechar para otras aplicaciones, como investigar el impacto de la exposición al humo de tabaco dinámico con bidireccional en el epitelio de la vía aérea pequeña humana para desarrollar nuevos biomarcadores de daño de pulmón23. Las posiciones definidas de las membranas planas y alta claridad óptica de los dispositivos hacen especialmente adecuado para análisis basados en la imagen y la integración de sensores embebidos. El estímulo mecánico activado por integra canales de vacío y materiales elastoméricos proporciona funcionalidades no es posibles en sistemas Transwell. Hemos demostrado que la tensión mecánica es esencial para la recapitulación de algunos en vivo funciones fisiológicas, incluyendo la absorción de nanopartículas en el pulmón4, edema pulmonar3 y diferenciación de maduro podocytes glomerulares derivados de iPS8.
Futuras aplicaciones de este protocolo pueden incluir la integración de varias modalidades de detección que pueden utilizarse para proporcionar lecturas en tiempo real de viruta órgano ante estímulos tales como drogas, toxinas o radiación. El protocolo que presentamos podría extenderse a los materiales con diferentes propiedades ópticas, mecánicas y químicas, incluyendo los materiales biodegradables no PDMS. El protocolo de órgano Chip presentado aquí debe permiten a los investigadores a fabricar dispositivos que ofrecen un alto grado de control sobre el microambiente de los tejidos sanos y fisiopatológicos y órganos, que pueden aprovecharse para el desarrollo terapéutico, incluyendo descubrimiento, la toxicidad y las evaluaciones farmacocinéticas de destino en cuanto a la medicina personalizada.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. es fundador y tiene acciones en emular, Inc. y preside su Consejo Asesor científico. J.P. es actualmente un empleado de emular, Inc. R.N., Y.C., J.P., y D.E.I. son inventores sobre propiedad intelectual que ha sido licenciada a emular, Inc.
Acknowledgments
Agradecemos a M. Rousseau y S. Kroll para obtener ayuda con la fotografía y videografía Ingram M., J. Nguyen, D. Shea y Wen N. contribuciones al desarrollo de protocolo de fabricación inicial. Esta investigación fue patrocinada por el Instituto Wyss para biológicamente inspirado de ingeniería en la Universidad de Harvard y la Defense Advanced Research Projects Agency bajo acuerdos cooperativo #W911NF-12-2-0036 y #W911NF-16-C-0050 y FDA concesión # HHSF223201310079C, subvenciones de NIH R01-EB020004 # y #UG3-HL141797-01, y la Fundación Bill y Melinda Gates concede #OPP1163237 y #OPP1173198 a DEI. Las opiniones y conclusiones contenidas en este documento son las de los autores y no debe interpretarse como que representa la política oficial, ya sea expresa o implícita, de la Defense Advanced Research Projects Agency, Food and Drug Administration, la Institutos nacionales de salud, o el gobierno de Estados Unidos.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Bioingeniería número 140 órgano-en-un-chip microphysiological sistema microfluídica microfabricación PDMS membrana porosa microcanal esfuerzo cíclico perfusiónErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
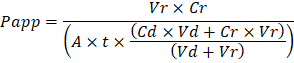
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
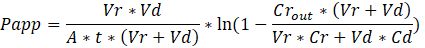
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



