ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Burada, açıklar gerilebilir, Çift Kanal imalatı, organ çip mikrosıvısal hücre kültür cihazlar organ düzeyi işlevlerine içinde in vitrorecapitulating için bir iletişim kuralı mevcut.
Abstract
Hayvan çalışmaları insan hastalarda klinik yanıt tahmin etmek sık sık başarısız olmaları nedeniyle çok sayıda kurşun bileşikleri ilaç boru hattı başarısız. Etkinlik, toksisite ve farmakokinetik (PK) profilleri insanlarda değerlendirmek için bir deneysel vitro platformu sağlayan insan Organ-on-a-Chip (Organ Chip) mikrosıvısal hücre kültür aygıtları,-ebilmek var olmak daha iyi tedavi edici etkinliği belirleyicileri ve Emanet için hayvan çalışmaları karşılaştırıldığında Kliniği. Bu cihazların hemen hemen herhangi bir organ türü işlevini model oluşturmak için kullanılan ve fluidically gerek kalmadan organ ve tüm vücut düzeyi insan fizyolojisi üzerinde vitro çalışmalar gerçekleştirmek için ortak endotel kaplı mikro aracılığıyla bağlanabilir insanlar üzerinde deneyler. Bu Organ fişleri geçirgen bir elastomerik membran organ özgü parenkima hücreleri bir tarafta ve hangi cyclically sağlamak için gergin olabilir diğer mikrovasküler endotel ile ayrılmış iki periosteum mikrosıvısal kanal oluşur organ özgü mekanik yardımlar (hareketleri akciğer nefesmesela ). Bu iletişim kuralı esnek, Çift Kanal imalatı detayları, Organ cips 3D kullanarak bölümlerinin döküm yoluyla kalıpları, birden fazla döküm kombinasyonu etkinleştirme ve adımları post-processing basılmış. Gözenekli poli (dimetil siloxane) (PDMS) membranlar boyutlu mikrometre ile döküm delik aracılığıyla silikon ayağı dizileri altında sıkıştırma kullanarak. İmalat ve montaj Organ fiş ekipman ve geleneksel bir temiz oda dışında uygulanabilir adımları içerir. Bu iletişim kuralı araştırmacılar vitro organ ve vücut düzey çalışmalar ilaç bulma, güvenlik ve etkinliğini test yanı sıra temel biyolojik süreçlerin mekanik çalışmaları için Organ çip teknolojisine erişim sağlar.
Introduction
Burada, Çift kanallı, imalatı bozukluklarına Organ-on-a-Chip (Organ Chip) mikrosıvısal kültür aygıtları kullanarak bir ölçeklenebilir protokol mükellef üniteleri ve geleneksel yumuşak litografi araçlarına erişim eksik araştırma grupları tarafından kullanılacak açıklayın. Bu cihazlar insan organ-düzey işlevleri anlayış normal ve hastalık Fizyoloji yanı sıra uyuşturucu yanıt vitro1,2için özetlemek için geliştirilmiştir. Kritik Mühendislik için bu işlevselliği yarı geçirgen bir zar (Şekil 1) tarafından ayrılmış iki periosteum mikrosıvısal kanallar vardır. Bu tasarım rekreasyon dokular, genellikle geçirgen membran bir tarafındaki organ parenkima hücreleri ve diğer vasküler endotel yanı sıra sıvı akış maruz kaldıkları en az iki tür arasındaki doku doku arayüzlerin sağlar. Ayrıca, çünkü elastomerik polimer, poli (dimetil siloxane) (PDMS) imal Organ çip vücut için kullanılır ve membran bileşenleri, döngüsel mekanik zorlanma mühendislik tüm uygulanabilir doku doku arabirim üzerinden elastik membran organlarının hareketleri akciğer ve bağırsak bağırsakların nefes gibi yaşam, doğal fiziksel microenvironment taklit etmek için.

Şekil 1: Organ çip kesiti. Organ cips iki kanal her iki tarafta hücrelerle seribaşı gözenekli, elastik zar ayrılmış oluşur. En iyi kanal kesitleri vardır 1 mm x 1 mm yüksek, alt geniş kanal çapraz bölüm 1 mm x 0.2 mm yüksek ve vakum kanalları hem de ve alt bölümleri geniş 0.3 mm genişliğinde, 0,5 mm yüksek vardır ve sıvı kanallardan 0.3 mm aralıklı vardır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Bu gerilebilir, Çift kanal, Organ cips nanopartikül emme akciğer ve akciğer ödemi ilaçla3,4hareket nefes etkisini gösteren için kullanılmıştır; farklılaşma5 ve bağırsak5,6,7bakteriyel büyüme üzerindeki etkileri peristaltik hareket; ve döngüsel deformasyonlar nedeniyle nabız kalp farklılaşması üzerine etkisi ve olgunlaşma böbrek8glomerular podocytes. Ayrıca, bir endotel kaplı vasküler kanal bir hücre dışı matriks (ECM) tarafından ayrılmış içeren bu iki lümen cihazlar-ayrı olarak erişilebilir bir kanal içinde parenkima hücrelerden kaplı membran uyuşturucu PK karakterizasyonu için uygundur parametreleri ve sınırlı tek perfüzyon yeni hedef bulma sistemleri kanal. Ayrıca, birden fazla Organ cips birlikte yolu ile bağlantılı olabilir etkili bir insan vücut-Tarih-hangi tedavi geliştirme9için bir çekici insan vitro platform teklif verebilir, cips, oluşturmak için onların vasküler kanallar 10. En mikro-fizyolojik sistemleri (MPS)11,12,13farklı olarak, Organ cips parenkima vasküler etkileşimlerine kolaylaştırır gözenekli bir zar ayrılmış iki mikrosıvısal kanal içerir. vivo organ fonksiyon özetlemek. Bu sadece vasküler kanallar aracılığıyla ortak bir orta ventriküler tarafından farklı organların birlikte bağlama kolaylaştırır, ancak doku ve sıvıları compartmentalization vivo içinde işlevlerini taklit eder ve farmakokinetik deneme destekler ve vitro-vivo içinde ekstrapolasyon9,zor veya imkansız tek kanal MPS14,15,1610 yanı sıra modelleme. PDMS popülaritesi mikrosıvısal aygıtları araçları geliştirme için malzemenin doğal yetenek küçük moleküller10,17emmek için üstesinden gelmek için açmıştır. Ancak, cips nerede PDMS emici bileşikleri ve mikrobiyal ajanlar kullanımı olun Organ fiş zor yeniden biyolojik çalışmaları desteklemek için gereken çok sayıda küçük araştırma grupları için bile bir ölçeklenebilir üretim süreci gerektirir. Burada açıklanan protokolü erişim üniteleri ve yumuşak litografi eksik dahil olmak üzere akademik laboratuarlarında kullanılmaya uygun cihaz imalat için bir yöntem sunar. Bu iletişim kuralı çok çeşitli temel biyolojik süreçlerin yanı sıra translasyonel terapötik geliştirme keşfetmek için gerilebilir, Çift Kanal aygıtları kullanmak isteyen araştırmacılar tarafından Organ yongaları için erişim genişletmek amaçlamaktadır.
Micromanufacturing alanları birleştirmek ile üretim için tasarım en iyi yöntemleri yararlanarak, sağlam bir yaklaşım yüksek tekrarlanabilirlik ve verim ile Organ çip cihazlar büyük miktarlarda imalatı için geliştirilmiştir. Burada açıklanan imalat Protokolü Organ çip üretimi için ölçeklenebilir bir yöntem sağlar. Biz kadar ölçeklendirme PDMS bileşenleri döküm etkinleştirmek için poliüretan conta şeritler ile birleştiğinde bir isteğe bağlı kalıp yerinde Jig (MIP; Ekmalzeme sökülüp takılması) nasıl kullanılacağını açıklar. Demolding dokulu yan kolaylaştırır süre poliüretan şeritler parlak yüz optik pürüzsüz PDMS parçalar üretmek. Ayrıca, bir isteğe bağlı otomatik membran fabrikatör (toplu iş başına 24 membranlar kadar imalatı için kür sırasında membran gofret kalıp Tekdüzen sıkıştırması sağlayan AMF) nasıl kullanılacağını açıklar. Tasarım geniş deneyim mekanik zorlanma ve perfüzyon dokuların oluşan organ çalışmaları için geçerlidir ve bu fişleri ile küçük ve büyük ihtiyaçlarını karşılamak için gereken miktarlar düşük çip çip değişkenlik üretilebilir araştırma grupları aynı. Bir toplu iş veya seri üretim bandından biçimine mükellef ve kolayca üretim süreçleri, personel eğitimi ve duyarlı sorun giderme kontrol için kalite değerlendirmesi protokolleri ile uyumlu akışıdır. Umarız bu protokolü erişim çift kanallı, gerilebilir, Organ yongaları için temel ve translasyonel araştırma yeteneklerini için genişleyecektir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. genel hazırlık
- Enkaz önlemek için çalışma alanı ambalaj bant kullanarak temiz ve temiz oda silin ve izopropil alkol alan aşağı silin.
- PDMS gerektiren tüm adımları için PDMS 10:1 oranında (10 Ajan, elastomer temel 100 g bağlama çapraz g) karıştırın. El ile veya piyasada bulunan bir mikser ile karıştırın. Burada bir gezegen santrifüj karıştırıcısını kullanır: 2000 rpm az 2 dakika boyunca karıştırma, sonra PDMS 2200 devirde 2 dakika gaz giderme.
- Darbe enkaz kullanmak için önceden dışarı için hava tabancası ile temiz tüm kalıpları.
Uyarı: Metal forseps kalıpları yüzeyine zarar verir gibi enkaz kaldırmak için kullanın.
2. üst kanal hazırlık
- Temizlik bezleri ve etanol ile poliüretan her parçanın parlak yüz aşağı silin. Tüm kalan etanol poliüretan yüzeyden kurutulur emin olun.
- Poliüretan parlak yüz sadece bir şey gibi açılış kalıp boşaltma PDMS için üstündeki bırakarak kalıp, açık tarafındaki bir mühür oluşturmak için MIP kalıp açık tarafına yerleştirin.
Not: Kontrol her kalıp poliüretan parça veya PDMS tarafından güvenli bir şekilde kaplıdır kalıpları dökme sırasında sızıntı olacaktır. - Kalıp ve poliüretan derlemeler karşı MIP jig sonu dokulu tarafı ile MIP jig içine yerleştirin. Kadar tüm kalıpları içinde jig yerleştirilir bu yapmaya devam edin.
- MIP jig jig aralığı 25 mm genişliğinde olana bir anahtarı kullanarak kolu çevirerek sıkıştırın.
- Alüminyum folyo yüzeyleri sızıntı aşırı PDMS önlemek için MIP jig çevreleyen bir tekne yapmak.
- PDMS her kalıpları içine de tam kadar dökün.
Not: Her küçük parça üst bileşen PDMS yaklaşık 3 mL gerektirir. - Bir kez tüm jig dolu, jig vakum desiccator içine yerleştirin. Vakum PDMS degas 1 h için-80 kPa, çek.
- 1 h sonra desiccator MIP jig çıkarın ve PDMS tedavi etmek en az 4 h 60 ° C fırında yerleştirin.
- Bir anahtarı kullanarak MIP jig sökmeye, jig kolu çevirerek gevşetin yönünün. Kalıplar sıkıştırma özgür olduğunda, kalıpları jig kaldırın.
- Poliüretan şeritler her kalıptan çıkartın ve atmak.
- Dikkatle de-kendi kalıpları PDMS parçaları kalıp ve onları özelliği-tarafı yukarı yatıyordu.
- Kiremit kazıyıcı, son sekme çentik bıçağına hizalamak ve her iki ucu için singulate en iyi bileşenler kes gitsin.
- Parçalar herhangi aşağıdaki hata modları için kontrol ve tatmin edici herhangi bir parça atmak: ana kanal, kanal alanı, büyük kabarcıklar, üzerindeki büyük enkaz çizikler deforme vakum kanalları.
- Parçalar kare Petri yemekler içinde basınç olumlu dolapları, oda sıcaklığında saklayın.
3. alt kanal hazırlık
- Kavite üst PDMS ulaşana kadar yaklaşık 10.5 g PDMS kalıpları içine dökün.
- Alt kanal kalıp kalıp altına tedavi PDMS için kontrol edin.
- Kalıp alt pürüzlü bir yüzeyde son parçaların düzensiz kalınlığı neden olabilir beri kirli, kalıp derinliklerinden gelen eski PDMS kazı.
Not: küçük için < ele geçen, 2 cm2 alanları hava tabancası çok yavaşça PDMS alan üzerinde taşımak için kullanılabilir.
- Kalıpları 1 h için vakum desiccator içine koyun.
- 1 saat sonra bir seviye 60 ° C fırında kalıpları taşınmak > 4 h.
- Laminar akış başlıklı masada kalıp yerleştirin. Kalıp bir kenarından PDMS gevşetin.
- Bir köşe kavrama ve yavaşça geri kalıp yüzeyinden PDMS soyma.
- Tamamen kaldırılır, kanal özellikleri yüz doldu çalışma yüzeyinde düzenleyin.
- Fayans Kesiciler, adım 2.12 olduğu gibi çentikli PDMS kiremit kesici bıçak yerleştirme ile dış kenarları boyunca parçalar kesip.
- Parçalar herhangi bir enkaz kaldırmak için kasette özelliği yan yatıyordu.
- Bant ambalaj bölümünü kaldırın. Bölümü gevşek sonunda slayt sürükleyin. Mutsuz son ile cam laminat.
Not: Bu bölümü. döşeme sırasında germe önlemek için önemlidir Eğer kabarcık bölümü ile cam arasında tuzak, yavaşça bölümü forseps ile kaldırın ve yeniden yatıyordu. - Parçaların kalite kontrol kontrol edin. Parçalar herhangi bir arıza modları için kontrol ve çizikler ana kanal, büyük enkaz, büyük kabarcıklar veya deforme vakum kanalları içeren kapsayan herhangi bir tatmin edici olmayan parçaları atın.
- Bant ile özellikleri kapsar.
- Parça pozitif basınç kabine oda sıcaklığında saklayın.
4. PDMS membran hazırlık
- Gofret arkasında PDMS ücretsiz olduğundan emin olun.
- Her zar gofret AMF kasetlerine atanmış yuva yerleştirin.
- 1 mL şırınga PDMS 0.09 mL her membran gofret yazı dizi merkezi yerleştirmek için kullanın. En az 5 dk PDMS membran gofret mesaj yaymak izin vermek için oturup PDMS izin.
Not: yazı dizi en az % 75'i PDMS içinde kaplı kadar bir sonraki adıma geçin değil. Artık PDMS uzun bekleme süreleri bu adımda tercih edilir böylece sonrası bölgeye fitil yetkisi olan membranlar kalitesini artırır. - Plazma 20 W 45 için Polikarbonat şerit tedavi s, O2 gaz plazma makine içinde 0.80 mbar.
- Polikarbonat levha plazma makineden çıkarın ve Polikarbonat levhalar 45 x 45 mm kareler halinde kesmek için makas kullanın.
Not: plazma ile teması en aza indirmek tedavi yüzey toz için Polikarbonat yapışmasını önlemek için. - Yavaşça Polikarbonat kareler üzerine sıvı PDMS membran gofret merkezli tedavi plazma yan yattı. Polikarbonat ve PDMS temas halinde olduğundan emin olun.
Not: hava cepleri polikarbonat ve PDMS arasında kaçının. - Önceden kesilmiş PDMS spacer Polikarbonat meydanın ortasına yerleştirin.
- Önceden kesilmiş dokulu Polikarbonat levha yapıştırma montaj sıkıştırma plaka tutmak için PDMS blok üzerine yerleştirin.
- Tepsi tepsi 3 arkada, tepsi 2 orta ve Kaset 1 ön ekleyin. Kaset 1 bir çentik hizalama için vardır.
- Çıkış basınç valfi açın ve giriş basıncı Vana yavaşça açın. Ancak o zaman çıkış basıncı Vanayı kapat.
Not: böylece çıkış gücünün 4 kg yavaş yavaş anında, hangi ekmeğine kırabilir aksine her membran gofret uygulanır bu. - AMF düğmeyi açık kür döngüsü başlar. Gofret altında 4 kg (16 kPa) sıkıştırma ve Tablo 1' de listelenen bayiliği bir sıcaklık döngüsü tedavi.
| Adım | Sıcaklık (° C) | Süresi (dk) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Basılı tutun |
Tablo 1 - membran koşullar kür
- Giriş basıncı Vanayı kapat ve hava silindir basınç serbest bırakmak için çıkış basınç valfi açın.
- Kasetlerdeki kaldırmak ve laminar akış hood getir.
- Dikkatle dokulu Polikarbonat soyma ve PDMS spacer dikkatli bir şekilde çıkarın.
Not: Bu farklı bir köşeden peeling başlangıç olursa da Polikarbonat taşıyıcı soyma değil emin olmak için PDMS spacer dikkat et.- Polikarbonat taşıyıcı için delikler aracılığıyla ile alanları aracılığıyla PDMS membran incelemek ve bir işaretleyici delik aracılığıyla alan anahat izlemek ve herhangi bir delik veya kusurları membranlarda işaretlemek için kullanın.
- Gofret forseps işleme kullanarak, gofret tepsisinden gevşetin.
- Her membran gofret çıkarın ve kabında yerleştirin.
Not: PDMS membran membran gofret--dan de-kalıp ve yedekleme Polikarbonat yapıştırılır. PDMS Polikarbonat gemisinden ayırma başlarsa, farklı bir bölgesinden kabuğu. - Membranlar ve gofret Petri yemekler pozitif basınç kabine oda sıcaklığında saklayın.
5. top derleme ve hazırlık
- Mat bant kullanarak, PDMS membranlar yanı sıra enkaz kaldırmak için Petri kabına içi temiz.
- İyice enkaz kaldırmak için en iyi her bileşenin Özellik yan bant.
- En iyi kanal bölümü ("top") özelliğini tarafı yukarı PDMS membran ile Petri kabına yerleştirin.
Not: bazı membranlar bir ya da iki üst kısımları kullanım alanı için boyutuna bağlı olarak kullanılabileceğini unutmayın. Her üst bölümü ana kanallar membran işaretli alana içinde uygun olmalıdır. - Petri yemekler plazma makineye yükleyin.
- Plazma tedavi membran ve üst 20 W için 45 s, O2 gaz 0.80 mbar.
- Bağ devir bitti sonra bulaşıkları kaldırmak ve aktif parça özelliği yan membran üstüne uzandı ve bölümü tamamen hava kabarcığı yok ile membran ile lamine sağlamak.
- 60 ° C fırında tavlama en az 2 h için parçalar yerleştirin.
- Bir neşter, Polikarbonat taşıyıcı üst-membran derlemesinden ayırmak için gümrüklü üst çevresinde izleme kullanarak.
Not: taşıyıcı kesme. - Bir kez bölümü takip, Polikarbonat derlemesinden kabuğu. Dön gümrüklü PDMS membran taşıyıcı soymak.
- Keskin uçlu forseps kullanarak, alt kanal erişim bağlantı noktalarından membran kaldırın ve bir stereoscope altında forseps ile herhangi bir enkaz veya toz kaldırma.
Not: erişim bağlantı noktası kapsayan membran herhangi bir bölümünü bırakmayın.
6. küçük parça derleme
- 5.5. adımda koşul kullanma alt bileşenleri ile tarafı yukarı, plazma tedavi derlemeleri bulunmaktadır.
- Ters bir mikroskop altında yarı en iyi derleme ile mikroskop slayt altına hizalayın.
- En az 2 h için 60 ° C fırında yerleştirin.
- Çip kalite kontrol muayene
Not: Ana bağlantı noktalarına yakın ilgi ve kanal çip ödeme. Hatası modları için göz bebekleri ve de mikroskop altında kontrol edin.- Çip tam gümrüklü denetlemek için hafifçe delaminating parçalar için kontrol etmek için belgili tanımlık küçük parça her köşesinde tug.
- Dalgalı bir desen veya hafif bir sapma kanal olarak görünür bir buruşuk veya sarkma membran denetlemek için çip kanal bakın.
- Enkaz ana kanaldaki incelemek için mikroskop kontrol edin.
Not: Enkaz vakum kanalları gibi kritik olmayan alanlarda kabul edilir. - Çipte ile hala ters mikroskop, ana kanal ve delaminasyon için vakum kanalları inceleyin.
Not: Delaminasyon kritik olmayan alanlarda (örn., çip kenarına) kabul edilir. - Ana kanal içinde 50-60 µm (1-2 membran gözenekleri) hizalanmış onay.
Not: Bu kanallar vakum kanalları ile üst üste değil önemlidir. - Ana kanal ve giriş ve çıkış kanal arasındaki zar belirgin herhangi bir delik sağlam olup olmadığını kontrol edin.
Not: Bir bulky çip ya da hücre büyümesini kanallar dışında zarda herhangi bir delik açabilir.
- Mağaza oda sıcaklığında kabine pozitif basınç Petri yemeklerinde fişleri.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Burada sunulan Protokolü PDMS Organ cips ölçeklenebilir imalatı açıklar. Bu cihazlar bir elastik geçirgen membran (Şekil 1) üzerinde iki ayrı derin doku türlerinin kültür sağlar. PDMS kanalları kullanarak 3D yazdırılan kalıpları, hangi yeni tasarımları (Şekil 2A ve 2B) prototip hızlandırır artığını. En iyi Kanal sıkıştırma alt kanal bileşenleri tepsilerde döküm ve (Şekil 2B) yedekleme mikroskop slayt üzerinde ele bileşenleri ile kalıplanmış liman (Şekil 2C) üretmek için uyumlu bir poliüretan conta karşı altında kalıp döküm. Bu imalat yaklaşım tek bir adım, zaman kazandırır, tekrarlanabilirlik ve izlenebilirlik geliştirir ve bağlantı noktası delme tarafından oluşturulan enkaz azaltır ve birden fazla kesme adım içine parçalar çok ölçek desenlendirme birleştirir. Gözenekli membranlar Organ Chip fonksiyonun kritik ve imalat yaklaşım desenli silikon gofret karşı membranlarda sonuçlarını tutarlı kalınlığı döküm dayanır ve yüzey kalitesi (Şekil 3). Polikarbonat taşıyıcıları ile işleme daha büyük toplu üretim ve depolama için izin verir.
Birleştirilmiş Organ çip (Şekil 4) iki perfüzyon kanal optik şeffaf bir paket içinde oluşur. Üst üste gelen bölgede gözenekli PDMS membran metabolitleri, proteinler, tedavi, patojenler ve iki tarafında iki paralel kanalları mekanik sağlamak için kullanılırken organ çip işlevi özetlemek için hücre, doku doku etkileşimi sağlar. Döngüsel vakum çalıştırma kullanarak zorlanma. PDMS membran biomimetically porozite akı metabolitleri, büyüme faktörleri ve hatta hücreler arasında damarlara ve organ parankimi (Şekil 5) destekler. Belirgin (Papp, cm/s) membran geçirgenliği boya konsantrasyon ve Caco2 bağırsak hücreleri olmayan çıkış kanalları kullanılarak tespit edilmiştir. Gut çip hücre katmanlar geçirgenliği önemli ölçüde artan bir engel sağlar. Organ çip nicelik ve tekrarlanarak çevrimsel gerilme membran ve bu nedenle kültürlü dokuları (Şekil 6) yükleme uygulamak için paralel vakum kanallarını kullanarak tahrik. Bu döngüsel zorlanma medya perfüzyon ile kombine daha iyi vivo içinde organ fizyolojisi, Gut yongası villus oluşumu gibi taklit etmek için hücresel başkalaşım destekler.

Resim 2 : Kanal imalat ile 3D baskı kalıpları. Organ yonga parçaları için büyük tasarım çok yönlülük ve prototip daha geleneksel yumuşak litografi sağlayan yüksek çözünürlüklü 3D yazdırılan kalıpları (A ve B), karşı artığını. En iyi kanal parçalar (C) bağlantı noktaları'nda parçalar delme gereksinimini ortadan kaldırarak sıkıştırma altında tedavi. İneklemek her döküm tek bir kesim ile singulated olduğunu. Alt kanal parçalar (D) kullanım kolaylığı ve görüntüleme kolaylaştırmak için cam slaytlar üzerine yerleştirilir. Ölçek çubukları yaklaşık 1 cm içinde tüm görüntüleri vardır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3 : Gözenekli PDMS membran DRIE desenli silikon gofret kullanarak artığını. (A) 7 µm çapı, 50 µm uzun boylu micropillars kazınmış DRIE silikon gofret kullanarak işleme. (B) PDMS bu dizinin altında 4 kg sıkıştırma (16 kPa) hexagonally 40 µm ayrı delik aralıklı olsa 50 µm kalınlığında membran 7 µm çapı bir dizi oluşturmak için tedavi edildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4 : Bir birleştirilmiş PDMS Organ çip fotoğrafı. Kırmızı boya genellikle kullanılan için vasküler endotel bazal kanal mavi boya vurgulamaktadır parenkima hücreleri için kullanılan büyük apikal kanal doldurur. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 5 : Atıl izleyici Cascade mavi gözenekli PDMS membran aracılığıyla geçirgenliği. Art arda sıralı mavi hydrazide boya orta Organ Chip en iyi kanal içine yüklenen ve boya akı membran arasında orta içeren alt kanalı ölçmek için 60 µL/s derin. Boş cips Gut yongaları için Caco2-BBe1 hücrelerin apikal kanal ve insan vasküler endotel hücrelerinde (HUVEC) 6 gündür kültürlü bazal kanal ile karşılaştırıldı. Hata çubukları ortalama standart hatasını gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 6 : Uygulama membran baskı vakum yan kanallarını kullanarak. Arsa doğrusal zorlanma modülasyon membran yanıt olarak uygulanan bir vakum basınç gösterir. Çevrimsel uniaxial zorlanma düzgün Organ paralel yan kanallar için uygulanan vakum kullanma Chip kültür bölgesine uygulanır. Zorlanma doğrusal olarak yaklaşık % 1 zorlanma her-10 kPa değişiklik vakum basınç, vakum basıncı azaltmak ile karşılıklı olarak ilişkilendirir (R2 0.992 =). Hata çubukları ortalama, standart sapma gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Ek malzemeler: Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
İmalat işleminin yüksek çözünürlükte 3D yazdırılan kalıpları için PDMS üst ve alt Organ çip karoserisi micromolded gözenekli PDMS Membranlar ile birleştiğinde desen kullanır. Bu kritik yaklaşım kurmak ölçeklendirilen imalat ve takım değiştirme içine hızlı geçiş ile birlikte prototipleme kolaylığı nedeniyle seçildi. Üst bileşen kalıp döküm adımı sırasında tanımlanmış dikey profilleri ile hassas yerlerde desen noktalarına tasarlanmıştır. Bu sadece emek erişim bağlantı noktalarının el ile delme dahil önler ancak da enkaz sağlar tekrarlanabilir bağlantı noktası hizalama arabirimi manifoldlar veya araçları, işyerinde azaltır ve denetim uyum ve mühürleme üretir parçalar eklenmiş tüp veya iğne sıvı ve pnömatik bağlantılar için. Kalıpları birbiri üstüne delik aracılığıyla döküm bağlantı noktalarının kolaylaştırmak için uyumlu poliüretan sayfaları tarafından ayrılmış bir sıkıştırma jig yer dizilir. Birden çok bölümü tek bir jig istifleme tarafından tek bir Kullanıcı bileşenleri ile bağlantı noktaları tek bir adımda komple büyük miktarlarda çevirebilirsiniz. Malzeme seçimi ve üretim kalıpları için yöntemi gerekli özelliği çözünürlük, düşük yüzey pürüzlülüğü ve düzlük aygıt montaj ve sonraki görüntüleme uygulamaları için yüksek derecede sağlamak için önemlidir. Her ne kadar yüksek saptırma sıcaklık (> 80 ° C) ile malzeme ve kür PDMS ile uyumluluk için polimer aralığını azaltmak stereolitografi bu ihtiyaçlarına cevap verebilecek. Reçineler, cam dolu dahil olmak üzere çeşitli ticari olarak mevcut reçineler, bu ölçütlere uyan.
Elastik gözenekli PDMS membran tartışmalı en benzersiz ve kritik bir Organ çip imal etmek en karmaşık olurken bileşenidir. Derin reaktif iyon (DRIE) işlemi bir satıcı için dış kaynaklı etches PDMS membran gözenekleri desen için kullanılan microfabricate 50 x 50 mm altıgen bir dizi sütun (7 µm çapı, 40 µm apart, 50 µm uzun boylu, boyalı C4F8 ) için kullanılır. Ayağı dizilerin kaliteli sağlam membran döküm ulaşmak için önemlidir. Özellikle, ayağı alttan veya başarısızlık kalıp neden olabilir aşırı kenarındaki pürüzlülük önlemek için düzgün dikey profilleri ile sıkı toleransları için kazınmış gerekir. "Grassing membran demolding etkileyebilir kazınmış bölge ve hücre ek alt kısmında" önlemek için özen gösterilmelidir. Membran imalat başarılı delik aracılığıyla desenlendirme ve aygıt entegrasyonu ile protokol tek en karmaşık bölümüdür. Eleştirel, PDMS 0.09 mL her gofret yerleştirerek ve yaymak yeterli zaman izin eksik delik aracılığıyla kalıplama önlemek için önemlidir. Düzgün yedekleme Polikarbonat tedavi plazma membran demolding ve kırışıklıklar veya germe olmadan adımları yapıştırma için güçlü destek ulaşmak için gereklidir. Destek kırılgan silikon gofret üzerinden dökme membran demolding güçlü bir araç sağlar.
Her gofret için uygulanan basınç yükü de tek tip delik aracılığıyla imalat için önemlidir. Önceki çabaları ağırlık kullanarak membran üretim engel ve düzgün olmayan güç dağıtım nedeniyle düşük verimleri sonuçlandı. Üretim performans sorunu aşmak için daha önce yayımlanmış membran imalat Protokolü18 en iyi duruma getirilmiş ve bir işlemi parallelize otomatik membran fabrikatör (AMF) inşa. AMF 24 Pnömatik pistonlar programlanmış bir PDMS işlem kür boyunca kontrollü basınç kuvveti için programlanabilir bir sıcak plaka üzerinde desteklenen oluşur. Film yedekleniyor bir polikarbonat iyileşmemiş PDMS yerleştirilir ve sonra düzgün AMF Pnömatik pistonlar ısıtmalı yaparken PDMS polimerize için kullanılarak sıkıştırılmış. Eleştirel, nerede kaynaklanan geçiş yumuşatma desen geliştirme kür sırasında kabarcık maksimum sıcaklık için tek bir adım daha yüksek kalite membranlarda Protokolü sonuçlarında açıklanan işlemi kür yavaş yavaş işlem gözlendi. İsteğe bağlı olsa da, AMF ne ağırlık fırın kullanarak mümkündür ötesinde önemli ölçüde işlem hacmi artar.
Sonuçta ortaya çıkan Organ cips sorun giderme iki düzeyde yer alır: imalat sürecinde ve Organ çip kültür sırasında. Kalite ve güvenilirliğini artırma Organ fiş monte ederken bu büyük ölçüde üretim sürecini hızlandırır delik aracılığıyla oluşumu döküm membranlarda kalite güvencesi (QA) için görsel bir yöntem geliştirdik. Sorun giderme işlemi bu QA yöntem sağlar ve izleme imalat etkinleştirmek için işlem koşulları kaydını tutmanız önerilir sırasında oluşabilecek sorunlar hücre kültür. Organ çip kültür sırasında inert izleyici boya imalat süreci ile ilgili sorunları giderme ve kültür adımları hücre için bariyer fonksiyonu ölçmenin en basit yöntem vardır. Lucifer sarı tarihsel olarak, küçük molekül ağırlığı ve doğuştan gelen floresans nedeniyle kullanılmıştır ama Art arda sıralı mavi aşağı akım deneyleri ile müdahale olasılığı daha düşüktür dar bir emisyon spektrum ile benzer özellikler sunuyor. Poli-ethyleneglycol (PEG) gibi büyük moleküllerin- veya dextran Birleşik fluorophores daha büyüktür ve sonuç olarak daha düşük geçirgenliği genel olarak neden ve düşük duyarlılık. İzleyici boyalar belirgin geçirgenlik (Papp, cm/s) organ veya doku (Şekil 4) bariyer işlevi özelliklerini belirlemek için kullanılabilir. Aşağıdaki denklemi Papp dozaj kanal ve alıcı kanal arasında hesaplamak için kullanılır ve öncelikle Transwell çalışmalar19,için20 kullanılan denklemler türetilir ve izleyici boya dökülmesi için düzeltir iki çıkış akışı karşılaştırarak ve kütle denge varsayımlar çıkış, güvenerek değil PDMS içine emme nedeniyle.

VR zaman tsonra kanal atık alma ml birimidir; Vd zaman tsonra ml dozaj kanal atık birimidir; A alandır membran delik aracılığıyla bölgenin cm2 (0,167 cm2 bu aygıt için); t saniye atık toplama zamanı; CR alıcı kanal atık izleyici boya konsantrasyon ölçülen değişimdir; CD izleyici boya dozaj kanal atık içinde ölçülen bölgedir. Anahtar varsayımlar için geçerli olması bu denklem içerir: 1) sürekli izleme boya dozaj konsantrasyon zaman tüzerinde 2) Cr konsantrasyonu küçük Cdiçin karşılaştırılır ve 3) sistem geçirgenliği birörnek dağıtılmış Kültür bölgede. Bu denklemin statik sistemler için kullanılabilmesine rağmen varsayımlar doğru tutun kontrol etmek için özen göstermelidir. Elektrik yöntemleri, trans-epitel elektrik direnci (aylarının) dahil olmak üzere Transwell çalışmalarda yaygın olarak uygulanan ve son zamanlarda PDMS Organ fiş içine anında ve sürekli bariyer fonksiyonu ölçüleri de21 dahil edilmiştir ,22.
Bu protokol sınırlamaları PDMS yanı sıra üretim oranları sınırlar el ile döküm ve derleme işlemi esnekliğini içerir. PDMS Organ mekanik zorlanma çalıştırma gerektiren yongaları için uygundur çok yönlü bir polimerdir ama onun esneklik üretim engel olabilir. Parçalar deformasyon ele almak zor olabilir ve membranlar filmleri manipülasyon için yedekleme gerektirir. Sonuç olarak, Organ çip Üretim otomasyon sınırlı olabilir. Döküm işleminden farklı olarak sıcak kabartma veya enjeksiyon kalıplama termoplastik polimerler için kullanılan toplu iş tabanlı ve bu nedenle de üretilen iş sınırlandırır.
Organ cips insan organ ve vücut düzey işlevleri içinde vivo vitro çalışmalar vasküler kanallar aracılığıyla ortak bir orta ventriküler tarafından etkinleştirin. Fizyolojik doku-doku arabirimleri, akı ve sıvı kesme ve taşıtlar, vasküler ve parenkimal bölmeleri, mekanik yardımlar arasında moleküllerin başlamaktan tarafından bu cihazlar histodifferentiation teşvik ve recapitulating yeteneğine sahiptirler vivo-tarihlerde normal ve hastalıklı organların işlevlerini. Doku ve sıvısının içinde iki bölmeleri compartmentalization vivo içinde işlevlerini taklit eder ve Organ çip çalışmalar içinde vitro-vivo içinde yanı sıra farmakokinetik deneme zaman karar vermek ve modelleme mükellef bulunmaktadır ekstrapolasyon9,10 zor veya imkansız tek kanal MPS14,15,16' dur. Microchannel yapıları ile çift yönlü akciğer hasarı23roman biyolojik geliştirmek için insan küçük hava yolu epitel içinde nefes dinamik tütün dumanı pozlama etkisini araştıran da dahil olmak üzere diğer uygulamalar için kullanılacak olabilir. Düzlemsel membranlar tanımlanan konumlarını ve cihazların yüksek optik netlik onları benzersiz olarak yansıma tabanlı analizler ve katıştırılmış sensörler entegrasyonu için uygun olun. Vakum kanalları tarafından etkin mekanik stimülasyon entegre ve elastomerik malzeme sağlar işlevleri Transwell sistemlerinde mümkün değil. Mekanik zorlanma Rekapitülasyon nanopartikül emme akciğer4, akciğer ödemi3 ve olgun farklılaşma dahil bazı in vivo fizyolojik fonksiyonları için gerekli olduğunu göstermiştir glomerular podocytes IP'leri türetilmiş8.
Bu protokol gelecekteki uygulamalar tümleştirme uyaranlara karşı ilaç, toksin ya da radyasyon gibi Organ çip yanıtının gerçek zamanlı sonuçlar sağlamak için kullanılan çeşitli algılama yöntemleri içerebilir. Burada sunulan protokolü için PDMS olmayan malzemeler ile farklı optik, mekanik ve kimyasal özellikleri, biyolojik olarak parçalanabilen malzemeler de dahil olmak üzere uzun olabilir. Burada sunulan Organ çip Protokolü araştırmacılar yüksek derecede microenvironment etyopatogenezi ve sağlıklı doku ve organlar, terapötik geliştirme için kullanılacak olabilir, üzerinde kontrol sunan cihazlar imal etkinleştirmeniz gerekir dahil olmak üzere hedef bulma, toksisite ve farmakokinetik değerlendirmeler de Kişiselleştirilmiş tıp gelince.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. bir kurucusu ve eşitlik taklit, Inc, tutar ve onun bilimsel Danışma Kurulu Başkanı. J.P. olduğunu şu anda taklit, Inc. adında, Y.C., J.P., çalışanı ve D.E.I. mucitler lisanslı taklit, Inc için fikri mülkiyet üzerinde
Acknowledgments
M. Rousseau ve S. Kroll ilk fabrikasyon Protokolü gelişimine katkıları için fotoğraf ve videografisi ve M. Ingram, J. Nguyen, ö. Shea ve N. Wen ile yardım için teşekkür. Bu araştırma için biyolojik ilham mühendislik Harvard Üniversitesi ve Savunma İleri Araştırma Projeleri Ajansı işbirliği anlaşmaları #W911NF-12-2-0036 ve #W911NF-16-C-0050 altında Wyss Enstitüsü tarafından sponsor oldu ve FDA verin # HHSF223201310079C, hibe NIH #R01-EB020004 ve #UG3-HL141797-01 ve Bill ve Melinda Gates Vakfı DEI için verir #OPP1163237 ve #OPP1173198. Sayısı ve sonuçlar bu belgede yer alan yazarlar ve resmi ilkelerine, ifade veya ima, Savunma İleri Araştırma Projeleri Ajansı, gıda ve İlaç İdaresi, temsil olarak yorumlanmalıdır değil Ulusal Sağlık Enstitüleri, veya ABD hükümeti.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Biyomühendislik sayı: 140 Organ-on-a-chip microphysiological sistemi mikrosıvısal microfabrication PDMS geçirgen membran microchannel döngüsel zorlanma perfüzyonErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
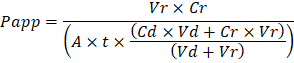
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
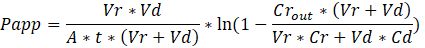
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



