ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
نقدم هنا، بروتوكول يصف تلفيق قناة المط، مزدوج، الجهاز رقاقة موائع جزيئية خلية الثقافة الأجهزة لأتصدى وظائف الجهاز-مستوى المختبر.
Abstract
فشل عدد كبير من مركبات الرصاص في خط الأنابيب الصيدلانية نظراً لأن الدراسات الحيوانية غالباً ما تعجز عن التنبؤ بالاستجابات السريرية في المرضى البشرية. قد يكون الجهاز على-رقيقة (الجهاز رقاقة) البشرية موائع جزيئية خلية الثقافة الأجهزة التي توفر منصة تجريبية في المختبر لتقييم فعالية وسمية، وملامح (PK) الحرائك الدوائية في البشر، تنبؤ أفضل من الفعالية العلاجية و السلامة في العيادة بالمقارنة مع الدراسات الحيوانية. يمكن استخدام نموذج الدالة من أي نوع الجهاز لهذه الأجهزة، ويمكن ربط فلويديكالي من خلال المشترك ميكروتشانيلس البطانة المبطنة لإجراء الدراسات في المختبر على علم وظائف الأعضاء البشرية على مستوى الجسم كله وعلى مستوى الجهاز دون الحاجة إلى إجراء تجارب على الناس. هذه "الرقائق الجهاز" تتألف من قناتين perfused موائع جزيئية مفصولة نفاذية الأغشية المرنة مع الخلايا الخاصة بالجهاز متني على جانب واحد والبطانة microvascular الأخرى، التي يمكن أن تمتد دورياً لتوفير الإشارات الميكانيكية الخاصة بالجهاز (مثل التنفس الالتماسات في الرئة). تفاصيل هذا البروتوكول تلفيق قناة مرنة، مزدوج، "رقائق الجهاز" عن طريق صب أجزاء باستخدام 3D طباعة قوالب، تمكن مجموعة من صب متعددة وتجهيز الخطوات. بولي المسامية (ثنائي ميثيل siloxane) ويلقي الأغشية (PDMS) مع ميكرومتر الحجم باستخدام صفائف عنصر السيليكون تحت ضغط من خلال الثقوب. تصنيع وتجميع "رقائق الجهاز" ينطوي على المعدات والخطوات التي يمكن أن تنفذ خارج تنظيم تقليدية. يوفر هذا البروتوكول الباحثين مع إمكانية الوصول إلى تكنولوجيا "رقاقة الجهاز" في المختبر الدراسات على مستوى الجهاز والهيئة في اكتشاف المخدرات والسلامة واختبار فعاليتها، فضلا عن الدراسات الميكانيكية للعمليات البيولوجية الأساسية.
Introduction
هنا، يمكننا وصف تلفيق قناة مزدوجة، أجهزة الثقافة vascularized موائع جزيئية الجهاز--على--رقيقة (الجهاز رقاقة) استخدام بروتوكول قابلة قابلة للاستخدام من قبل المجموعات البحثية التي تفتقر إلى الوصول إلى الأدوات التقليدية في الطباعة الحجرية الناعمة وكليانرومس. وقد وضعت هذه الأجهزة أن الخص وظائف الجهاز البشري لفهم عادي وفسيولوجيا الأمراض، فضلا عن المخدرات الردود في المختبر1،2. حاسمة بالنسبة للهندسة هذه الوظيفة قناتين perfused موائع جزيئية مفصولة بغشاء شبه منفذ (الشكل 1). يتيح هذا التصميم الترفيه واجهات الأنسجة الأنسجة بين نوعين على الأقل من الأنسجة، وعادة خلايا الجهاز متني على جانب واحد من الغشاء المسامية وبطانة الأوعية الدموية الأخرى،، فضلا عن تعرضهم لتدفق السوائل. وبالإضافة إلى ذلك، نظراً لأن البوليمر المرنة، بولي (ثنائي ميثيل siloxane) (PDMS)، ويستخدم لاختلاق الجسم "رقاقة الجهاز" ومكونات الغشاء، سلالة الميكانيكية دوري يمكن تطبيقها على كامل هندسيا الأنسجة الأنسجة واجهة عبر المرونة غشاء لتقليد المكروية الفيزيائية الطبيعية للأجهزة الحية، مثل التنفس الالتماسات في الرئة والتمعج في الأمعاء.

رقم 1: رقاقة الجهاز عبر الباب. رقائق الجهاز تتألف من قناتين مفصولة بغشاء المسامية، المرونة التي يمكن أن تبذر مع الخلايا على كلا الجانبين. قناة أعلى المقاطع العرضية 1 مم × 1 مم عالية، أسفل القناة عبر أقسام هي 1 مم × 0.2 مم قنوات عالية، وفراغ في كليهما والأجزاء السفلي هي 0.3 مم، 0.5 ملم عالية، والتباعد بين 0.3 مم من القنوات فلويديك. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
وقد استخدمت هذه القناة المط، مزدوج، "رقائق الجهاز" لإظهار تأثير التنفس الحركة على امتصاص نانوحبيبات في الرئة وذمة الرئة الناجمة عن المخدرات3،4؛ تأثيرات الحركة تحوي على التمايز5 وفرط البكتيرية في الأمعاء5،،من67؛ وتأثير التشوهات دوري سبب نبض القلب على تمايز ونضج بودوسيتيس الكبيبي في الكلي8. بالإضافة إلى ذلك، هذه الأجهزة اثنين-التجويف التي تحتوي على قناة مبطنة بطانة الأوعية الدموية مفصولة بمصفوفة خارج الخلية (ECM)-المغلفة غشاء من الخلايا متني داخل قناة موجوداً بشكل منفصل، أيضا مناسبة لتوصيف المخدرات PK المعلمات وهدف الاكتشاف الجديد، الذي اقتصر في نضح واحد قناة النظم. وعلاوة على ذلك، قد تكون مرتبطة متعددة "الجهاز رقائق" معا عن طريق قنواتهم الأوعية الدموية لفعالية إنشاء بشرية هيئة-على-رقائق، التي يمكن أن توفر منصة جذابة بشرية في المختبر للمداواة التنمية9، 10. خلافا الصغرى-الفسيولوجية أكثر النظم (MPS)11،12،13، تتضمن "رقائق الجهاز" قناتين موائع جزيئية مفصولة بغشاء مسامية تسهل التفاعلات الوعائية متني إلى الخص في فيفو وظيفة الجهاز. هذا يبسط ليس فقط الربط بين الأجهزة المختلفة معا بيرفوسينج متوسطة مشتركة من خلال القنوات والأوعية الدموية، ولكن التجزئة من الأنسجة والسوائل يحاكي وظائف في فيفو ويدعم التجريب الحرائك الدوائية و النمذجة وكذلك في المختبر-في فيفو استقراء9،10 التي من الصعب أو المستحيل في قناة واحدة من أعضاء البرلمان14،،من1516. شعبية PDMS في أجهزة موائع جزيئية قد أدى إلى تطوير أدوات للتغلب على هذه المواد المتأصلة قدرة على استيعاب جزيئات صغيرة10،17. ومع ذلك، يقتضي أعدادا كبيرة من رقائق المطلوبة لدعم الدراسات البيولوجية حيث جعل استخدام العوامل الميكروبية ومركبات امتصاص PDMS إعادة استخدام رقائق الجهاز صعبة عملية قابلة تصنيع حتى بالنسبة لمجموعات صغيرة للبحث. البروتوكول هو موضح هنا يقدم طريقة لتصنيع الجهاز مناسب للاستخدام في المختبرات الأكاديمية، بما في ذلك تلك التي تفتقر إلى الوصول إلى كلينرومس والطباعة الحجرية الناعمة. ويهدف هذا البروتوكول إلى توسيع نطاق الوصول إلى "رقائق الجهاز" بمجموعة واسعة من الباحثين تسعى إلى استخدام الأجهزة المط، مزدوجة القناة لاستكشاف العمليات البيولوجية الأساسية، فضلا عن التنمية العلاجية متعدية الجنسيات.
الاستفادة من أفضل الممارسات المستمدة من حقول ميكرومانوفاكتورينج إلى جانب التصميم للتصنيع، تم تطوير نهج قوية لاختلاق أجهزة "رقاقة الجهاز" بكميات كبيرة مع إمكانية تكرار نتائج عالية والعائد. ويوفر البروتوكول تلفيق الموصوفة هنا طريقة قابلة لإنتاج "الرقائق الجهاز". يصف لنا استخدام الاختياري العفن في مكان الرقصة (MiP؛ وتفاصيل التصميم في مواد تكميلية) مقترنة بشرائط البولي يوريثان طوقا تمكينا للارتقاء بصب المكونات PDMS. الجانب اللامع من شرائط البولي يوريثان تنتج السلس بصريا PDMS أجزاء بينما الجانب محكم يسهل ديمولدينج. ونحن أيضا وصف الاستخدام للاختياري الآلي غشاء المفترى (صندوق النقد العربي) يوفر ضغط موحدة من العفن ويفر الغشاء أثناء علاج لاختلاق ما يصل إلى 24 الأغشية كل دفعة. التصميم الواجب التطبيق على نطاق واسع للدراسات المتعلقة بالأجهزة التي تتكون من الأنسجة التي تعاني من إجهاد الميكانيكية ونضح، ويمكن أن تنتج هذه الرقائق مع تقلب رقاقة رقاقة انخفاض في الكميات المطلوبة لتلبية الاحتياجات الكبيرة والصغيرة المجموعات البحثية على حد سواء. سير العمل قابلة لشكل دفعي أو خط التجميع، وسهولة متوافق مع بروتوكولات تقييم الجودة للسيطرة على عمليات الإنتاج وتدريب الموظفين، واستكشاف الأخطاء وإصلاحها متجاوبة. ونأمل أن هذا البروتوكول سيتم توسيع نطاق الوصول إلى قدرات مزدوجة القناة، المط، "رقائق الجهاز" للبحوث الأساسية ومتعدية الجنسيات.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1-إعداد معلومات عامة
- لتجنب الحطام، تنظيف مساحة العمل باستخدام الشريط التعبئة ومسح أسفل المنطقة بتنظيم القضاء وكحول الأيزوبروبيل.
- لجميع الخطوات التي تتطلب PDMS، مزيج PDMS بنسبة 10:1 (10 جرام من عبر ربط عامل، 100 غرام من قاعدة الاستومر). خلط باليد أو باستخدام خلاط متاحة تجارياً. استخدام خلاط الطرد مركزي الكواكب هنا: خلط لمدة دقيقتين عند 2000 دورة في الدقيقة، ثم جليحه في PDMS لمدة دقيقتين عند 2200 دورة في الدقيقة.
- تنظيف جميع قوالب مع بندقية الهواء لضربة من الحطام قبل استخدامها.
تنبيه: عدم استخدام الملقط المعدني لإزالة الحطام كما أنها سوف تلحق الضرر سطح القوالب.
2-إعداد قناة الأعلى
- مسح أسفل الجانب اللامع من كل قطعة البولي يوريثان مع الإيثانول وتقضي على تنظيم. تأكد من أن جميع الإيثانول المتبقي هو المجففة من سطح البولي يوريثان.
- ضع الجانب اللامع البولي على الجانب المفتوح من العفن MiP لإنشاء ختم على الجانب المفتوح من العفن، تاركاً فقط من افتتاح الشبيهة بشكل جيد في الجزء العلوي من القالب لصب PDMS.
ملاحظة: تحقق من أن كل العفن مغطى بشكل أمن بقطعة البولي يوريثان أو تسرب PDMS من قوالب أثناء صب. - ضع التجميعات العفن والبولي في رقصة خطة التأمين الطبي، مع الجانب محكم ضد نهاية الرقصة خطة التأمين الطبي. الاستمرار في القيام بذلك حتى تم وضع جميع قوالب في الرقصة.
- تشديد الرقصة خطة التأمين الطبي عن طريق تحويل المؤشر باستخدام وجع حتى يتم التباعد الرقصة 25 مم في العرض.
- تجعل قارب رقائق الألومنيوم المحيطة الرقصة MiP للحيلولة دون تسرب على السطوح PDMS الزائدة.
- صب PDMS في كل من القوالب جيدا حتى كامل.
ملاحظة: يتطلب كل مكون من مكونات أعلى شرائح حوالي 3 مل PDMS. - حالما يتم تعبئة الرقصة كاملة، ضع الرقصة إلى مجففة فراغ. سحب فراغ في الجيش الشعبي الكوري-80 ح 1 ديغا PDMS.
- بعد ح 1، إزالة الرقصة خطة التأمين الطبي من مجففة ووضعه في الفرن 60 درجة مئوية على الأقل 4 ح لعلاج PDMS.
- تفكيك الرقصة خطة التأمين الطبي باستخدام وجع، تخفف الرقصة التي تحول المقبض عكس عقارب الساعة. وبمجرد قوالب خالية من ضغط، إزالة قوالب من الرقصة.
- إزالة شرائط البولي يوريثان من كل العفن وتجاهل.
- بعناية إزالة العفن PDMS أجزاء من تلك القوالب ووضع لهم ميزة--الجانب الأعلى.
- خط شفرة مكشطة بلاط في نهاية التبويب الشق وقطع بعيداً كل نهاية للعزاب أعلى المكونات.
- فحص أجزاء لأي من وسائط الفشل التالية وتجاهل أي أجزاء غير مرضية: خدوش في القناة الرئيسية، كبير الحطام فوق منطقة القناة، فقاعات كبيرة، مشوهاً قنوات فراغ.
- تخزين أجزاء الانتهاء في أطباق بتري مربعا داخل خزانات الضغط الإيجابي في درجة حرارة الغرفة.
3-إعداد القناة السفلي
- صب حوالي 10.5 g PDMS في قوالب حتى تصل PDMS إلى الجزء العلوي من التجويف.
- فحص العفن أسفل القناة ل PDMS الشفاء إلى الجزء السفلي من القالب.
- إذا كانت قذرة، كشط PDMS القديمة من الجزء السفلي من القالب منذ أحد الأسطح غير متكافئ في الجزء السفلي من القالب يمكن أن يسبب سماكة متفاوتة من الأجزاء النهائية.
ملاحظة: بالنسبة الصغيرة < يمكن استخدامها 2 سم2 المناطق التي كشفت، بندقية الهواء بلطف جداً لنقل PDMS عبر الفضاء.
- وضع قوالب في فراغ مجففة ح 1.
- بعد ح 1، نقل القوالب في فرن مستوى 60 درجة مئوية > ح 4.
- ضع القالب في الجدول في هود الاندفاق الصفحي. قم بفك PDMS من حافة واحدة من العفن.
- قبضة إحدى زوايا وقشر بلطف مرة PDMS من سطح القالب.
- عند إزالة تماما، تقع على سطح العمل، حيث أن ميزات القناة هي الوجه الأعلى.
- قص الأجزاء على طول الحواف الخارجية مع قطع البلاط، وضع شفرة قطع البلاط في PDMS مسنن كما في الخطوة 2، 12.
- وضع أجزاء الجانب ميزة على الشريط لإزالة أي حطام.
- إزالة جزء من تعبئة الشريط. اسحب نهاية فضفاض من الجزء الشريحة. وسوف صفح نهاية فضفاض مع الزجاج.
ملاحظة: من المهم تجنب تمتد الجزء في حين أنه يرسي. إذا فقاعة عالقة بين جزء والزجاج، برفق مع الملقط رفع الجزء وإعادة إرساء. - القيام بمراقبة نوعية التفتيش على أجزاء. فحص أجزاء من أي وسائط الفشل وتجاهل أي أجزاء غير مرضية، بما في ذلك تلك التي تحتوي على الخدوش في القناة الرئيسية، أو الحطام الكبيرة أو فقاعات كبيرة، أو قنوات فراغ مشوه.
- وتشمل الميزات مع الشريط.
- تخزين أجزاء في ضغط إيجابي مجلس الوزراء في درجة حرارة الغرفة.
4-PDMS إعداد الغشاء
- تحقق من خالية من PDMS على ظهره الرقائق.
- ضع كل يفر الغشاء في فتحات معينة في الصواني صندوق النقد العربي.
- استخدام المحاقن 1 مل لوضع مل 0.09 من PDMS في وسط كل غشاء يفر وظيفة الصفيف. السماح للجلوس لمدة 5 دقائق للسماح PDMS منتشرا في جميع الوظائف ليفر غشاء PDMS.
ملاحظة: عدم المضي قدما إلى الخطوة التالية حتى يتم تغطية 75 في المائة على الأقل من الصفيف وظيفة في PDMS. ويحسن نوعية الأغشية أطول PDMS مسموح بالفتيل إلى المنطقة بعد ذلك أوقات الانتظار أطول في هذه الخطوة المفضلة. - علاج البلازما في قطاع البولي في 20 ث ل 45 ق، س2 الغاز في 0.80 [مبر] في جهاز بلازما.
- إزالة ورقة البولي من الجهاز البلازما واستخدام مقص لقص الأوراق البولي في الساحات 45 ملم × 45 ملم.
ملاحظة: إلى تقليل الاتصال مع البلازما المعالجة السطحية لمنع الغبار من التمسك البولي. - بلطف يكمن الجانب البلازما تعامل المربعات البولي على PDMS السائلة التي تركزت على رقاقة الغشاء. ضمان البولي و PDMS في الاتصال.
ملاحظة: تجنب جيوب هوائية بين البولي و PDMS. - ضع فاصل PDMS قبل قطع في وسط ساحة البولي.
- ضع الورقة قبل قطع مادة البولي على كتلة PDMS أن تبقى الجمعية من الترابط إلى لوحة الضغط.
- إدراج علبة الورق بحيث 3 علبة في الظهر، 2 علبة في الوسط، وعلبة 1 في الجبهة. وقد درج 1 الشق للمحاذاة.
- فتح صمام الضغط الإخراج وفتح صمام الضغط الإدخال ببطء شديد. فقط قم بإغلاق صمام الضغط الناتج.
ملاحظة: هذا حيث أنه يتم تطبيق الإخراج 4 كجم من القوة تدريجيا إلى كل يفر غشاء مقابل على الفور، مما قد يؤدي إلى قطع الرقائق. - الوجه التبديل على أن تبدأ دورة علاج صندوق النقد العربي. علاج يفر 4 كغ (16 كيلو باسكال) تحت ضغط ودورة درجة حرارة تكثف المدرجة في الجدول 1.
| الخطوة | درجة الحرارة (درجة مئوية) | المدة (دقيقة) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | عقد |
الجدول 1-غشاء علاج الأوضاع
- إغلاق صمام الضغط الإدخال وفتح صمام الضغط الناتج للإفراج عن ضغط من اسطوانات الهواء.
- إزالة الصواني وتقديمهم إلى هود الاندفاق الصفحي.
- تقشر بعناية البولي محكم وإزالة فاصل PDMS بعناية.
ملاحظة: مشاهدة فاصل PDMS التأكد من أنها ليست أيضا تقشر الناقل البولي، إذا كان هذا يحدث ابدأ تقشير من زاوية مختلفة.- فحص الغشاء PDMS عن طريق الناقل البولي للمناطق من خلال الثقوب واستخدام علامة تتبع الخطوط العريضة للمنطقة من خلال ثقب ووضع علامة على أي ثغرات أو عيوب في الأغشية.
- استخدام رقاقة معالجة الملقط، تخفف ويفر من علبة الورق.
- إزالة كل الغشاء من يفر وتوضع في طبق بتري.
ملاحظة: سوف إزالة العفن من يفر غشاء الغشاء PDMS وتلتزم بالبولي النسخ. إذا PDMS يبدأ فصل من الناقل البولي، قشر من منطقة مختلفة. - تخزين الأغشية والرقائق في أطباق بتري في ضغط إيجابي مجلس الوزراء في درجة حرارة الغرفة.
5-أعلى الجمعية وإعداد
- باستخدام الشريط غير لامع، تنظيف الأغشية PDMS فضلا عن الدواخل طبق بيتري لإزالة الحطام.
- دقة الشريط إلى جانب ميزة كل المكون الأعلى لإزالة الحطام.
- مكان قناة أعلى جزء ("أعلى") ميزة الجانب الأعلى في صحن بتري مع غشاء PDMS.
ملاحظة: تكون على علم أن بعض الأغشية يمكن أن تستخدم لأجزاء أعلى واحد أو اثنين تبعاً لحجم منطقة قابلة للاستخدام. وينبغي أن تناسب القنوات الرئيسية لكل الجزء العلوي داخل منطقة ملحوظ من الغشاء. - تحميل أطباق بيتري في الجهاز البلازما.
- بلازما علاج الغشاء وأعلى في 20 ث ل 45 ق، س2 الغاز في 0.80 [مبر].
- وبمجرد الانتهاء من دورات الترابط، إزالة الأطباق ووضع أجزاء تنشيط ميزة الجانب أسفل أعلى الغشاء وضمان جزء هو مغلفة تماما بغشاء مع لا فقاعات.
- ضع الأجزاء في الفرن 60 درجة مئوية على الأقل 2 ح يصلب.
- استخدام مشرط، تتبع حول محيط أعلى الاستعبادي لفصل الجمعية الغشاء أعلى من الناقل البولي.
ملاحظة: لا تقطع الناقل. - حالما يتم إرجاع الجزء، قشر الجمعية العامة من البولي. وينبغي أن قشر الغشاء PDMS هو الرهينة إلى الأعلى من الناقل.
- استخدام الملقط مقلوب حادة، إزالة الغشاء من المنافذ التي الوصول إلى أسفل القناة، وإزالة أي الحطام أو الغبار مع الملقط تحت ستيريوسكوبي.
ملاحظة: لا تترك أي جزء من الغشاء الذي يغطي ميناء الوصول.
6-رقاقة الجمعية
- وتتميز الجانب الأعلى، جمعيات علاج البلازما مع مكونات أسفل باستخدام الشروط في الخطوة 5، 5.
- تحت مجهر مقلوب محاذاة الجمعية العليا مع الشريحة المجهر إلى الأسفل النصف.
- وضع في الفرن 60 درجة مئوية على الأقل ح 2.
- رقاقة مراقبة نوعية التفتيش
ملاحظة: اهتماما وثيقا إلى الموانئ الرئيسية وقناة للرقائق. التحقق من وجود وسائط الفشل بالعين وأيضا تحت المجهر.- للتحقق من أن الرقاقة هو الرهينة بالكامل، الساحبة طفيفة في كل زاوية من الرقائق للتحقق من أجزاء ديلاميناتينج.
- انظروا إلى قناة رقاقة للتحقق من وجود غشاء التجاعيد أو الترهل، التي ستظهر كنقش مموج أو انحراف ضوء في القناة.
- القيام بعملية تفتيش مجهر فحص للحطام في القناة الرئيسية.
ملاحظة: الحطام في مجالات غير حاسمة، مثل قنوات فراغ مقبول. - مع رقاقة لا يزال على المجهر المقلوب، تفقد القناة الرئيسية والقنوات فراغ تنسل الأطراف.
ملاحظة: تنسل الأطراف في المجالات غير الضرورية (مثل حافة الرقاقة) مقبول. - تحقق من أنه قد تمت محاذاة القنوات الرئيسية إلى داخل 50-60 ميكرومتر (مسام الغشاء 1-2).
ملاحظة: من الأهمية بمكان أن القنوات ليست متداخلة مع قنوات فراغ. - تحقق من أن الغشاء بين القنوات الرئيسية والقنوات مداخل ومخارج سليمة دون أي ثغرات واضحة.
ملاحظة: يمكن أن يؤدي أي ثقب في الغشاء على رقاقة راشح أو نمو الخلايا خارج القنوات.
- رقائق مخزن في أطباق بتري في ضغط إيجابي مجلس الوزراء في درجة حرارة الغرفة.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ويصف البروتوكول المعروضة هنا قابلة تصنيع الرقائق الجهاز PDMS. هذه الأجهزة تمكين ثقافة نوعين من الأنسجة perfused متميزة في الأغشية مسامية مرونة (الشكل 1). ويلقي القنوات PDMS استخدام قوالب المطبوعة 3D، مما يعجل بالنماذج تصاميم جديدة (الشكل 2 ألف و 2 باء). ويلقي كبار القنوات في قوالب تحت ضغط ضد طوقا البولي يوريثان متوافقة لإنتاج المكونات مع منافذ مصبوب (الشكل 2) حين يلقي في علب أسفل القناة المكونات والتعامل معها على شريحة المجهر النسخ (الشكل 2D). يجمع هذا النهج تلفيق الزخرفة مقياس متعدد الأجزاء في خطوة واحدة، مما يوفر الوقت ويحسن من إمكانية تكرار نتائج والتعقب ويقلل من الحطام المتولد عن ميناء اللكم وخطوات شاملة لقطاعات متعددة. الأغشية المسامية الحرجة للدالة من "شرائح الجهاز"، ويستند النهج تلفيق الصب ضد رقائق السليكون منقوشة النتائج في أغشية من سماكة متسقة وصقل السطح (الشكل 3). معالجة عن طريق شركات البولي يسمح لأكبر دفعة الإنتاج والتخزين.
رقاقة الجهاز المجمعة (الشكل 4) يتكون من قناتين التروية في حزمة شفافة بصريا. في المنطقة متداخلة، تمكن غشاء PDMS مسامية تفاعل الأنسجة الأنسجة من نواتج الأيض، والبروتينات والمداواة، ومسببات الأمراض والخلايا الخص الجهاز رقاقة وظيفة بينما تستخدم قناتين متوازية على جانبي لتوفير الميكانيكية سلالة استخدام يشتغل فراغ دوري. وتدعم التسلل بيوميميتيكالي غشاء PDMS التمويه من نواتج الأيض، وعوامل النمو والخلايا حتى بين حمة المفرج والجهاز (الشكل 5). نفاذية الغشاء الظاهر (فالتطبيق، cm/s) عازمة على استخدام تركيز الصبغة في القنوات منفذاً مع أو بدون خلايا القناة الهضمية Caco2. طبقات الخلية رقاقة القناة الهضمية توفر حاجزاً كبيرا زيادة النفاذية. يمكن أن تكون دفعتها "رقاقة الجهاز" استخدام القنوات فراغ موازية للكمية وتكاثر تطبيق إجهاد دوري تحميل الغشاء وبالتالي زيادة الأنسجة المستزرعة (الشكل 6). ويدعم هذه السلالة دوري جنبا إلى جنب مع وسائط الإعلام نضح التمايز الخلوي لأفضل تقليد في فيفو فسيولوجيا الجهاز، مثل تشكيل الزوائد في "رقاقة القناة الهضمية".

الشكل 2 : تصنيع قناة مع 3D طباعة قوالب. ويلقي الجهاز رقاقة أجزاء ضد عالية الدقة 3D مطبوعة قوالب (A و B)، الذي يسمح لزيادة مرونة التصميم والنماذج من الطباعة الحجرية الناعمة التقليدية. قناة أعلى أجزاء (ج) يشفي تحت ضغط القضاء على الحاجة إلى اللكم الموانئ في الأجزاء النهائية. كل صب ثلاث سينجولاتيد مع قطع واحد. أسفل القناة أجزاء (د) توضع على الشرائح الزجاجية لتيسير سهولة الاستخدام والتصوير. أشرطة مقياس من 1 سم تقريبا في جميع الصور. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3 : مسامية الغشاء PDMS هو يلقي استخدام رقائق السليكون DRIE منقوشة. (أ) التقديم من 7 ميكرومتر قطرها 50 ميكرون ميكروبيلارس القامة محفوراً في استخدام DRIE في رقاقة سيليكون. (ب) PDMS يشفي في هذا الصفيف تحت 4 كجم من ضغط (16 كيلو باسكال) لإنشاء غشاء سميك 50 ميكرومتر مع صفيف من 7 ميكرومتر القطر على الرغم من ثقوب متباعدة عن بعضها البعض هاكسغنلي 40 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4 : صورة فوتوغرافية "رقاقة" إلكترونية المجتمعة في الجهاز PDMS. الصبغ الأحمر يملأ القناة قمي أكبر المستخدمة للخلايا متني بينما الصبغة الزرقاء يسلط الضوء على قناة القاعدية التي عادة ما تستخدم للبطانة الوعائية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 5 : نفاذية الراسم خاملة "الأزرق تتالي" عبر غشاء PDMS microporous- صبغة زرقاء المالئيك تتالي في المتوسط تم تحميله إلى القناة أعلى شريحة الجهاز و perfused في 60 ميليلتر/ساعة لقياس تدفق الصبغة عبر الغشاء إلى أسفل القناة التي تحتوي على المتوسط. وقورنت "القناة الهضمية رقائق" رقائق فارغة مع خلايا Caco2-BBe1 في قناة قمي والخلايا البشرية غشائي الأوعية الدموية (هوفيك) في قناة القاعدي مثقف لمدة 6 أيام. أشرطة الخطأ تشير إلى الخطأ المعياري للوسط. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 6 : تطبيق إجهاد غشاء استخدام قنوات الجانب فراغ. الأرض يشير إلى التحوير السلالة الخطي من الغشاء استجابة لضغط فراغ تطبيقية. سلالة أونياكسيال دوري هو تطبيقها تطبيقاً موحدا لمنطقة الثقافة رقاقة الجهاز استخدام الفراغ التطبيقية إلى قنوات موازية من الجانب. السلالة يرتبط خطيا مع تناقص الضغط فراغ في حوالي 1% في سلالة لكل تغيير-10 الجيش الشعبي الكوري في فراغ الضغط (ص2 = 0.992). أشرطة الخطأ تشير إلى الانحراف المعياري للوسط. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
مواد تكميلية: الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Subscription Required. Please recommend JoVE to your librarian.
Discussion
عملية التصنيع تعتمد على قوالب المطبوعة 3D عالية الدقة لنمط مكونات الجسم PDMS "رقاقة الجهاز" أعلى وأسفل مقترنة بالأغشية PDMS المسامية ميكرومولديد. واختير هذا النهج النقدي الواجب للتخفيف من النماذج جنبا إلى جنب مع التحول السريع إلى تلفيق المحجمة عن واستبدال الأدوات. قوالب العنصر الأعلى مصممة لنمط الموانئ في المواقع بدقة مع التشكيلات الجانبية عمودية محددة أثناء الخطوة الصب. هذا ليس فقط تجنب حزب العمل المشاركة في اللكم منافذ الوصول يدوياً ولكن أيضا يقلل من الحطام في مكان العمل، وتمكن منفذ استنساخه بمحاذاة الفتحات واجهة أو الأجهزة، وإدراج أجزاء تنتج مع السيطرة على احتواء وختم أنابيب أو دبابيس للاتصالات فلويديك والهوائية. القوالب هي مكدسة فوق بعضها البعض في رقصة ضغط، مفصولة بواسطة متوافقة مع أوراق البولي يوريثان لتسهيل الصب من خلال ثقب في الموانئ. بالتراص أجزاء متعددة في رقصة مفردة، مستخدم واحد يمكن تحويل كميات كبيرة من المكونات كاملة مع منافذ في خطوة واحدة. اختيار المواد والتصنيع الأسلوب للقوالب بالغة الأهمية لتوفير ميزة ضرورية القرار وخشونة السطح منخفضة، ودرجة عالية من التسطيح للجمعية الجهاز وتطبيقات التصوير اللاحقة. المجسمة ويمكن تلبية هذه الاحتياجات، على الرغم من أن المواد مع انحراف ارتفاع درجات الحرارة (> 80 درجة مئوية) والتوافق مع PDMS علاج تقليل نطاق البوليمر المتاحة. مختلف راتنجات المتاحة تجارياً، بما في ذلك راتنجات مليئة بالزجاج، تفي بهذه المعايير.
هو الغشاء PDMS مسامية مطاطا يمكن القول أن المكون الأكثر فريدة من نوعها وحاسمة "الجهاز رقاقة" إلكترونية بينما يجري الأكثر تعقيداً تلفيق. أيون العميق القائم على رد الفعل اتشيس (DRIE) عملية الاستعانة بمصادر خارجية لبائع يستخدم ميكروفابريكاتي 50 x 50 مم سداسية صفائف من ركائز (7 ميكرومتر في القطر، 40 ميكرومتر وبصرف النظر، طوله 50 ميكرومتر، ج4و8 المغلفة) التي يتم استخدامها لنمط المسام في غشاء PDMS. نوعية صفيفات الدعامة أمر حاسم في تحقيق صب غشاء متين. على وجه الخصوص، يجب أن محفوراً الدعائم للتحمل مشددة مع التشكيلات الجانبية الرأسية السلس لتجنب يضعف أو خشونة الجدار المفرطة يمكن أن تؤدي إلى فشل العفن. وينبغي الحرص على تجنب "جراسينج" في الجزء السفلي من المنطقة المحفورة، التي يمكن أن تؤثر على غشاء ديمولدينج ومرفق خلية. تصنيع غشاء مع نجاح التكامل من خلال ثقب الزخرفة والجهاز هو الجزء الأكثر تعقيداً واحدة من البروتوكول. نقديا، وضع مل 0.09 من PDMS على كل رقاقة والسماح بوقت كاف لأنه ينتشر ضروري لتجنب صب من خلال ثقب غير مكتملة. صحيح البلازما علاج البولي النسخ مطلوب لتحقيق دعم قوي للغشاء ديمولدينج والترابط الخطوات دون التجعد أو تمتد. ويوفر الدعم وسيلة قوية ديمولدينج الغشاء المدلى بها من رقاقة السليكون الهشة.
تحميل ضاغطة المطبقة على كل رقاقة ضروري أيضا موحدة من خلال ثقب تلفيق. الجهود السابقة باستخدام أوزان تعوق إنتاج الأغشية وأسفر عن غلة الفقراء بسبب توزيع القوة غير موحدة. للتغلب على اختناقات الإنتاج، نحن الأمثل البروتوكول تصنيع غشاء المنشورة سابقا18 وبنيت الآلي غشاء كاذب (صندوق النقد العربي) باراليليزي العملية. صندوق النقد العربي يتكون من 24 المكابس الهوائية يؤيد على صفيحة ساخنة قابلة لبرمجة لتوفير قوة ضاغطة الخاضعة للرقابة في جميع أنحاء PDMS مبرمجة علاج عملية. البولي دعم الفيلم ينصب على PDMS أونكوريد وثم موحد ضغطها باستخدام المكابس الهوائية لصندوق النقد العربي حين يتم تسخينها إلى بلمرة في PDMS. نقديا، تدريجيا علاج العملية الموصوفة في نتائج البروتوكول في أعلى نوعية الأغشية من خطوة واحدة إلى درجة الحرارة القصوى، حيث أنماط ريش الناتجة عن فقاعة التنمية أثناء المعالجة العملية لوحظ. بينما الاختياري، صندوق النقد العربي يزيد الإنتاجية إلى حد كبير يتجاوز ما هو ممكن باستخدام الأوزان في فرن.
استكشاف الأخطاء وإصلاحها "رقائق الجهاز" الناتجة تجري على مستويين: أثناء عملية التصنيع وخلال الثقافة "رقاقة الجهاز". قمنا بتطوير أسلوب بصرية لضمان الجودة (QA) لتشكيل من خلال ثقب في الأغشية المدلى بها أن يتسارع بشكل كبير في عملية الإنتاج مع تحسين الجودة والموثوقية لتجميع "الرقائق الجهاز". يسمح هذا الأسلوب سؤال وجواب لعملية استكشاف الأخطاء وإصلاحها، ونوصي بالاحتفاظ بسجل للظروف العملية لتمكين تتبع اختﻻق المشاكل التي قد تحدث أثناء خلية ثقافة. خلال "رقاقة الجهاز" الثقافة، الأصباغ الراسم خاملة هي أبسط طريقة لقياس وظيفة الحاجز استكشاف الأخطاء وإصلاحها في عملية التصنيع، والخلية خطوات الثقافة. إبليس الأصفر قد استخدمت تاريخيا نظراً للكتلة الجزيئية الصغيرة والأسفار الفطرية، ولكن "الأزرق تتالي" يوفر خصائص مماثلة مع طيف انبعاث أضيق الذي أقل من المحتمل أن تتداخل مع فحوصات المتلقين للمعلومات. الجزيئات الكبيرة، مثل بولي-اثيلينيجليكول (شماعة)-أو مترافق ديكستران فلوروفوريس هي أكبر ونتيجة لذلك ينتج نفاذية أقل عموما وأقل حساسية. نفاذية الراسم الأصباغ الظاهر (فالتطبيق، cm/s) يمكن استخدامها لتحديد خصائص دالة الحاجز أو الأنسجة (الشكل 4). المعادلة التالية يمكن استخدامها لحساب فالتطبيق بين الجرعات القناة والقناة المستقبلة ومشتق من المعادلات المستخدمة أساسا للدراسات ترانسويل19،20 وتصحيح لفقدان صبغة الراسم سبب باستيعابهم في PDMS مقارنة تدفقات الإخراج اثنين وعدم الاعتماد على الافتراضات توازن الكتلة في التدفق.

الواقع الافتراضي هو المجلد في مل من تلقي النفايات السائلة القناة بعد الزمن t؛ مرض جنسي هو وحدة التخزين في مل من النفايات السائلة قناة الجرعات بعد الزمن t؛ (أ) هو المنطقة المنطقة من خلال ثقب الغشاء في سم2 (0.167 سم2 لهذا الجهاز)؛ t هو وقت جمع النفايات السائلة في ثوان؛ Cr هو قياس التغيير في تركيز الصبغة الراسم في قناة تلقي النفايات السائلة؛ مؤتمر نزع السلاح هو قياس تركيز الصبغة الراسم في النفايات السائلة قناة الجرعات. مفتاح افتراضات لهذه المعادلة لتكون صالحة وتشمل: صبغ الراسم 1) مطرد تركيز الجرعات على مر الزمن t، 2) تركيز Cr صغير بالمقارنة مع مؤتمر نزع السلاح، وتوزع 3) نفاذية النظام موحد عبر منطقة الثقافة. على الرغم من أن يمكن استخدام هذه المعادلة لنظم ثابتة، يجب الحرص على التحقق من أن الافتراضات صحيحاً. أساليب الكهربائية، بما في ذلك عبر الظهارية المقاومة الكهربائية (طير) وتنفذ عادة في الدراسات ترانسويل وأدرجت مؤخرا في رقائق الجهاز PDMS للحاجز الفوري والمستمر، فضلا عن القياسات الدالة21 ،22.
وتشمل القيود المفروضة على هذا البروتوكول مرونة PDMS، فضلا عن عملية الصب والجمعية اليدوي الذي يحد من معدلات الإنتاج. PDMS هو بوليمر تنوعاً التي مناسبة تماما "رقائق الجهاز" تتطلب يشتغل السلالة الميكانيكية، ولكن مرونته يمكن أن تعرقل الإنتاج. أجزاء يمكن أن تكون صعبة التعامل معها دون تشوه وأغشية تتطلب دعم الأفلام للتلاعب. كنتيجة لذلك، يمكن أتمتة لإنتاج "الرقائق الجهاز" محدودة. عملية الصب، خلافا للنقش الساخنة أو حقن صب يستخدم للبوليمرات الحرارية، ترتكز على دفعة وذلك كما يحد من الإنتاجية.
تمكين الجهاز رقائق الدراسات في المختبر للبشرية على مستوى الجهاز والهيئة مهام في فيفو بيرفوسينج متوسطة مشتركة من خلال القنوات والأوعية الدموية. بإعادة تشكيل الواجهات فسيولوجية النسيج-النسيج، التمويه الجزيئات بين المقصورات الأوعية الدموية ومتني والرموز الميكانيكية، والقص فلويديك والنقل، تشجيع هيستوديفيرينتييشن هذه الأجهزة وقادرون على أتصدى في فيفو--مثل وظائف الأجهزة العادية والمريضة على حد سواء. التجزئة من الأنسجة والسوائل في مقصورات اثنين يقلد وظائفها في الجسم الحي ، ودراسات "الجهاز رقاقة" قابلة للتجريب الحرائك الدوائية حل الوقت والنمذجة، فضلا عن- في المختبرفي فيفو استقراء9،10 وهذا أمرا صعباً أو مستحيلاً في قناة واحدة من أعضاء البرلمان14،،من1516. يمكن أن تكون الاستدانة بنيات microchannel للتطبيقات الأخرى، بما في ذلك التحقيق في تأثير التعرض لدخان التبغ دينامية مع ثنائي الاتجاه في التنفس في ظهارة مجرى الهواء الصغيرة البشرية لوضع المؤشرات الحيوية رواية الرئة الضرر23. مواقف محددة بالأغشية مستو وعالية الوضوح البصري للأجهزة التي تجعلها مناسبة فريدة للتحليلات المستندة إلى الصور والتكامل بين أجهزة الاستشعار المضمنة. حفز الميكانيكية التي يوفرها المتكاملة فراغ القنوات والمواد المرنة يوفر وظائف غير ممكن في نظم ترانسويل. وقد أثبتنا أن السلالة الميكانيكية ضروري لخلاصة في فيفو الفسيولوجية وظائف معينة، بما في ذلك استيعاب نانوحبيبات في الرئة4وذمة الرئة3 والتفريق بين ناضجة 8من بودوسيتيس الكبيبي المستمدة من البرامج المتكاملة.
التطبيقات المستقبلية لهذا البروتوكول قد تشمل إدماج مختلف طرائق الاستشعار التي يمكن استخدامها لتوفير قراءات في الوقت الحقيقي "الجهاز رقاقة" الاستجابة للمحفزات مثل المخدرات أو السموم أو الإشعاع. ويمكن تمديد البروتوكول المعروضة هنا لمواد غير PDMS مع الخصائص البصرية والميكانيكية والكيميائية المختلفة، بما في ذلك المواد القابلة للتحلل الحيوي. بروتوكول "الجهاز رقاقة" المعروضة هنا ينبغي أن تمكن الباحثين من اختﻻق الأجهزة التي توفر درجة عالية من التحكم المكروية أنسجة صحية وباثوفيسيولوجيك والأجهزة، التي يمكن أن تكون الاستدانة للتنمية العلاجية، بما في ذلك تستهدف اكتشاف وسمية والتقييمات الحرائك الدوائية، وكذلك فيما يتعلق بالطب الشخصي.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. هو مؤسس ويحمل الإنصاف في محاكاتها، وشركة، ويرأس المجلس الاستشاري العلمي. جيه بي وحاليا موظف في محاكاتها، وشركة المعنية، أ، ج ب، وهي D.E.I. المخترعين في مجال الملكية الفكرية التي قد تم ترخيصها لمحاكاتها، وشركة
Acknowledgments
ونحن نشكر روسو م. و. س. كرول للحصول على التعليمات مع التصوير الفوتوغرافي بالفيديو وانجرام م. J. نغوين، شي د وون أ. مساهمات لتطوير بروتوكول التصنيع الأولية. هذا البحث كان تحت رعاية المعهد ويس "بيولوجيا الهم الهندسة" في جامعة هارفارد، ووكالة مشاريع البحوث المتقدمة الدفاع ضمن "الاتفاقات التعاونية" #W911NF-12-2-0036 ورقم W911NF-16-ج-0050، ومنح إدارة الأغذية والعقاقير # HHSF223201310079C، والمعاهد الوطنية للصحة يمنح #R01-EB020004 ورقم UG3-HL141797-01، وبيل وميليندا غيتس يمنح #OPP1163237 و #OPP1173198 DEI. الآراء والاستنتاجات الواردة في هذه الوثيقة هي آراء المؤلفين، ويجب أن لا تفسر على أنها تمثل السياسات الرسمية، سواء كانت صريحة أو ضمنية، وكالة مشاريع البحوث المتقدمة الدفاع والغذاء و "الدواء"، المعاهد الوطنية للصحة، أو الحكومة الأمريكية.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
الهندسة الحيوية، العدد 140، الجهاز على شريحة، ونظام ميكروفيسيولوجيكال، موائع جزيئية، ميكروفابريكيشن، PDMS، الأغشية المسامية، microchannel، سلالة دوري، ونضحErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
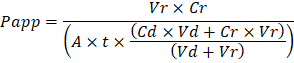
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
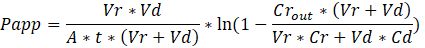
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



