ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Vi præsenterer her, en protokol, der beskriver fabrikation af elastisk, dual channel, orgel chip mikrofluid celle kultur enheder for recapitulating orgel-niveau funktionalitet in vitro.
Abstract
Et betydeligt antal af blyforbindelser mislykkes i den farmaceutiske pipeline, fordi dyreforsøg undlader ofte at forudsige klinisk respons i menneskelige patienter. Menneskelige orgel-on-a-Chip (orgel Chip) mikrofluid celle kultur enheder, som giver en eksperimentel in vitro- platform for at vurdere effekten, toksicitet og farmakokinetiske (PK) profiler hos mennesker, kan være bedre prædiktorer for terapeutiske virkning og sikkerhed i klinikken i forhold til dyreforsøg. Disse enheder kan bruges til at modellere funktion af stort set enhver type, orgel og fluidically kan forbindes via fælles endotel-foret microchannels til at udføre in vitro- undersøgelser på menneskelige orgel- og hele kroppen-niveau fysiologi uden at skulle udføre eksperimenter på mennesker. Disse orgel Chips består af to perfunderet mikrofluid kanaler adskilt af en gennemtrængelig elastomere membran med orgel-specifikke parenkymalt celler på den ene side og mikrovaskulære endotelet på den anden side, som kan strækkes cyklisk at give orgel-specifikke mekaniske stikord (fx vejrtrækning bevægelser i lunge). Denne protokol detaljer fabrikation af fleksible, dual channel, orgel Chips gennem støbning af dele ved hjælp af 3D trykte forme, muliggør kombination af flere støbning og efterbehandling skridt. Porøse poly (dimethyl siloxan) (PDMS) membraner er støbt med mikrometer størrelse gennem huller ved hjælp af silicium søjle arrays under komprimering. Fabrikation og montering af orgel Chips omfatter udstyr og trin, der kan gennemføres uden for en traditionel renrum. Denne protokol giver forskere med adgang til orgel Chip teknologi til in vitro- orgel - og krop-niveau undersøgelser i drug discovery, sikkerhed og effektivitetsforsøgene samt Mekanistiske undersøgelser af grundlæggende biologiske processer.
Introduction
Her beskriver vi fabrikation af dual channel, vaskulariserede orgel-on-a-Chip (orgel Chip) mikrofluid kultur enheder ved hjælp af en skalerbar protokol modtagelig for brug af forskningsgrupper mangler adgang til renrum og traditionelle blødt litografi værktøjer. Disse enheder er udviklet til at sammenfatte menneskelige orgel-niveau funktioner for forståelse normal samt sygdom fysiologi og medicin svar in vitro-1,2. Kritisk til ingeniør denne funktionalitet er to perfunderet mikrofluid kanaler adskilt af en semipermeabel membran (figur 1). Dette design giver mulighed for genskabelse af væv-væv grænseflader mellem mindst to typer af væv, typisk orgel parenkymalt celler på den ene side af den porøse membran og vaskulære endotel på den anden, samt deres eksponering for flydende flow. Hertil kommer, fordi elastomere polymeren, poly (dimethyl siloxan) (PDMS), der bruges til at fabrikere orgel Chip kroppen og membran komponenter, cyklisk mekanisk belastning kan anvendes på hele manipuleret væv-væv interface via elastiske membran til at efterligne den naturlige fysiske mikromiljø af levende organer, såsom vejrtrækning bevægelser i lungen og peristaltikken i tarmen.

Figur 1: orgel Chip tværsnit. Orgel Chips består af to kanaler adskilt af en porøs, elastisk membran, der kan være seedet med celler på begge sider. Top channel tværsnit er 1 mm bred x 1 mm høj, nederste kanal tværs sektioner er 1 mm bred x 0,2 mm høj og vakuum kanaler i både og nederste dele er 0,3 mm bred, 0,5 mm høj, og fordelte 0.3 mm fra fluidic kanaler. Venligst klik her for at se en større version af dette tal.
Disse elastisk, dual channel, orgel Chips har været brugt til demonstrerer virkningen af vejrtrækning motion på nanopartikel absorption i lunge og narkotika-induceret lungeødem3,4; virkningerne af peristaltiske bevægelser på differentiering5 og bakteriel overvækst i tarmen5,6,7; og indflydelse af cykliske deformationer på grund af pulsering i hjertet på differentiering og modning af glomerulær podocytes i nyre8. Desuden, disse to-lumen-enheder, der indeholder en endotel-foret vaskulære kanal adskilt af en ekstracellulære matrix (ECM)-coated membran fra parenkymalt celler i en separat tilgængelige kanal er velegnet til karakterisering af lægemiddel PK parametre og nye mål discovery, som har været begrænset i enkelt perfusion kanal systemer. Desuden flere orgel Chips kan kobles sammen via deres vaskulære kanaler til effektivt skabe en menneskelig krop-på-chips, som kunne tilbyde en attraktiv menneskelige in vitro- platform for therapeutics udvikling9, 10. I modsætning til de fleste mikro-fysiologiske systemer (MPS)11,12,13indeholder orgel Chips to mikrofluid kanaler adskilt af en porøse membran, der letter kar-parenkymalt interaktioner til sammenfatte i vivo organfunktion. Dette ikke kun forenkler sammenkobling af forskellige organer sammen af perfusing en fælles medium gennem de vaskulære kanaler, men opdelingen i væv og væsker efterligner i vivo funktioner og understøtter farmakokinetiske forsøg og modellering og i in vitro-i vivo ekstrapolering9,10 , der er vanskeligt eller umuligt i én kanal MPS14,15,16. Populariteten af PDMS i mikrofluid enheder har ført til udvikling af redskaber til at overvinde materialets iboende evne til at absorbere små molekyler10,17. Men det store antal chips skal støtte biologiske undersøgelser hvor brugen af mikrobielle agenser og PDMS-absorberende forbindelser gøre genbrug af orgel Chips vanskeligt nødvendiggør en skalerbar fremstillingsprocessen selv for små forskergrupper. Protokollen beskrevet her præsenterer en metode for enheden fabrikation egnet til brug i akademiske laboratorier, herunder dem, der mangler adgang til renrum og bløde litografi. Denne protokol har til formål at udvide adgangen til orgel Chips af en lang række forskere søger at bruge de elastisk, dual-channel enheder for at udforske grundlæggende biologiske processer samt translationel terapeutisk udvikling.
Bedste løftestangsvirkningen fra micromanufacturing felter kombineret med design for manufacturing, blev en robust tilgang udviklet for at fabrikere orgel Chip enheder i store mængder med høj reproducerbarhed og udbytte. Fabrikation protokollen beskrevet her giver en skalerbar metode for orgel Chip produktion. Vi beskriver brugen af en valgfri skimmel-in-Place Jig (MiP; designdetaljer i Supplerende materialer) kombineret med polyurethan pakning strips til at aktivere optrapning af casting PDMS komponenter. Den blanke side af polyurethan strimler producere optisk glat PDMS dele, mens den ru side letter demolding. Vi beskriver også brug af en valgfri automatiserede membran fabrikator (AMF) der giver ensartet komprimering af membran wafer skimmelsvampe under hærdning for opdigte op til 24 membraner pr. parti. Designet er generelt gældende for undersøgelser af organer, der er sammensat af væv, der oplever mekanisk belastning og perfusion, og disse chips kan produceres med lave chip til chip variabilitet i mængder, der kræves til at opfylde behovene i små og store forskningsgrupper ens. Arbejdsprocessen er indstillet til en batch eller samlebånd format, og vanskeligt kan forenes med kvalitet vurdering protokoller til styring af produktionsprocesser, personaleuddannelse og lydhør fejlfinding. Vi håber, at denne protokol vil udvide adgangen til mulighederne i dual channel, elastisk, orgel Chips for grundlæggende og Translationel forskning.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. generelle forberedelse
- For at undgå snavs, rense arbejdsområde ved hjælp af emballage tape og tørre ned området med renrum tørre og isopropylalkohol.
- For alle trin der kræver PDMS, bland PDMS i forholdet 10:1 (10 g af tværs forbinder agent, 100 g af elastomer base). Bland i hånden eller med en kommercielt tilgængelig mixer. Brug en planetarisk centrifugal mixer her: blande i 2 minutter ved 2000 rpm, så afgasning til PDMS i 2 minutter ved 2200 rpm.
- Ren alle forme med air pistol til at blæse ud snavs før anvendelsen.
Forsigtighed: Brug ikke metal pincet til at fjerne snavs, da det vil beskadige overfladen af formene.
2. top Channel forberedelse
- Tør ned den blanke side af hvert polyurethan stykke med ethanol og renrummet klude. Kontroller, at alle resterende ethanol er tørret fra polyurethan overflade.
- Placer den blanke side af polyurethan over den åbne side af MiP formen til at oprette et segl på den åbne side af mug, forlader kun en vel-lignende åbning i toppen af formen for hælde PDMS.
Bemærk: Kontroller at alle mold er omfattet sikkert af polyurethan stykke eller PDMS vil lække fra forme under hælde. - Placer mug og polyurethan forsamlingerne til en mindsteimportpris jig, med den ru side mod slutningen af MiP jig. Fortsætte med at gøre dette, indtil alle forme er blevet placeret på jig.
- Stramme MiP jig ved at dreje håndtaget ved hjælp af en skruenøgle, indtil jig afstanden er 25 mm i bredden.
- Gøre en båd af aluminiumsfolie omkring MiP jig for at forhindre, at overskydende PDMS utæt på overflader.
- Hæld PDMS i hver af formene godt indtil fuld.
Bemærk: Hver chip top komponent kræver ca. 3 mL PDMS. - Når det hele jig er fyldt, placere jig i vacuum-ekssikkator. Trække vakuum på-80 kPa for 1 h til degas PDMS.
- Efter 1 time, fjerne MiP jig fra ekssikkatoren og sted i 60 ° C ovn for mindst 4 h at helbrede PDMS.
- Adskille MiP jig ved hjælp af en skruenøgle, løsne jig ved at dreje håndtaget mod uret. Når forme er fri for komprimering, skal du fjerne forme fra jig.
- Fjern polyurethan strips fra hver mug og kassér.
- Omhyggeligt de forme PDMS dele fra deres forme og lægge dem funktion-side op.
- Line up klinge af flise skraber på udgangen tab hak og skære væk hver ende til singulate top-komponenter.
- Kontroller dele for nogen af de følgende svigt og kassér eventuelle utilfredsstillende dele: ridser i den vigtigste kanal, store snavs over området kanal, store bobler, deforme vakuum kanaler.
- Gemme færdige dele i firkantede petriskåle inden for pres positive kabinetter ved stuetemperatur.
3. nederste kanal forberedelse
- Hæld ca. 10,5 g PDMS i formene, indtil PDMS når toppen af hulrummet.
- Undersøg bunden kanal støbeform til PDMS helbredt til bunden af mug.
- Hvis snavset, skrabe gammel PDMS fra bunden af formen, da en ujævn overflade på bunden af formen kan forårsage ujævn tykkelsen af de endelige dele.
Bemærk: For små < 2 cm2 områder der er afdækket, den luft gevær kan bruges meget forsigtigt at flytte PDMS over rummet.
- Placere forme i vakuum ekssikkator til 1 h.
- Efter 1 time, flytte formene ind en level 60 ° C ovnen for > 4 h.
- Der mug på bordet i laminar flow hætte. Løsne PDMS fra kanten af formen.
- Greb et hjørne og forsigtigt skrælle PDMS fra mold overfladen.
- Når fuldt fjernet, lå på bordpladen, så at kanal funktioner er ansigt op.
- Skære dele langs udvendige kanter med flise kuttere, placere flise skærebladet i indskåret PDMS som i trin 2.12.
- Lægge dele funktion side på tape for at fjerne eventuelle rester.
- Fjerne en del fra emballeringsforskrifter tape. Træk den løse ende af del på tværs af diaset. Den løse ende vil laminat med glasset.
Bemærk: Det er afgørende for at undgå at strække del mens fastsættelse. Hvis boblen er fanget mellem del og glas, forsigtigt løfte del med pincet og igen lå. - Udføre kvalitetskontrol inspektion af dele. Kontroller dele for eventuelle fejltilstande og kassér eventuelle utilfredsstillende dele, herunder dem, der indeholder ridser i den vigtigste kanal, store snavs, store bobler eller deforme vakuum kanaler.
- Dække funktioner med tape.
- Gemme dele i et positivt pres kabinet ved stuetemperatur.
4. PDMS membran forberedelse
- Check at vafler er fri for PDMS på bagsiden.
- Placer hver membran wafer i de udpegede slots i AMF bakker.
- Brug 1 mL sprøjten til at placere 0,09 mL PDMS på midten af hver membran wafer post array. Lad PDMS sidde i mindst 5 min. at tillade PDMS at sprede sig i hele indlæg af membran wafer.
Bemærk: Fortsæt ikke til næste trin, indtil mindst 75% af matrixen indlæg er dækket i PDMS. Kvaliteten af membraner forbedrer, jo længere PDMS er tilladt at væge i post region så længere ventetider i dette trin er at foretrække. - Plasma behandle polycarbonat strip på 20 W for 45 s, O2 gas på 0,80 mbar i en plasma maskine.
- Fjern polycarbonat ark fra plasma maskinen og bruge saks til at skære polycarbonat plader i 45 mm x 45 mm firkanter.
Bemærk: Minimere kontakt med plasma behandlede overflade for at forhindre støv klistrer til polycarbonat. - Forsigtigt lægge plasma behandlet side af polycarbonat firkanter på den flydende PDMS centreret om membran wafer. Sikre at polycarbonat og PDMS kontakt.
Bemærk: Undgå luftlommer mellem polycarbonat og PDMS. - Placer den pre-cut PDMS spacer på midten af pladsen polycarbonat.
- Placer pre-cut tekstureret polycarbonat ark på PDMS blok til at holde samling fra limning til komprimering pladen.
- Sæt bakken, således at bakke 3 er i ryggen, bakke 2 er i midten og skuffe 1 er i front. Bakke 1 har et hak for justering.
- Åbne output pres ventil og meget langsomt åbne input pres ventil. Luk kun derefter output pres ventil.
Bemærk: Dette er således at output 4 kg magtanvendelse gradvist anvendes til hver membran wafer i stedet for straks, som kan bryde vafler. - Flip AMF-kontakten til ON for at begynde hærdende cyklussen. Helbrede wafer under 4 kg (16 kPa) kompression og en ramping temperatur cyklus opført i tabel 1.
| Trin | Temperaturen (° C) | Varighed (min) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Hold |
Tabel 1 - membran hærdning betingelser
- Lukke input trykventilen og åbne output pres ventil til at frigive trykket fra luft cylindre.
- Fjerne skufferne og bringe dem til laminar flow hætte.
- Omhyggeligt skrælle den teksturerede polycarbonat og fjern forsigtigt PDMS spacer.
Bemærk: Watch PDMS spacer for at sikre, at det ikke også skrælle polycarbonat luftfartsselskab, hvis dette sker start peeling fra et andet hjørne.- Inspicere PDMS membranen gennem polycarbonat transportør for områder med gennem huller og brug en markør til at spore omridset af området gennem hullet og markere eventuelle huller eller fejl i membraner.
- Bruger wafer håndtering pincet, løsne vafler fra bakken.
- Fjern hver membran fra wafer og placere i petriskålen.
Bemærk: PDMS membran vil fjerne skimmel fra membran wafer og vil blive overholdt polycarbonat opbakning. Hvis PDMS begynder at løsrive fra polycarbonat carrier, skræl fra en anden region. - Gemme membraner og vafler i petriskåle i et positivt pres kabinet ved stuetemperatur.
5. top forsamling og forberedelse
- Ved hjælp af mat tape, rense PDMS membraner samt indersiden af petriskål til at fjerne snavs.
- Grundigt tape funktion side af hver top komponent til at fjerne snavs.
- Læg øverste kanal del ("top") funktion side op i petriskål med PDMS membran.
Bemærk: Vær opmærksom på at nogle membraner kan bruges til én eller to øverste dele afhængigt af størrelsen af den nytteareal. De vigtigste kanaler for hver øverste del skal passe inden for det markerede område af membranen. - Læg Petriskålene i plasma maskine.
- Plasma behandle membran og top på 20 W for 45 s, O2 gas på 0,80 mbar.
- Når limning cyklusser er færdig, Fjern opvasken og fastsætte de aktiverede dele funktion side oven på membranen og sikre del er fuldt lamineret med membran med ingen bobler.
- Placere dele til 60 ° C ovn i mindst 2 timer at anneal.
- Ved hjælp af en skalpel, spor langs omkredsen af agglomererede toppen at adskille top-membran forsamling fra polycarbonat luftfartsselskab.
Bemærk: Ikke skære Flyselskabet. - Når del er spores, skræl forsamling fra polycarbonat. PDMS membran, der er bundet til toppen bør skræl fra Flyselskabet.
- Bruger skarpe tippes pincet, fjerne membranen fra de havne, der har adgang til den nederste kanal, og fjerne snavs eller støv med pincet under en Stereoskopet.
Bemærk: Lad ikke nogen del af den membran, der dækker adgangsport.
6. chip montage
- Funktionen side op, plasma godbid forsamlinger med sålens komponenter ved hjælp af betingelserne i trin 5.5.
- Under en inverteret mikroskop, justere den øverste forsamling med objektglas til bunden halvt.
- Sted i 60 ºC ovn i mindst 2 timer.
- Chip kvalitetskontrol inspektion
Bemærk: Betaler meget opmærksom på de vigtigste porte og kanal chip. Check for fejltilstande ved øjet og også under mikroskop.- For at kontrollere, at chippen er bundet fuldt ud, slæbebåd let på hvert hjørne af chip til at kontrollere for delaminating dele.
- Kig på kanal chip hen til indskrive nemlig en rynket eller sagging membran, som vises som et bølget mønster eller en lys afbøjning i kanalen.
- Udføre et mikroskop inspektion til at inspicere for snavs i den vigtigste kanal.
Bemærk: Vragrester i ikke-kritiske områder, såsom vakuum-kanaler er acceptabel. - Med chip stadig på den inverterede mikroskop, inspicere vigtigste kanal og vakuum kanaler for delaminering.
Bemærk: Delaminering i ikke-kritiske områder (fx kanten af chippen) er acceptabel. - Kontroller, at de vigtigste kanaler er justeret til inden for 50-60 µm (1-2 membran porer).
Bemærk: Det er afgørende, at kanalerne ikke overlapper med vakuum kanaler. - Kontroller, at membranen mellem de vigtigste kanaler og indsugnings- og udstødningsporte kanaler er intakt uden nogen synlige huller.
Bemærk: Enhver hul i membranen kan føre til en utæt chip eller cellevækst uden for kanalerne.
- Butik chips i petriskåle i et positivt pres kabinet ved stuetemperatur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Protokollen præsenteres her beskriver den skalerbare fabrikation af PDMS orgel Chips. Disse enheder aktiverer kultur af to særskilte perfunderet vævstyper på en elastisk porøse membran (figur 1). PDMS kanaler er støbt bruger 3D trykte forme, som accelererer prototyper af nye designs (figur 2A og 2B). Øverste kanaler er støbt i forme under kompression mod en kompatibel polyurethan pakning til at producere komponenter med støbte porte (figur 2 c), mens bunden kanal komponenter er støbt i bakker og håndteres på objektglas opbakning (figur 2D). Denne fabrikation tilgang kombinerer multi-skala mønster af dele i et enkelt trin, hvilket sparer tid, forbedrer reproducerbarhed og sporbarhed og reducerer debris genereret af port stansning og flere skæring trin. De porøse membraner er kritisk for funktionen af orgel-Chip, og fabrikation tilgang baseret på casting mod mønstrede silicium wafers resultater i membraner af ensartet tykkelse og overfladefinish (figur 3). Håndtering via polycarbonat luftfartsselskaber giver mulighed for større serieproduktion og opbevaring.
De forsamlede orgel Chip (figur 4) består af to perfusion kanaler i en optisk gennemsigtige pakke. I regionen overlappende muliggør en porøs PDMS membran væv-væv interaktion af metabolitter, proteiner, therapeutics, patogener og celler til at sammenfatte chip organfunktion, mens to parallelle kanaler på enten side bruges til at give mekanisk stamme ved hjælp af cykliske vakuum aktivering. Porøsitet af PDMS membran biomimetically understøtter flux af metabolitter, vækstfaktorer og selv celler mellem vaskulatur og orgel parenkym (figur 5). Den tilsyneladende permeabilitet (Papp, cm/s) af membranen blev fedtfrie farvestof koncentration i outlet kanaler med og uden Caco2 gut celler. Gut chip cellelag giver en betydeligt større hindring for permeabilitet. Orgel Chip kan aktiveres ved hjælp af de parallelle vakuum kanaler kvantitativt og reproducerbar anvende cyklisk stamme indlæsning af membranen og derfor de kulturperler væv (figur 6). Denne cykliske stamme kombineret med media perfusion understøtter cellulære differentiering for at bedre efterligne i vivo orgel fysiologi, såsom dannelsen af villi i Gut Chip.

Figur 2 : Kanal fabrikation med 3D trykt forme. Orgel chip dele er støbt mod høj opløsning 3D trykte forme (A og B), som giver mulighed for større design alsidighed og prototyping end traditionelle blødt litografi. Top channel dele (C) er hærdet under komprimering eliminerer behovet for stansning havne i de færdige dele. Hver tredobbelt støbning er singulated med et enkelt snit. Nederste kanal dele (D) er placeret på glas dias til at fremme brugervenlighed og billedbehandling. Skala barer er ca 1 cm i alle billeder. Venligst klik her for at se en større version af dette tal.

Figur 3 : Den porøse PDMS membran er støbt ved hjælp af DRIE mønstrede silicium wafers. (A) gengivelse af 7 µm diameter, 50 µm høje micropillars ætset bruger DRIE i en silicium wafer. B PDMS er hærdet på dette array under 4 kg af kompression (16 kPa) til at oprette en 50 µm tykt membran med en bred vifte af 7 µm diameter, selvom huller fordelt hexagonalt 40 µm apart. Venligst klik her for at se en større version af dette tal.

Figur 4 : Fotografi af en samlet PDMS orgel Chip. Røde farvestof fylder den større apikale kanal anvendes til parenkymalt celler, mens den blå farvestof fremhæver den basale kanal anvendes typisk til vaskulære endotel. Venligst klik her for at se en større version af dette tal.

Figur 5 : Permeabilitet af inert tracer Cascade blå gennem Mikroporøs PDMS membran. Cascade blå maleinhydrazid farvestof i medium blev indlæst i den øverste kanal på den jeton, orgel og perfunderet på 60 µL/h til at måle flux af farvestoffet på tværs af membranen i den nederste kanal indeholdende medium. Tom chips blev sammenlignet med Gut Chips med Caco2-BBe1 celler i den apikale kanal og menneskelige vaskulære endotel celler (HUVEC) i basal kanal kulturperler i 6 dage. Fejllinjer angive standard fejl af middelværdien. Venligst klik her for at se en større version af dette tal.

Figur 6 : Anvendelse af membran stamme ved hjælp af vakuum side kanaler. Plot angiver lineær stamme graduering af membranen i en anvendt vakuum pres. Cyklisk enakset stamme er ensartet anvendelse til regionen kultur orgel chip bruger anvendes vakuum til parallel side kanaler. Stammen, der korrelerer lineært med faldende vakuum pres på ca 1% belastning for alle-10 kPa ændringer i vakuum pres (R2 = 0.992). Fejllinjer angiver standardafvigelsen for middelværdien. Venligst klik her for at se en større version af dette tal.
Supplerende materialer: Venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Fabrikationsproces bygger på høj opløsning 3D trykte forme til mønster PDMS top og bund orgel Chip organ komponenter kombineret med micromolded porøse PDMS membraner. Denne kritiske tilgang blev valgt skulle lette prototyping kombineret med hurtig overgang til skaleret op fabrikation og udskiftning af værktøj. Top komponent forme er designet til mønster havne i præcise steder med definerede lodrette profiler under trinnet støbning. Dette ikke kun undgår arbejdskraft involveret i manuelt stansning adgang til havne, men også reducerer vragrester i arbejdspladsen, giver reproducerbare port justeringen interface mangfoldigheder eller instrumentering, og producerer dele med kontrol over pasform og forsegling af indsat slanger eller stifter til fluidic og pneumatiske forbindelser. Formene er stablet oven på hinanden i en kompression jig, adskilt af kompatible polyurethan ark til at lette gennem hullet støbning af havne. Ved at stable flere dele i en enkelt jig, kan en enkelt bruger kaste store mængder af komponenter komplet med porte i et enkelt trin. Materialevalg og fremstillingsmåden for formene er afgørende for at give nødvendige feature opløsning, lav ruhed og høj grad af fladhed for enhed forsamling og efterfølgende billedbehandlingsprogrammer. Stereolithography kan opfylde disse krav, selv om materialer med høj vibrationsisolering temperaturer (> 80 ° C) og kompatibilitet med PDMS hærdning reducere rækken tilgængelige polymer. Forskellige kommercielt tilgængelige harpiks, herunder glas-fyldt harpiks, opfylder disse kriterier.
Elastisk porøse PDMS membranen er velsagtens den mest unikke og kritisk komponent af et orgel Chip samtidig den mest komplekse til at fabrikere. En dyb reaktive ion ætser (DRIE) proces outsourcet til en kreditor bruges til at microfabricate 50 x 50 mm sekskantede arrays af søjler (7 µm diameter, 40 µm apart, 50 µm tall, C4F8 belagt), der bruges til mønster porer i PDMS membran. Kvaliteten af søjle arrays er afgørende for at opnå robuste membran støbning. Især skal søjler være ætset til snævre tolerancer med glatte lodrette profiler at undgå underskæringer eller overdreven dæksiden ruhed, der kan føre til at forme fiasko. Pleje bør tages til at undgå "græs" nederst i regionen ætset, som kan påvirke membran demolding og celle vedhæftet fil. Membran fabrikation med succes gennem hullet mønster og enheden integration er den fælles mest komplekse del af protokollen. Kritisk, er markedsføring 0,09 mL PDMS hver wafer og giver tilstrækkelig tid til det at sprede afgørende for at undgå ufuldstændige gennem hullet støbning. Korrekt er plasma behandling af polycarbonat opbakning forpligtet til at opnå robuste opbakning af membranen for demolding og limning trin uden rynker eller stretching. Opbakning leverer en robust demolding støbt membran fra den skrøbelige silicium wafer.
Trykstyrke belastningen påføres hver wafer er også afgørende for ensartet gennem hullet fabrikation. Tidligere indsats ved hjælp af vægte forhindret membran produktion og resulterede i dårlig udbytter på grund af uensartet force distribution. For at overvinde produktion flaskehalsen, vi optimeret tidligere udgivne membran fabrikation protokol18 og bygget en automatiseret membran fabrikator (AMF) for at parallelize processen. AMF består af 24 pneumatiske stempler støttet over en programmerbar varmeplade at give kontrolleret trykstyrke kraft i hele en programmeret PDMS hærdning proces. En polycarbonat opbakning filmen er placeret på det uhærdede PDMS og så komprimeret ensartet ved hjælp af pneumatiske stempler af AMF mens opvarmes til at polymerisere PDMS. Kritisk, den gradvise hærdning proces beskrevet i protokollen medfører højere kvalitet membraner end et enkelt skridt til den maksimale temperatur, hvor udtynding mønstre som følge af boble udvikling under hærdning proces blev observeret. Mens valgfri, øger AMF overførselshastighed betydeligt ud over hvad der er muligt ved hjælp af vægte i ovn.
Fejlfinding den resulterende orgel Chips finder sted på to niveauer: under fabrikationsproces og under orgel Chip kultur. Vi har udviklet en visuel metode for kvalitetssikring (QA) gennem hul dannelsen i støbt membraner der høj grad fremskynder produktionsprocessen, mens forbedre kvaliteten og pålideligheden af samlet Organ Chips. Denne QA metode giver mulighed for processen fejlfinding, og vi anbefaler, at holde et referat af processen betingelser at aktivere sporing fabrikation problemer der kan opstå under celle kultur. Under orgel Chip kultur er inert tracer farvestoffer den enkleste metode til måling af barriere funktion for at foretage fejlfinding af fabrikationsproces og celle kultur trin. Lucifer gul er blevet anvendt historisk på grund af sin lille molekylmasse og medfødte fluorescens, men Cascade blå tilbyder lignende ejendomme med et smallere emission spektrum, der er mindre tilbøjelige til at forstyrre downstream assays. Større molekyler, som poly-ethylenglycol (PEG)- eller dextran-konjugeret fluorophores er større og derfor resultere i lavere permeabilitet samlet og lavere følsomhed. Tilsyneladende permeabilitet (Papp, cm/s) af tracer farvestoffer kan bruges til at bestemme barriereegenskaber funktion af organerne eller vævene (figur 4). Følgende ligning kan bruges til at beregne Papp mellem dosering kanal og modtagende kanal og stammer fra ligninger anvendes primært til Transwell undersøgelser19,20 og korrigerer for tracer farvestof tab skyldes absorption i PDMS ved at sammenligne to output strømmene og ikke afhængige af massebalancen antagelser på udstrømningen.

VR er rumfanget i mL af modtager kanal spildevand efter tiden t; Vd er rumfanget i mL af den dosering kanal spildevand efter tiden t; A er området i membranen gennem hullet region i cm2 (0.167 cm2 for denne enhed); t er tid af spildevand samling i sekunder; CR er den målte ændringer i koncentrationen af røbestoffet farvestof i det modtagende kanal spildevand; Cd er den målte koncentration af tracer farvestof i dosering kanal overløbet. Centrale antagelser for denne ligning at være gyldig indeholde: 1) støt tracer farvestof dosering koncentration over tid t, 2) koncentrationen af Cr er små sammenlignet med Cdog 3) permeabilitet af systemet er jævnt fordelt på tværs af regionen kultur. Selvom denne ligning kan bruges til statiske systemer, skal sørges for at kontrollere, at antagelserne holder stik. Elektriske metoder, herunder trans-epitelial elektrisk modstand (TEER) gennemføres almindeligvis i Transwell undersøgelser og for nylig er blevet indarbejdet i PDMS orgel Chips for instant og kontinuerlig barriere funktion målinger samt21 ,22.
Begrænsninger af denne protokol omfatter elasticitet af PDMS samt manuel støbning og forsamling processen, der begrænser produktionen priser. PDMS er en alsidig polymer, der er velegnet til orgel Chips der kræver mekanisk belastning aktivering, men dens elasticitet kan hæmme produktionen. Dele kan være svært at håndtere uden deformation og membraner kræver opbakning film for manipulation. Som et resultat, kan automatisering af orgel Chip produktion begrænses. Støbeprocessen, i modsætning til varme prægning eller injektion molding anvendes til termoplastisk polymerer, er batch-baseret og derfor også begrænser overførselshastighed.
Orgel Chips aktiverer in vitro- undersøgelser af menneskelige orgel - og krop-niveau funktioner i vivo af perfusing en fælles medium gennem de vaskulære kanaler. Af erstatningsgodtgørelse fysiologiske væv-væv grænseflader, flux af molekyler mellem vaskulære og parenkymalt rum, mekanisk cues, og fluidic shear og transport, disse enheder fremme histodifferentiation og er i stand til at recapitulating i vivo-som funktioner af både normale og syge organer. Opdelingen i væv og væsker i to rum efterligner deres i vivo funktioner, og orgel Chip undersøgelser er indstillet til tidsopløst farmakokinetiske forsøg samt modellering og in vitro-i vivo ekstrapolation9,10 , er vanskeligt eller umuligt i én kanal MPS14,15,16. Microchannel strukturer kan udnyttes til andre programmer, herunder undersøge virkningen af dynamiske tobaksrøg eksponering med tovejs vejrtrækning i menneskelige små luftveje epitel at udvikle nye biomarkører for lunge skader23. De definerede positioner af planar membraner og høj optisk klarhed af enhederne gøre dem entydigt velegnet til image-baserede analyser og integration af integrerede sensorer. Den mekaniske stimulation aktiveres med integreret vakuum kanaler og elastomere materialer giver funktionaliteter ikke muligt i Transwell systemer. Vi har demonstreret, at mekanisk belastning er afgørende for sammenfatning af visse i vivo fysiologiske funktioner, der herunder nanopartikel absorption i lunge4, lungeødem3 og differentiering af modne iPS-afledte glomerulær podocytes8.
Fremtidige ansøgninger af denne protokol kan omfatte integration af forskellige sensing modaliteter, der kan bruges til at levere real-time udlæsninger af orgel Chip respons på stimuli som narkotika, toksiner eller stråling. Protokollen præsenteres her kunne udvides til at omfatte ikke-PDMS materialer med forskellige optiske, mekaniske og kemiske egenskaber, herunder biologisk nedbrydelige materialer. Orgel Chip protokollen præsenteres her bør sætte forskerne til at fabrikere enheder, der tilbyder en høj grad af kontrol over mikromiljø af sunde og patofysiologiske væv og organer, som kan udnyttes terapeutisk udvikling, herunder målrette opdagelse, toksicitet og farmakokinetiske vurderinger, såvel som for personlig medicin.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. er en grundlægger og besidder kapitalandele i emulere, Inc., og stole sin videnskabelige rådgivende bestyrelse. J.P. er i øjeblikket ansat i emulere, Inc. R.N., YC, J.P., og D.E.I. er opfindere om intellektuel ejendomsret, der har fået licens til at emulere, Inc.
Acknowledgments
Vi takker M. Rousseau og S. Kroll hjælp til fotografering og Videografi og M. Ingram, J. Nguyen, D. Shea og N. Wen for bidrag til indledende fabrikation protokol udvikling. Denne forskning blev sponsoreret af Wyss Institut for biologisk inspirerede Engineering ved Harvard University og Defense Advanced Research Projects Agency under Cooperative aftaler #W911NF-12-2-0036 og #W911NF-16-C-0050, og FDA yde # HHSF223201310079C, NIH tilskud #R01-EB020004 og #UG3-HL141797-01, og Bill og Melinda Gates Foundation giver #OPP1163237 og #OPP1173198 DEI. De synspunkter og konklusioner er indeholdt i dette dokument er dem af forfatterne og bør ikke fortolkes som repræsenterer den officielle politik, hverken udtrykt eller underforstået, af Defense Advanced Research Projects Agency, Food and Drug Administration, den Nationale kontorer i sundhed, eller den amerikanske regering.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Bioteknologi spørgsmål 140 orgel-on-a-chip microphysiological system mikrofluid microfabrication PDMS porøse membran microchannel cyklisk stamme perfusionErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
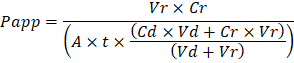
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
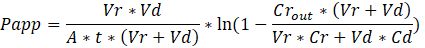
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



