ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Hier presenteren we een protocol dat beschrijft de fabricage van rekbare, dual channel, orgel chip microfluidic cel cultuur apparaten voor Recapitulerend orgel-niveau functionaliteit in vitro.
Abstract
Een aanzienlijk aantal loodverbindingen mislukken in de farmaceutische pijpleiding omdat dierproeven niet vaak te voorspellen klinische reacties in menselijke patiënten. Menselijke orgel-on-a-Chip (orgel Chip) microfluidic cel cultuur apparaten, waarmee een experimentele in vitro -platform voor de beoordeling van de werkzaamheid, toxiciteit en farmacokinetische (PK) profielen bij de mens, kunnen beter voorspellers van therapeutische werking en veiligheid in de kliniek ten opzichte van dierproeven. Deze apparaten kunnen worden gebruikt voor de functie van vrijwel elk orgaan type model en fluidically kunnen worden gekoppeld door middel van gemeenschappelijke endotheel omzoomde microchannels in vitro studies uitvoeren op menselijke fysiologie van de orgel- en hele lichaam-niveau zonder naar uitvoering van experimenten op mensen. Deze fiches orgel bestaat uit twee geperfundeerd microfluidic kanalen gescheiden door een permeabel elastomere membraan met orgel-specifieke parenchymal cellen aan de ene kant en de microvasculaire endotheel anderzijds, die worden cyclisch uitgerekt kan te verstrekken orgel-specifieke mechanische signalen (b.v. ademhaling bewegingen in Long). Dit protocol gegevens de fabricage van flexibele, dual channel, orgel Chips door gieten van delen met behulp van 3D afgedrukt mallen, inschakelen van de combinatie van meerdere gieten en post-processing stappen. Poreuze poly (dimethyl siloxaan) (PDMS) membranen zijn uitgebracht met micrometer formaat via-holes met behulp van silicium pijler arrays onder compressie. Fabricage en assemblage van orgel Chips omvat apparatuur en stappen die kunnen worden uitgevoerd buiten een traditionele cleanroom. Dit protocol biedt onderzoekers toegang tot orgel chiptechnologie voor in vitro orgel - en lichaam-level studies drugontdekking, de veiligheid en de werkzaamheid te testen, alsook mechanistisch onderzoek van fundamentele biologische processen.
Introduction
Hier beschrijven we de fabricage van dual-channel, gevacuoliseerd orgel-on-a-Chip (orgel Chip) microfluidic cultuur apparaten met behulp van een schaalbare protocol vatbaar voor gebruik door onderzoeksgroepen die geen toegang hebben tot cleanrooms en traditionele zachte lithografie hulpmiddelen. Deze apparaten zijn ontwikkeld om te recapituleren menselijke orgel-niveau functies voor begrip normale fysiologie van de ziekte, alsmede drug reacties in vitro1,2. Cruciaal belang voor engineering deze functionaliteit zijn twee geperfundeerd microfluidic kanalen gescheiden door een semi-permeabel membraan (Figuur 1). Dit ontwerp maakt recreatie van weefsel-weefsel interfaces tussen ten minste twee soorten weefsels, gewoonlijk orgel parenchymal cellen aan de ene kant van het poreuze membraan en vasculaire endotheel anderzijds, evenals hun blootstelling aan vloeistofstromen. Bovendien, omdat het elastomere polymeer, poly (dimethyl siloxaan) (PDMS), wordt gebruikt voor het fabriceren van het orgel Chip lichaam en membraan componenten, cyclische mechanische spanning kunnen worden toegepast op de gehele ontworpen weefsel-weefsel interface via de elastische membraan om na te bootsen de natuurlijke fysieke communicatie van levende organen, zoals de ademhaling van de bewegingen in de longen en de peristaltiek in de darm.

Figuur 1: dwarsdoorsnede van de orgel Chip. Orgel Chips bestaan uit twee kanalen, gescheiden door een poreuze, elastisch membraan dat kan worden ontpit met cellen aan beide zijden. Bovenste kanaal kruissecties zijn 1 mm x 1 mm hoog, onderkant breed kanaal Kruis secties zijn 1 mm breed x 0,2 mm hoog en vacuüm kanalen in beide en onderste delen zijn 0.3 mm breed, 0,5 mm hoog, en spaced 0.3 mm van de fluidic kanalen. Klik hier voor een grotere versie van dit cijfer.
Deze rekbare, dual channel, orgel Chips zijn gebruikt voor het aantonen van de invloed van ademhaling van motion op nanoparticle absorptie in de Long- en drug-geïnduceerde longoedeem3,4; effecten van de peristaltische beweging op differentiatie5 en bacteriële overgroei in de darm5,6,7; en invloed van cyclische vervormingen als gevolg van de pulsatie van het hart over differentiatie en rijping van glomerulaire podocytes in de nier8. Bovendien, in het geval van deze twee-lumen-apparaten die een vasculaire endotheel omzoomde-kanaal gescheiden door een extracellulaire matrix (ECM bevatten)-gecoate membraan van parenchymal cellen binnen een afzonderlijk toegankelijk kanaal zijn geschikt voor de karakterisatie van drug PK parameters en nieuwe ontdekking van de doelgroep, die heeft is beperkt in één perfusie channel-systemen. Bovendien meerdere orgel Chips kunnen aan elkaar worden gekoppeld via hun vasculaire kanalen effectief maken een menselijk lichaam-op-chips, die zou kunnen een aantrekkelijke menselijke in vitro -platform voor therapeutiek ontwikkeling9bieden, 10. In tegenstelling tot de meeste micro-fysiologische systemen (MPS)11,12,13bevatten de orgel-Chips twee microfluidic kanalen gescheiden door een poreuze membraan dat vasculaire-parenchymal interacties te vergemakkelijkt in vivo orgaanfunctie recapituleren. Dit vereenvoudigt niet alleen het koppelen van verschillende organen samen zoogdierlevercellen een gemeenschappelijk medium via de vasculaire kanalen, maar de compartimentering van de weefsels en vloeistoffen bootst in vivo functies en ondersteunt farmacokinetische experimenten en modelleren en in vitro-in vivo extrapolatie9,10 , dat is moeilijk of onmogelijk is in één kanaal MPS14,15,16. De populariteit van PDMS in microfluidic apparaten heeft geleid tot de ontwikkeling van instrumenten om te overwinnen de inherente vermogen van het materiaal om het absorberen van kleine molecules10,17. Echter noodzaakt het grote aantal chips vereist ter ondersteuning van biologische studies waar het gebruik van microbiële agentia en PDMS-absorberende stoffen maken hergebruik orgel Chips moeilijk een schaalbare productieproces zelfs voor kleine onderzoeksgroepen. Het protocol beschreven hier presenteert een methode voor het apparaat fabrikatie geschikt voor het gebruik in academische laboratoria, met inbegrip van die geen toegang hebben tot cleanrooms en zachte lithografie. Dit protocol is gericht op het verruimen van de toegang tot orgel Chips door een breed scala aan onderzoekers willen de rekbare, dual channel-apparaten gebruiken voor het verkennen van elementaire biologische processen, alsmede translationeel therapeutische ontwikkeling.
Leveraging best practices van micromanufacturing-velden gekoppeld met ontwerpen voor productie, werd een robuuste aanpak ontwikkeld voor het fabriceren van orgel Chip apparaten in grote hoeveelheden met hoge reproduceerbaarheid en rendement. Het hier beschreven fabricage-protocol biedt een schaalbare methode voor orgel Chip productie. We beschrijven het gebruik van een optionele schimmel-in-Place Jig (MiP; ontwerpdetails in Aanvullende materialen) in combinatie met polyurethaan pakking strips om schaalvergroting van het PDMS onderdelen gieten. De glanzende zijde van polyurethaan strips produceren optisch glad PDMS delen terwijl de gestructureerde kant demolding vergemakkelijkt. Ook beschrijven we het gebruik van een optionele geautomatiseerde membraan Fabricator (AMF) waarmee tijdens het genezen van membraan wafer mallen uniforme gecomprimeerd voor het fabriceren van maximaal 24 membranen per batch. Het ontwerp is breed toepasbare voor studies van organen die zijn samengesteld uit weefsels die ondervinden van mechanische spanning en perfusie, en deze chips kunnen worden geproduceerd met lage chip-op-Spaander variabiliteit in moet voldoen aan de behoeften van kleine en grote hoeveelheden onderzoeksgroepen gelijk. De werkstroom is vatbaar voor een batch- of assemblagelijn indeling en gemakkelijk compatibel is met kwaliteit beoordeling protocollen voor controle van productieprocessen, opleiding van personeel en responsieve probleemoplossing. Wij hopen dat dit protocol toegang uit te tot de mogelijkheden van dual-channel, rekbare, orgel Chips voor fundamenteel en translationeel onderzoek breiden zal.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. algemene voorbereiding
- Om te voorkomen dat vuil, schoon werkgebied met behulp van verpakkingstape en veeg vaststelling van gebied met een cleanroom wipe en isopropyl alcohol.
- Voor alle maatregelen waarvoor PDMS, meng PDMS op een 10:1-verhouding (10 g Kruis koppelen agent, 100 g van elastomeer base). Meng met de hand of met een commercieel beschikbare mixer. Gebruik maken van een planetaire centrifugaal mixer hier: mengen gedurende 2 minuten bij 2000 toeren per minuut, dan de PDMS ontgassing gedurende 2 minuten bij 2200 rpm.
- Schone all mallen met lucht pistool om te blazen uit puin voorafgaand aan gebruik.
Let op: Gebruik geen metalen pincet voor het verwijderen van puin, zoals het aan het oppervlak van de mallen schade zal.
2. top Channel voorbereiding
- Veeg beneden de glanzende zijde van elk polyurethaan stuk met ethanol en cleanroom veegt af. Zorg ervoor dat alle resterende ethanol is gedroogd uit het polyurethaan oppervlak.
- De glanzende zijde van de polyurethaan op de open zijde van de MiP mal voor het maken van een zegel op de open zijde van de schimmel, waardoor alleen een goed lijkende opening aan de bovenkant van de mal voor gieten PDMS plaatst.
Opmerking: Controleer dat elke schimmel is vallende veilig polyurethaan stuk of het PDMS zal lekken van mallen tijdens het gieten. - Plaats de schimmel en polyurethaan vergaderingen in een MiP-mal, met de getextureerde kant tegen het einde van de MiP-mal. Blijven dit doen totdat alle mallen zijn geplaatst in de mal.
- Draai de MiP-mal door te draaien aan het handvat met behulp van een moersleutel totdat de mal afstand 25 mm breed is.
- Een boot van aluminiumfolie rondom de MiP mal om te voorkomen dat overtollige PDMS lekken op oppervlakken maken
- Giet PDMS in elk van de mallen goed tot volledig.
Opmerking: Elke chip top component vereist ongeveer 3 mL PDMS. - Zodra de gehele mal is gevuld, plaats de mal in de exsiccator vacuüm. Trek vacuüm bij-80 kPa voor 1 h tot ontgas PDMS.
- Na 1 h, verwijder de MiP-mal uit de exsiccator en zet in de oven 60 ° C gedurende ten minste 4 uur om te genezen PDMS.
- Demonteren van de mal van de MiP met behulp van een moersleutel, los van de mal door te draaien aan het handvat tegen de klok. Zodra de mallen zijn vrij van compressie, verwijder mallen uit jig.
- Verwijderen van de polyurethaan strips uit elke schimmel en gooi deze weg.
- Zorgvuldig-schimmel PDMS delen van hun mallen en leg ze functie-kant naar boven.
- Het blad van Tegel schraper op einde tabblad inkeping line-up en weggesneden elk uiteinde aan singulate de top componenten.
- Onderdelen gecontroleerd voor een van de volgende modi van de mislukking en negeren onbevredigend delen: krassen in het belangrijkste kanaal, grote puin boven het kanaal gebied, grote bubbels, vervormd vacuüm kanalen.
- Afgewerkte onderdelen in vierkante petrischalen binnen druk positieve kasten bij kamertemperatuur worden opgeslagen.
3. onder kanaal voorbereiding
- Giet ongeveer 10.5 gram PDMS in mallen totdat het PDMS de top van de spouw bereikt.
- Inspecteer de onderkant kanaal mal voor PDMS genezen naar de bodem van schimmel.
- Als vies, schraap oude PDMS vanaf de onderkant van de schimmel, aangezien een oneffen oppervlak op de bodem van de mal leiden ongelijke dikte van de laatste delen tot kan.
Opmerking: voor kleine < 2 cm2 gebieden die onthuld worden, de lucht pistool heel zachtjes kunnen worden gebruikt voor het verplaatsen van PDMS over de ruimte.
- Plaats mallen in vacuüm exsiccator gedurende 1 uur.
- Na 1 h, verplaatsen de mallen in een oven van level 60 ° C voor > 4 h.
- Plaats mal op tafel laminaire flow Hood. Los PDMS van een van de randen van de mal.
- Greep van een hoek en zachtjes schil terug het PDMS van het oppervlak van de schimmel.
- Wanneer volledig verwijderd, leg op werkvlak, zodat kanaal functies gezicht zijn.
- Geknipte onderdelen langs de buitenranden met tegel scharen, plaatsen van Tegel cutter blade in ingekeepte PDMS zoals in stap 2.12.
- Leg delen functie kant omhoog op tape te verwijderen elke puin.
- Deel van de verpakking van de tape verwijderen. Sleep het losse einde van het gedeelte over de dia. Het losse einde zal laminaat met het glas.
Opmerking: Het is van cruciaal belang om te voorkomen dat zich uitstrekt van het deel terwijl het vaststelling van. Als bubble tussen deel en glas opgesloten ligt, zachtjes heffen van het deel met de pincet en opnieuw leggen. - Uitvoeren inspectie van de kwaliteitscontrole van de onderdelen. Onderdelen gecontroleerd voor elke mislukking modi en negeren onbevredigend delen, met inbegrip van degenen die krassen in de belangrijkste kanaal, grote puin, grote bubbels of misvormde vacuüm kanalen bevatten.
- Dekking van functies met tape.
- Onderdelen in een positieve druk kabinet bij kamertemperatuur worden opgeslagen.
4. PDMS membraan voorbereiding
- Controleer of de wafels kosteloos voor PDMS achterop zijn.
- Plaats elk membraan wafer in de aangewezen "slots" in de AMF-vakken.
- Gebruik de 1 mL spuit om 0.09 milliliters PDMS in het midden van elk membraan wafer postserie. Laat PDMS zitten voor een minimum van 5 min om PDMS om verspreid over de posten van de membraan wafer.
Opmerking: Ga niet naar volgende stap verder totdat ten minste 75% van de postserie is bedekt met PDMS. De kwaliteit van membranen verbetert hoe langer de PDMS mag pit in post regio dus langere wachttijden in deze stap hebben de voorkeur. - Plasma behandelen de polycarbonaat strip op 20 W voor 45 s, O2 gas bij 0.80 mbar in een plasma-machine.
- Verwijder het polycarbonaat blad uit de plasma-machine en gebruik van schaar te snijden van de polycarbonaat platen in 45 x 45 mm vierkanten.
Opmerking: Minimaliseer contact met de plasma behandelde oppervlak om te voorkomen dat stof vasthouden aan de polycarbonaat. - Voorzichtig leggen de plasma behandeld kant van de vierkanten polycarbonaat op de vloeibare PDMS gecentreerd op het membraan wafer. Ervoor zorgen dat de polycarbonaat en het PDMS in contact.
Opmerking: Vermijd luchtzakken tussen de polycarbonaat en het PDMS. - Plaats de voorgesneden PDMS spacer op het midden van het plein van polycarbonaat.
- Leg de voorgesneden getextureerde polycarbonaat vel op het PDMS blok te houden van de vergadering van de hechting aan de compressie-plaat.
- Schuif de lade zodat lade 3 in de rug is, lade 2 in het midden is en lade 1 aan de voorkant is. Lade 1 heeft een inkeping voor uitlijning.
- De output druk ventiel open en heel langzaam het invoeren druk ventiel. Alleen sluit de klep van de druk uitgang.
Opmerking: Dit is zodat de output 4 kg van geweld is geleidelijk toegepast op elke membraan wafer in tegenstelling tot het direct, die de wafeltjes breken kan. - Flip de AMF-schakelaar aan om te beginnen de uithardende cyclus. Genezen wafer onder 4 kg (16 kPa) compressie en een ramping temperatuur cyclus vermeld in tabel 1.
| Stap | Temperatuur (° C) | Duur (min) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Houd |
Tabel 1 - membraan genezen voorwaarden
- Sluit de klep van de invoer druk en open het ventiel druk uitgang om los van de druk van de lucht-cilinders.
- Verwijder de schaaltjes en breng ze naar de laminaire flow kap.
- Zorgvuldig afschilferen van de getextureerde polycarbonaat en verwijder voorzichtig het PDMS tussenstuk.
Opmerking: Bekijk de PDMS spacer om ervoor te zorgen dat het doet ook niet schil af de polycarbonaat vervoerder, in dat geval start peeling uit een andere hoek.- Inspecteren van het membraan PDMS door de polycarbonaat drager voor gebieden met via-holes en gebruik een marker op te sporen van de omtrek van het gebied door middel van holes en markeren van eventuele gaten of gebreken in de membranen.
- Met behulp van wafer behandeling pincet, los in bladen, hosties uit de lade.
- Elke membraan uit de wafer verwijderen en plaatsen in een petrischaal.
Opmerking: Het PDMS membraan zal de schimmel uit de wafer membraan en de polycarbonaat back-ups zal worden nageleefd. Als PDMS loskoppelen van de vervoerder van polycarbonaat begint, schil van een andere regio. - Het opslaan van membranen en wafeltjes in petrischalen in een positieve druk kabinet bij kamertemperatuur.
5. top vergadering en voorbereiding
- Met behulp van matte tape, reinig de PDMS membranen, alsook de binnenkant van de petrischaal te verwijderen van puin.
- Grondig tape de kant van de functie van elke bovenste component verwijderen van puin.
- Plaats top kanaal deel ("boven") functie kant naar boven in de petrischaal met PDMS membraan.
Opmerking: Let erop dat sommige membranen voor één of twee bovenste delen afhankelijk van de grootte van het bruikbare gebied kunnen worden gebruikt. De belangrijkste kanalen van elke bovenste gedeelte moeten passen binnen het gemarkeerde gebied van het membraan. - Laad de petrischaaltjes in de plasma-machine.
- Plasma behandelen membraan en top 20 W voor 45 s, O2 gas bij 0.80 mbar.
- Zodra de hechting cycli heeft beëindigd, verwijderen van de gerechten en vast de geactiveerde delen functie kant bovenop het membraan en zorgen deel is volledig gelamineerd met membraan met geen bubbels.
- Plaats de delen in de oven 60 ° C gedurende ten minste 2 uur te ontharden.
- Met behulp van een scalpel, trace rond de omtrek van de gekleefde top om te scheiden van de top-membraan vergadering van de vervoersmaatschappij voor polycarbonaat.
Opmerking: Dus knip de vervoerder niet af. - Zodra het deel is getraceerd, schil de vergadering van de polycarbonaat. Het PDMS membraan dat is gebonden aan de top moet schil van de vervoerder.
- Met behulp van scherpe omver te werpen pincet, het membraan van de poorten die toegang het onderste kanaal tot verwijderen en Verwijder vuil of stof met een tang onder een stereoscoop.
Opmerking: Laat niet enig deel van het membraan die betrekking hebben op de toegangspoort.
6. chip assemblage
- Functie kant naar boven, plasma traktatie samenstellingen met onderdelen van de bodem met behulp van de voorwaarden in stap 5.5.
- Onder een omgekeerde Microscoop, half de bovenste vergadering met microscoopglaasje naar de bodem uitlijnen
- Plaats in de oven 60 ° C gedurende ten minste 2 uur.
- Chip kwaliteitscontrole inspectie
Opmerking: Nauwe aandacht besteden aan de mainports en kanaal van chip. Controleren op mislukte modi door oog en ook onder de Microscoop.- Om te controleren dat de chip volledig is gebonden, sleepboot licht op elke hoek van de chip te controleren voor delaminating onderdelen.
- Kijk naar het kanaal van de chip te controleren voor een gerimpeld of slappe membraan, dat als een golvend patroon of een lichte vervorming in het kanaal verschijnt.
- Het uitvoeren van een inspectie van de Microscoop te inspecteren voor puin in het belangrijkste kanaal.
Opmerking: Puin in niet-kritieke gebieden, zoals de vacuüm kanalen is aanvaardbaar. - Inspecteer de belangrijkste kanaal en vacuüm kanalen voor delaminatie met de chip nog steeds op de omgekeerde Microscoop.
Opmerking: Delaminatie in niet-kritische gebieden (bijvoorbeeld de rand van de chip) is aanvaardbaar. - Controleer of de belangrijkste kanalen, worden uitgelijnd naar binnen 50-60 µm (1-2 membraan poriën).
Opmerking: Het is cruciaal dat de kanalen niet met vacuüm kanalen overlappen. - Controleer of het membraan tussen de belangrijkste kanalen en de inlaat en uitlaat kanalen intact zonder enige schijnbare gaten is.
Opmerking: Een gat in het membraan kan leiden tot een lekkende chip of de celgroei buiten de kanalen.
- Winkel fiches in petrischalen in een positieve druk kabinet bij kamertemperatuur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Het hier gepresenteerde protocol beschrijft de schaalbare fabricage van PDMS orgel Chips. Deze apparaten inschakelen cultuur van twee verschillende geperfundeerd weefseltypes (HLA) op een elastische poreuze membraan (Figuur 1). De PDMS kanalen worden gegoten met behulp van 3D gedrukte mallen, die versnelt prototyping van nieuwe ontwerpen (figuur 2A en 2B). Top kanalen zijn gegoten in mallen onder compressie tegen een compatibele polyurethaan pakking voor de productie van componenten met gegoten poorten (figuur 2C), terwijl onder kanaal componenten zijn gegoten in schaaltjes en behandeld op microscoopglaasje back (figuur 2D). Deze fabricage aanpak combineert Multi-Scale patronen van de onderdelen in een enkele stap, die bespaart u tijd, verbetert de reproduceerbaarheid en traceerbaarheid, en vermindert afval gegenereerd door poort ponsen en meerdere snijden stappen. De poreuze membranen zijn cruciaal voor de functie van de orgel-Chip, en de fabricage benadering gebaseerd op gieten tegen gedessineerde silicium wafers resultaten in membranen van consistente dikte en oppervlak (Figuur 3). Afhandeling via polycarbonaat vervoerders zorgt voor grotere batch productie en opslag.
De geassembleerde orgel Chip (Figuur 4) bestaat uit twee perfusie kanalen in een optisch transparante pakket. In het overlappende gebied kan een poreuze PDMS membraan weefsel-weefsel interactie van metabolieten, eiwitten, therapeutiek, pathogenen en cellen te recapituleren chip orgaanfunctie terwijl twee parallelle kanalen aan beide zijden worden gebruikt voor mechanische stam met behulp van cyclische vacuüm bediening. De poreusheid van de PDMS membraan-biomimetically ondersteunt de flux van metabolieten, groeifactoren en zelfs cellen tussen de therapieën en orgel parenchym (Figuur 5). De schijnbare permeabiliteit (Papp, cm/s) van de membraan werd bepaald met behulp van de concentratie van de kleurstof in de outlet-kanalen met en zonder Caco2 gut cellen. De darm chip cel lagen bieden een aanzienlijk grotere belemmering voor permeabiliteit. Het orgel-Chip kan worden bediend met behulp van de parallelle vacuüm kanalen kwantitatief en reproducibly toepassen cyclische stam laden op het membraan en derhalve de gekweekte weefsels (Figuur 6). Deze cyclische stam gecombineerd met media perfusie ondersteunt celdifferentiatie om beter na te bootsen in vivo orgaanfysiologie, zoals vorming van villi in de Gut-Chip.

Figuur 2 : Kanaal fabricage met 3D afgedrukt mallen. Orgel chip delen worden geworpen tegen hoge resolutie 3D gedrukte mallen (A en B), die zorgt voor een grotere veelzijdigheid van ontwerp en prototyping dan traditionele zachte lithografie. Bovenste kanaal delen (C) worden genezen onder compressie elimineren de noodzaak voor het ponsen van havens in de afgewerkte onderdelen. Elke drievoudige gieten is singulated met een enkele snede. Onder kanaal delen (D) worden geplaatst op glas dia's om gebruiksgemak en beeldvorming. Schaal bars zijn ongeveer 1 cm in alle beelden. Klik hier voor een grotere versie van dit cijfer.

Figuur 3 : Het poreuze PDMS membraan is gegoten met behulp van DRIE patroon silicium wafers. (A) weergave van de 7 µm diameter, 50 µm lang micropillars geëtst met behulp van DRIE in een silicium wafer. (B) PDMS is genezen op deze array minder dan 4 kg van compressie (16 kPa) als u wilt maken van een 50 µm dik membraan met een scala aan 7 µm diameter al gaten verdeeld hexagonally 40 µm uit elkaar. Klik hier voor een grotere versie van dit cijfer.

Figuur 4 : Foto van een geassembleerd PDMS orgel Chip. Rode kleurstof vult de grotere apicale kanaal dat wordt gebruikt voor parenchymal cellen, terwijl de blauwe kleurstof de basale kanaal dat meestal wordt gebruikt voor vasculaire endotheel hoogtepunten. Klik hier voor een grotere versie van dit cijfer.

Figuur 5 : Permeabiliteit van inerte tracer Cascade blauwe via het microporeuze PDMS membraan. Cascade blauwe hydrazide kleurstof in medium was geladen in het bovenste kanaal van de orgel-Chip en geperfundeerd bij 60 µL/h te meten van de flux van de kleurstof in het membraan in het kanaal van de bodem met medium. Lege chips werden vergeleken met Gut Chips met Caco2-BBe1 cellen in het apicale kanaal en menselijke vasculaire endotheliale cellen (HUVEC) in het basale kanaal gekweekt voor 6 dagen. Foutbalken geven de standaardfout van het gemiddelde. Klik hier voor een grotere versie van dit cijfer.

Figuur 6 : Toepassing van membraan stam met vacuümzijde kanalen. Perceel geeft lineaire stam modulatie van membraan in reactie op een toegepaste vacuüm druk. Cyclische eenassige stam is uniform toegepast op het gebied van de cultuur van de orgel-Chip met behulp van toegepaste vacuüm om parallelle kant kanalen. De stam correleert lineair met afnemende vacuüm druk bij ongeveer 1% belasting voor elke wijziging van de-10 kPa vacuüm druk (R2 = 0.992). Foutbalken geven de standaarddeviatie van het gemiddelde. Klik hier voor een grotere versie van dit cijfer.
Aanvullende materialen: Klik hier voor een grotere versie van dit cijfer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De productie-procédé berust op hoge resolutie 3D gedrukte mallen naar het patroon van de PDMS boven- en onderkant orgel Chip lichaam componenten in combinatie met micromolded poreuze PDMS membranen. Deze kritische benadering werd geselecteerd moeten verlichten van prototyping gecombineerd met de snelle overgang naar schaal van fabricage en vervanging van tooling. De bovenste component mallen zijn bedoeld om patroon havens in exacte locaties met gedefinieerde verticale profielen tijdens het gieten stap. Dit vermijdt niet alleen de arbeid die betrokken zijn bij het handmatig ponsen-poorten maar ook vermindert puin op de werkplek, stelt reproduceerbare poort aanpassing aan interface variëteiten of instrumentatie, en produceert onderdelen met controle over de pasvorm en de afdichting van ingevoegd buizen of pins voor fluidic en pneumatische verbindingen. De mallen worden op elkaar gestapeld in een mal van compressie, gescheiden door compatibele polyurethaan bladen te vergemakkelijken door middel van holes gieten van poorten. Door het stapelen van meerdere onderdelen in een single jig, kan een enkele gebruiker grote hoeveelheden onderdelen compleet met poorten in een enkele stap werpen. Materiaalkeuze en productie methode voor de mallen zijn cruciaal voor het voorzien van de nodige functie resolutie lage oppervlakteruwheid, en hoge mate van vlakheid voor montage van het apparaat en latere weergavetoepassingen. Stereolithografie kan aan deze vereisten voldoet, hoewel de materialen met de afbuiging van de hoge temperaturen (> 80 ° C) en compatibiliteit met de PDMS genezen de beschikbare polymeer bereik verminderen. Verschillende verkrijgbare harsen, met inbegrip van glas gevulde harsen, aan deze criteria voldoen.
De elastische poreuze PDMS membraan is aantoonbaar de meest unieke en kritische component van een orgel-Chip terwijl ze het meest complex te fabriceren. Een deep reactive ion etsen (DRIE) proces uitbesteed aan een leverancier wordt gebruikt om te microfabricate 50 x 50 mm zeskant matrices van pijlers (7 µm diameter 40 µm apart, 50 µm lang, C4F8 gecoat) die worden gebruikt voor het patroon van de poriën in het membraan van het PDMS. De kwaliteit van de pijler matrices is cruciaal voor het bereiken van de robuuste membraan gieten. In het bijzonder moeten pijlers worden geëtst krappe toleranties met gladde verticale profielen om onderstukken of buitensporige zijwand ruwheid die leiden kan tot mislukking schimmel te voorkomen. Zorg moet worden genomen om te voorkomen dat "grassing" aan de onderkant van de geëtste regio, die kan invloed hebben op de membraan demolding en cel bijlage. Membraan fabricage met succesvolle via holes patronen en apparaat integratie is het één van de meest complexe afdeling van het protocol. Kritisch, is 0.09 milliliters PDMS plaatsen op elke wafer en waardoor voldoende tijd voor het te verspreiden essentieel voor het vermijden van onvolledige via holes molding. Goed is plasma behandeling van de polycarbonaat back-ups maken vereist voor het bereiken van de robuuste steun van het membraan voor demolding en verlijmen van stappen zonder kreuken of uitrekken. De steun biedt een robuuste manier van het demolding van het membraan van de cast van de fragiele silicium wafer.
De druksterkte belasting toegepast op elke wafer is ook essentieel voor uniforme via holes fabricage. Eerdere pogingen met behulp van gewichten belemmerd membraan productie en resulteerde in slechte opbrengst als gevolg van de kracht van de niet-uniforme verdeling. Om te overwinnen de bottleneck productie, we de eerder gepubliceerde membraan fabricage protocol18 geoptimaliseerd en een geautomatiseerde membraan Fabricator (AMF) om het proces parallelize gebouwd. De AMF bestaat uit 24 pneumatische zuigers ondersteund via een programmeerbare hete plaat zodat gecontroleerde drukkracht tijdens een geprogrammeerde PDMS genezen proces. Een polycarbonaat back-film wordt geplaatst op de niet-uitgeharde PDMS en vervolgens gelijkmatig gecomprimeerd met behulp van pneumatische zuigers van de AMF terwijl verwarmd te polymeriseren het PDMS. Kritisch, de geleidelijke genezen proces dat is beschreven in het protocol resulteert in hogere kwaliteit membranen dan één stap aan de maximale temperatuur, waar doezelen patronen die voortvloeien uit bubble ontwikkeling tijdens het genezen proces werden waargenomen. Terwijl optioneel, verhoogt de AMF doorvoer aanzienlijk buiten wat is mogelijk met behulp van gewichten in een oven.
Oplossen van problemen met de resulterende orgel Chips vindt plaats op twee niveaus: tijdens het fabricageproces en tijdens orgel Chip cultuur. We hebben een visuele methode voor kwaliteitsborging (QA) ontwikkeld door holes vorming in de cast membranen die sterk het productieproces, versnelt terwijl de verbetering van de kwaliteit en de betrouwbaarheid van geassembleerd orgel Chips. Deze QA-methode kan voor het oplossen van het proces, en we raden u een record van proces voorwaarden om tracking fabricage problemen die tijdens optreden kunnen cel cultuur. Tijdens orgel Chip cultuur zijn inerte tracer kleurstoffen de eenvoudigste methode voor het meten van de barrièrefunctie cel cultuur stappen te lossen van het fabricageproces. Gele Lucifer is gebruikt historisch vanwege de kleine moleculaire massa en aangeboren fluorescentie, maar Cascade Blue biedt vergelijkbare eigenschappen met een smaller emissiespectrum die is minder waarschijnlijk te mengen met stroomafwaartse testen. Grotere moleculen, zoals poly-ethyleenglycol (PEG)- of dextran-geconjugeerde fluorophores zijn groter en dus globaal resulteren in lagere permeabiliteit en lagere gevoeligheid. De schijnbare permeabiliteit (Papp, cm/s) van tracer kleurstoffen kan worden gebruikt om te bepalen van de barrière functieeigenschappen van organen of weefsels (Figuur 4). De volgende vergelijking kan worden gebruikt voor het berekenen van Papp tussen de dosering kanaal en ontvangende kanaal en is afgeleid van vergelijkingen hoofdzakelijk gebruikt voor Transwell studies19,20 en corrigeert voor tracer kleurstof verlies veroorzaakt door absorptie in PDMS door vergelijking van de twee uitgang stromen en niet vertrouwen op massabalans aannames bij de uitstroom.

VR = het volume in milliliters ontvangen kanaal afvalwater na tijd t; Vd = het volume in milliliters het doseren kanaal effluent na tijd t; A is het gebied van membraan via holes regio in cm2 (0.167 cm2 voor dit apparaat); t is de tijd van afvalwater collectie in seconden; CR is de gemeten verandering in de concentratie van de tracer kleurstof in het ontvangende kanaal afvalwater; Cd is de gemeten concentratie van de tracer kleurstof in het effluent kanaal doseren. Belangrijke aannames voor deze vergelijking te gelden omvatten: 1) stabiele tracer kleurstof doseren concentratie op tijdstip t, 2) de concentratie van Cr is klein vergeleken met Cden 3) de permeabiliteit van het systeem wordt gelijkmatig verdeeld over het gebied van cultuur. Hoewel deze vergelijking kan worden gebruikt voor statische systemen, moet worden gezorgd om te controleren dat de veronderstellingen waar houden. Elektrische methoden, met inbegrip van de trans-epitheliale elektrische weerstand (TEER) worden gewoonlijk geïmplementeerd in Transwell studies en onlangs zijn opgenomen in PDMS orgel Chips voor onmiddellijke en voortdurende barrière functie metingen alsmede21 ,22.
Beperkingen van dit protocol zijn de elasticiteit van het PDMS evenals het gieten en vergadering handproces productie tarieven te beperken. PDMS is een veelzijdige polymeer dat is geschikt voor orgel Chips vereisen van de bediening van de mechanische spanning, maar zijn elasticiteit kan productie afremmen. Onderdelen kunnen moeilijk te behandelen zonder vervorming en membranen vereisen back-films voor manipulatie. Dientengevolge, kan automatisering van orgel Chip-productie worden beperkt. De casting proces, in tegenstelling tot hete reliëf of spuitgieten gebruikt voor thermoplastische polymeren, batch gebaseerd is en stelt daarom beperkingen ook doorvoer.
Orgel Chips inschakelen in vitro studies van menselijke orgel - en lichaam-niveau functies in vivo door zoogdierlevercellen een gemeenschappelijk medium via de vasculaire kanalen. Door de krachten van fysiologische weefsel-weefsel interfaces, flux van moleculen tussen de vasculaire en parenchymal compartimenten, mechanische signalen, en fluidic schuintrekken en vervoer, deze apparaten bevorderen van histodifferentiation en kunnen Recapitulerend in vivo-als functies van zowel de normale als de zieke organen. De opdeling van de weefsels en vloeistoffen in twee compartimenten bootst hun functies in vivo , en orgel Chip studies zijn vatbaar voor time-resolved farmacokinetische experimenten en modellering, alsmede van in vitro-in vivo extrapolatie9,10 dat is moeilijk of onmogelijk is in één kanaal MPS14,15,16. De microchannel-structuren kunnen worden benut voor andere toepassingen, waaronder onderzoek naar de impact van dynamische tabaksrook blootstelling met bidirectionele ademhaling in menselijke kleine luchtwegen epitheel aan het ontwikkelen van nieuwe biomarkers voor longkanker schade23. De gedefinieerde posities van de vlakke membranen en hoge optische duidelijkheid van de apparaten maken ze uniek geschikt voor beeld-gebaseerde analyses en integratie van ingesloten sensoren. De mechanische stimulatie ingeschakeld door geïntegreerd vacuüm kanalen en elastomerische materialen biedt functionaliteiten niet mogelijk in Transwell systemen. We hebben aangetoond dat de mechanische spanning essentieel voor de recapitulatie van bepaalde in-vivo fysiologische functies is, met inbegrip van nanoparticle absorptie in de longen4, longoedeem3 en differentiatie van volwassen iPS-afgeleide glomerulaire podocytes8.
Toekomstige toepassingen van dit protocol bevatten integratie van verschillende sensing modaliteiten die kan worden gebruikt om real-time uitlezingen van orgel Chip reactie op prikkels zoals drugs, toxines of straling. Het protocol hier gepresenteerd kan worden uitgebreid tot niet-PDMS materialen met verschillende optische, mechanische en chemische eigenschappen, met inbegrip van biologisch afbreekbare materialen. Het orgel Chip protocol hier gepresenteerd in staat moet stellen onderzoekers te fabriceren van apparaten die een hoge mate van controle over de communicatie van gezonde en uitlokkende weefsels en organen, die kunnen zijn leveraged voor therapeutische ontwikkeling bieden, met inbegrip van target discovery, toxiciteit en farmacokinetische evaluaties, alsook wat betreft de gepersonaliseerde geneeskunde.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. is een van de oprichters en houdt van de "equity" in emuleren, Inc., en stoelen van haar wetenschappelijke adviesraad. J.P. is momenteel een medewerker van emuleren, Inc. R.N., Y.C., J.P., en D.E.I. zijn uitvinders op intellectuele eigendom dat is gelicentieerd te emuleren, Inc.
Acknowledgments
Wij danken M. Rousseau en S. Kroll voor hulp met fotografie en videografie en M. Ingram, J. Nguyen, D. Shea en N. Wen voor bijdrage aan initiële fabricage protocol ontwikkeling. Dit onderzoek werd gesponsord door het Instituut Wyss voor biologisch geïnspireerde Engineering aan de Harvard University en het Defense Advanced Research Projects Agency onder coöperatieve overeenkomsten #W911NF-12-2-0036 en #W911NF-16-C-0050, en FDA verlenen # HHSF223201310079C, NIH verleent #R01-EB020004 en #UG3-HL141797-01 en Bill en Melinda Gates Foundation verleent #OPP1163237 en #OPP1173198 DEI. De standpunten en conclusies in dit document zijn die van de auteurs en moet niet worden geïnterpreteerd als het vertegenwoordigen van het officiële beleid, hetzij expliciet of impliciet, van de Defense Advanced Research Projects Agency, Food en Drug Administration, de National Institutes of Health, of de Amerikaanse regering.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Bioengineering kwestie 140 orgel-on-a-chip microphysiological systeem microfluidic microfabrication PDMS poreuze membraan microchannel cyclische stam perfusieErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
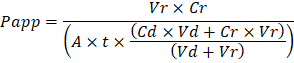
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
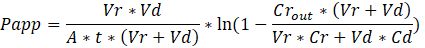
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



