ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Nous présentons ici un protocole qui décrit la fabrication de canal extensible, double, orgue puce cell culture microfluidiques pour récapitulant les organes au niveau fonctionnalité in vitro.
Abstract
Un nombre important de composés de plomb échoue dans le pipeline pharmaceutique parce que les études chez l’animal omettent souvent de prévoir les réactions cliniques chez des patients humains. Humaine orgue-on-a-Chip (puce de l’orgue) cell culture Dispositifs microfluidiques, qui fournissent une plate-forme expérimentale in vitro pour évaluer l’efficacité, la toxicité et profils pharmacocinétiques de (PK) chez les humains, peut-être meilleurs prédicteurs de l’efficacité thérapeutique et sécurité dans la clinique par rapport aux études chez l’animal. Ces dispositifs peuvent être utilisés pour modéliser la fonction de n’importe quel type d’orgue et peuvent être assistés connectés en commun microcanaux bordées d’endothélium pour effectuer des études in vitro sur la physiologie humaine ensemble corps-niveau et orgue sans avoir à réaliser des expériences sur les personnes. Ces puces d’orgue se composent de deux canaux microfluidiques perfusé séparés par une membrane élastomère perméable avec organe-spécifiques des cellules parenchymateuses sur un côté et endothélium microvasculaire sur l’autre, qui peut être étiré de façon cyclique à fournir certains organes mécaniques cues (p. ex., respiration des requêtes dans les poumons). Ce protocole détaille la fabrication de canal flexible double, orgue puces par moulage de pièces en 3D imprimé de moules, de combiner plusieurs casting et étapes de post-traitement. Poly poreux (siloxane diméthylique) membranes (PDMS) sont coulés avec micromètre de taille à travers-trous à l’aide de tableaux de pilier de silicium sous compression. Fabrication et assemblage de puces orgue consiste à équipement et des mesures pouvant être mises en œuvre à l’extérieur de la salle blanche traditionnelle. Le présent protocole aux chercheurs accès à la technologie de la puce de l’orgue pour in vitro études niveau des organes et des corps dans la découverte de médicaments, de sécurité et de tests d’efficacité, ainsi que des études mécanistes de processus biologiques fondamentaux.
Introduction
Nous décrivons ici la fabrication de double canal, vascularisée orgue-on-a-Chip (puce de l’orgue) culture des dispositifs microfluidiques utilisant un protocole évolutif se prêtent à l’usage des groupes de recherche manque d’accès aux salles propres et aux outils de la lithographie douce traditionnelle. Ces appareils ont été développés pour récapituler les fonctions organe humaines pour compréhension normale et physiologie de la maladie, comme drogue responses in vitro1,2. Critique de génie cette fonctionnalité sont deux canaux microfluidiques perfusé, séparés par une membrane semi-perméable (Figure 1). Cette conception permet aux loisirs des interfaces un tissu entre au moins deux types de tissus, typiquement les cellules parenchymateuses orgue sur un côté de la membrane poreuse et l’endothélium vasculaire, d’autre part, ainsi que leur exposition à l’écoulement du fluide. En outre, parce que le polymère élastomère, poly (siloxane diméthylique) (PDMS), sont utilisées pour fabriquer le corps de la puce de l’orgue et constituants membranaires, des sollicitations mécaniques cycliques peuvent être appliqués à l’ensemble d’ingénierie-un tissu d’interface via l’élastique membrane pour imiter le microenvironnement physique naturel de la vie, tels que respiration des requêtes dans le poumon et le péristaltisme de l’intestin.

Figure 1 : orgue puce cross section. Orgue Chips sont constitués de deux chaînes, séparées par une membrane poreuse et élastique qui peut être ensemencée avec des cellules des deux côtés. Canal du haut sont des sections droites 1 mm de large x 1 mm en bas hauteur, canal cross sections sont de 1 mm de large x canaux 0,2 mm de haut et sous vide dans les deux et les parties inférieures sont de 0,3 mm de large, 0,5 mm de hauteur et espacés de 0,3 mm à partir des canaux fluidiques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Ces extensible, double canal, orgue Chips ont été utilisés pour démontrer l’impact de la respiration motion sur l’absorption des nanoparticules dans le poumon et l’oedème pulmonaire induite par le médicament3,4; effets de mouvement péristaltique sur5 de la différenciation et la prolifération bactérienne dans l’intestin5,6,7; et l’influence des déformations cycliques en raison de la pulsation du cœur sur la différenciation et la maturation des podocytes glomérulaire du rein8. En outre, ces dispositifs de deux-lumen qui contiennent un canal vasculaire endothélium bordé, séparé par une matrice extracellulaire (ECM)-membrane enduite de cellules parenchymateuses dans un canal accessible séparément sont bien adaptés pour la caractérisation des drogues PK paramètres et nouvelle découverte de cible, qui a été limitée en perfusion unique canal systèmes. En outre, plusieurs organes Chips peuvent être reliés entre eux via leurs canaux vasculaires de créer efficacement un humain corps-on-Chip, qui pourrait offrir une plate-forme attractive humaine in vitro pour thérapeutique développement9, 10. Contrairement aux systèmes (MPS) plus micro-physiologiques11,12,13, les puces d’orgue contiennent deux canaux microfluidiques, séparés par une membrane poreuse qui facilite les interactions vasculaire parenchymateux à récapituler dans vivo fonction des organes. Cela simplifie non seulement lier ensemble différents organes en perfusant un moyen commun à travers les canaux vasculaires, mais le cloisonnement des tissus et les fluides imite en vivo fonctions et prend en charge l’expérimentation pharmacocinétique et la modélisation ainsi que in vitro-in vivo extrapolation9,10 qui est difficile, voire impossible à canal unique MPS14,15,16. La popularité du PDMS dans Dispositifs microfluidiques a conduit à l’élaboration d’outils pour surmonter la capacité intrinsèque du matériau à absorber les petites molécules10,17. Cependant, le grand nombre de jetons nécessaires pour appuyer les études biologiques où l’utilisation d’agents microbiens et composés absorbant les PDMS faire réutiliser des puces orgue difficile nécessite un procédé de fabrication évolutive même pour les petits groupes. Le protocole décrit ici présente une méthode pour la fabrication de dispositifs appropriée pour l’usage dans des laboratoires universitaires, y compris ceux qui manquent d’accès aux salles propres et doux lithographie. Ce protocole vise à élargir l’accès aux puces de l’orgue par un large éventail de chercheurs qui cherchent à utiliser les appareils extensibles, double canal pour explorer les processus biologiques fondamentaux ainsi que le développement de thérapeutique translationnelle.
S’appuyant sur les meilleures pratiques des champs micromanufacturing couplés avec la conception à la fabrication, de façon robuste a été développé pour la fabrication de dispositifs de puce de l’orgue en grande quantité avec un rendement et une reproductibilité élevée. Le protocole de fabrication décrit ici fournit une méthode évolutive pour la production de copeaux de l’orgue. Les auteurs décrivent l’utilisation d’une option moule en Place Jig (MiP ; détails de conception en Matériaux supplémentaires) couplé avec des bandes de joint polyuréthane pour permettre l’intensification de la coulée des composants PDMS. Le côté brillant des bandes en polyuréthane de produire des pièces PDMS optiquement lisses tandis que le côté texturé facilite le démoulage. Nous décrivons également l’utilisation d’un facultatif automatisé Membrane manufacturier (AMF) qui fournit une compression uniforme de moules de gaufrette de membrane durant le mûrissement de fabrication jusqu'à 24 membranes par lot. Le design est largement applicable pour l’étude des organes qui sont composés de tissus qui connaissent les sollicitations mécaniques et la perfusion, et ces puces peuvent être produites avec une faible variabilité puce-à-puce dans les quantités requises pour répondre aux besoins des petites et grandes groupes de recherche aussi bien. Le flux de travail est favorable à un format de lot ou de la chaîne de montage et difficilement compatibles avec les protocoles d’évaluation de qualité pour le contrôle des procédés de production, formation du personnel et le dépannage réactif. Nous espérons que ce protocole étendra l’accès aux possibilités de double canal, extensible, copeaux de l’orgue pour la recherche fondamentale et translationnelle.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. préparation générale
- Pour éviter les débris, nettoyer la zone de travail à l’aide de ruban adhésif et essuyer avec une lingette de salle blanche et l’alcool isopropylique.
- Pour toutes les étapes nécessitant le PDMS, mélanger PDMS à un ratio de 10:1 (10 g de croix reliant agent, 100 g de base élastomère). Mélanger à la main ou avec un mélangeur disponible dans le commerce. Utilisez un mélangeur centrifuge ici : mélange pendant 2 minutes à 2000 tr/mn, puis dégazage le PDMS pendant 2 minutes à 2200 tr/min.
- Nettoyer toutes les moules avec pistolet à air pour souffler les débris avant de les utiliser.
Mise en garde : Ne pas utiliser de pinces métalliques pour enlever les débris car cela endommagera la surface des moules.
2. top Channel préparation
- Essuyer la face brillante de chaque morceau de polyuréthane avec des lingettes éthanol et salle blanche. Assurez-vous que tous les éthanol résiduel est séché de la surface de polyuréthane.
- Placez le côté brillant de la polyuréthane sur le côté ouvert du moule MiP pour créer un joint sur le côté ouvert du moule, laissant seulement une ouverture bien-comme dans la partie supérieure du moule sur le versant de PDMS.
Remarque : Vérifiez que chaque moule est couvert solidement par morceau en polyuréthane ou le PDMS provoquera une fuite de moules pendant la coulée. - Placer les moule et polyuréthane assemblées dans un dispositif de serrage de MiP, avec le côté texturé contre l’extrémité de la gigue de la MiP. Continuez à faire ceci jusqu'à ce que toutes les moules ont été placées dans le gabarit.
- Serrez le gabarit de MiP en tournant la poignée à l’aide d’une clé jusqu'à ce que l’espacement de la sauteuse est de 25 mm de largeur.
- Faire un bateau d’aluminium entourant la gigue de la MiP pour empêcher toute fuite sur les surfaces PDMS excédentaire.
- Versez le PDMS dans chacun des moules bien jusqu'à complète.
Remarque : Chaque composante haut puce nécessite environ 3 mL de PDMS. - Une fois le gabarit de l’ensemble est rempli, placer le gabarit dans le dessiccateur à vide. Tirer à vide à-80 kPa pendant 1 h à dégazer PDMS.
- Après 1 h, retirer le dessiccateur de la gigue de la MiP et placer au four à 60 ° C pendant au moins 4 h guérir PDMS.
- Démonter la gigue de MiP à l’aide d’une clé, desserrer la gigue en tournant la poignée dans le sens inverse. Dès que les moules sont exempts de compression, retirer les moules de jig.
- Retirez les bandes polyuréthane de chaque moule et jetez-le.
- Soigneusement le moule hors pièces PDMS de leurs moules et disposez-les fonctionnalité-vers le haut.
- Alignez la lame du racloir de tuile à encoche onglet fin et couper chaque extrémité aux célibataires les composants haut de la page.
- Vérifier les pièces pour les modes de défaillance suivants et de jeter des pièces insatisfaisants : rayures dans le chenal principal, gros débris au-dessus de la zone du canal, grosses bulles, déforment les canaux sous vide.
- Stocker les pièces finies en Pétri carré dans les armoires positives de pression à température ambiante.
3. préparation de canal du bas
- Verser environ 10,5 g du PDMS dans des moules jusqu'à ce que le PDMS atteint le sommet de la cavité.
- Inspecter le moule bas de canal pour PDMS guéri au fond du moule.
- S’il est sale, gratter vieux PDMS du fond du moule car une surface inégale sur le fond du moule peut provoquer des épaisseurs inégales des parties finales.
Remarque : pour les petites < 2 cm2 zones à découvert, le pistolet à air peuvent être utilisés très doucement pour déplacer le PDMS au-dessus de l’espace.
- Mettre les moules dans le dessiccateur à vide pendant 1 h.
- Après 1 h, déplacer les moules dans un four de niveau 60 ° C pour > 4 h.
- Placer le moule sur table sous hotte à flux laminaire. Desserrer le PDMS d’un bord du moule.
- Attraper un coin et décollez délicatement le PDMS de la surface du moule.
- Lorsque complètement retiré, poser sur la surface de travail, afin que les fonctionnalités de canal sont face vers le haut.
- Parties coupées le long des bords extérieurs avec coupe-carreaux, plaçant la lame de coupe carreau dans cranté PDMS comme à l’étape 2.12.
- Poser pièces côté fonctionnalité vers le haut sur un ruban pour enlever tous les débris.
- Retirez le ruban d’emballage par partie. Faites glisser l’extrémité libre de la partie sur la diapositive. L’extrémité libre sera stratifié avec le verre.
Remarque : Il est essentiel d’éviter qui s’étendent de la partie en ce fixant. Si la bulle est coincé entre le cadre et le verre, soulevez la partie avec la pince doucement et re-poser. - Effectuer l’inspection de contrôle de la qualité des pièces. Vérifier les pièces pour les modes de défaillance et jeter des pièces peu satisfaisantes, y compris celles qui contiennent des rayures dans le chenal principal, gros débris, grosses bulles ou déformés de chaînes vide.
- Couvre les caractéristiques avec du ruban adhésif.
- Stocker les pièces dans une coffret à température ambiante une pression positive.
4. préparation de Membrane PDMS
- Vérifier que les gaufres sont exemptes de PDMS sur le dos.
- Placer chaque plaquette de membrane dans les emplacements désignés dans les plateaux de l’AMF.
- Utilisez la seringue de 1 mL pour placer 0,09 mL du PDMS vers le centre de chaque tableau de post de gaufrette de membrane. Laisser des PDMS pendant au moins 5 min pour permettre de PDMS à se répandre dans les postes de la plaquette de la membrane.
Remarque : Ne passez pas à l’étape suivante jusqu'à ce qu’au moins 75 % du tableau post est couverte dans le PDMS. La qualité des membranes s’améliore plus le PDMS est autorisé à mèche dans la région de post donc plus longs temps d’attente dans cette étape sont préférés. - Plasma traiter la bande en polycarbonate à 20 W pour 45 s, O2 gaz à 0,80 mbar dans une machine de plasma.
- Retirer la feuille de polycarbonate de la machine de plasma et utiliser des ciseaux pour couper les feuilles de polycarbonate en carrés de 45 x 45 mm.
NOTE : Minimiser le contact avec le plasma surface traitée pour empêcher la poussière de coller sur le polycarbonate. - Poser délicatement le côté plasma traité des places sur le PDMS liquide centrée sur la plaquette de la membrane en polycarbonate. Veiller à ce que le polycarbonate et le PDMS sont en contact.
Remarque : Éviter les poches d’air entre le polycarbonate et le PDMS. - Poser le PDMS prédécoupés sur le centre de la place en polycarbonate.
- Placez la feuille de polycarbonate texturé prédécoupés sur le bloc PDMS de tenir l’Assemblée de coller à la plaque de compression.
- Insérez le plateau pour que bac 3 est dans le dos, bac 2 est au milieu et bac 1 est à l’avant. Bac 1 possède une encoche pour l’alignement.
- Ouvrir la soupape de pression de sortie et ouvrir très lentement la vanne de pression d’entrée. Seulement ensuite, fermez la soupape de sortie.
NOTE : Ceci est pour que la sortie 4 kg de force est progressivement appliquée à chaque tranche de membrane par opposition à instantanément, qui risque de casser les gaufrettes. - Appuyer sur l’interrupteur de l’AMF sur ON pour commencer le cycle de polymérisation. Guérir la plaquette moins de 4 kg (16 kPa) de compression et un cycle de température rampe énumérés au tableau 1.
| Étape | Température (° C) | Durée (min) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Maintenez |
Tableau 1 - Membrane, durcissement des conditions
- Fermer la vanne d’entrée la pression et ouvrir la soupape de pression de sortie pour relâcher la pression sur des bouteilles d’air.
- Enlever les plateaux et apportez-les à la hotte à flux laminaire.
- Décoller soigneusement le polycarbonate texturé et retirer délicatement l’entretoise PDMS.
NOTE : Regardez l’entretoise PDMS pour assurer qu'il ne pas aussi décoller le transporteur en polycarbonate, dans ce cas démarrer peeling depuis un angle différent.- Inspectez la membrane PDMS par le transporteur en polycarbonate pour zones avec trous et utilisez un marqueur pour tracer le contour de la zone d’à travers-trou et marquer des trous ou des défauts dans les membranes.
- À l’aide de pinces de manipulation de wafer, desserrez gaufrettes du plateau.
- Retirer la plaquette de chaque membrane et placer dans la boîte de Pétri.
Remarque : La membrane PDMS sera le moule de la plaquette de la membrane et le polycarbonate sauvegarde est respectée. Si PDMS commence à détacher le transporteur en polycarbonate, éplucher d’une autre région. - Stocker les membranes et les gaufrettes en boîtes de Pétri dans une armoire à température ambiante une pression positive.
5. classement assemblage et préparation
- À l’aide de ruban adhésif mat, nettoyer les membranes PDMS ainsi que l’intérieur de la boîte de Pétri pour enlever les débris.
- Du ruban soigneusement le côté caractéristique de chaque composant haut pour enlever les débris.
- Placez le canal du haut partie (« top ») fonctionnalité côté vers le haut en boîte de Pétri avec membrane PDMS.
Remarque : N’oubliez pas que certaines membranes peuvent être utilisées pour une ou deux parties supérieures selon la taille de la zone utilisable. Les principaux canaux de chaque partie supérieure doivent s’insérer dans la zone de la membrane. - Charger les boîtes de Pétri dans la machine à plasma.
- Plasma traiter la membrane et haut à 20 W pour 45 s, O2 gaz à 0,80 mbar.
- Lorsque les cycles de collage est terminée, retirer les plats et fixer les éléments activés côté fonctionnalité sur le dessus de la membrane et assurent la partie est entièrement stratifié avec membrane avec pas de bulles.
- Placer les pièces dans le four à 60 ° C pendant au moins 2 h de recuire.
- À l’aide d’un scalpel, trace autour du périmètre du collé dessus pour séparer par le transporteur en polycarbonate à haut-membrane.
Remarque : Ne pas couper le transporteur. - Une fois que la partie qui est tracée, éplucher l’ensemble entre le polycarbonate. La membrane PDMS qui est collée sur la partie supérieure doit peler auprès du transporteur.
- À l’aide de pinces à pointe pointu, retirer la membrane des orifices qui accèdent le canal du bas et enlever tout débris ou poussière avec une pince dans un stéréoscope.
Remarque : Ne pas laisser n’importe quelle partie de la membrane qui recouvre le port d’accès.
6. puce Assemblée
- Fonction face vers le haut, assemblages délice plasma avec des composants de fond avec les conditions à l’étape 5.5.
- Sous un microscope inversé, aligner l’assemblage supérieur avec lame de microscope à fond moitié.
- Placez au four à 60 ° C pendant au moins 2 h.
- Inspection de contrôle de la qualité de puce
NOTE : Payer une attention particulière aux principaux ports et canaux de puce. Rechercher des modes de défaillance de l’oeil et aussi au microscope.- Pour vérifier que la puce est entièrement collée, tirer légèrement sur chaque coin de la puce pour vérifier les pièces de délamination.
- Regardez le canal de la puce pour vérifier une membrane plissée ou tombantes, qui apparaîtra comme un zig-zag ou une légère déviation dans le chenal.
- Effectuer une inspection de microscope pour vérifier si des débris dans le chenal principal.
Remarque : Les débris dans les zones non critiques, tels que les canaux sous vide sont acceptable. - Avec la puce toujours sur le microscope inversé, inspecter le chenal principal et des canaux sous vide pour la délamination.
Remarque : La délamination dans des zones non critiques (par exemple, le bord de la puce) est acceptable. - Vérifier que les principaux canaux sont alignés à dans 50 à 60 µm (pores de membrane de 1-2).
Remarque : Il est crucial que les canaux ne sont pas superposés avec canaux sous vide. - Vérifier que la membrane entre les canaux principaux et les canaux d’entrée et de sortie est intacte sans aucun trou apparent.
Remarque : N’importe quel trou dans la membrane peut conduire à une puce qui fuit ou la croissance des cellules hors des circuits.
- Magasin de puces dans les boîtes de Pétri dans une armoire à température ambiante une pression positive.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Le protocole présenté ici décrit la fabrication évolutive de PDMS orgue jetons. Ces dispositifs permettent la culture de deux types distincts de tissus perfusés sur une membrane poreuse élastique (Figure 1). Les canaux PDMS sont converties à l’aide de moules imprimés 3D, qui accélère le prototypage de nouveaux designs (Figure 2 a et 2 b). Canaux haut de la page est coulés dans des moules sous compression contre un joint polyuréthane compatible pour produire des composants avec ports moulés (Figure 2), tandis que le bas canal composants sont exprimés dans des plateaux et manipulés sur lame de microscope, chœurs (Figure 2D). Cette approche de fabrication combine modélisation multi-échelle des pièces en une seule étape, ce qui fait gagner du temps, améliore la reproductibilité et la traçabilité et réduit les débris générés par le port de poinçonnage et de multiples étapes de coupe. Les membranes poreuses sont essentiels à la fonction de la puce de l’orgue et l’approche de fabrication basée sur bâti contre les plaquettes de silicium à motifs résultats dans les membranes d’épaisseur uniforme et finition de surface (Figure 3). Gérer par les transporteurs en polycarbonate permet pour le stockage et la plus grande production par lots.
La puce assemblé de l’orgue (Figure 4) se compose de deux canaux de perfusion dans un emballage optiquement transparent. Dans la région qui se chevauchent, une membrane poreuse de PDMS autorise une interaction un tissu de métabolites, protéines, thérapeutique, agents pathogènes et des cellules pour récapituler la fonction puce orgue tandis que deux canaux parallèles de chaque côté sont utilisés pour fournir mécanique souche à l’aide d’actionnement vide cyclique. La porosité de la biomimetically de membrane PDMS prend en charge le flux des métabolites, des facteurs de croissance et même des cellules entre le parenchyme vasculaire et orgue (Figure 5). La perméabilité apparente (Papp, cm/s) de la membrane a été déterminée à l’aide de la concentration de colorant dans les canaux de sortie avec et sans des cellules Caco2 gut. Les couches de cellules de puce gut offrent une barrière une augmentation significative de perméabilité. La puce de l’orgue peut être actionnée en utilisant les canaux parallèles sous vide quantitativement et de façon reproductible appliquer la contrainte cyclique de chargement à la membrane et, par conséquent, les tissus cultivés (Figure 6). Cette souche cyclique combinée avec perfusion de média prend en charge la différenciation cellulaire pour mieux imiter en vivo orgue la physiologie, tels que la formation des villosités dans la puce de l’intestin.

Figure 2 : Fabrication de canal avec 3D imprimés moules. Pièces de puce d’orgue sont jetés contre haute résolution imprimée moules 3D (A et B), qui permet une plus grande souplesse de conception et prototypage que la lithographie douce traditionnelle. Pièces (C) de la chaîne sont polymérisées sous compression, éliminant le besoin de poinçonnage des ports dans les pièces finies. Chaque coulée en triple est puce avec une seule coupe. Parties inférieures de la chaîne (D) sont placées sur des lames de verre pour assurer la facilité d’utilisation et d’imagerie. Barreaux de l’échelle est environ 1 cm de toutes les images. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : La membrane poreuse de PDMS est castée à l’aide de plaquettes de silicium DRIE patterned. (A) affichage de 7 µm de diamètre, 50 µm tall micropiliers gravés à l’aide de DRIE dans une plaquette de silicium. (B) PDMS est guéri sur ce tableau moins de 4 kg de compression (kPa 16) pour créer une membrane épaisse de 50 µm avec un tableau de 7 µm de diamètre, bien que les trous espacés apart hexagonal 40 µm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Photographie d’une puce d’orgue PDMS assemblé. Colorant rouge remplit le canal apical plu utilisé pour les cellules parenchymateuses, alors que le colorant bleu souligne le canal basal généralement utilisé pour l’endothélium vasculaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Perméabilité de traceur inerte bleu Cascade à travers la membrane PDMS microporeuse. Colorant bleu hydrazide cascade dans le milieu a été chargé dans le canal du haut de la puce de l’orgue et perfusé à 60 µL/h pour mesurer le flux du colorant à travers la membrane dans le canal inférieur contenant le support. Jetons vides ont été comparés à Gut Chips avec cellules Caco2-BBe1 dans le canal apical et les cellules endothéliales vasculaires humaines (HUVEC) dans le chenal basal cultivés pendant 6 jours. Barres d’erreur indiquent erreur type de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Application de déformation de membrane à l’aide de canaux secondaires vide. Terrain indique modulation déformation linéaire de la membrane en réponse à une pression sous vide. Souche uniaxiale cyclique est appliquée uniformément à la région culturelle de la puce d’orgue à l’aide de vide appliquée aux canaux secondaires parallèles. La souche est linéairement corrélée avec une diminution de pression de vide à environ 1 % de déformation pour chaque changement de-10 kPa de pression de vide (R2 = 0,992). Barres d’erreur indiquent la déviation standard de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Matériaux supplémentaires : S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le procédé de fabrication s’appuie sur les moules imprimés 3D haute résolution au motif que les éléments de carrosserie de puce orgue à haut et en bas PDMS couplés avec micromolded membranes poreuses de PDMS. Cette approche critique a été sélectionnée due à la facilité de prototypage combiné avec transition rapide à plus grande échelle de fabrication et remplacement de l’outillage. Les moules de composant haut de la page sont conçus aux ports de motif dans des endroits précis avec des profils verticaux définis lors de l’étape de la coulée. Cela évite non seulement le travail impliqué dans le poinçonnage manuellement les ports d’accès, mais réduit aussi les débris dans le lieu de travail, alignement reproductible port permet aux collecteurs d’interface ou d’instrumentation, et produit avec contrôle de l’ajustement et le scellement des inséré tuyau ou broches pour raccordements fluidiques et pneumatiques. Les moules sont empilés sur les uns les autres dans un gabarit de compression, séparé par des feuilles polyuréthane compatibles pour faciliter l’à travers-trou coulée des ports. Par empilage de plusieurs pièces dans un gabarit unique, un seul utilisateur peut monter de grandes quantités de composants complets avec les ports en une seule étape. Choix des matériaux et la méthode pour les moules de fabrication sont essentiels pour fournir la fonctionnalité nécessaire résolution, faible rugosité et degré élevé de planéité pour l’assemblage de l’appareil et les demandes ultérieures d’imagerie. Stéréolithographie peut répondre à ces exigences, bien que les matériaux dont la température de déflexion élevé (> 80 ° C) et compatibilité avec PDMS polymérisation réduisent la portée de polymère disponible. Différentes résines disponibles dans le commerce, y compris les résines de fibre de verre, répondent à ces critères.
La membrane élastique de PDMS poreuse est sans doute le composant plus unique et critique d’une puce d’orgue tout en étant le plus complexe à fabriquer. Un deep reactive ion etches processus (DRIE) sous-traité à un vendeur est utilisée pour microfabricate 50 x 50 mm hexagonal tableaux des piliers (7 µm de diamètre, apart 40 µm, 50 µm de hauteur, C4F8 couché) qui servent à mires de pores dans la membrane PDMS. La qualité des tableaux pilier est essentielle à la réalisation de moulage de membrane robuste. En particulier, piliers doivent être gravés à tolérances serrées avec des profils verticaux lisses pour éviter les contre-dépouilles ou rugosité de la paroi latérale excessive pouvant conduire à l’échec de moule. Il faut éviter « gazonner » au bas de la région gravée, ce qui peut affecter le démoulage de la membrane et la fixation des cellules. Fabrication de membrane avec trou traversant structuration et dispositif d’une intégration réussie est la seule section plus complexe du protocole. Critique, plaçant 0,09 mL de PDMS sur chaque tranche et permettre suffisamment de temps pour elle de se propager sont essentiel d’éviter incomplète bâti d’à travers-trou. Correctement traiter le polycarbonate soutenant le plasma est nécessaire à la réalisation d’un soutien solide de la membrane pour le démoulage et collage d’étapes sans faux plis ni étirement. Le soutien fournit un moyen fiable de démoulage de la membrane de la fonte de la plaquette de silicium fragiles.
La charge compressive appliquée à chaque plaquette est également essentielle pour la fabrication d’à travers-trou uniforme. Les efforts précédents en utilisant des poids empêché la production de la membrane et a donné lieu à piètres rendements grâce à une répartition non uniforme de force. Pour surmonter le goulot d’étranglement de la production, nous avons optimisé la membrane publiées antérieurement fabrication protocole18 et construit un manufacturier de Membrane automatisé (AMF) pour paralléliser le processus. L’AMF est composé de 24 pistons pneumatiques, appuyés sur une plaque chauffante programmable pour fournir une force de compression contrôlée tout au long d’un PDMS programmée, procédé de polymérisation. Un polycarbonate support film est placé sur le PDMS non polymérisée et ensuite uniformément compressé à l’aide de pistons pneumatiques de l’AMF tout en réchauffant à polymériser le PDMS. Critique, le graduel processus décrit dans les résultats de protocole dans les membranes de qualité plus élevés qu’un seul pas à la température maximale, où les motifs de contour progressif résultant de bulle développement pendant le durcissement de polymérisation processus ont été observés. Bien que facultative, l’AMF augmente significativement au-delà de ce qui est possible en utilisant des poids dans un four.
Dépannage les puces d’orgue qui en résulte se déroule à deux niveaux : au cours du processus de fabrication et durant la culture de la puce de l’orgue. Nous avons développé une méthode visuelle pour l’assurance qualité (QA) de formation à travers-trou dans les membranes de fonte qui accélère grandement le processus de production tout en améliorant la qualité et la fiabilité des assemblées orgue Chips. Cette méthode QA permet le processus de dépannage, et nous vous recommandons de conserver une trace des conditions de processus permettant la fabrication de suivi des problèmes qui peuvent survenir au cours de la culture de cellules. Durant la culture de l’orgue Chip, traceur inerte colorants sont la méthode la plus simple de mesurer la fonction de barrière pour dépanner le processus de fabrication et étapes de la culture de cellules. Le jaune Lucifer a été utilisé historiquement en raison de sa faible masse moléculaire et la fluorescence innée, mais Blue Cascade offre des propriétés similaires avec un spectre d’émission plus étroit qui est moins susceptible d’interférer avec les dosages en aval. Des molécules plus grosses, comme poly-éthylèneglycol (PEG)- ou conjugué dextran fluorophores sont plus grandes et par conséquent entraîner plus faible perméabilité globale et sensibilité inférieure. La perméabilité apparente (Papp, cm/s) des traceurs colorants peut être utilisée pour déterminer les propriétés de fonction de barrière d’organes ou de tissus (Figure 4). L’équation suivante peut être utilisée pour calculer Papp entre le dosage de canal et le canal de réception et est dérivée d’équations utilisées principalement pour des études de Transwell19,20 et corrige la perte de colorant traceur causée par l’absorption en PDMS en comparant les flux de deux sortie et ne pas en se fondant sur des hypothèses de bilan massique à l’exutoire.

VR est le volume en mL de recevoir les effluents de canal après le temps t; DV est le volume en mL de l’effluent de canal dosage après le temps t; A est la surface de membrane à travers-trou région en cm2 (0,167 cm2 pour cet appareil) ; t est le temps des effluent collection en secondes ; CR est celle mesurée dans la concentration du colorant traceur dans l’effluent de canal récepteur ; CD est la concentration mesurée du colorant traceur dans l’effluent de canal dosage. Hypothèses pour cette équation valide clés comprennent : 1) constant traceur teindre dosage concentration au temps t, 2) la concentration de Cr est faible par rapport au Cd, et 3) la perméabilité du système est uniformément distribuée dans l’ensemble de la région de culture. Bien que cette équation peut être utilisée pour des systèmes statiques, il faut vérifier que les hypothèses soient justes. Méthodes électriques, y compris la résistance électrique trans épithélial (TEER) sont généralement implémentées dans les études Transwell et récemment ont été intégrées PDMS orgue Chips pour les mesures de fonction barrière instantanée et continue ainsi21 ,,22.
Limites du présent protocole comprennent l’élasticité du PDMS ainsi que le processus de moulage et assemblage manuel qui limite le taux de production. PDMS est un polymère polyvalent bien adaptée pour les puces d’orgue nécessitant l’actionnement de la déformation mécanique, mais son élasticité peut entraver la production. Pièces peuvent être difficiles à gérer sans déformation et membranes nécessitent la sauvegarde des films pour la manipulation. Ainsi, l’automatisation de la production de copeaux de l’orgue peut être limitée. Le procédé de coulée, contrairement à chaud gaufrage ou moulage par injection, utilisé pour des polymères thermoplastiques, est axée sur le traitement par lots et par conséquent limite également le débit.
Orgue Chips permettent des études in vitro du niveau corps et organes humain fonctions in vivo en perfusant un moyen commun à travers les canaux vasculaires. En reconstituant les interfaces physiologique des tissus-tissus, flux de molécules entre les compartiments vasculaires et parenchymateux, signaux mécaniques et cisaillement fluidique et des transports, ces dispositifs promouvoir histodifferentiation et sont capables de récapitulant en vivo-comme les fonctions des organes normaux et malades. Le cloisonnement des tissus et les fluides dans deux compartiments imite leurs fonctions in vivo , et études d’orgue puce sont prêtent bien à la résolution temporelle pharmacocinétique expérimentation et modélisation ainsi que in vitro-en vivo extrapolation9,10 , c’est difficile, voire impossible à canal unique MPS14,15,16. Les structures de microcanaux peuvent être exploitées pour d’autres applications, y compris l’enquête sur l’impact de l’exposition de la fumée de tabac dynamique avec bidirectionnel de respiration dans l’épithélium pulmonaire humain de petit à développer de nouveaux biomarqueurs de dommages de poumon23. Les positions déterminées des membranes planes et haute clarté optique des dispositifs les rendent particulièrement bien adapté pour les analyses axées sur l’image et l’intégration des capteurs embarqués. La stimulation mécanique activée par intégré canaux sous vide et matériaux élastomères fournit des fonctionnalités n’est pas possibles dans les systèmes Transwell. Nous avons démontré que les sollicitations mécaniques sont essentielle pour la récapitulation de certaines fonctions de physiologique in vivo , comprenant des nanoparticules d’absorption dans le poumon4, l’oedème pulmonaire3 et la différenciation des matures iPS-dérivé glomérulaire podocytes8.
Les applications futures du présent protocole peuvent inclure l’intégration de diverses modalités de détection qui peut être utilisé pour fournir des lectures en temps réel de réponse orgue puce aux stimuli tels que des médicaments, des toxines ou rayonnement. Le protocole présenté ici pourrait être étendu à des matériaux non-PDMS avec différentes propriétés optiques, mécaniques et chimiques, y compris les matériaux biodégradables. Le protocole Chip orgue présenté ici devrait permettre aux chercheurs fabriquer des appareils qui offrent un degré élevé de contrôle sur le microenvironnement des tissus sains et physiopathologiques et des organes, qui peuvent être un levier pour le développement de thérapeutique, y compris cibler la découverte, la toxicité et les évaluations pharmacocinétiques, aussi bien en ce qui concerne la médecine personnalisée.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Dei est des fondateurs et détient des actions en émuler, Inc. et préside son Comité consultatif scientifique. J.P. est actuellement un employé d’émuler, Inc. R.N., Y.C., J.P., et dei sont inventeurs sur la propriété intellectuelle qui a été autorisé à émuler, Inc.
Acknowledgments
Nous remercions M. Rousseau et S. Kroll pour aide avec photographie et vidéographie et M. Ingram, J. Nguyen, D. Shea, N. Wen pour contribution à l’élaboration de protocoles de fabrication initiale. Cette recherche a été parrainée par l’Institut Wyss pour biologiquement inspiré Engineering à l’Université Harvard et le Defense Advanced Research Projects Agency sous accords de coopération #W911NF-12-2-0036 et #W911NF-16-C-0050, et la FDA accorde le # HHSF223201310079C, NIH accorde #R01-EB020004 et #UG3-HL141797-01, et Bill et Melinda Gates Foundation accorde #OPP1163237 et #OPP1173198 DEI. Les vues et les conclusions contenues dans ce document sont celles des auteurs et ne doit pas être interprétées comme représentant les politiques officielles, soit expresse ou implicite, de la Defense Advanced Research Projects Agency, l’alimentation et l’Administration de médicaments, la National Institutes of Health, ou le gouvernement des États-Unis.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Numéro 140 orgue-on-a-chip système microphysiological microfluidique bio-ingénierie microfabrication PDMS membrane poreuse microcanaux souche cyclique perfusionErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
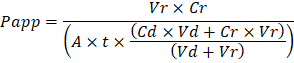
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
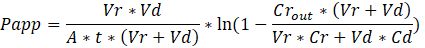
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



