ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
כאן, אנו מציגים פרוטוקול המתאר את ייצור של הערוץ מתיחה, כפול, איברים שבב microfluidic תא תרבות מכשירי recapitulating איברים ברמת פונקציונליות בתוך חוץ גופית.
Abstract
מספר משמעותי של תרכובות עופרת להיכשל בצבר התרופות כי מחקרים שנעשו בבעלי חיים לעיתים קרובות אינם מצליחים לחזות תגובות קליניים בחולים אנושיים. האדם איברים-על-שבב (צ'יפ איברים) microfluidic תא תרבות התקנים, המספקים פלטפורמה ניסיוני במבחנה כדי להעריך את היעילות, רעילות, פרופילים פרמקוקינטיקה ופרמקודינמיקה (PK) אצל בני אדם, עשויים להיות גורמים מנבאים טוב יותר של יעילות טיפולית, בטיחות במרפאה לעומת מחקרים שנעשו בבעלי חיים. התקנים אלה עשויים לשמש מודל הפונקציה של כמעט כל סוג האיבר והוא יכול להיות מקושר fluidically דרך נפוצה microchannels מצופה אנדותל לביצוע מחקרים במבחנה על הפיזיולוגיה של איברים וברמת כל הגוף ברמת בני ללא צורך לערוך ניסויים על אנשים. האסימונים איבר מורכב בשני ערוצים perfused microfluidic מופרדים באמצעות קרום חדיר אלסטומריים עם תאים parenchymal ייחודיים בצד אחד, אנדותל microvascular מצד שני, אשר יכול להיות מתח המזמורים לספק איבר ספציפי מכני רמזים (למשל, נשימה תנועות בריאה). פרוטוקול זה פרטים הזיוף של הערוץ גמיש, כפול, צ'יפס איברים דרך הליהוק של חלקים באמצעות 3D מודפס בתבניות, המאפשרת שילוב של מספר הליהוק ועיבוד פוסט-שלבים. פוליפוני נקבובי (דימתיל siloxane) ממברנות (PDMS) מושלך עם מיקרומטר בגודל דרך הפתחים באמצעות סיליקון מערכים עמוד תחת דחיסה. ייצור והרכבה של איברים שבבי כרוך ציוד שלבים אשר ניתן ליישם מחוץ חדר נקי מסורתיים. פרוטוקול זה מספק חוקרים עם גישה טכנולוגיית השבבים איברים במבחנה איברים, גוף-ברמת לימודי גילוי תרופות, בטיחות, יעילות הבדיקה, כמו גם מחקרים מכניסטית של התהליכים הביולוגיים הבסיסיים.
Introduction
כאן, אנו מתארים הזיוף של ערוץ כפול, vascularized איברים-על-שבב (צ'יפ איברים) microfluidic תרבות התקנים באמצעות פרוטוקול מדרגי קלה לשימוש על ידי קבוצות מחקר חסר גישה cleanrooms וכלים מסורתיים ליתוגרפיה רך. התקנים אלה פותחו כדי לסכם את התפקודים האנושיים איברים ברמת ההבנה רגיל פיזיולוגיה של המחלה, כמו גם סמים תגובות במבחנה1,2. פונקציונליות זו קריטית הנדסה הם שני ערוצים perfused microfluidic מופרדים באמצעות קרום חדיר למחצה (איור 1). עיצוב זה מאפשר בילוי של רקמות רקמות ממשקים בין לפחות שני סוגים של רקמות, בדרך כלל איברים תאים parenchymal בצד אחד של קרום נקבובי, אנדותל כלי הדם מאידך, כמו גם את חשיפתם זרימת נוזלים. בנוסף, כי הפולימר אלסטומריים פוליפוני (דימתיל siloxane) (PDMS), משמשת כדי להמציא שבב איבר הגוף ואת קרום רכיבים, מאמץ מכני מחזורית שניתן להחיל על כל מהונדסים רקמות רקמות ממשק דרך הגומי ממברנה לחקות את microenvironment הפיזי הטבעי של איברים חיים, כמו נשימה בריאה ותנועות הפריסטלטיקה במעי.

איור 1: שבב איברים לעבור סעיף- צ'יפס איבר מורכב בשני ערוצים מופרדים באמצעות קרום נקבובי, אלסטי זה יכול להיות נזרע עם תאים משני הצדדים. הערוץ העליון הם חתכי רוחב רחב x תחתון גבוה, 1 מ 1 מ"מ ערוץ הצלב שמקטעים הם 1 מ"מ x 0.2 מ מ גבוה, ואקום וערוצי בשני חלקים התחתון הן 0.3 מ מ רחב, 0.5 מ מ גבוה, מרווח 0.3 מ מ הערוצים fluidic. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
אלה ערוץ מתיחה, כפול, צ'יפס איברים שימשו הממחיש את ההשפעה של נשימה תנועה על ספיגת ננו-חלקיק ריאות, בצקת ריאות שיכרון3,4; ההשפעות של ממברנות תנועה על בידול5 ו מוגבר ב-6,' המעי5,'7; ואת ההשפעה של העיוותים מחזורית עקב pulsation הלב על בידול התבגרותם של podocytes glomerular הכליה8. בנוסף, לומן שני התקנים אלה המכילים מצופה אנדותל כלי הדם ערוץ המופרדים של מטריצה חוץ-תאית (ECM)-מצופה קרום תאים parenchymal בתוך ערוץ בנפרד נגיש מתאימים היטב אפיון של סמים PK הפרמטרים ואת גילוי יעד חדש, אשר הגביל ב זלוף יחיד ערוץ מערכות. יתר על כן, שבבי איברים מרובים עשויים להיות מקושרים זה לזה באמצעות ערוצי כלי הדם שלהם ליצירת ביעילות של האדם גוף-על-צ'יפס, אשר יכול להציע פלטפורמה מושכת אנושיים במבחנה הרפוי פיתוח9, 10. בניגוד ביותר מיקרו-פיזיולוגיים מערכות (MPS)11,12,13, האסימונים איברים מכילים שני ערוצים microfluidic מופרדים באמצעות קרום נקבובי המקל על כלי הדם parenchymal אינטראקציות כדי מסכם את הדברים ויוו תפקוד האיבר. זה לא רק מפשט את הקישור של איברים שונים ביחד על ידי פרפוזיה מדיום משותף דרך הערוצים כלי הדם, אבל מידור של רקמות ונוזלים מחקה ויוו פונקציות ותומך ניסויים פרמוקוקינטיים ו מידול כמו גם במבחנה-ויוו אקסטרפולציה9,10 כי קשה או בלתי אפשרי בכל אחד מהערוצים MPS14,15,16. הפופולריות של PDMS במכשירים microfluidic הוביל לפיתוח כלים להתגבר על יכולת מובנית של החומר כדי לספוג את מולקולות קטנות10,17. עם זאת, מספרם של שבבי הנדרשים כדי לתמוך במחקרים ביולוגיים שבו השימוש סוכנים חיידקים ותרכובות קליטת PDMS לעשות שימוש חוזר של איברים שבבי קשה מחייבת תהליך ייצור מדרגי גם עבור קבוצות מחקר קטן. הפרוטוקול המתואר כאן מציג שיטת הזיוף המכשיר מתאים לשימוש במעבדות אקדמית, כולל אלה חסר גישה cleanrooms, הדפס אבן רכה. פרוטוקול זה שואפת להרחיב את הגישה שבבי איברים על ידי מגוון רחב של חוקרים המבקשים להשתמש המכשירים מתיחה, ערוץ כפול עבור חקר תהליכים ביולוגיים בסיסיים, כמו גם פיתוח טיפולית translational.
מינוף מומלצות משדות micromanufacturing בשילוב עם עיצוב ייצור, בגישה חזקים פותחה עבור בדיית איברים שבב מכשירים בכמויות גדולות עם הפארמצבטית גבוהה ועם תשואה. פרוטוקול פבריקציה נוספת המתוארים כאן מספק שיטה מדרגי לייצור השבב איברים. אנו מתארים את השימוש אופציונלי עובש-in-Place יג (MiP; פרטי העיצוב בתוספת חומרים) בשילוב עם רצועות פוליאוריתן אטם כדי לאפשר אולם שינוי קנה המידה של השלכת PDMS רכיבים. הצד מבריק של רצועות פוליאוריתן לייצור חלקים PDMS שטיחות חלקה ואילו הצד עם מרקם מקלה על demolding. אנו מתארים גם את השימוש של אופציונלי אוטומטית ממברנה מפברק (אלירן לגזיאל) מספק דחיסה אחידה של קרום וופל בתבניות במהלך ריפוי בדיית עד 24 ממברנות לכל אצווה. העיצוב הוא ישים באופן כללי עבור מחקרים של איברים מורכבים של רקמות להיתקל מאמץ מכני זלוף, הצ'יפס הזה, יכול להיות מיוצר עם השתנות צ'יפ לצ'יפס-נמוכה בכמויות הנדרשות כדי לענות על הצרכים של קטנים וגדולים קבוצות מחקר כאחד. זרימת העבודה היא נוטה תבנית אצווה או קו הרכבה, ברצון תואם עם איכות הערכת פרוטוקולים לשליטה של תהליכי הייצור, אנשי הדרכה, ופתרון מגיבים. אנו מקווים כי פרוטוקול זה יתרחב גישה ליכולות של ערוץ כפול, מתיחה, שבבי איברים למחקר בסיסי והתרגום.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. כללי הכנה
- כדי להימנע פסולת, לנקות את אזור העבודה באמצעות דבק סלוטפ, והורסים אזור עם חדר נקי לנגב, איזופרופיל אלכוהול.
- עבור כל השלבים הדורשים PDMS, מערבבים PDMS ביחס של 10:1 (10 גרם של צלב קישור סוכן, 100 גרם של אלסטומר הבסיס). מערבבים ידנית או עם מערבל זמינים מסחרית. השתמש מערבל צנטריפוגלי פלנטרית כאן: ערבוב 2 דקות ב 2000 סל ד, ואז degassing את PDMS למשך 2 דקות ב 2200 סל ד.
- הכל נקי תבניות עם רובה אוויר להתפוצץ פסולת לפני השימוש.
התראה: אין להשתמש מלקחיים מתכת להסיר פסולת. יהרוס את פני השטח של התבניות.
2. לראש ערוץ הכנה
- נגב למטה בצדדים מבריק כל פיסת פוליאוריתן עם מגבונים אתנול וביו -חדר נקי. ודא כי כל אתנול שיורית הוא מיובש מהמשטח פוליאוריטן.
- מניחים בצד מבריק של הפוליאורטן בצד הפתוח התבנית MiP כדי ליצור חותמת בצד הפתוח של העובש, עוזב רק חור טוב כמו בחלק העליון של, התבנית PDMS השוטף.
הערה: לבדוק כי כל עובש מכוסה בצורה מאובטחת ע י חתיכת פוליאוריתן או PDMS ידלוף מ בתבניות במהלך לשפוך. - במקום ההרכבות עובש, פוליאוריתן לתוך ג'יג MiP, עם הצד עם מרקם נגד בסוף החגיגה MiP. להמשיך לעשות את זה. עד כל תבניות הוצבו לרעתנו.
- הדק רוסמ MiP על-ידי הפעלת הידית באמצעות מפתח ברגים עד 25 מ מ רוחב המרווח יג.
- לעשות סירה רדיד אלומיניום סביב התוכנית MiP כדי למנוע עודף PDMS נוזלת על משטחים.
- שופכים PDMS לתוך כל אחד התבניות. ובכן עד מלא.
הערה: כל רכיב העליון של שבב דורשת כ 3 מ"ל של PDMS. - ברגע. החגיגה כולה מלאה, מקום החגיגה לתוך desiccator ואקום. משוך ואקום ב-80 kPa עבור h 1 כדי דגה PDMS.
- לאחר 1 h, החגיגה MiP להסיר desiccator, הכנס לתנור 60 מעלות צלזיוס במשך לפחות 4 שעות לרפא את PDMS.
- לפרק רוסמ MiP באמצעות מפתח ברגים, לשחרר את התוכנית על-ידי הפעלת הידית נגד כיוון השעון. לאחר בתבניות ללא דחיסה, להסיר עובש יג.
- הסר את רצועות פוליאוריתן עובש כל וזורקים.
- בזהירות דה-עובש PDMS חלקים מ בתבניות שלהם ולהניח אותן כוללים מקצה לקצה.
- בשורה הלהב של אריח המגרד-סוף tab חריץ, לחתוך בכל קצה singulate את הרכיבים העליון.
- לבדוק חלקים עבור כל מצבי כשל הבאים ולמחוק כל חלקים משביעת רצון: שריטות בתעלה הראשית, פסולת גדולה מעל האזור ערוץ, בועות גדולות, מעוותים ערוצי ואקום.
- לאחסן חלקים סיים פטרי מרובע בתוך ארונות לחץ חיובי בטמפרטורת החדר.
3. בתחתית הערוץ הכנה
- יוצקים כ- 10.5 גרם של PDMS לתוך תבניות עד PDMS מגיע לפסגה של החלל.
- בדוק, התבנית הערוץ התחתון PDMS נרפא לתחתית של עובש.
- אם מלוכלך, לגרד PDMS ישן מהחלק התחתון של העובש מאז משטח לא אחיד לתחתית התבנית יכול לגרום עובי אחיד של החלקים הסופי.
הערה: עבור קטנות < 2 ס מ2 אזורים ונחשפים, אוויר יכול לשמש בעדינות כדי לעבור PDMS על פני השטח.
- מניחים בתבניות desiccator ואקום לשעה.
- לאחר 1 h, להעביר התבניות לתוך תנור ברמה 60 ° C עבור > 4 שעות.
- במקום עובש על שולחן למינארי. שחרר PDMS מקצה אחד של העובש.
- אחיזה בפינה אחת, בעדינות לקלף את PDMS מפני השטח עובש.
- בעת הסרת באופן מלא, שכב על משטח העבודה, כך תכונות הערוץ הם הפנים למעלה.
- חותכים חלקים לאורך קצות בחוץ עם חותכני אריח, הנחת אריח חותך להב PDMS מחורץ כמו שלב 2.12.
- נשכב חלקים תכונה בצד בקלטת כדי להסיר את כל הלכלוך.
- הסר את החלק של קלטת אריזה. גרור את הקצה של החלק לרוחב השקופית. הקצה למינציה עם הזכוכית.
הערה: זה קריטי כדי למנוע מתיחות החלק כשהניח את זה למטה. אם הבועה הוא לכוד בין חלק זכוכית, בעדינות להרים את החלק עם המלקחיים ושכבה מחדש. - לבצע פיקוח בקרת איכות של חלקים. לבדוק חלקים עבור כל מצבי כשל ולמחוק כל חלקים משביעת רצון, כולל אלה המכילים שריטות הערוץ העיקרי, פסולת גדולה, בועות גדולות, או מעוותים ערוצי ואקום.
- מכסים תכונות עם הקלטת.
- חנות חלקים לחץ חיובי ארון בטמפרטורת החדר.
4. PDMS ממברנה הכנה
- בדוק מוצרי קונדיטוריה חופשיים של PDMS על הגב.
- מקם כל וופל ממברנה במכונה ייעודית במגשי מסלולי.
- להשתמש במזרק 1 מ"ל כדי למקם 0.09 מ של PDMS במרכז כל מערך פוסט וופל ממברנה. תן PDMS לשבת למשך תקופה מינימלית של 5 דקות כדי לאפשר PDMS להתפשט ברחבי ההצבות הנגדי של הממברנה.
הערה: אין להמשיך לשלב הבא עד לפחות 75% מערך פוסט מכוסה PDMS. האיכות של ממברנות משפר עוד PDMS מותרת עד לפתיל לאזור פוסט אז זמני ההמתנה ארוכים יותר בשלב זה הם העדיפו. - פלזמה מתייחסים רצועת פוליקרבונט בגיל 20 W עבור 45 s, O גז2 על mbar 0.80 במכונת פלזמה.
- הסר את גיליון פוליקרבונט המכונה פלזמה, להשתמש במספריים לחתוך את הסדינים פוליקרבונט לריבועים 45 מ"מ x 45 מ"מ.
הערה: למזער מגע עם הפלזמה השטח המטופל כדי למנוע אבק נדבקות פוליקרבונט. - בעדינות שכב בצד הפלזמה יחס הריבועים פוליקרבונט על גבי PDMS נוזלי שבמרכזה כשהפחד ממברנה. ודא את פוליקרבונט, PDMS את הקשר.
הערה: להימנע כיסי אוויר בין פוליקרבונט את PDMS. - מניחים את מרווח PDMS חתוכות מראש במרכז הכיכר פוליקרבונט.
- מקם את גיליון פוליקרבונט בעלי מרקם חתוכות מראש על הבלוק PDMS לשמור את מכלול של מליטה לצלחת דחיסה.
- הכנס את המגש כך מגש 3 הוא מאחור, מגש 2 הוא האמצעי, מגש 1 הוא במושב הקדמי. מגש 1 יש חריץ עבור יישור.
- פתח את שסתום הלחץ פלט, לאט לאט פתח את שסתום הלחץ קלט. רק אז סגור את שסתום הלחץ פלט.
הערה: זהו כך הפלט 4 ק ג של כוח מוחלת בהדרגה על כל וופל ממברנה בניגוד באופן מיידי, אשר עשוי לשבור את מוצרי קונדיטוריה. - . מפעילים את המתג מסלולי כ- ON להתחיל מחזור ריפוי לרפא וופל מתחת לגיל 4 ק ג (16 kPa) של דחיסה, מחזור טמפרטורה ramping המפורטים בטבלה1.
| שלב | טמפרטורה (° C) | משך הזמן (דקות) |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | . תחזיק |
טבלה 1 - ממברנה אשפרה תנאים
- סגור את השסתום לחץ קלט ופתח את שסתום הלחץ פלט לשחרור לחצים בין הגלילים אוויר.
- להסיר את המגשים ולהביא להם למינארי.
- לקלף בזהירות את מרקם פוליקרבונט, הסר בזהירות את מרווח PDMS.
הערה: צפה את מרווח PDMS כדי להבטיח שזה לא גם לקלף ההובלה פוליקרבונט, אם מצב זה מתרחש התחלה פילינג מפינה שונה.- לבדוק את הקרום PDMS דרך המוביל פוליקרבונט אזורים עם דרך חורים ולהשתמש סמן כדי לאתר את קווי המתאר של האזור דרך חור ולסמן כל החורים או פגמים בקרום.
- באמצעות וופל טיפול מלקחיים, שחרר ופלים מהמגש.
- הסר כל קרום כשהפחד ומניחים בצלחת פטרי.
הערה: קרום PDMS בטל עובש מן כשהפחד ממברנה ו להיות דבקה את פוליקרבונט מגבה. אם PDMS מתחיל ניתוק מנושאת המטוסים פוליקרבונט, לקלף מאזור אחר. - לאחסן ממברנות ומתקני ופלים פטרי לחץ חיובי ארון בטמפרטורת החדר.
5. ראש האסיפה והכנות
- באמצעות הקלטת מט, לנקות את הקרומים PDMS, כמו גם הקרביים של הפטרי להסיר את הלכלוך.
- ביסודיות להקליט את הצד תכונה של כל רכיב העליון כדי להסיר את הלכלוך.
- מקום הערוץ העליון חלק ("למעלה") תכונה בצד את צלחת פטרי עם קרום PDMS.
הערה: להיות מודעים כי ממברנות מסוימים עשויים לשמש אחד או שניים העליון חלקי בהתאם לגודל האזור שמיש. הערוצים העיקריים של כל חלק העליון צריך להתאים בתוך השטח המסומן של הקרום. - לטעון את צלחות פטרי לתוך המכונה פלזמה.
- פלזמה לטיפול קרום העליון בגיל 20 W עבור 45 s, O גז2 על 0.80 mbar.
- לאחר סיום מחזורי מליטה, להסיר את הכלים ואת נשכב החלקים מופעל תכונה בצד על גבי הקרום ולהבטיח חלק מאובזרות עם קרום עם אין בועות.
- למקם חלקים לתנור 60 מעלות צלזיוס במשך לפחות 2 h כדי anneal.
- באמצעות אזמל, מעקב בהיקף של למעלה מלוכדות להפרדת העליון-הממברנה הרכבה מנושאת המטוסים פוליקרבונט.
הערה: לא לחתוך את המוביל. - לאחר החלק נמצא במעקב, לקלף את מכלול מפוליקרבונט. קרום PDMS אשר מודבקת לחלק העליון צריך לקלף מנושאת המטוסים.
- באמצעות מלקחיים משופעת חדה, הסרת הקרום היציאות לגשת בערוץ התחתון והסר כל לכלוך או אבק עם מלקחיים תחת סטריאוסקופ.
הערה: אל תשאירו שום חלק קרום המכסה את יציאת גישה.
6. שבב הרכבה
- כוללים מקצה לקצה, פלזמה פינוק הרכבות עם רכיבים התחתון באמצעות התנאים בשלב 5.5.
- תחת מיקרוסקופ הפוכה, יישר את מכלול העליונים עם שקופיות מיקרוסקופ לתחתית חצי.
- מניחים בתנור 60 מעלות צלזיוס במשך שעתיים לפחות.
- שבב בקרת איכות הבדיקה
הערה: לשלם קרוב לב הנמלים העיקריים וערוץ של השבב. בדוק אם מצבי כשל לפי העין וגם מתחת למיקרוסקופ.- כדי לבדוק השבב מודבקת באופן מלא, tug קלות על כל פינה של השבב כדי לבדוק חלקים delaminating.
- תראו הערוץ של השבב כדי לבדוק אם קרום מקומט או נפול, אשר תופיע תבנית גלי או אפשרות סטיה קלה בערוץ.
- לבצע בדיקה במיקרוסקופ כדי לפקח על פסולת בתעלה המרכזית.
הערה: פסולת בתחומים שאינם קריטיים, כגון הערוצים ואקום מקובל. - עם שבב עדיין על המיקרוסקופ הפוכה, לבדוק את הערוץ העיקרי וערוצי ואקום עבור delamination.
הערה: Delamination באזורים שאינם קריטיים (למשל, הקצה של השבב) מקובל. - בדוק כי מיושרים הערוצים העיקריים בתוך 50-60 מיקרומטר (1-2 ממברנה נקבוביות).
הערה: חשוב כי הערוצים לא חופפות עם ערוצי ואקום. - בדוק כי קרום בין הערוצים העיקריים ואת הערוצים כניסת ולשקע הוא שלם ללא חורים נראית לעין.
הערה: כל חור הקרום יכול להוביל שבב דולף או צמיחת תאים מחוץ הערוצים.
- חנות שבבי פטרי לחץ חיובי ארון בטמפרטורת החדר.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
פרוטוקול המובאת כאן מתאר הזיוף מדרגי של שבבי איבר PDMS. מכשירים אלו מאפשרים תרבות של שני סוגי רקמות perfused ברורים על אלסטי נקבובי ממברנה (איור 1). הערוצים PDMS מושלך שימוש בתבניות מודפס 3D, אשר מאיצה שטנץ של עיצובים חדשים (איור 2A ו- 2B). ערוצי העליון נוצקו בתבניות תחת דחיסה נגד אטם פוליאוריתן תואם כדי לייצר רכיבים עם יציאות יצוק (איור 2C) בעוד לרכיבי ערוץ התחתון הם הטלת המגשים, שטופלו על שקופיות מיקרוסקופ גיבוי (איור דו-ממדי). גישה זו ייצור משלב המתבנת מידה מרובה החלקים לתוך צעד יחיד, אשר חוסך זמן משפר את הפארמצבטית, עקיבות, מפחית פסולת שנוצרו על-ידי היציאה ניקוב והשלבים חיתוך מרובים. הממברנות נקבובי הם קריטיים לתפקוד של השבב איברים, ואת הגישה פבריקציה נוספת המבוססת על השלכת נגד סיליקון בדוגמת תוצאות ממברנות של עובי אחיד וסיום השטח (איור 3). טיפול באמצעות נשאים פוליקרבונט מאפשר ייצור אצווה גדול ואחסון.
השבב איבר התאספו (איור 4) מורכב בשני ערוצים זלוף בחבילה שקוף אופטית. באזור חופפים, קרום PDMS נקבובי מאפשר אינטראקציה רקמות רקמות של מטבוליטים, חלבונים, הרפוי, פתוגנים ותאים כדי לסכם את תפקוד האיבר שבב בעוד שני ערוצים מקבילים משני צדדיו משמשים כדי לספק מכני זן באמצעות הופעה ואקום מחזורית. נקבוביות biomimetically הממברנה PDMS תומך השטף של מטבוליטים, גורמי גדילה ותאים אפילו בין parenchyma להערכת ו עוגב (איור 5). החדירות נראית לעין (Papp, ס"מ/s) של הקרום נקבע באמצעות ריכוז לצבוע בערוצים שקע עם ובלי Caco2 בטן תאים. הרבדים תא שבב בטן לספק מחסום חדירות מוגברת באופן משמעותי. השבב איבר יכול להיות actuated באמצעות ערוצי ואקום במקביל להחלת באופן כמותי, reproducibly זן מחזורי טעינה הקרום ולכן הרקמות בתרבית (איור 6). זן מחזורית זה בשילוב עם זלוף המדיה תומך התמיינות לחקות טוב יותר ויוו איברים פיזיולוגיה, כגון היווצרות villi בשבב הבטן.

איור 2 : ערוץ פבריקציה נוספת עם תלת-ממד מודפס בתבניות. איברים שבב חלקים מושלך נגד ברזולוציה גבוהה 3D מודפסים תבניות (A ו- B), המאפשר יותר עיצוב צדדיות ו שטנץ מאשר מסורתיים ליתוגרפיה רך. ערוץ עליון החלקים (ג) נרפאים תחת דחיסה ומבטל את הצורך על חבטות יציאות בחלקים המוגמר. כל יציקה triplicate הוא singulated עם חתך אחד. חלקים בערוץ התחתון (D) ממוקמים בשקופיות זכוכית כדי להקל על קלות השימוש ואת ההדמיה. גודל ברים הם כ-1 ס מ כל התמונות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3 : קרום PDMS נקבובי הוא יצוק באמצעות DRIE עם תבנית סיליקון. (א) עיבוד של 7 מיקרומטר, קוטר 50 מיקרומטר גבוה micropillars חרוט באמצעות DRIE לתוך רקיק סיליקון. (ב) PDMS נרפא על מערך זה מתחת לגיל 4 ק ג של דחיסה (16 kPa) ליצירת קרום עבה 50 מיקרומטר עם מערך של קוטר מיקרומטר 7 למרות חורים במרווחים hexagonally 40 µm בנפרד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : צילום של שבב איבר התאספו PDMS. צבע אדום ממלא את הערוץ הפסגה גדול יותר המשמש תאים parenchymal בזמן מדגיש צבע כחול בערוץ הבסיס משמש בדרך כלל עבור אנדותל כלי הדם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5 : חדירות של מעקב אינרטי מפל כחול דרך קרום PDMS נקבובי. אשד צבען כחול hydrazide בינוני לטעון לתוך התעלה העליונה של השבב איברים, perfused-µL 60/h למדידת השטף של לצבוע על פני הקרום לתוך הערוץ התחתון הכולל בינוני. צ'יפס ריק הושוו שבבי בטן עם תאים Caco2-BBe1 בערוץ הפסגה, כלי הדם אנדותל תאים אנושיים (HUVEC) בערוץ הבזליים תרבותי ל-6 ימים. קווי שגיאה מציינים את שגיאת התקן של הממוצע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6 : יישום של קרום המתח באמצעות ערוצי הצד ואקום. מגרש מציין זן ליניארי אפנון של הממברנה בתגובה לחץ ואקום יישומית. זן uniaxial מחזורית מוחל בצורה אחידה על האזור תרבות של השבב איברים באמצעות ואקום יישומית בערוצים מקבילים בצד. המתח בקורלציה באופן ליניארי עם הפחתת לחץ ואקום-כ-1% המתח על כל שינוי-10 kPa בלחץ ואקום (R2 = 0.992). קווי שגיאה מציינות סטיית התקן של הממוצע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
תוספת חומרים: אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
תהליך ייצור מסתמך על תבניות מודפסות תלת-ממד ברזולוציה גבוהה לתבנית PDMS העליון והתחתון שבב איבר גוף המרכיבים יחד עם ממברנות PDMS נקבובי micromolded. גישה ביקורתית זו נבחר בשל נוחות של שטנץ בשילוב עם המעבר מהיר לתוך המשנה את גודלו את ייצור והחלפה של אבזור. התבניות הרכיב העליון מיועדים ליציאות דפוס במיקומים מדויק עם פרופילים אנכי מוגדר במהלך השלב הליהוק. זה לא רק מונע העבודה מעורב באופן ידני ניקוב גישה יציאות אלא גם מפחית פסולת במקום העבודה, מאפשר יישור לשחזור יציאת ממשק יריעות או מכשור, ונוסף מייצרת חלקים עם שליטה על התאמה ואטימות אבובים או סיכות עבור חיבורים fluidic פנאומטי. התבניות מעורמים אחד על גבי השני ג'יג דחיסה, כשהם מופרדים באמצעות גליונות פוליאוריתן תואם כדי להקל על דרך חור הליהוק של יציאות. על-ידי סידור בערימה בכמה חלקים ג'יג יחיד, משתמש יחיד יכול להטיל כמויות גדולות של רכיבים להשלים עם יציאות בשלב אחד. בחירת חומרים וייצור שיטת התבניות הם קריטיים כדי לספק את הצורך תכונה ברזולוציה, חספוס פני שטח נמוכה, דרגה גבוהה של שטיחות התקן הרכבה ויישומים הדמיה עוקבות. Stereolithography יכול לעמוד בדרישות אלה, למרות חומרים עם טמפרטורות גבוהות סטיה (> 80 ° C), תאימות עם PDMS אשפרה לצמצם את הטווח פולימר זמינים. שרפים זמינים מסחרית שונים, כולל זכוכית מלא שרפים, עונים על קריטריונים אלה.
אלסטי PDMS נקבובי הוא ניתן לטעון המרכיב הקריטי וייחודי ביותר של שבב איברים בעת היותו מורכב מחומות. יון עמוק חורט (DRIE) תהליך במיקור חוץ ליצרן משמש microfabricate 50 x 50 מ מ משושה מערכים של עמודים (7 מיקרומטר קוטר 40 µm בנפרד, גבוה 50 מיקרומטר, C4נ8 מצופה) המשמשים דפוס נקבוביות ממברנה PDMS. האיכות של המערכים עמוד חיוני להשגת קרום חזקים הליהוק. בפרט, עמודי חייב להיות חרוט על טולרנסים הדוקים עם חלקה האנכי פרופילים כדי להימנע undercuts או חספוס sidewall מופרז יכול להוביל עובש כשל. צריך לקחת כדי למנוע "grassing" בחלק התחתון של האזור חרוט, אשר יכול להשפיע על הממברנה demolding וקובץ מצורף התא. ייצור קרום עם השילוב המתבנת והתקן דרך חור המוצלח הוא המקטע המורכבים ביותר יחיד של הפרוטוקול. אנושות, הצבת 0.09 מ של PDMS על כל פרוסת סיליקון המאפשר מספיק זמן בשביל זה להפיץ חיונית כדי למנוע לכייר דרך חור לא שלם. כראוי פלזמה בטיפול של פוליקרבונט גיבוי נדרש להשגת גיבוי חזקה של קרום demolding ו מליטה צעדים ללא קמטים או מתיחות. הגיבוי מספק אמצעים חזקים demolding קרום יצוק מן כשהפחד סיליקון שביר.
העומס compressive חלה על כל פרוסת סיליקון חיוני גם עבור ייצור דרך חור אחיד. המאמצים קודמת באמצעות משקולות הפריע ייצור קרום וכתוצאה התשואות עניים עקב חלוקת כוח לא אחידה. כדי להתגבר על צוואר הבקבוק הייצור, אנו ממוטב ממברנה שפורסמו בעבר פבריקציה נוספת פרוטוקול18 ובנה של אוטומטית ממברנה מפברק (אלירן לגזיאל) כדי parallelize את התהליך. מסלולי מורכב 24 בוכנות הידראוליות נתמך מעל צלחת חמה לתכנות לספק כוח compressive מבוקרת לאורך PDMS מתוכנתים תהליך ריפוי. פוליקרבונט גיבוי בסרט מושם על PDMS משומרים, ואז בצורה אחידה שנדחסו באמצעות בוכנות הידראוליות של אלירן לגזיאל תוך כדי להיות מחומם כדי פולימריזציה של PDMS. אנושות, ההדרגתית ריפוי התהליך המתואר בתוצאות פרוטוקול ממברנות באיכות גבוהה יותר מאשר צעד בודד טמפרטורה מקסימלית, איפה דפוסי ריכוך הנובע בועה פיתוח במהלך לריפוי תהליך נצפו. בעוד אופציונלי, מסלולי מגדיל את התפוקה באופן משמעותי מעבר מה אפשרי באמצעות משקולות בתוך תנור.
פתרון בעיות האסימונים איברים וכתוצאה מכך מתרחש בשני מישורים: במהלך תהליך ייצור ובמהלך איברים שבב תרבות. פיתחנו שיטה חזותית עבור אבטחת איכות (QA) של צורה דרך חורים בקרום יצוקה זה מאיץ את תהליך ייצור בזמן לשפר את האיכות והאמינות של שבבי איבר התאספו. שיטה זו QA מאפשרת תהליך פתרון בעיות, אנו ממליצים לשמור תיעוד של תהליך תנאים כדי לאפשר מעקב ייצור בעיות שעלולות להתרחש במהלך תרבית תאים. במהלך איברים שבב תרבות, מעקב אינרטי צבעי הן השיטה הפשוטה ביותר של מדידה מכשול פונקציה כדי לפתור בעיות בתהליך ייצור וסלולרי תרבות צעדים. לוציפר הצהוב שימש היסטורית בשל המסה המולקולרית קטן שלה פלורסצנטיות מולדת, אך מפל כחול מציעה מאפיינים דומים עם ספקטרום הפליטה צר יותר, סביר פחות להתערב עם מבחני במורד הזרם. מולקולות גדולות יותר, כגון פולי-ethyleneglycol (PEG)- או fluorophores מצומדת לתוספי גדולים, כתוצאה מכך לגרום חדירות נמוכה יותר באופן כללי, להוריד את הרגישות. החדירות נראית לעין (Papp, ס"מ/s) של צבעי מעקב יכול לשמש כדי לקבוע מכשול תכונות הפונקציה של איברים או רקמות (איור 4). המשוואה הבאה יכול לשמש כדי לחשב Papp בין מינון ערוץ ערוץ המקבל, נגזרת משוואות המשמש בעיקר Transwell מחקרים19,20 ומתקנת לירידה לצבוע מעקב נגרמת על ידי ספיגתו PDMS על-ידי השוואת על תזרימי פלט שני לא סמכו על מאזן מסה הנחות-זרימה החוצה.

Vr הוא אמצעי ב mL של קבלת ערוץ למטעי לאחר זמן t; וי זה נפח מיליליטר למסקנות ערוץ מינון לאחר זמן t; A הוא האזור של קרום דרך חורים באזור ס מ2 (0.167 ס מ2 עבור התקן זה); t הוא הזמן של אוסף קולחים בשניות; Cr הוא השינוי נמדד ריכוז לצבוע מעקב בלמסקנות ערוץ המקבל; תקליטור הוא נמדד ריכוז לצבוע מעקב בלמסקנות ערוץ מינון. מפתח הנחות עבור המשוואה הזו תהיה חוקית כוללים: מעקב קבוע 1) לצבוע את ריכוז מינון במשך זמן t, 2) את הריכוז של Cr הוא קטן בהשוואה ל- Cd, 3) את החדירות של המערכת מופץ בצורה אחידה ברחבי האזור תרבות. למרות המשוואה הזו יכולה לשמש עבור מערכות סטטיות, חייבים להקפיד לבדוק ההנחות נכונה. שיטות חשמל, כולל ההתנגדות החשמלית הטרנס-אפיתל (TEER) מיושמים כלל במחקרים Transwell, לאחרונה שולב PDMS צ'יפס איברים עבור מכשול מיידי, רציף פונקציית המידות גם21 ,22.
מגבלות של פרוטוקול זה כוללים את האלסטיות של PDMS, כמו גם את הליהוק והרכבה תהליך ידני אשר מגביל את קצב ייצור. PDMS הוא פולימר רב-תכליתי זה הוא מתאים היטב עבור שבבי איברים הדורשים מאמץ מכני הופעה, אבל את האלסטיות שלו יכול לעכב את הייצור. חלקים יכול להיות קשה לטפל ללא דפורמציה ודורשים ממברנות גיבוי סרטים עבור מניפולציה. כתוצאה מכך, אוטומציה לייצור השבב איבר יכול להיות מוגבל. תהליך הליהוק, בניגוד הטבעה חמה או הזרקת פלסטיק המשמשים פולימרים תרמופלסטיים, הוא מבוסס-אצווה, ולכן גם מגביל את התפוקה.
איברים שבבי מאפשרים מחקרים במבחנה של האדם איברים, גוף-ברמת פונקציות ויוו מאת פרפוזיה מדיום משותף דרך הערוצים כלי הדם. מאת לשחזר רקמות רקמות פיזיולוגיים ממשקים, השטף של מולקולות בין תאים parenchymal של כלי הדם, רמזים מכני, ו הטיה fluidic התחבורה, התקנים אלה לקדם את histodifferentiation ולא מסוגלים recapitulating אין ויוו-אוהב את הפונקציות של איברים נורמלי וחולים. מידור של רקמות ונוזלים ב שני תאים מחקה הפונקציות שלהם ויוו ולאחר לימודי אורגן שבב נתונות זמן לפתור ניסויים פרמוקוקינטיים ו דוגמנות, כמו גם בתוך חוץ גופית-ויוו אקסטרפולציה9,10 זה קשה או בלתי אפשרי בערוץ בודד MPS14,15,16. ניתן למנף את המבנים microchannel עבור יישומים אחרים, לרבות חקר את ההשפעה של חשיפה עשן טבק דינמי עם דו-כיווני לינשום אפיתל דרכי הנשימה קטן האנושית לפתח הרומן סמנים ביולוגיים של נזק ריאות23. המיקומים המוגדרים של הממברנות מישורי ובהירות גבוהה אופטי של ההתקנים להפוך אותם באופן ייחודי מתאים מבוססת תמונה ניתוחים ושילוב של חיישנים מוטבעים. גירוי מכאני מופעל על-ידי משולב ערוצי ואקום ומספק חומרים אלסטומריים פונקציות לא אפשרי במערכות Transwell. הראו כי מאמץ מכני חיונית עבור החוק הביוגנטי של ויוו פיזיולוגיים פונקציות מסוימות, לרבות ספיגת ננו-חלקיק ריאות4, בצקת ריאות3 , הבידול של בוגרים שב ס-derived podocytes glomerular8.
יישומים עתידיים של פרוטוקול זה עשוי לכלול שילוב של שיטות חישה שונות, יכול לשמש כדי לספק קריאות בזמן אמת של איברים שבב תגובה לגירויים כגון תרופות, רעלים, או קרינה. אפשרות להאריך את פרוטוקול המובאת כאן לחומרים שאינם-PDMS עם מאפיינים אופטיים, מכאני וכימי שונים, כולל חומרים מתכלים. פרוטוקול איברים שבב המובאת כאן צריך לאפשר לחוקרים לפברק התקנים המציעים רמה גבוהה של שליטה microenvironment של pathophysiologic ובריאה רקמות ואיברים, אשר עלולים לשמש מנוף לפיתוח טיפוליות, כולל המטרה גילוי, רעילות, הערכות פרמוקוקינטיים, כמו גם באשר רפואה אישית.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. הוא מייסד מחזיק הון עצמי Emulate, inc., ו כיסאות שלה המדעית המייעצת. ג'יי. פי היא כיום אחת העובדים שאמרתי Emulate, inc. ווי. סי, ג'יי. פי, D.E.I. הם ממציאים על קניין רוחני זה מותקן ברשיון כדי Emulate, inc.
Acknowledgments
אנו מודים רוסו מ ו ס קרול לעזרה עם צילום, צילום וידאו, מסיה אינגרם, ג'יי נגוין, שיאה ד ש ון תרומתו פיתוח פרוטוקול ייצור ראשוני. מחקר זה היה בחסות מכון Wyss ביולוגית בהשראת הנדסה באוניברסיטת הרווארד, את ההגנה מתקדם הסוכנות למחקרי תחת הסכמי שיתופי #W911NF-12-2-0036 ו- #W911NF-16-C-0050 ולהעניק ה-FDA # HHSF223201310079C, NIH מעניקה #R01-EB020004 ו- #UG3-HL141797-01, ביל ומלינדה גייטס מעניקה #OPP1163237 ו- #OPP1173198 DEI. מנופים ומסקנות הכלולים במסמך זה הם אלה של המחברים, אין לפרש כמייצג את המדיניות הרשמית, גם בין מפורשת ובין משתמעת, של הסוכנות האמריקאית לפרויקטי מחקר מתקדמים ההגנה, המזון והתרופות האמריקאי, המכונים הלאומיים לבריאות, או ממשלת ארה ב.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
בביו-הנדסה בעיה 140 איברים-על-שבב מערכת microphysiological microfluidic מיקרו-מלאכותית PDMS נקבובי ממברנה microchannel זן מחזורית זלוףErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
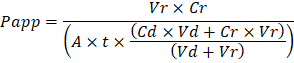
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
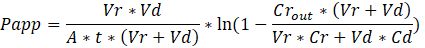
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



