Summary
该协议描述插管成年斑马鱼与生物;然后对肠道进行解剖和制备, 用于细胞术、共焦显微镜和 qPCR。这种方法允许管理生物活性化合物, 以监测肠道摄取和局部免疫刺激诱发。对口腔预防手段的肠道动态检测有重要意义。
Abstract
大多数病原体通过其粘膜侵入生物体。这种情况在鱼类中尤其如此, 因为它们不断地接触到微生物丰富的水环境。开发有效的方法来口服免疫增强剂或疫苗, 激活免疫系统, 以抵御传染性疾病, 是非常可取的。在设计预防性工具时, 需要有良好的实验模型来测试其性能。在这里, 我们展示了一个成人斑马鱼口服插管的方法和一套程序, 以解剖和准备肠道的细胞术, 共焦显微镜和定量聚合酶链反应 (qPCR) 分析。通过这项协议, 我们可以精确地管理多达50µL 的鱼量, 它能简单快速地重约1克, 而不会伤害动物。通过这种方法, 我们可以探讨肠道粘膜对荧光标记化合物的直接体内吸收, 以及这种生物制剂在插管后局部部位的免疫调节能力。通过对肠道组织的流式细胞仪、组织学、qPCR 和共聚焦显微术等下游方法的结合, 我们可以了解免疫增强剂或疫苗如何能够跨越肠道粘膜屏障, 通过固有的层层, 并到达肌肉, 对肠道粘膜免疫系统产生影响。该模型可用于测试候选口服预防手段和分娩系统或任何口服生物活性化合物的局部效果。
Introduction
本文的目的是深入描述一种直接的方法, 对斑马鱼的口服插管, 连同有用的相关下游程序。使用斑马鱼进行口服插管已成为研究传染病动力学、口服疫苗/immunostimulant、药物/纳米微粒的摄取和功效以及肠道黏膜免疫的一个实用模型。例如, 斑马鱼口服插管已用于研究marinum 分枝杆菌和peregrinum 杆菌感染1。Lovmo等。还成功地利用该模型将纳米粒子和m marinum到成年斑马鱼2的胃肠道。此外, 陈等人使用斑马鱼口服插管, 以表明药物封装的纳米颗粒, 当通过胃肠道管理, 被运送到血脑屏障3。这些作者根据弗兰克·科利莫尔等gauvage 方法进行插管。4与一些修改。然而, 他们没有提供一个非常详细的协议描述口服插管程序。在这里, 我们提出了一个成人斑马鱼在弗兰克·科利莫尔等的口服插管方法。4我们还包括用细胞术、共焦显微镜和 qPCR 为相关下游分析准备肠道。
肠道和特别它的黏膜是第一行防御传染和营养素吸收的主要站点5。当粘膜屏障内的上皮细胞和抗原呈现细胞觉察到危险信号时, 就会触发直接的先天免疫反应。其次, 高度特异的自适应免疫应答是由 T 和 B 淋巴细胞6,7建立的。口服疫苗的研制是目前疫苗的一个重点领域。由于粘膜相关淋巴组织 (麦芽)8、9中的免疫细胞的特定反应, 这种疫苗将是保护暴露部位生物体的有效工具。在水产养殖中, 与注射疫苗相比, 黏膜疫苗具有明显的优势。它们对于大规模的疫苗接种是切实可行的, 较少劳动密集型, 对鱼的压力较小, 可以对幼鱼进行管理。然而, 黏膜疫苗候选者必须达到第二肠道部分, 而不变性的口腔环境。它们还必须穿过粘膜屏障, 以便获得抗原呈现细胞 (apc), 以诱导局部和/或系统性反应10。因此, 在口服疫苗的研制中, 对候选口服抗原及其运载系统所获得的粘膜吸收以及诱发的免疫应答的检测是必不可少的。
在生物医学的背景下, 建立一个模型来测试化合物在口服插管后的生物效应, 这是越来越多的兴趣。许多的解剖和生理特征的肠道是保守之间的 bilaterian 血统, 与哺乳动物和骨鱼类11。这种口服插管模型连接到下游分析可以是一个工具, 以提供对人类生物学的洞察力, 以及生物制剂或其他化合物在体内的测试场地。
口服插管协议可以由一个操作员执行,例如, 成功地管理多达50µL 的蛋白纳米颗粒悬浮到鱼重1克, 具有较高的存活率。该程序设置简单, 快速;30条鱼可以在1小时内插管。肠道准备的协议是提供质量细胞和组织样本的关键, 以供后续分析。给出了下游结果的例子, 表明该协议在获取与肠道摄取有关的数据和分离 qPCR 质量 RNA 方面是有用的。该协议将是非常有用的那些需要一个合适的模型来测试口腔预防手段或其他化合物在肠道的动态。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
所有涉及斑马鱼 (斑马斑马) 的实验程序均由巴塞罗那大学 Autònoma 道德委员会 (CEEH 号 1582) 授权, 与有关动物研究的国际指导原则达成一致 (欧盟 2010/63)。所有的活斑马鱼的实验都是在26–28°c 进行的。
1. 准备口服插管设备
- 在31克鲁尔锁针上放置大约1厘米的细硅胶管以覆盖针尖。
- 切10µL 无菌过滤器针尖 (约2厘米), 采取更精细的一端, 并把它放在硅胶管作为鞘。确保吸管延伸到针的尖端之外, 以免伤害动物。
- 将针头连接到100µL 鲁尔锁注射器。
注: 总是用乙醇冲洗, 然后磷酸盐缓冲盐水 (PBS, 看材料) 彻底之间的治疗。
2. 所需解决办法
- 准备150毫克/升 (麻醉) 或300毫克/升 (安乐死) 的乙基 3-氨基苯甲酸甲基磺酸 (MS-222) 溶液与水从水族馆的斑马鱼保持。用1升的麻醉剂溶液填充一个小罐, 并保持它的充气。
- 用1升的水族水填充另一个小水箱, 不 MS-222 鱼的回收, 并保持它的充气。
- 从10x 无菌库存溶液中制作50毫升 1x PBS。
- 对于细胞分析/肠道细胞隔离, 准备足够新鲜的0.15% 胶原酶 IV 型溶液1毫升每鱼从一个库存溶液或从粉末 Dulbecco 的改良鹰培养基 (DMEM) 与1% 伏/v 青霉素和链霉素 (见材料)。使整除数 (每条鱼 1) 的1毫升在2毫升离心管。保持在4摄氏度, 直到30分钟的解剖步骤。
- 为共焦显微术/样品固定, 准备50毫升新鲜4% 多聚甲醛 (粉煤灰) 溶液在 PBS 或解冻的股票解决方案从-20 °c 冰箱的油烟机。
注意: 粉煤灰是有毒的。在使用之前, 请先阅读材料安全数据表。手套和安全眼镜应佩戴, 并始终留在通风罩内的解决方案。
3. 制备荧光纳米微粒悬浮液
- 根据制造商的说明, 将蛋白纳米粒与 Atto-488 NHS 酯 (见材料表) 或适当的荧光染料贴上标签。
- 并用重悬在0.1 米碳酸氢钠缓冲液中的纳米粒子, 浓度为2毫克/毫升。
- 在2毫克/毫升的无胺二甲基亚砜 (亚砜) 中溶解阿托 488 NHS 酯。保持整除10µL 检查标签效率 (步骤 3.7–3.8)。
- 混合纳米粒子和阿托 488 NHS 酯在摩尔比 1:2 (蛋白质: 染料) 通过搅拌在黑暗中。
- 在室温下以 8000 x g为10分钟, 将所标记的纳米粒子向下旋转, 取出上清, 并保持它检查标签效率 (步骤 3.7–3.8)。
- 用涡流和吹打上下 resuspending 1 毫升0.1 米碳酸氢钠缓冲液中的标记纳米粒子。然后在室温下离心 8000 x g , 以10分钟的温度, 将上清液丢弃。重复步骤 3.6 5 次。
- 并用重悬在15毫升离心管中的5毫升0.1 米碳酸氢钠缓冲颗粒, 并在1.5 毫升离心管 (30 整除数) 中制成荧光纳米粒子的整除数。在室温下, 在 8000 x g处旋转10分钟, 丢弃上清, 并保存在-80 摄氏度的保护下免受光线的侵害。
-
使用 microvolume 分光光度计测量标签效率。
- 采取1µL 的原始阿托488溶液保持从步骤 3.3, 并进一步稀释它在亚砜 (例如, 1:20 根据体积比)。这是用于获得蛋白质纳米粒子和阿托488混合在步骤3.4 的摩尔比率的体积。
- 从步骤3.5 中的标签反应中取1µL 保存的上清液。测量吸收 (abs) 在 = 501 毫微米。标签的百分比为:
(
- 在实验之前, 用 1x PBS 溶液制备所需浓度的纳米粒子悬浮液。
4. 斑马鱼麻醉和口服插管
- 快速鱼 (> 0.5 g) 至少48小时在实验之前清空肚腑。
- 在实验前一晚将鱼 (12 条鱼) 移动到实验罐 (6 升), 允许驯化12。
- 将纳米微粒溶液涡旋 (例如, 2500 rpm 和三十年代), 并将所需的纳米粒子悬浮量 (如20–50µL) 绘制到附着在受保护针头上的注射器中。
- 将鱼放在加气的150毫克/升 MS-222 溶液中 (见第2节), 直到它们沉到罐底, 不响应尾翅夹;这个过程需要少于5分钟。
- 将被麻醉的鱼用网快速转移到湿塑料托盘上, 将动物水平定位到针头上, 立即开始口服插管。
- 用一只手小心地支撑鱼, 用另一只手张开嘴巴, 用保护针。轻轻地将针插入食道, 从口开口约1厘米。
注意: 当吸管尖端的末端通过鳃时, 操作者可能会感到轻微的阻力。注意不要把针进入太多, 可能穿孔鳃。 - 慢慢地将纳米颗粒悬浮在鱼上。确保悬浮液不会通过鳃或嘴向外流动。
- 轻轻地取出针头, 将鱼放进回收箱 (见2节)。恢复通常需要1分钟以内。
- 仔细检查鱼是否有任何异常 (例如, 鳃出血是穿孔的标志)。
- 一旦鱼恢复了, 把它们送回实验舱。
5. 斑马鱼肠道解剖
- 在指定的一段时间后插管 (例如, 5 小时和/或24小时), 将鱼用网放入300毫克/升 MS-222 溶液中安乐死 (见2节)。确保笼盖停止移动, 没有尾部捏反射。五分钟通常是足够的。
- 用网捡起安乐死的动物, 把它放在滤纸上。
注: 过滤纸对于去除肠道的粘附组织非常有用。 - 使用锋利的解剖剪刀, 用细镊子从肛门到笼盖切开切口。切开肠道的两端, 取出所有内脏, 放在滤纸上。
注意: 快速工作以减少细胞新陈代谢和死亡。
注: 或者, 去除 PBS 和冰上的粘附组织。 - 将肠道与内脏分开, 确保保持其方向 (前肠段) 并伸展。通常, 肠道前段比后段宽。解剖时要注意获得所有的肠道。
注意: 后端是相当精细和脆弱的小鱼, 并可能脱落, 特别是在动物 < 0.7 克。 - 用镊子在滤纸上卷上小肠, 以便从肠道中分离粘附组织。
- 着手为各种下游分析 (6、7和8节) 准备肠道。
6. 为细胞术制备肠道细胞
- 提前准备整除数0.15% 胶原酶溶液 (见2.4 节)。
注: 整除数应在室温下继续进行。 - 可选: 从步骤5.5 继续, 切开肠道纵向和洗涤 1x PBS。
- 使用镊子, 放置在2毫升离心管填充0.15% 胶原酶溶液的肠道。
- 在黑暗的室温下, 将管子放在垂直的实验室转子上1小时。
- 将肠道放置在100µm 细胞过滤器上, 50 毫升离心管支持。用5毫升注射器柱塞分离肠道, 用 1x PBS 洗涤3次, 在50毫升离心管中采集样品流。
- 离心机50毫升离心管在 400 x g 10 分钟, 在4摄氏度。
- 小心地把大部分上清液吸走, 同时不失去细胞, 其中一些可能与粘液有关。
- 并用重悬在离心管底部的肠道细胞与500µL 的 1x PBS 和保持在冰上, 直到细胞仪分析
- 通过30µm 细胞过滤器将样品过滤成5毫升的圆底管用于细胞术。
- 设置在细胞仪设备上的参数 (例如,用于分析的单元数、感兴趣的区域、电压和补偿、检测器的选择) (见材料)。
- 根据使用说明13, 立即对细胞仪进行分析。
7. 制备肠 Cryosections 共聚焦显微术
- 用最佳切削温度 (O.C.T.) 化合物填充塑料模具 (见材料表) 到半卷。
- 继续从步骤5.5 和解剖后立即, 小心地放置在塑料模具肠道。确保肠道完全嵌入 O.C.T. 化合物中。如有必要, 在塑料模具中加入更多的 O.C.T. 化合物。
注: 建议将肠道与 "Z" 形状在 O.C.T. 化合物, 以方便地遵循其自然方向。 - 把塑料模具放在干冰上, 直到它不透明 (不到一分钟)。
- 使用以下程序立即将塑料模具存放在-80 摄氏度, 以便长期使用或加工。
注意: 协议可以在这里暂停。 - 将冷冻肠道切成10µm 切片或适当厚度, 使用恒温器-20 摄氏度。
- 在幻灯片上用细刷子收集肠道部分。
- 在室温下浸泡4% 粉煤灰中的滑块15分钟以修复样品。
注意: 粉煤灰是有毒的。在使用之前, 请先阅读材料安全数据表。手套和安全眼镜应佩戴, 并始终留在通风罩内的解决方案。 - 用 1x PBS 清洗幻灯片3次, 每张10分钟。
- 添加一滴安装介质, 并将盖玻片在试样上。
注意: 协议可以在这里暂停。 - 用适当的放大倍数观察共焦显微镜下的样品。
8. 实时 qPCR (RT-qPCR) 的肠道准备
- 继续从步骤 5.5, 把肠道在一个低温小瓶, 迅速冻结肠道在液氮和储存在-80 °c, 直到使用。
注意: 协议可以在这里暂停。 - 为均匀化, 添加200µL 2% (v/v) 冷冻 1-Thioglycerol/均质溶液 (见材料表) 或替代均质溶液的肠道样品。
- 快速工作, 融汇在冰上的肠道样品与实验室均质体高速 (设置在 25–30,000 rpm), 直到没有可见的组织碎片保持。3次为 5 s 通常是充足的。
- 根据制造商的说明14或适当的替代方法, 使用商业套件 (见材料表) 隔离 RNA。根据需要, 将 RNA 储存在-80 摄氏度, 以便长期使用。
注意: 协议可以在这里暂停。 - 使用分光光度计15对 rna 浓度进行量化, 并使用 rna 分析仪16对质量进行评估。
- 根据制造商的指示, 使用 cdna 合成试剂盒准备1µg 或适当数量的 cdna。
注意: 协议可以在这里暂停。对于 qPCR 分析, 请遵循 MIQE 准则17。 - 为感兴趣的基因设计合适的底漆对。
- 选择合适的参考基因, 并通过 qPCR 检测系统分析每个基因的表达 (见材料)。
注: 例如, 添加5µL 的 SYBR 绿色 supermix, 0.5 µM 底漆, 2.5 µL 的稀释 cDNA 和1.5 µL 的水在最后量10µL 为每个井的 qPCR 板。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
斑马鱼 (平均重量: 1.03, 0.16 克) 混合性被成功地插管与不同的重组蛋白纳米粒子 (细菌包涵体) 使用我们自制的口服插管装置 (图 1)。我们成功地进行了口服插管, 并取得了较低的平均死亡率 (6.8%)(表 1)。斑马鱼要么插管与30µL 或50µL 的纳米颗粒悬浮, 死亡率计算在 24 h 后插管。实验由两名操作员进行, R 在斑马鱼口服插管方面的经验比 J 少。结果表明, 即使是一个新的操作者, 也可以独立进行口服插管实验, 并且通过该协议很容易达到较高的生存率。从我们的经验来看, 鱼的最佳尺寸是1克, 但我们已经成功地将鱼插管到0.5 克小。
为了更好地了解荧光纳米粒子 IBsTNFα (重组细胞因子蛋白纳米结构为包涵体) 是否被我们的方法交付给斑马鱼, 并采取了斑马鱼的肠道或没有, 我们进行了细胞术分析。纳米微粒 (100 µg/鱼, 50 µL) 和 PBS (控制) 口服 (经插管), 以斑马鱼和肠道解剖 5 h 和 24 h 后插管。步骤6制备了肠道总细胞, 并通过检测荧光发射信号进行分析。图 2显示了荧光强度的代表性直方图和荧光细胞百分比的点块。纳米微粒插管组荧光细胞密度明显高于 5 h 和 24 h 的对照组 (图 2A)。在 5 h (46.3%) 和 24 h (43.0%) 的纳米微粒插管组中, 荧光细胞的百分比显著高于 (图 2B)。
为了进一步研究在纳米微粒吸收中, 肠道层的哪一部分参与, 我们进行了共焦显微分析。纳米微粒 (20 µg/鱼, 50 µL) 和 PBS (控制) 被口头插管到斑马鱼和肠道被解剖 5 h 后插管。根据步骤 7 (图 3a), 用冷冻组织法制备肠道切片。图 3B显示了肠道中荧光纳米粒子的共焦图像。荧光纳米粒子被发现在斑马鱼肠道。我们观察了上皮细胞、固有层和肌肉细胞的荧光。
为了验证我们的协议是否可以提取高质量的 rna, 我们分析了从肠道提取的 rna 与 bioanalyzer (也称为 rna 分析仪)。斑马鱼用 PBS (50 µL) 或纳米微粒 (20 µg/鱼, 50 µL) 口服插管。对肠道进行解剖, 以提取 24 h 后插管的 RNA。我们选择了七个 RNA 样本来测试分析仪。我们发现, 所有被测试的 rna 样本都有高 rna 完整性的数字, 从7.9 到 8.9 (图 4)。
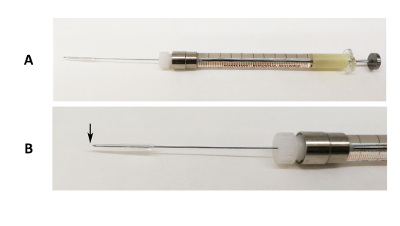
图 1:口服插管装置.(a) 31 克鲁尔锁针的图像, 固定在100µL 注射器上, 硅管和吸管尖端端盖在针的尖端。(B) 针头部分的放大图像。黑色箭头指示吸管尖端末端超过针尖的位置。请单击此处查看此图的较大版本.

图 2:斑马鱼肠道荧光纳米粒子流式细胞仪分析通过口服插管.斑马鱼以 PBS 或荧光 IBsTNFα (100 µg) 分别治疗5小时和24小时。(A) 荧光强度的代表性直方图。(B) 荧光细胞百分比点图。每个绿点代表一个个体的荧光细胞的百分比, n ≥4。数据代表平均值的标准误差 (SEM)。采用单向方差分析法对差异进行了研究。控制方面的显著差异 (**, p < 0.01)请单击此处查看此图的较大版本.

图 3: 图像共焦显微分析.用 PBS 或20µg/鱼荧光纳米粒子对鱼进行口服插管。肠道被解剖 5 h 后插管。(A) 在 OCT 化合物中嵌入斑马鱼肠道。肠道被放置与自然方向的 "Z" 形状 (a: 前端; p: 后端)。(B) 斑马鱼肠道的共焦显微图像。白色箭头表明, 荧光纳米粒子在肠道粘膜中占去。请单击此处查看此图的较大版本.

图 4: rna 分析仪虚拟凝胶图像, 显示从7斑马鱼肠道取样后插管提取 rna。样本数1和2是 PBS 插管组和样本数3至7是纳米微粒插管组。RNA 完整性数字 (玲) 在底部从7.9 到8.9 被给。请单击此处查看此图的较大版本.
| 算子 | 体积 | # 鱼插管 | 平均重量 (g) |
# 死亡 | 死亡率 (%) |
| R | 30µL | 22 | 0.88 @ 0.14 | 3 | 13。6 |
| R | 30µL | 17 | 0.93 @ 0.19 | 0 | 0 |
| J | 50µL | 19 | 1.23 @ 0.31 | 1 | 5。2 |
| J | 50µL | 30 | 1.08 @ 0.40 | 2 | 6。6 |
| 总 | 88 | 1.03 @ 0.16 | 6 | 6。8 | |
| SD: 平均值的标准偏差 | |||||
表 1:两名经营者使用该议定书所造成的斑马鱼死亡率的比较.显示了操作员识别码、插管量、鱼数和鱼平均重量 (克)。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
本协议是对先前描述的弗兰克·科利莫尔的口服插管技术的改进. 4我们的协议详细描述了口服插管方法, 包括为下游分析准备肠道。我们的方法提高了鱼的操作速度, 使得一个人能够快速执行整个协议, 而操作者之间没有太大的变化。我们的协议与前一项的主要区别是, 我们评估一个口服插管实验的成功, 不仅是观察动物的福祉 (如没有出血), 并没有泄漏的液体管理, 但也通过检查利用下游分析 (细胞术、共焦显微镜和 qPCR) 对肠道中生物活性纳米颗粒的吸收。我们表明, 在肠道中发现了标记为纳米粒子的插管荧光。
在实际的方面, 插管设备便宜, 精确, 可重用: 基本设备是由一个可重用的100µL 玻璃 (如汉密尔顿) 注射器耦合到一个31克针与一块硅在顶部。切割不育尖端被放置在硅管上, 可以为每个单独的管理改变。注射器是可重用的, 并且稀薄的针允许插管小鱼以成功的高可能性。此外, 切不育尖端可以直接放置在针没有硅管, 使插管设备更容易在实验室制造。所管理的生物活性化合物是明显可见的, 正确的管理可以很容易地监测。插管过程中的一个关键步骤是针头进入。重要的是, 针不倾斜或插入太多, 以避免穿孔的鳃。用这种方法观察到的死亡率很低 (大约 7%), 并且取决于鱼的大小。鳃穿孔是鱼类死亡的最常见原因, 在第一个小时内鱼会死亡。虽然0.5 克鱼可以很容易插管的最佳的鱼大小是大约1克。另一种不同的方法, 由弗兰克·科利莫尔等。是, 鱼禁食48小时, 以确保胃肠道是空的。整个插管过程可以做得非常快 (30 动物/小时) 由一个操作员和重要地, 方法是一致的在不同的操作员4之间。插管法易于学习, 不需要多练习才能掌握。
肠道解剖程序必须正确执行, 以获得良好的质量样本的细胞术, 共焦和 qPCR 分析。此时的关键步骤是整个肠道的解剖;后段易碎, 易失。一旦肠道被解剖, 它可以进一步处理的细胞术 (2 h 协议), qPCR 分析 (2 小时的协议, 直到总 RNA 隔离) 或共焦显微镜 (1 小时的样本准备 cryosection)。保持肠道的方位, 特别是共焦显微镜是非常重要的。细胞分析需要快速处理, 在完成前不能停止。而为 cryosection 准备的 RNA 分离和样品可以在任何时候得到适当的储存和处理。对于细胞术, 质量好的样品无杂物结块, 机器可以用这种方法隔离, 快速分析荧光细胞的存在可以很容易地对个体进行。rna 质量监测表明, 高质量的 rna 可以从肠道分离, 允许 qPCR 分析单个鱼类。最后, 共焦显微镜的 cryosection 准备提供了有关蛋白质纳米粒子摄取的重要结构信息。因此, 我们的方法提供了一个模型, 以测试口腔预防手段或其他化合物在肠道的动态。
我们的研究的局限性是鱼的大小, 因为我们没有测试在小于0.5 克的鱼的管理和使用化学麻醉剂来使动物镇静。一些作者使用冷水 (0–4°c) 麻醉斑马鱼18 , 但在动物福利和欧洲法律约束的背景下, 我们决定 MS-222 是选择的方法。
斑马鱼提供了许多优势比其他模型系统, 包括一套完整的基因数据和可用的转基因线。对于位免疫学家, 转基因线 (如 Tg mpx: GFP和tg mpeg1:GFP) 为体内观察免疫细胞 (如巨噬菌和中性粒细胞19,20) 设置了一个场景。结合我们的口服插管和下游分析与转基因线, 可能是理想的识别细胞类型的吸收, 运输和处理的口服疫苗, 纳米颗粒和病原体的鱼。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
提交人声明, 没有竞争的利益存在。
Acknowledgments
这项工作得到西班牙科学部、欧洲委员会和 AGAUR 基金提供的赠款的支持 (AGL2015-65129-R MINECO/菲德和 2014 sgr-345 AGAUR)。RT 持有来自 AGAUR (西班牙) 的博士预科奖学金, JJ 得到了中国奖学金理事会 (中国) 博士奖学金的支持, NR 由拉蒙 y Cajal 计划 (RYC-2010-06210, 2010, MINECO) 支持。我们感谢 Torrealba 博士在蛋白质生产方面的专家建议, n. 芭巴从 "Servei de Microscopia" 和 m. 哥斯达黎加博士, 从 Servei Citometria de 巴塞罗那的 "大学 de Autònoma" 得到了有益的技术援助。
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




