Summary
생물 학적;와 intubating 성인 zebrafish를 프로토콜에 설명 합니다. 그리고 해 부 cytometry, confocal 현미경 검사 법 및 정량에 대 한 소장을 준비 합니다. 이 메서드는 관리를 장의 글귀와 로컬 면역 자극을 갖는 생리 활성 화합물의 수 있습니다. 그것은 구두 prophylactics의 장 역학 테스트 관련이 있습니다.
Abstract
대부분 병원 체 유기 체 그들의 점 막을 통해 침입 한다. 이것은 생선에 특히 사실 그들은 지속적으로 미생물이 풍부한 물 환경에 노출 되는. Immunostimulants 또는 백신, 전염 성 질병에 대 한 면역 시스템을 활성화 하는 구두 납품을 위한 효과적인 방법을 개발 하는 것이 매우 바람직하다입니다. 예방 도구를 고안, 좋은 실험 모델의 성능을 테스트 필요 합니다. 여기, 우리는 성인 zebrafish의 구강 삽 관 법에 대 한 방법 및 해 부 cytometry, confocal 현미경 검사 법 및 정량적 중 합 효소 연쇄 반응 (정량) 분석에 대 한 소장을 준비 하는 절차의 집합을 보여줍니다. 이 프로토콜, 우리가 정확 하 게 동물을 해치지 않고 약 1 g을 간단 하 고 신속 하 게, 무게 물고기 50 µ L까지 볼륨을 관리할 수 있습니다. 이 방법은 삽 관 법 후 장 점 막 및 로컬 사이트에 같은 생물 의약품의 immunomodulatory 용량 붙일 이라는 화합물의 직접 vivo에서 이해를 탐험 수 있습니다. 장 조직의 confocal 현미경 검사 법, 정량, 조직학, cytometry 등 다운스트림 메서드를 결합해 서, 우리는 immunostimulants 또는 예방 접종 수 있는 방법을 장 점 막 방 벽을 교차, 통과 lamina propria 이해할 수 있다 고 장내 점 막 면역 시스템에 효과 발휘 하는 근육에 도달 합니다. 모델 후보 구두 prophylactics 및 전달 시스템 또는 로컬 효과 있는 구두 관리 생리 활성 화합물의 테스트 사용 될 수 있습니다.
Introduction
이 문서의 목표는 깊이에 유용한 연결 된 다운스트림 절차 함께 zebrafish의 구강 삽 관 법에 대 한 간단한 방법 설명. 제 브라를 사용 하 여 구강 삽 관 법의 전염병 역학, 구강 백신/immunostimulant, 마약/나노 통풍 관 및 효능, 장내 점 막 면역 연구에 실용적인 모델 되고있다. 예를 들어 zebrafish 구강 삽 관 법 진 균 marinum 고 진 균 peregrinum 감염1의 연구에 사용 되었습니다. Lovmo 외. 또한 나노 입자 및 M. marinum 는 위장 지역 성인 zebrafish2를 제공을 성공적으로이 모델을 사용. 첸 외. 마약, 나노 입자에 의해 캡슐화 보여 zebrafish 구강 삽 관 법을 사용 하는 또한 때 관리를 통해 위장 관의 혈액 두뇌 방 벽3에서 수송 되었다. 이 저자 수행 Collymore 그 외 여러분 에 의해 설명 하는 gauvage 방법에 따라 삽 관 법 몇 가지 수정 4 . 그러나, 그들은 구두 삽 관 법 절차를 설명 하는 매우 상세한 프로토콜을 제공 하지 않았다. 여기, 우리 Collymore 외 에 성인 zebrafish의 구강 삽 관 법에 대 한 방법 제시 4 우리는 더 cytometry, confocal 현미경 검사 법 및 정량 소장 관련 다운스트림 분석에 대 한 준비 포함.
소장 및 특히 그것의 점 막 감염에 대 한 방어의 첫 번째 라인 및 양분 통풍 관5의 주 사이트입니다. 상피 세포와 점 막 장벽 내에서 항 원 제시 세포 위험 신호 인식 때 즉시 타고 난 면역 반응은 트리거됩니다. 다음으로, 매우 구체적인 적합 한 면역 반응 T와 B 림프 톨6,7으로 설정 됩니다. 구강 백신의 개발 백신에 현재 초점 지역 이다. 이러한 백신 노출된 사이트 점 막 관련 림프 조직 (맥 아)8,9에 면역 세포의 특정 응답 때문에 유기 체를 보호 하기 위해 효과적인 도구 것입니다. 양식, 점 막 백신 주사 백신에 비해 분명 장점이 있다. 그들은 보다 적게 노동 집약 대량 예방 접종에 대 한 실용적, 물고기, 보다 적게 스트레스가 많은 있으며 젊은 물고기를 관리할 수 있습니다. 그럼에도 불구 하 고, 점 막 백신 후보자 없이 구강 환경에서 변성 되 고 두 번째 직감 세그먼트를 도달 해야 한다. 그들은 또한 항 원 제시 세포 (Apc) 로컬 및/또는 조직의 응답10유도 하에 액세스 점 막 방 벽을 교차 해야 합니다. 따라서, 후보 구두 항 원 및 그들의 배달 시스템을 함으로써 점 막 통풍 관의 테스트, 갖는, 면역 반응 뿐만 아니라에 필수적입니다 구강 백신의 개발.
생물 의학 맥락에서 후 구강 삽 관 법은 성장 관심사의 이다 화합물의 생물 학적 효과 테스트 하는 모델을 개발. 내장의 해 부 및 생리 기능의 많은 포유류와 나폴레옹 물고기11bilaterian 계보 사이 보존 됩니다. 다운스트림 분석에 연결 하는이 구두 삽 관 법 모델 생물 의약품에 대 한 테스트 땅 뿐 아니라 인간의 생물학으로 통찰력을 제공 하는 도구 일 수 있다 또는 다른 비보에화합물.
구강 삽 관 법 프로토콜 성공적으로 물고기는 높은 생존 율과 무게 1 g, 단백질 나노 입자 현 탁 액의 최대 50 µ L를 관리 예를 들어, 하나의 연산자에 의해 수행할 수 있습니다. 절차는 간단 설정 하 고 빠른; 1 시간에 30 물고기를 intubated 수 있습니다. 내장 준비를 위한 프로토콜은 후속 분석을 위한 질 세포 및 조직 샘플을 제공 하는 열쇠입니다. 다운스트림 결과의 예는 장 통풍 관에 관련 된 데이터를 취득 및 정량에 대 한 품질 RNA 격리 프로토콜의 유용성을 표시 하는 주어진 다. 프로토콜 내장에서 구두 prophylactics의 역학 또는 다른 화합물을 테스트 하는 적합 한 모델을 필요 들을 잘 사용 될 것 이다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Zebrafish (Danio rerio)를 포함 하는 모든 실험 절차 연구와 관련 된 동물 (국제 원칙와 Universitat Autònoma de 바르셀로나 (CEEH 수 1582)의 윤리 위원회에 의해 승인 되었다 EU 2010/63). 라이브 zebrafish 모든 실험 26-28 ° c.에 수행 되었다
1. 구강 삽 관 법에 대 한 장비 준비
- 31 G Luer 잠금 바늘 바늘 팁을 커버 하기에 좋은 실리콘 튜브의 대략 1 cm를 놓습니다.
- 컷 10 µ L 살 균 필터 피 펫 팁 (약 2cm), 미세한 끝과 칼 집으로 실리콘 튜브 위에 그것을 배치. 피펫으로 확장 부상 동물을 피하기 위해 바늘의 끝 다는 것을 확인 하십시오.
- 100 µ L Luer 잠금 주사기 바늘을 연결 합니다.
참고: 항상 에탄올으로 씻어 고 다음 인산 염 버퍼 (PBS, 자료를 참조) 치료 사이의 철저 하 게.
2입니다. 솔루션 필요
- 150 mg/L (마 취) 또는 300 mg/L (안락사)는 zebrafish 유지는 수족관에서 물과 에틸 3-aminobenzoate methanesulfonate (MS-222) 솔루션의 준비. 마 취 솔루션의 1 리터와 작은 탱크를 화난 그것을 유지.
- 물고기 복구에 대 한 MS-222 없이 수족관 물 1 리터와 함께 또 다른 작은 탱크를 화난 그것을 유지.
- 살 균 재고 솔루션 x 10에서 1 x PBS의 50 mL를 확인 합니다.
- Cytometry 분석/장내 세포 격리에 대 한 1 %v / v 페니실린과 스 (자료 참조)와 함께 물고기 재고 솔루션 또는 Dulbecco의 수정된이 글 매체 (DMEM) 분말 당 1 ml 충분 한 신선한 0.15% 콜라 유형 IV 솔루션을 준비 합니다. 2 mL 원심 분리기 튜브에 aliquots (물고기 당 1) 1 ml를 확인 합니다. 해 부 단계 전에 30 분까지 4 ° C에서 유지.
- Confocal 현미경 검사 법/샘플 고정, 50 mL PBS에 신선한 4 %paraformaldehyde (PFA) 솔루션의 준비 또는 재고 솔루션 증기 두건에서-20 ° C 냉장고에서 해 동.
주의: PFA 독성이 있다. 그것으로 작업 하기 전에 물질 안전 데이터 시트를 읽어 보시기 바랍니다. 장갑, 안전 안경 착용 해야 하 고 항상 증기 두건 내부 솔루션을 떠나.
3. 준비 형광 나노 서 스 펜 션
- Atto 488 NHS 에스테 르 단백질 나노 레이블 ( 테이블의 자료를 참조) 또는 제조업체의 지침에 따라 적절 한 형광 성 염료.
- 2 mg/mL의 농도에서 0.1 M 탄산 버퍼에는 나노 입자를 resuspend.
- 2 mg/mL에 디 메 틸 아민 무료 sulfoxide (DMSO)에 거 488 NHS 에스테 르 분해. 라벨 효율 (3.7-3.8 단계)을 확인 하는 10 µ L의 약 수를 유지 합니다.
- 어둠 속에서 감동으로는 나노 입자와 1:2 (단백질: 염료)의 어 금 니 비율에서 Atto 488 NHS 에스테 르를 혼합.
- 실 온에서 10 분 동안 8000 x g 에서 원심 분리 하 여 레이블이 지정 된 나노 입자를 회전 시키십시오, 제거는 상쾌한 고 라벨 효율 (3.7-3.8 단계)을 확인 하.
- Vortexing 및 아래로 pipetting으로 1 mL의 0.1 M 탄산 버퍼에 resuspending에 의해 레이블이 지정 된 나노 입자를 씻어. 다음 실 온에서 10 분 동안 8000 x g 에서 원심 분리 하 여는 상쾌한을 삭제 합니다. 5 회 3.6 단계를 반복 합니다.
- 15 mL 원심 분리기 튜브에 0.1 M 탄산 버퍼의 5 mL에 펠 릿을 resuspend 하 고 aliquots 형광 나노 입자의 1.5 mL 원심 분리기 튜브 (30 aliquots). 실 온에서 10 분 동안 8000 x g 에 아래로 회전, 삭제는 상쾌한 고 빛 으로부터 보호-80 ° C에 저장 합니다.
-
Microvolume 분 광 광도 계를 사용 하 여 라벨 효율성을 측정 합니다.
- 원래 거 488 솔루션 단계 3.3에서에서 유지의 1 µ L을 추가 (예를 들어, 볼륨 비율에 따라 1시 20분) DMSO에 희석. 이것은 단계 3.4에서 단백질 나노 입자와 거 488 믹스의 어 금 니 비율을 얻을 하는 데 사용 하는 볼륨입니다.
- 3.5 단계에서 라벨 반응에서 저장 된 상쾌한의 1 µ L를 가져가 라. 흡수 (abs) 측정 = 501 nm. 라벨의 백분율은:
(
- 실험 전에 나노 서 스 펜 션 1 x PBS 솔루션을 사용 하 여 원하는 농도에서 준비 합니다.
4. 제 브라 Anesthetization 및 구강 삽 관 법
- 빠른 물고기 (> 0.5 g) 이상 48 h 소장을 실험 하기 전에.
- 하룻밤 순응12수 있도록 실험 전에 실험 탱크 (6 패) 물고기 (12 생선)을 이동 합니다.
- 회오리 잘 나노 솔루션 (예: 2500 rpm 및 30 s) 보호 바늘에 연결 된 주사기에 원하는 양의 나노 서 스 펜 션 (예를 들어, 20-50 µ L)를 그립니다.
- 화난된 150 mg/L MS에서에서 장소 물고기-222 솔루션 (섹션 2 참조) 그들은 탱크의 바닥에 가라앉을 때까지 꼬리 핀치;에 응답 하지 않는 이 과정에는 5 분 미만 걸립니다.
- 신속 하 게 젖은 플라스틱 쟁반에 그물과 마 취 물고기를 전송, 바늘 얼굴과 구강 삽 관 법을 즉시 시작 하 가로 동물을 찾으시는.
- 조심 스럽게 한 손으로 물고기를 지원 하 고 보호 된 바늘을 사용 하 여 다른 손으로 입을 열어. 부드럽게 열고 입에서 약 1 cm 식도 아래로 바늘을 삽입 합니다.
참고: 연산자는 피 펫 팁의 끝은 길 통과 하는 때 약간의 저항을 느낄 수 있습니다. 알아서 하지 각도 아가미 구멍 수 있습니다 너무 많은 바늘 항목. - 천천히 물고기를 나노 입자 현 탁 액을 주입. 정지 아가미 또는 입을 통해 밖으로 흐름 하지 않습니다 다는 것을 확인 하십시오.
- 부드럽게 바늘을 제거 하 고 복구 탱크 (섹션 2 참조)에 물고기를 놓습니다. 복구는 일반적으로 1 분 이내 소요 됩니다.
- 신중 하 게 어떤 이상에 대 한 물고기를 확인 하십시오 (예를 들어, 아가미에 출혈 구멍 뚫 기의 표시 이다).
- 일단 물고기, 회복 실험 탱크에 그들을 반환 합니다.
5. 제 브라 내장 해 부
- 지정 된 기간 후 게시 삽 관 법 (예를 들어, 5 h / 24 h), 장소 300 mg/L MS에 그물을 사용 하 여 물고기-안락사 (섹션 2 참조)에 대 한 222 솔루션. operculum 이동 중지 하 고 아무 꼬리 핀치 반사는 다는 것을 확인 하십시오. 5 분은 일반적으로 충분 합니다.
- 그물을 가진 안락사 동물을 선택 하 고 필터 종이에 그것을 배치.
참고: 필터 종이 소장을 따라 접착제 조직을 제거에 대 한 매우 유용 합니다. - 날카로운 해 부가 위를 사용 하는 operculum에 항문에서 세미 원형 절 개 및 오픈 절 개 괜 찮 핀셋을 사용 하 여 확인 합니다. 내장의 양쪽 끝을 잘라, 모든 내부 장기를 꺼내와 필터 종이에 그들을 배치.
주의: 세포 대사와 죽음을 줄이기 위해 신속 하 게 작동 합니다.
참고: 또는, PBS에 얼음에 접착제 조직을 제거 합니다. - (앞쪽 후부 장 세그먼트) 방향을 유지 하 고 그것을 밖으로 기지개 하는 내부 장기에서 내장을 분리 합니다. 일반적으로, 내장의 앞쪽 세그먼트는 후부 세그먼트 보다 넓은. 내장의 모든 해 부 할 때를 돌 봐.
참고: 후부 끝은 아주 작은 물고기에 연약한 고 끊다 수 있습니다, 특히 동물에서에서 < 0.7 g. - 소장에서 접착제 조직 분리 하기 위해 핀셋으로 필터 종이에 소장 롤.
- 다양 한 다운스트림 분석 (섹션 6, 7, 8)에 대 한 소장을 준비를 진행 합니다.
6. Cytometry 장 세포 준비
- 0.15% 콜라 솔루션 (섹션 2.4 참조)의 aliquots 사전에 준비 합니다.
참고: 계속 하기 전에 실내 온도에 Aliquots 이어야 한다. - 옵션: 단계 5.5에서에서 계속, 슬릿 오픈 소장 경도 하 고 1x PBS로 세척.
- 핀셋을 사용 하 여, 0.15% 콜라 솔루션으로 가득 2 mL 원심 분리기 튜브에 내장을 놓습니다.
- 어둠 속에서 실 온에서 1 h에 대 한 수직 실험실 회전자에 튜브를 놓습니다.
- 100 µ m 셀 거르는 50 mL 원심 분리기 튜브 지원에 소장을 놓습니다. 50 mL 원심 분리기 튜브에 샘플을 통해 흐름을 수집 1 x PBS로 3 번 세척 5 mL 주사기 플런저와 소장을 휴식.
- 4 ° c.에서 10 분, 400 x g 에서 50 mL 원심 분리기 튜브 원심
- 신중 하 게 일부는 점액에 연결 될 수 있습니다, 셀을 잃지 않는 하는 동안 상쾌한의 대부분에서 피 펫.
- Resuspend 1 x PBS의 500 µ L 원심 분리기 튜브의 하단에 장 세포와 cytometry 분석까지 얼음에 계속
- 5 mL로 30 µ m 셀 필터를 통해 필터 샘플 하단 튜브 cytometry에 대 한 라운드.
- 매개 변수 (예를 들어, 분석에 대 한 셀의 수, 관심 지역, 전압 보상, 검출기의 선택) cytometer 장비에 설정 (자료 참조).
- 즉시 분석에 사용13의 지침에 따라는 cytometer 세포.
7. Confocal 현미경 검사 법에 대 한 내장 Cryosections 준비
- 플라스틱 몰드 채우기 ( 재료의 표참조) 절반 볼륨 최적의 절삭 온도 (O.C.T.) 화합물.
- 신중 하 게 장소 단계 5.5에서에서 해 부 후에 즉시 계속, 플라스틱 형 소장. 내장은 완전히 O.C.T. 화합물에서 포함 된 다는 것을 확인 하십시오. 필요한 경우, 플라스틱 형에 더 O.C.T. 화합물을 추가 합니다.
참고: 그것은 쉽게 자연 방향을 따라 복합 O.C.T.에 "Z" 모양으로 소장을 배치 하 고 좋습니다. - (1 분 미만) 불투명가 될 때까지 드라이 아이스에 플라스틱 금형을 놓습니다.
- 장기간 사용 하거나 즉시 다음 절차를 사용 하 여 프로세스에 대 한-80 ° C에서 플라스틱 금형을 저장 합니다.
참고: 프로토콜 수 수 일시 중지 여기. - 10 µ m 섹션 또는-20 ° c.에 있는 cryostat를 사용 하 여 적절 한 간격으로 냉동된 내장 슬라이스
- 슬라이드에 좋은 브러쉬 내장 섹션을 수집 합니다.
- 4%에서 슬라이드를 담가 PFA 실 온에서 15 분에 대 한 예제를 해결 하기 위해.
주의: PFA 독성이 있다. 그것으로 작업 하기 전에 물질 안전 데이터 시트를 읽어 보시기 바랍니다. 장갑, 안전 안경 착용 해야 하 고 항상 증기 두건 내부 솔루션을 떠나. - 슬라이드 1 x PBS, 10 분으로 3 회 씻는 다.
- 설치 매체의 한 방울을 추가 하 고 장소는 coverslip 표본.
참고: 프로토콜 수 수 일시 중지 여기. - 적절 한 배율에 confocal 현미경 샘플을 관찰 합니다.
8. 실시간 정량 pcr (RT-정량) 소장 준비
- 단계 5.5에서에서 계속, 극저온 유리병에 내장을 넣어 하 고 빠르게 사용까지 액체 질소와-80 ° C에 게 소장을 동결.
참고: 프로토콜 수 수 일시 중지 여기. - 균질, 추가 200 µ L 2% (v/v)의 냉장 1-Thioglycerol/균질 솔루션 ( 재료의 표참조) 또는 대체 균질 솔루션 내장 샘플을.
- 신속 하 게 작업, 얼음에 내장 샘플 균질 아니 보이는 조직까지 (25-30000 rpm 설정) 빠른 속도로 실험실 균질 화기 파편 남아 있다. 5를 3 번 s 일반적으로 충분 하다.
- 상업을 사용 하 여 RNA를 분리 ( 재료의 표참조) 키트 제조 업체의 지침14 또는 적당 한 다른 방법. 필요에 따라 장기간 사용-80 ° C에서 RNA를 저장 합니다.
참고: 프로토콜 수 수 일시 중지 여기. - 15 분 광 광도 계 사용 하 여 RNA 농도 계량 하 고 RNA 분석기16를 사용 하 여 품질을 평가 합니다.
- 1 µ g 또는 제조업체의 지침에 따라 cDNA 합성 키트를 사용 하 여 cDNA의 적절 한 금액을 준비 합니다.
참고: 프로토콜 수 수 일시 중지 여기. 정량 분석을 위한 MIQE 지침17을 따르시기 바랍니다. - 관심사의 유전자/s에 대 한 적절 한 뇌관 쌍을 디자인 합니다.
- 적합 한 참조 유전자를 선택 하 고 실시간 정량 검출에 의해 각 유전자의 표현 분석 상업을 사용 하 여 시스템 키트 (자료 참조).
참고: 예를 들어 정량 플레이트의 각 잘 10 µ L의 최종 볼륨에서 SYBR 녹색 supermix의 5 µ L, 0.5 µ M 뇌관, 희석된 cDNA의 2.5 µ L 및 1.5 µ L의 물 추가 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
제 브라 (중량 평균: 1.03 ± 0.16 g) 혼합 섹스 했다 성공적으로 intubated 다른 재조합 단백질 나노 입자 (세균 포함 시체)가 우리 집에서 만든 구강 삽 관 법 장치 (그림 1)를 사용 하 여 함께. 우리는 성공 구강 삽 관 법을 수행 하 고 낮은 평균 비율 사망률 (6.8%) (표 1)입니다. Zebrafish 되었고 중 intubated 30 µ L 또는 나노 입자 현 탁 액의 50 µ L 사망률 24 h 게시물 삽 관 법 내에서 산출 되었다. 실험 두 연산자에 의해 수행 되었다, R 작업 제이 보다 zebrafish 구강 삽 관 법을 덜 경험을 했다 심지어 새로운 연산자 독립적으로 수행할 수 없는 구강 삽 관 법을 보여준 결과 실험 쉽게이 프로토콜에 의해 높은 생존 율을 달성. 우리의 경험에서 최적의 물고기 크기 1 g, 하지만 우리는 성공적으로 intubated 0.5 g으로 작은 물고기.
이해 하 고 더 나은 형광 나노 입자 IBsTNFα (재조합 사이토카인 단백질 nanostructured 포함 시체로) zebrafish에 우리의 방법에 의해 전달 되었고 안 zebrafish 창 자에 의해 채택 여부, cytometry 수행 분석입니다. 나노 입자 (100 µ g/물고기, 50 µ L)와 PBS (제어) 제 브라를 (삽 관 법)에 의해 구두로 관리 되었다 소장 5h와 24 시간 게시물 삽 관 법에는 해 부 했다. 총 장 세포 단계 6에서 준비 하 고 형광 방출 신호를 감지 하 여 분석 했다. 형광 강도의 대표적인 히스토그램과 형광 세포 비율의 점 플롯 그림 2에 표시 됩니다. 형광 세포의 밀도 5 h에 24 h (그림 2A) 컨트롤 그룹에 비해 나노 intubated 그룹에 명확 하 게 높다. 5 h (46.3%)에 24 h (43.0%) 나노 intubated 그룹 (그림 2B)의 형광 세포의 비율이 상당히 높다.
더 연구는 장 레이어 부분을 나노 통풍 관에 참여, 우리 confocal 현미경 분석 수행. 나노 입자 (20 µ g/물고기, 50 µ L)와 PBS (제어) 했다 구두로 intubated zebrafish 하 고 소장 5 h 게시물 삽 관 법에는 해 부 했다. 내장 섹션 7 (그림 3A) 단계에 따라 냉동된 조직 방법에 의해 준비 되었다. 소장에서 형광 나노 입자의 공초점 이미지 그림 3B에 나와 있습니다. 형광 나노 입자 zebrafish 소장에서 발견 됐다. Lamina propria, 상피 세포, 근육 세포에 형광을 관찰합니다.
우리가 우리의 프로토콜에 의해 고품질의 RNA를 추출할 수 있는지 여부를 확인 하려면 우리는 bioanalyzer (RNA 분석기 여기 라고도 함)와 창 자에서 추출한 RNA를 분석 했다. Zebrafish 했다 intubated 구두로 PBS와 (50 µ L) 또는 나노 입자 (20 µ g/물고기, 50 µ L). 창 자가 24 시간 게시물 삽 관 법에서 RNA 추출에 대 한 해 부 했다. 우리는 7 개의 RNA 샘플 테스트 분석기를 선택. 우리는 모든 시험된 RNA 샘플 7.9에서 8.9 (그림 4)에 이르는 높은 RNA 무결성 숫자는 발견.
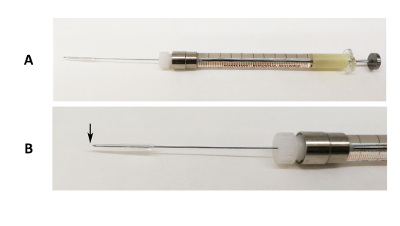
그림 1 : 구강 삽 관 법 장치. (A) 실리콘 튜브 및 피 펫 팁 끝이 바늘의 끝을 덮고 100 µ L 주사기에 고정 31 G Luer 잠금 바늘의 이미지. (B) 바늘 부분의 확대 이미지. 검은색 화살표 피 펫 팁 끝 바늘의 끝을 초과 하는 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : Cytometry 분석 zebrafish 내장에서 형광 나노 입자의 흐름 통해 구강 삽 관 법. Zebrafish는 PBS 또는 형광 IBsTNFα 로 치료 했다 (100 µ g) 5h와 24 시간, 각각. (A) 형광 강도의 대표 히스토그램. (B) 점 형광 세포 비율의 그래프를 플롯합니다. 각 녹색 점은 하나의 개별, n ≥4 형광 세포의 비율을 나타냅니다. 데이터는 의미 (SEM)의 평균 ± 표준 오차를 나타냅니다. 차이점은 단방향 ANOVA를 사용 하 여 분석 되었다. 컨트롤에 대해 상당한 차이 (* *, p < 0.01) 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 이미지 confocal 현미경 분석. 생선은 구두로 intubated PBS 또는 20 µ g/물고기 형광 나노 입자. 내장 5 h 게시물 삽 관 법에는 해 부 했다. (A) 10 월 화합물에 포함 된 Zebrafish 소장. 소장 "Z" 모양 (a: 앞쪽 끝; p: 후부 끝)의 자연 스러운 방향으로 배치 했다. 제 브라 내장의 (B) 공초점 현미경 이미지. 흰색 화살표 표시는 형광 나노 입자는 장 점 막에서 채택. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : RNA 분석기 가상 젤 이미지 7 zebrafish 창 자에서 추출한 RNA 샘플 게시물 삽 관 법. 샘플 숫자 1과 2는 PBS intubated 그룹 되며 샘플 번호 3 7 나노 intubated 그룹. RNA 무결성 번호 (린)는 7.9에서 8.9까지 하단에 제공 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 연산자 | 볼륨 | # 생선 intubated | 평균 체중 (g ± SD) |
# 죽음 | 사망률 (%) |
| R | 30 Μ L | 22 | 0.88 ± 0.14 | 3 | 13.6 |
| R | 30 Μ L | 17 | 0.93 ± 0.19 | 0 | 0 |
| J | 50 Μ L | 19 | 1.23 ± 0.31 | 1 | 5.2 |
| J | 50 Μ L | 30 | 1.08 ± 0.40 | 2 | 6.6 |
| 총 | 88 | 1.03 ± 0.16 | 6 | 6.8 | |
| SD: 표준 편차 평균 | |||||
표 1: 프로토콜을 사용 하 여 두 연산자에 의해 발생 하는 제 브라 사망률의 비교. 연산자 식별 코드, intubated 볼륨, 물고기 수와 물고기 평균 무게 그램 (g)에 표시 됩니다.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
이 프로토콜은 Collymore 그 외 여러분 에 의해 구강 삽 관 법에 대 한 앞에서 설명한 방법의 개선 4 우리의 프로토콜 구강 삽 관 법 방법 자세히 설명 하 고 다운스트림 분석에 대 한 내장의 준비를 포함 한다. 우리의 방법은 사업자 사이 많은 변화 없이 빠르게, 전체 프로토콜을 수행 하는 한 사람을 허용 하는 물고기 조작 속도를 향상 시킵니다. 우리의 이전 프로토콜의 주요 차이점은 우리 복지에 대 한 동물의 관찰에 의해 뿐만 아니라 구강 삽 관 법 실험의 성공을 평가 하는 (예를 들어, 아무 출혈)와 확인 하 여 뿐만 아니라 관리, 액체의 누설에 대 한 다운스트림 분석 (cytometry, confocal 현미경 검사 법 및 정량)를 사용 하 여 대 장의 생리 활성 나노의 이해. 우리는 intubated 붙일 레이블된 나노 입자 소장에서 발견 된 것을 보여줍니다.
실용적인 측면에서 삽 관 법 장비는 저렴 한, 정확 하 고 재사용: 기본 장치 (예를 들어, 해밀턴)는 재사용 가능한 100 µ L 유리로 만들어진 주사기 31 G 바늘 위에 실리콘의 조각와 함께 결합. 잘라 멸 균 팁 실리콘 튜브 위에 배치 되 고 각 개별 관리에 대 한 변경 될 수 있습니다. 주사기 재사용, 이며 얇은 바늘 성공의 높은 가능성과 작은 물고기를 intubating 수 있습니다. 또한, 컷된 불 임 팁 실리콘 튜브 삽 관 법 장비를 쉽게 실험실에서 만들어질 수 있는 없이 바늘에 직접 배치 수 있습니다. 관리 생리 활성 화합물이 명확 하 게 표시 하 고 올바른 관리를 쉽게 모니터링할 수 있습니다. 삽 관 법 절차 중 중요 한 단계는 바늘 항목. 바늘 기울이면 또는 아가미를 꿰뚫기를 피하기 위해 너무 많이 삽입 하지는 중요 하다.입니다. 이 방법으로 관찰 하는 사망은 매우 낮은 (약 7%)와 물고기의 크기에 따라 달라 집니다. 아가미 구멍 뚫 기 및 첫 번째 시간 내 물고기 다 일어나면 물고기 죽음의 가장 일반적인 원인입니다. 0.5 g의 물고기를 쉽게 intubated 수 최적의 물고기 크기는 약 1 g. Collymore 그 외 여러분 에 의해 개발 된 방법으로 다른 차이 물고기는 위장이 비어 해야 48 h에 대 한 금식은 이다.입니다. 모든 삽 관 법 절차를 매우 신속 하 게 할 수 있는 (30 동물/h) 중요 한, 그리고 하나의 연산자에 의해 방법은 다른 연산자4사이 일관 된. 삽 관 법 방법 배우기 쉽습니다 그리고 마스터 많은 연습을 필요로 하지 않습니다.
Cytometry, confocal 및 정량 분석에 대 한 좋은 품질의 샘플을 얻기 위해 내장 해 부 절차를 제대로 수행 되어야 합니다. 중요 한 단계는이 시점에서 전체 내장;의 해 부는 후부 섹션에는 취약 하며 쉽게 잃을 수입니다. 일단 소장 해 부, cytometry (2 h 프로토콜), 정량 분석 (총 RNA 격리까지 2 h 프로토콜) 또는 confocal 현미경 검사 법 (샘플 cryosection에 대 한 준비를 1 시간)에 대 한 추가 처리할 수 있습니다. 그것은 매우 특히 confocal 현미경 검사 법에 대 한 내장의 방향을 추적 하는 것이 중요입니다. Cytometry 분석이 빠른 처리, 그리고 절차는 완료 되기 전에 중지할 수 없습니다. 반면, RNA 격리 및 예제 cryosection를 제대로 저장 하 고 언제 든 지 처리 수에 대 한 준비. Cytometry, 파편 기계 응집 없이 좋은 품질 샘플이이 방법으로 격리 될 수 있습니다 및 형광 세포의 존재에 대 한 빠른 분석 개인에 쉽게 수행할 수 있습니다. RNA 품질 모니터링 보여주었다 고품질 RNA 정량 개별 생선의 내장 수 있도록 분석에서 격리할 수 있습니다. 마지막으로, confocal 현미경 검사 법에 대 한 cryosection 준비 단백질 나노 입자 도입에 대 한 중요 한 구조 정보를 제공합니다. 우리의 방법을 따라서 소장에서 구두 prophylactics의 역학 또는 다른 화합물을 테스트 하는 모델을 제공 합니다.
우리의 연구의 한계는 물고기의 크기 때문에 우리가 0.5 g 및 동물을 진정 하는 화학 마 취의 사용 보다는 더 작은 물고기에 관리를 시험 하지 않았다. 몇몇 저자 사용 냉 수 (0-4 ° C) zebrafish18 anesthetize를 그러나 동물 복지 및 유럽 법적 제약의 맥락에서 우리가 MS-222 방법의 선택은 결정 했다.
Zebrafish는 유전자 데이터와 사용 가능한 유전자 변형 라인의 완전 한 세트를 포함 하 여 다른 모델 시스템에 비해 많은 장점을 제공 합니다. Immunologists, 유전자 변형 선 (예: Tg mpx:GFP 및 Tg mpeg1:GFP) 대 식 세포와 호 중구19,20등 면역 세포의 생체 내에서 관찰에 대 한 장면을 설정합니다. 우리의 구강 삽 관 법 및 다운스트림 분석 유전자 변형 라인에 결합 해야 통풍 관, 관련 된 세포 유형 식별에 대 한 운송 및 구강 백신, 나노 입자 및 물고기에 있는 병원 체의 처리.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 아무 경쟁 관심사 존재 선언 합니다.
Acknowledgments
이 작품은 유럽 위원회와 AGAUR 자금 (AGL2015-65129-R MINECO/페더 및 2014SGR-345 AGAUR) NR 과학, 스페인 정부에서 교부 금에 의해 지원 되었다. RT는 AGAUR (스페인), JJ에서에서 전 박사 장학금 중국 장학금 위원회 (중국)에서 박사 학위 장학금에 의해 지원 되었다와 NR 라몬 y Cajal 프로그램 (RYC-2010-06210, 2010, MINECO)에 의해 지원 됩니다 보유 하고있다. 우리는 단백질 생산, "룸 드 Microscopia"에서 명 Barba 전문가 조언에 감사 박사 Torrealba와 Universitat Autònoma 드 바르셀로나 유용한 기술 지원의 "룸 드 Citometria"에서 닥터 엠 코스타.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




