Summary
Le protocole décrit intubating poisson-zèbre adulte avec un produit biologique ; puis dissection et la préparation de l’intestin pour la cytométrie en flux, microscopie confocale et qPCR. Cette méthode permet à l’administration de composés bioactifs pour surveiller l’absorption intestinale et la stimulation immunitaire locale évoquée. Il est utile pour tester la dynamique intestinale de la prophylaxie par voie orale.
Abstract
Plupart des agents pathogènes envahissent les organismes par l’intermédiaire de leur muqueuse. Cela est particulièrement vrai chez les poissons, car ils sont exposés en permanence à un environnement microbien riches en eau. Développer des méthodes efficaces pour l’administration orale d’immunostimulants ou de vaccins, qui activent le système immunitaire contre les maladies infectieuses, est hautement souhaitable. Dans l’élaboration des outils prophylactiques, bons modèles expérimentaux sont nécessaires pour tester leurs performances. Ici, nous montrons une méthode pour l’intubation orale du poisson-zèbre adulte et un ensemble de procédures de disséquer et de préparer l’intestin pour la cytométrie en flux, microscopie confocale et analyse la réaction en chaîne (qPCR) polymérase quantitative. Avec ce protocole, nous pouvons administrer précisément les volumes jusqu'à 50 µL de pêcher pesant environ 1 g simplement et rapidement, sans nuire aux animaux. Cette méthode permet d’explorer l’absorption directe in vivo des composés fluorescents marqués par la muqueuse intestinale et la capacité immunomodulatrice de tels produits biologiques sur le site local après intubation. En combinant des méthodes en aval comme la cytométrie en flux, histologie, qPCR et microscopie confocale du tissu intestinal, nous pouvons comprendre comment immunostimulants ou vaccins sont capables de traverser les barrières muqueuses intestinales, passent par la lamina propria, et atteindre le muscle, exerçant un effet sur le système immunitaire des muqueuses intestinal. Le modèle pourrait servir à tester la prophylaxie orale de candidat et de vecteurs ou de l’effet local de tous les composés bioactifs administré par voie orale.
Introduction
L’objectif de cet article est de décrire en détail une méthode simple pour l’intubation orale du poisson-zèbre, ainsi que des procédures en aval connexes utiles. Intubation orale à l’aide de poisson-zèbre est devenu un modèle de pratique dans l’étude de la dynamique des maladies infectieuses, vaccin oral/immunostimulant, absorption de drogues/NANOPARTICULE et efficacité et immunité muqueuse intestinale. Par exemple, le poisson zèbre intubation orale a été utilisée dans l’étude de l’infection à Mycobacterium marinum et Mycobacterium peregrinum 1. Lovmo et al. également utilisé avec succès ce modèle pour livrer des nanoparticules et M. marinum vers le tractus gastro-intestinal du poisson-zèbre adulte2. En outre, Chen et coll. utilisé zebrafish intubation orale pour montrer que les médicaments encapsulés par nanoparticules, quand administré via le tractus gastro-intestinal, ont été transportés à travers le sang cerveau barrière3. Ces auteurs ont effectué l’intubation selon la méthode de gauvage décrite par Collymore et al. 4 sous réserve de modifications. Toutefois, ils ne prévoyaient pas un protocole très détaillé décrivant la procédure d’intubation orale. Ici, nous présentons une méthode pour l’intubation orale du poisson-zèbre adulte s’appuyant sur l’arrêt Collymore et al. 4 nous incluons également la préparation de l’intestin pour analyse en aval pertinent par cytométrie en flux, microscopie confocale et qPCR.
L’intestin et particulièrement sa muqueuse est la première ligne de défense contre l’infection et le principal site d’absorption des éléments nutritifs5. Lorsque les cellules épithéliales et les cellules présentatrices d’antigène dans les barrières muqueuses perçoivent les signaux de danger, une réponse immédiate d’immunitaire innée est déclenchée. Ensuite, l’immuno-réaction adaptative très spécifique est établie par de6,les lymphocytes T et B7. Mise au point de vaccins oraux est une zone de mise au point actuelle en vaccinologie. Ces vaccins serait un outil efficace pour protéger l’organisme à des sites exposés en raison de la réponse spécifique des cellules immunitaires dans les tissus lymphoïdes associé aux muqueuses (MALT)8,9. En aquaculture, les vaccins ont des avantages évidents par rapport à l’aide de vaccins injectables. Ils sont pratiques pour la vaccination de masse, beaucoup moins de travail, sont moins stressants pour les poissons et peuvent être administrés aux jeunes poissons. Néanmoins, muqueuse vaccins candidats doivent atteindre le deuxième segment de l’intestin sans être dénaturé dans le milieu buccal. Ils doivent aussi franchir les obstacles muqueux pour accéder à l’antigène présentant des cellules (CPA) pour provoquer des réactions locales ou systémiques,10. Test de l’absorption muqueuse atteindre par les antigènes orale de candidats et de leurs vecteurs, ainsi que de la réponse immunitaire évoquée, est donc essentiel dans le développement de vaccins oraux.
Dans un contexte biomédical, élaboration d’un modèle pour tester les effets biologiques des composés après que intubation orale est d’un intérêt croissant. Bon nombre des caractéristiques anatomiques et physiologiques de l’intestin sont conservées entre deux lignées forment, avec les mammifères et poissons osseux11. Ce modèle d’intubation orale relié à l’analyse en aval peut être un outil pour donner un aperçu de la biologie humaine, mais aussi un terrain d’essai pour les produits biologiques ou autres composés en vivo.
Le protocole d’intubation orale peut être effectué par un seul opérateur, par exemple, administrer avec succès jusqu'à 50 µL de la suspension de nanoparticules de protéines de poissons pesant 1 g, avec un taux de survie élevé. La procédure est simple à mettre en place et rapide ; 30 poissons peuvent être intubés en 1 h. Le protocole pour la préparation intestinale est essentielle pour fournir des échantillons de cellules et de tissus de qualité pour une analyse ultérieure. On trouvera des exemples de résultats en aval qui montrent utilité du protocole dans l’obtention de données relies à l’absorption intestinale et à isoler l’ARN de qualité pour qPCR. Le protocole serait d’une grande utilité pour ceux qui ont besoin d’un modèle approprié pour tester la dynamique de la prophylaxie par voie orale ou d’autres composés dans l’intestin.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les procédures expérimentales impliquant le poisson zèbre (Danio rerio) ont été autorisés par le Comité d’éthique de l’Universitat Autònoma de Barcelona (nombre CEEH 1582) en accord avec les principes directeurs de l’International pour la recherche avec des animaux) EU 2010/63). Toutes les expériences avec webcam live poisson zèbre ont été effectuées à 26 et 28 ° C.
1. préparer le matériel pour l’Intubation orale
- Placer environ 1 cm d’un tube de silicone fine sur l’aiguille Luer lock 31 G pour couvrir la pointe de l’aiguille.
- Couper une pipette de filtre stérile 10 µL bout (environ 2 cm), prenez l’extrémité plus fine et placez-le sur le tube de silicone comme une gaine. S’assurer que la pipette s’étend au-delà de l’extrémité de l’aiguille pour ne pas blesser l’animal.
- Fixer l’aiguille à une 100 µL Luer lock seringue.
NOTE : Toujours rincer avec de l’éthanol et puis solution saline tamponnée au phosphate (PBS, voir Materials) soigneusement entre les traitements.
2. les solutions requises
- Préparer 150 mg/L (anesthésie) ou 300 mg/L (d’euthanasie) de solution de méthanesulfonate (MS-222) 3-aminobenzoate éthylique avec de l’eau de l’aquarium où le poisson-zèbre sont entretenus. Remplir un petit réservoir avec 1 L de solution anesthésique et gardez-le aéré.
- Remplir un autre petit réservoir avec 1 L d’eau de l’aquarium sans MS-222 pour la récupération du poisson et gardez-le aéré.
- Faire 50 mL de solution de 1 PBS x d’un 10 x solution mère stérile.
- Pour l’isolation de la cellule intestinale/analyse cytométrie en flux, préparer assez fraîche collagénase de 0,15 % solution de Type IV 1 mL par poisson d’une solution-mère ou de la poudre au moyen d’eagle modifié de Dulbecco (DMEM) avec la pénicilline 1 % v/v et à la streptomycine (voir documentation). Faites parties aliquotes (1 par poisson) de 1 mL à tubes de centrifugeuse de 2 mL. Conserver à 4 ° C jusqu'à 30 min avant l’étape de la dissection.
- Pour la fixation de la microscopie confocale/échantillon, préparer 50 mL de la solution fraîche de paraformaldéhyde (PFA) 4 % dans du PBS ou décongeler une solution-mère du congélateur-20 ° C sous une hotte.
ATTENTION : PFA est toxique. Veuillez lire la fiche signalétique avant de travailler avec elle. Gants et lunettes de protection devraient être portés et laissent toujours des solutions à l’intérieur d’une hotte aspirante.
3. préparation de la Suspension de nanoparticules fluorescentes
- Étiqueter les nanoparticules de protéine avec ester Atto-488 NHS (voir Table des matières) ou un colorant fluorescent approprié selon les instructions du fabricant.
- Remettre en suspension les nanoparticules dans un tampon bicarbonate de sodium 0,1 M à la concentration de 2 mg/mL.
- Dissoudre l’ester Atto 488 NHS en amines libres diméthylsulfoxyde (DMSO) à 2 mg/mL. Garder une partie aliquote de 10 µL à contrôler l’efficacité de l’étiquetage (étape 3,7 à 3,8).
- Mélanger les nanoparticules et l’ester d’Atto 488 NHS à un rapport molaire de 1:2 (protéine : colorant) en le remuant dans l’obscurité.
- Tournez en bas des nanoparticules étiquetées par centrifugation à 8 000 x g pendant 10 min à température ambiante, éliminer le surnageant et gardez-le pour contrôler l’efficacité de l’étiquetage (étape 3,7 à 3,8).
- Lavez les nanoparticules étiquetées en resuspendant dans 1 mL de tampon bicarbonate de sodium 0,1 M de vortex et de pipetage de haut en bas. Puis jeter le surnageant par centrifugation à 8 000 x g pendant 10 min à température ambiante. Répétez l’étape 3.6 pour 5 fois.
- Resuspendre le culot dans 5 mL de tampon bicarbonate de sodium 0,1 M dans un tube à centrifuger 15 mL et faire des parties aliquotes de la NANOPARTICULE fluorescente dans des tubes à centrifuger 1,5 mL (30 parties aliquotes). Filer vers le bas à 8 000 x g pendant 10 min à température ambiante, jeter le surnageant et stocker à-80 ° C, abri de la lumière.
-
Mesurer l’efficacité d’étiquetage à l’aide d’un spectrophotomètre microvolume.
- Prendre 1 µL de la solution d’Atto 488 originale conservée à l’étape 3.3 et plus loin le diluer dans le DMSO (par exemple, 01:20 d’après le rapport de volume). Il s’agit du volume utilisé pour obtenir le rapport molaire des protéines NANOPARTICULE et Atto 488 mix à l’étape 3.4.
- Prendre 1 µL de surnageant sauvé par la réaction d’étiquetage à l’étape 3.5. Mesurer l’absorption (abs) a = 501 nm. Le pourcentage de l’étiquetage est :
(
- Avant l’expérience, préparer la suspension de la NANOPARTICULE à la concentration désirée à l’aide de la solution de PBS 1 x.
4. poisson-zèbre Anesthetization et Intubation orale
- Rapidement le poisson (> 0,5 g) au moins 48 h avant l’expérience de vider l’intestin.
- Déplacez les poissons (12) dans les bassins expérimentaux (6 L) une nuit avant l’expérience pour permettre l’acclimatation12.
- Vortex la solution de nanoparticules bien (par exemple, 2 500 tr/min et 30 s) et établit le volume souhaité de nanoparticules suspension (p. ex., 20 – 50 µL) dans la seringue, attachée à l’aiguille protégée.
- Placer le poisson dans le gazeuse 150 mg/L MS-222 solution (voir chapitre 2) jusqu'à ce qu’ils se déposent au fond de la cuve et ne répondent pas à une pincée de la nageoire caudale ; Ce processus prend moins de 5 min.
- Rapidement transférer les poissons anesthésiés avec un filet sur un plateau en plastique mouillé, orienter l’animal horizontalement pour faire face à l’aiguille et commencer immédiatement l’intubation orale.
- Avec précaution, soutenir le poisson d’une main et ouvrir la bouche de l’autre main à l’aide de l’aiguille protégée. Insérer délicatement l’aiguille vers le bas de le œsophage à environ 1 cm de la bouche d’ouverture.
Remarque : L’opérateur peut se sentir une légère résistance lorsque l’extrémité de l’embout de la pipette a passé les branchies. Prendre soin de ne pas l’entrée de l’aiguille trop qui peut perforer les branchies d’angle. - Injecter lentement la suspension de nanoparticules pour le poisson. Veillez à ce que la suspension ne s’écoule pas vers l’extérieur par les branchies ou la bouche.
- Doucement, retirer l’aiguille et placer le poisson dans le réservoir de récupération (voir chapitre 2). Récupération prend généralement moins de 1 min.
- Vérifier le poisson soigneusement pour toute anomalie (par exemple, des saignements au niveau des branchies est un signe de perforation).
- Une fois que les poissons ont récupéré, Reverse dans les bassins expérimentaux.
5. Dissection de l’intestin du poisson-zèbre
- Après un certain temps après intubation (p. ex., 5 h ou 24h), placez le poisson à l’aide d’un filet en 300 mg/L MS-222 solution d’euthanasie (voir chapitre 2). Assurez-vous que l’opercule s’immobilise et il n’y a aucun réflexe de pincée de queue. Cinq minutes est normalement suffisant.
- Ramasser l’animaux euthanasié avec un filet et le placer sur un papier filtre.
Remarque : Le papier filtre est très utile pour enlever le tissu adhésif le long de l’intestin. - À l’aide de ciseaux de dissection pointu, faites une incision semi-circulaire de l’anus à l’opercule et l’incision ouverte à l’aide de pinces fines. Couper les deux extrémités de l’intestin, retirez tous les organes internes et placez-les sur du papier filtre.
ATTENTION : Les travaux rapidement à réduire la mortalité et le métabolisme cellulaire.
NOTE : Ou bien, supprimez le tissu adhésif dans du PBS et sur glace. - Séparer les organes internes, en veillant à conserver son orientation (antérieur à segment intestinal postérieur) et de l’étirer l’intestin. Habituellement, le segment antérieur de l’intestin est plus large que le segment postérieur. Veiller à obtenir tout l’intestin lorsque la dissection.
Remarque : L’extrémité postérieure est assez fine et fragile dans petits poissons et peuvent se rompre, en particulier chez les animaux < 0,7 g. - Rouler l’intestin sur le papier filtre avec des pincettes pour détacher les tissus adhésifs de l’intestin.
- Passez à préparer l’intestin pour diverses analyses en aval (Articles 6, 7 et 8).
6. préparation des cellules intestinales de cytométrie en flux
- Préparer à l’avance des parties aliquotes de solution de collagènase de 0,15 % (voir la section 2.4).
Remarque : Les parties aliquotes doivent être à température ambiante avant de procéder. - Facultatif : Continuant de l’étape 5.5, fente ouverte l’intestin longitudinalement et laver avec du PBS 1 x.
- À l’aide de pinces à épiler, placer l’intestin dans le tube à centrifuger 2 mL rempli de solution de collagènase de 0,15 %.
- Placer les tubes sur un agitateur de laboratoire vertical pendant 1 h à température ambiante dans l’obscurité.
- Placez l’intestin sur un tamis de cellule 100µm appuyé sur un tube de centrifugation de 50 mL. Briser l’intestin avec un piston de seringue de 5 mL, laver 3 fois avec du PBS 1 x, recueillant le débit à travers l’échantillon dans le tube à centrifuger 50 mL.
- Centrifuger le tube de centrifuger de 50 mL à 400 x g pendant 10 min, à 4 ° C.
- Pipetter soigneusement la plupart du surnageant tout en ne perdant ne pas les cellules, dont certaines peuvent être associés à la glaire.
- Remettre en suspension les cellules intestinales en bas du tube centrifuge avec 500 µL de PBS 1 x et rester sur la glace jusqu'à l’analyse de la cytométrie en flux
- Échantillons de filtre par un filtre de cellule 30 µm dans 5 mL autour des tubes du bas pour la cytométrie en flux.
- Réglez les paramètres (par exemple, le nombre de cellules pour l’analyse, la région d’intérêt, de tension et de compensation, choix des détecteurs) sur un équipement cytomètre (voir documentation).
- Immédiatement analyser les cellules sur un cytomètre, suivant les instructions d’utilisation13.
7. préparer l’intestins Cryosections pour la microscopie confocale
- Remplissez le moule en plastique (voir la Table des matières) à la moitié du volume avec la température de coupe optimale (PTOM) composé.
- Continue de l’étape 5.5 et immédiatement après la dissection, poser délicatement l’intestin dans le moule en plastique. Assurez-vous que l’intestin est totalement intégré dans l’enceinte des PTOM. Si nécessaire, ajouter composé plus PTOM dans le moule en plastique.
Remarque : Il est recommandé de placer l’intestin en forme de « Z » dans les PTOM composé de suivre facilement son orientation naturelle. - Placer le moule en plastique sur la glace sèche jusqu'à ce qu’il va opaque (moins d’une minute).
- Stocker le moule en plastique à-80 ° C pour une utilisation à long terme ou procédé immédiatement à l’aide de la procédure suivante.
Remarque : Le protocole peut être suspendu ici. - Couper l’intestin congelé en 10 sections de µm ou épaisseur appropriée à l’aide d’un cryostat à-20 ° C.
- Recueillir la section intestinale avec une brosse fine sur une lame.
- Plonger la lame dans 4 % PFA pendant 15 min à température ambiante pour fixer l’échantillon.
ATTENTION : PFA est toxique. Veuillez lire la fiche signalétique avant de travailler avec elle. Gants et lunettes de protection devraient être portés et laissent toujours des solutions à l’intérieur d’une hotte aspirante. - Laver la lame 3 fois avec 1 x PBS, 10 min chacun.
- Ajouter une goutte de milieu de montage et placez une lamelle sur le spécimen.
Remarque : Le protocole peut être suspendu ici. - Observer l’échantillon sous un microscope confocal à grossissement approprié.
8. préparation de l’intestin pour temps réel qPCR (RT-qPCR)
- Continue de l’étape 5.5, mettre l’intestin dans un flacon cryogénique et congeler rapidement l’intestin dans l’azote liquide et conserver à-80 ° C jusqu'à l’utilisation.
Remarque : Le protocole peut être suspendu ici. - Pour l’homogénéisation, ajouter 200 µL de 2 % (v/v) réfrigérée 1-thioglycérol/homogénéisation solution (voir la Table des matières) ou solution alternative homogénéisation de l’échantillon de l’intestin.
- Travailler rapidement, homogénéiser l’échantillon intestin sur la glace avec un homogénéisateur de laboratoire à grande vitesse (fixé à 25 – 30 000 tr/min) jusqu'à ce qu’aucun tissu visible des fragments demeurent. 3 fois pendant 5 s est généralement suffisant.
- Isoler l’ARN à l’aide d’un film publicitaire nécessaire (voir la Table des matières) selon d’instructions du fabricant14 ou une autre méthode appropriée. Au besoin, conservez l’ARN à-80 ° C pour une utilisation à long terme.
Remarque : Le protocole peut être suspendu ici. - Quantifier la concentration d’ARN à l’aide d’un spectrophotomètre15 et évaluer la qualité à l’aide d’un analyseur de RNA16.
- Préparer 1 µg ou une quantité appropriée de cDNA utilisant un kit de synthèse de cDNA selon les instructions du fabricant.
Remarque : Le protocole peut être suspendu ici. Pour l’analyse de qPCR, veuillez suivre les directives MIQE17. - Création de paires d’amorces appropriées pour le gène ou d’intérêt.
- Sélectionnez un gène de référence appropriés et d’analyser l’expression de chaque gène par une détection de la RT-qPCR kit de système à l’aide d’un film publicitaire (voir documentation).
NOTE : par exemple, ajouter 5 µL de supermix SYBR green, des amorces 0,5 µM, 2,5 µL du cDNA dilué et 1,5 µL d’eau dans un volume final de 10 µL de chaque puits de la plaque de qPCR.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Poisson-zèbre (poids moyen : 1,03 ± 0,16 g) de sexe mixte ont été intubés avec succès avec des nanoparticules de différentes protéines recombinantes (inclusions bactériennes) à l’aide de notre dispositif d’intubation orale fait maison (Figure 1). Nous avons avec succès effectué l’intubation orale et atteint un taux de mortalité faible pourcentage moyen (6,8 %) (Tableau 1). Poisson zèbre ont été soit intubé avec 30 µL ou 50 µL de suspensions de nanoparticules et de la mortalité a été calculée au sein de l’intubation après 24h. Les expériences ont été réalisées par deux opérateurs, R avait moins d’expérience travaillant avec intubation orale zebrafish que J. Les résultats ont montré que même un nouvel opérateur pouvait accomplir indépendamment de l’intubation orale experiment et facilement atteignent un taux de survie élevé par le présent protocole. D’après notre expérience, la taille des poissons optimale est de 1 g, mais nous avons intubé avec succès les poissons aussi petites que 0,5 g.
Pour mieux comprendre si les nanoparticules fluorescentes IBsTNFα (une protéine de cytokines recombinantes nanostructurés comme corps d’inclusion) ont été livrés à poisson zèbre par notre méthode et absorbés par l’intestin du poisson-zèbre ou non, nous avons effectué la cytométrie en flux analyse. Les nanoparticules (100 µg/poissons, 50 µL) et PBS (contrôle) ont administré par voie orale (par intubation) de poisson-zèbre et l’intestin a été disséqué à 5 h et 24h après intubation. Les cellules intestinales totales ont été préparés par étape 6 et analysés par la détection du signal d’émission de fluorescence. Les histogrammes représentant d’intensité de fluorescence et les parcelles de point de pourcentage de cellules fluorescentes sont indiquées à la Figure 2. La densité de cellules fluorescentes est nettement plus élevée en nanoparticules groupe intubés par rapport au groupe témoin en 5 h et 24h (Figure 2A). Les pourcentages de cellules fluorescentes sont significativement plus élevés en 5 h (46,3 %) et en 24 h (43,0 %) des groupes de nanoparticules intubé (Figure 2B).
Afin d’étudier de quelle partie de la couche intestinale est impliquée dans l’absorption de la NANOPARTICULE, nous avons réalisé la microscopie confocale analyse. Les nanoparticules (20 µg/poissons, 50 µL) et PBS (contrôle) a intubé par voie orale pour le poisson-zèbre et l’intestin a été disséqué à intubation après 5 h. Les sections intestins ont été préparées par une méthode de tissus congelés selon étape 7 (Figure 3A). Les images confocales de nanoparticules fluorescentes dans l’intestin sont indiquées à la Figure 3B. Les nanoparticules fluorescentes ont été trouvés dans l’intestin du poisson-zèbre. Nous avons observé la fluorescence dans les cellules épithéliales, lamina propria et les cellules musculaires.
Pour vérifier si nous pouvions extraire RNA de haute qualité par notre protocole, nous avons analysé l’ARN extrait de l’intestin avec un bioanalyzer (également dénommé analyseur de RNA ici). Poisson-zèbre a intubé par voie orale avec du PBS (50 µL) ou les nanoparticules (20 µg/poissons, 50 µL). Les intestins ont été disséqués pour extraction de l’ARN à l’intubation après 24h. Nous avons sélectionné sept échantillons d’ARN pour tester avec l’analyseur. Nous avons constaté que tous les échantillons d’ARN testés ont un nombre RNA intégrité élevé allant de 7,9 à 8,9 (Figure 4).
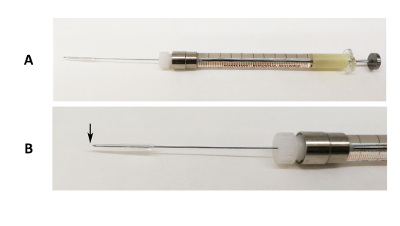
Figure 1 : Dispositif d’intubation orale. (A) Image de 31 G Luer lock needle fixé sur une seringue de 100 µL avec l’extrémité tube et pipette de silicium couvrant la pointe de l’aiguille. (B) une image agrandie de la partie de l’aiguille. La flèche noire indique lorsque l’extrémité de pipette est supérieure à la pointe de l’aiguille. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Analyse d’écoulement cytometry de nanoparticules fluorescentes dans l’intestin du poisson-zèbre par l’intermédiaire intubation orale. Poisson zèbre ont été traités avec PBS ou fluorescents IBsTNFα (100 µg) pour 5 h et 24 h, respectivement. (A) les histogrammes représentant d’intensité de fluorescence. (B) Dot trace graphique montrant le pourcentage de cellules fluorescentes. Chaque point vert représente le pourcentage de cellules fluorescentes dans un ≥4 individuels, n. Les données représentent la moyenne ± écart-type de la moyenne (SEM). Des différences ont été analysées à l’aide d’ANOVA à. Des différences significatives en matière de contrôle (**, p < 0,01) s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Images d’analyse de la microscopie confocale. Poisson a intubé oralement avec PBS ou 20 µg/poisson nanoparticules fluorescentes. L’intestin a été disséqué à intubation après 5 h. (A) intestin Zebrafish incorporé dans OCT composés. L’intestin a été placé avec l’orientation naturelle d’une forme de « Z » (r : extrémité antérieure ; p : extrémité postérieure). Images de microscopie confocale (B) de l’intestin du poisson-zèbre. Les flèches blanches montrent que les nanoparticules fluorescentes sont repris dans la muqueuse intestinale. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : RNA analyseur gel virtuel, l’image ARN extrait des 7 intestins du poisson-zèbre échantillonnées après intubation. Numéro de l’échantillon 1 et 2 sont des groupes de PBS intubé et numéro 3 à 7 de l’échantillon sont des groupes de nanoparticules intubé. RNA intégrité nombres (RIN) sont donnés en bas allant de 7,9 à 8,9. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Opérateur | Volume | poissons # intubés | Poids moyen (g ± SD) |
décès de # | Mortalité (%) |
| R | 30 ΜL | 22 | 0,88 ± 0,14 | 3 | 13,6 |
| R | 30 ΜL | 17 | 0,93 ± 0,19 | 0 | 0 |
| J | 50 ΜL | 19 | 1.23 ± 0,31 | 1 | 5.2 |
| J | 50 ΜL | 30 | 1.08 ± 0,40 | 2 | 6.6 |
| Total | 88 | 1,03 ± 0,16 | 6 | 6.8 | |
| SD : écart-type de la moyenne | |||||
Tableau 1 : Comparaison de poisson-zèbre mortalité causée par deux opérateurs utilisant le protocole. Code d’identification de l’opérateur et le volume intubé, le nombre de poissons, le poids moyen de poissons en grammes (g) sont indiquées.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Ce protocole est une amélioration de la technique décrite précédemment pour l’intubation orale par Collymore et al. 4 notre protocole décrit en détail la méthode intubation orale et comprend la préparation de l’intestin pour les analyses en aval. Notre méthode améliore la vitesse de manipulation de poissons permettant à une personne d’effectuer le protocole entier rapidement, sans beaucoup de variation entre les opérateurs. Une différence principale de notre protocole avec la précédente, c’est que nous évaluons le succès d’une expérience d’intubation orale non seulement par l’observation de l’animal pour le bien-être (p. ex., pas de saignement) et pour aucune fuite du liquide administré, mais aussi en vérifiant l’absorption d’une NANOPARTICULE bioactif dans l’intestin à l’aide de l’analyse en aval (microscopie confocale, cytométrie en flux et qPCR). Nous montrons que les nanoparticules fluorescent étiquetés intubés trouvées dans l’intestin.
Sur le plan pratique, le matériel d’intubation est bon marché, précise et réutilisable : l’appareil de base est faite d’un verre de 100 µL réutilisables (p. ex., Hamilton) seringue couplé à une aiguille de 31 G avec un morceau de silicium sur le dessus. Une coupe pointe stérile est placée sur le tube en silicone et peut être modifiée pour chaque administration individuelle. La seringue est réutilisable, et l’aiguille fine permet d’intubation de petits poissons avec un risque élevé de réussite. En outre, l’extrémité coupée stérile pourrait être placée directement au-dessus de l’aiguille sans le tube de silicone qui permet l’équipement d’intubation plus facile à faire dans un laboratoire. La substance bioactive administrée est clairement visible, et une administration correcte peut être contrôlée facilement. Une étape cruciale au cours de la procédure d’intubation est l’entrée de l’aiguille. Il est important que l’aiguille n’est pas incliné ou inséré trop afin d’éviter la perforation des branchies. Le taux de mortalité observé avec cette méthode est très faible (environ 7 %) et dépend de la taille du poisson. Perforation de Gill est la cause la plus fréquente de la mort de poissons, et quand il arrive des poissons meurent au sein de la première heure. Bien que les poissons de 0,5 g peuvent être intubés facilement la taille des poissons optimale est autour de 1 g. Une autre différence avec la méthode développée par Collymore et al. est que les poissons sont soumis à un jeûne pendant 48 h pour s’assurer que cet appareil gastro-intestinal est vide. La procédure d’intubation entier peut être faite très rapidement (30 animaux/h) par un seul opérateur et surtout, la méthode est cohérente entre les différents opérateurs4. La méthode de l’intubation est facile à apprendre et ne nécessite pas beaucoup de pratique pour le maître.
La procédure de dissection intestin doit être correctement effectuée pour obtenir des échantillons de bonne qualité pour la cytométrie en flux, confocale et analyses de qPCR. L’étape critique est à ce stade la dissection de l’intestin entier ; la portion postérieure est fragile et facile à perdre. Une fois que l’intestin est disséqué, il peut être traité plus loin pour la cytométrie en flux (protocole de 2 h), analyse de qPCR (protocole 2 h jusqu’au total isolement d’ARN) ou microscopie confocale (1 h pour avoir des échantillons prêts à cryosection). Il est très important de suivre l’orientation de l’intestin, en particulier pour la microscopie confocale. Analyse de la cytométrie en flux nécessite un traitement rapid, et la procédure ne peut pas être arrêtée avant la fin. Considérant que, échantillons et ARN préparé pour cryosection peut être correctement stockées et traitées en tout temps. Pour la cytométrie en flux, échantillons de bonne qualité sans débris s’agglutiner la machine peuvent être isolés avec cette méthode et analyse rapide de la présence de cellules fluorescentes peut être réalisée facilement sur les individus. La surveillance de la qualité de RNA a montré que RNA de haute qualité peut être isolée de l’intestin permettant l’analyse de chaque poisson par qPCR. Enfin, la préparation de cryosection pour la microscopie confocal fournit des informations structurelles importantes concernant l’absorption de nanoparticules de protéine. Nos méthodes fournissent ainsi un modèle pour tester la dynamique de la prophylaxie par voie orale ou d’autres composés dans l’intestin.
Les limites de notre étude sont la taille du poisson car nous n’ai pas tester l’administration chez les poissons de taille inférieure à 0,5 g et l’utilisation d’un anesthésique chimique pour endormir les animaux. Certains auteurs utilisent l’eau froide (0 – 4 ° C) à anesthésier les poissons zèbres18 mais dans le contexte du bien-être animal et les contraintes juridiques européennes, nous avons décidé que MS-222 était la méthode de choix.
Le poisson-zèbre offre de nombreux avantages par rapport aux autres systèmes de modèles, y compris un ensemble complet de données sur des gènes et les lignées transgéniques disponibles. Pour immunologistes, les lignées transgéniques (p. ex., Tg mpx:GFP et mpeg1:GFP Tg) a défini une scène pour l’observation in vivo des cellules immunitaires comme les macrophages et les neutrophiles19,20. Combinant notre intubation orale et analyse en aval avec des lignées transgéniques, pourrait être idéal pour identifier les types de cellules mettant en cause l’absorption, transport et traitement des vaccins oraux, les nanoparticules et les pathogènes chez les poissons.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs déclarent qu’aucun intérêts contradictoires n’existent.
Acknowledgments
Ce travail a été soutenu par des subventions du ministère espagnol de la Science, la commission européenne et des fonds AGAUR NR (AGL2015-65129-R MINECO/FEDER et AGAUR 2014SGR-345). RT est titulaire d’une bourse d’études pré-doctorales de AGAUR (Espagne), JJ a été soutenue par une bourse de doctorat de la China Scholarship Council (Chine) et NR est pris en charge par le programme Ramón y Cajal (RYC-2010-06210, 2010, MINECO). Nous remercions m. Torrealba conseils spécialisés dans la production de protéines, N. Barba de la « Servei de Microscopia » et Dr M. Costa de la « Servei de Citometria » de l’Universitat Autònoma de Barcelona pour assistance technique utile.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




