Summary
Protokollen beskriver intubere voksen zebrafisk med en biologiske; derefter dissekere og forberede flowcytometri, Konfokal mikroskopi og qPCR tarmen. Denne metode tillader administration af bioaktive stoffer til at overvåge tarmens optagelse og den lokale immun stimulus fremkaldt. Det er relevant for afprøvning intestinal dynamikken i mundtlig forebyggelse.
Abstract
De fleste patogener invaderer organismer gennem deres slimhinde. Dette gælder især i fisk som de konstant er udsat for en mikrobiel-rige vandmiljø. Udvikle effektive metoder til oral levering af immunostimulanter eller vacciner, som aktiverer immunsystemet mod smitsomme sygdomme, er ønskeligt. I udformningen af profylaktisk værktøjer, gode eksperimentelle modeller er nødvendige for at teste deres ydeevne. Her viser vi en metode til oral intubation af voksen zebrafisk og et sæt af procedurer til at dissekere og forberede tarmen til flowcytometri, Konfokal mikroskopi og kvantitative polymerase kæde reaktion (qPCR) analyse. Med denne protokol, kan vi netop administrere mængder op til 50 µL til at fiske, vejer ca. 1 g enkelt og hurtigt, uden at skade dyrene. Denne metode gør det muligt for os at udforske direkte i vivo optagelsen af fluorescently mærket forbindelser i tarmslimhinden og immunmodulerende kapacitet af sådanne biologics på det lokale websted efter intubation. Ved at kombinere downstream metoder såsom flowcytometri, histologi, qPCR og konfokal mikroskopi af tarmens væv, kan vi forstå, hvordan immunostimulanter eller vacciner er i stand til at krydse de intestinale mucosale barrierer, passere gennem lamina propria, og nå muskel, have en virkning på tarmens slimhinde immunsystemet. Modellen kan bruges til at teste kandidat mundtlige forebyggelse og levering systemer eller den lokale virkning af enhver oralt administreret bioaktive foderblandinger.
Introduction
Målet med denne artikel er at beskrive i dybde en enkel metode til oral intubation af zebrafisk, sammen med nyttige tilhørende downstream procedurer. Mundtlige intubation ved hjælp af zebrafisk er blevet en praktisk model i studiet af infektionssygdom dynamics, oral vaccine/immunostimulant, stof/nanopartikel udbredelse og effekt og tarm mucosal immunitet. For eksempel er zebrafisk mundtlige intubation blevet brugt i studiet af Mycobacterium marinum og Mycobacterium peregrinum infektion1. Lovmo et al. også brugt med succes denne model til at levere nanopartikler og M. marinum til mave-tarmkanalen af voksen zebrafisk2. Derudover Chen et al. bruges zebrafisk mundtlige intubation til at vise, at narkotika indkapslet af nanopartikler, hvornår administreres via mave-tarmkanalen, blev transporteret på tværs af blod hjerne barrieren3. Disse forfattere udført intubation baseret på den gauvage metode beskrevet af Collymore et al. 4 med nogle ændringer. Imidlertid de ikke giver en meget detaljeret protokol beskriver proceduren mundtlig intubation. Vi præsenterer her, en metode til oral intubation af voksen zebrafisk bygning på Collymore et al. 4 vi yderligere omfatter forberedelse af tarmen til relevante downstream analyse ved flowcytometri, Konfokal mikroskopi og qPCR.
Tarmen og især dens slimhinde er den første linje i forsvaret mod infektion og den primære lokalitet af næringsstof optagelse5. Når epitelceller og antigen-præsenterer celler inden for mucosale barrierer opfatter faresignaler, udløses en umiddelbar medfødte immunrespons. Næste, den meget specifikke adaptive immunrespons er etableret af T- og B-lymfocytter6,7. Udvikling af mundtlig vaccines er en nuværende fokusområde i vaccinologi. Sådanne vacciner vil være et effektivt redskab til at beskytte organismen på udsatte steder på grund af den specifikke svar af immunceller i slimhinde-associerede lymfoide væv (MALT)8,9. I akvakultur har slimhinde vacciner åbenlyse fordele i forhold til injicerbare vacciner. De er praktiske for massevaccination, mindre arbejdskrævende, er mindre stressende til fisk, og kan gives til unge fisk. Ikke desto mindre skal slimhinde vaccine kandidater nå den anden gut segment uden at blive denatureret i den mundtlige miljø. De skal også krydser mucosale barrierer for at få adgang til antigen præsentere celler (PMV'er) til at fremkalde lokale og/eller systemisk svar10. Dermed, afprøvning af slimhinde optagelsen opnået af kandidatlande mundtlige antigener og deres fremføringsmidler, samt immun reaktion fremkaldt, er afgørende i udviklingen af orale vacciner.
I forbindelse med biomedicinske, udvikle en model for at teste biologiske virkninger af forbindelser efter mundtlig intubation er af stigende interesse. Mange af de anatomiske og fysiologiske funktioner for tarmen er bevaret mellem bilaterian slægter, med pattedyr og knoklede fisk11. Denne mundtlige intubation model tilsluttet downstream analyse kan være et redskab til at give indsigt i menneskets biologi, såvel som et testområde for biologiske lægemidler eller andre forbindelser i vivo.
Den mundtlige intubation protokol kan udføres af én operatør, fxkorrekt administration af op til 50 µL af protein nanopartikel suspension til fisk vejer 1 g, med en høj overlevelsesrate. Proceduren er enkel at sætte op og hurtig; 30 fisk kan være intubated i 1 h. Protokol for tarmen forberedelse er nøglen til at levere kvalitet celle og væv prøver til efterfølgende analyse. Der gives eksempler af downstream resultater som viser den protokol nytte i at opnå data relateret til tarmens optagelse og isolere kvalitet RNA for qPCR. Protokollen ville være til stor gavn for dem, der har behov for en passende model til at teste dynamikken i mundtlig forebyggelse eller andre forbindelser i tarmen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle eksperimentelle procedurer, der involverer zebrafisk (Danio rerio) blev godkendt af den etiske komité Universitat Autònoma de Barcelona (CEEH antallet 1582) i samarbejde med den internationale vejledende principper for forskningen involverer dyr ( EU 2010/63). Alle eksperimenter med levende zebrafisk blev udført på 26-28 ° C.
1. forberede udstyr til mundtlig Intubation
- Placer ca 1 cm af et fint silikone rør på 31 G Luer lock nål til at dække nål-spidsen.
- Skær en 10 µL sterilt filter pipette tip (ca 2 cm), før den finere ende og Placer det over silikone rør som en kappe. Kontroller, at pipetten strækker sig ud over spidsen af nålen til at undgå at beskadige dyret.
- Tillægge en 100 µL Luer lock sprøjte nålen.
Bemærk: Altid skylles med ethanol og derefter fosfatbufferet saltopløsning (PBS, se materialer) grundigt mellem behandlinger.
2. løsninger kræves
- Forberede 150 mg/L (for anæstesi) eller 300 mg/L (for aktiv dødshjælp) ethyl 3-aminobenzoat methanesulfonate (MS-222) løsning med vand fra akvariet hvor zebrafisk vedligeholdes. Fylde en lille tank med 1 L af bedøvelsesmiddel løsning og holde det tilsat kulsyre.
- Fyld en anden lille tank med 1 L akvarium vand uden MS-222 for fisk opsving og holde det tilsat kulsyre.
- Gøre 50 mL af 1 x PBS fra en 10 x sterile stamopløsning.
- Til flowcytometri analyse/tarm celle isolation, forberede nok friske 0,15% collagenase Type IV løsning til 1 mL per fisk fra en stamopløsning eller pulver i Dulbeccos modificerede eagle medium (DMEM) med 1% v/v penicillin og streptomycin (Se materialer). Gøre delprøver (1 pr. fisk) af 1 mL i 2 mL centrifugeglas. Holde på 4 ° C indtil 30 min før dissektion trin.
- Konfokal mikroskopi/prøve fiksering, forberede 50 mL frisk 4% PARAFORMALDEHYD (PFA) løsning i PBS eller tø en stamopløsning fra-20 ° C fryser i et stinkskab.
Forsigtig: PFA er giftigt. Læs venligst det materiale sikkerhedsdatablad før arbejdet med det. Handsker og sikkerhedsbriller, bør bæres, og altid forlade løsninger inde i et stinkskab.
3. forberedelse af fluorescerende nanopartikel Suspension
- Label protein nanopartikel med Atto-488 NHS ester (Se Tabel af materialer) eller en passende fluorescerende farvestof ifølge producentens anvisninger.
- Resuspend af nanopartikler i 0,1 M natriumbikarbonat buffer i koncentration på 2 mg/mL.
- Opløse Atto 488 NHS ester i Amin-fri dimethylsulfoxid (DMSO) på 2 mg/mL. Holde en alikvot af 10 µL til at kontrollere mærkning effektivitet (trin 3,7-3,8).
- Bland nanopartikler og Atto 488 NHS ester på en kindtand forholdet 1:2 (protein: farvestof) ved omrøring i mørke.
- Spin ned af mærket nanopartikler ved centrifugering ved 8.000 x g i 10 min. ved stuetemperatur, Fjern supernatanten og holde det for at kontrollere mærkning effektivitet (trin 3,7-3,8).
- Vask af mærket nanopartikler af resuspending i 1 mL af 0,1 M natriumbikarbonat buffer af vortexing og pipettering op og ned. Derefter supernatanten ved centrifugering ved 8.000 x g i 10 min. ved stuetemperatur. Gentag trin 3.6 for 5 gange.
- Resuspenderes i 5 mL af 0,1 M natriumbikarbonat buffer i en 15 mL centrifugeglas og gøre delprøver af de fluorescerende nanopartikel i 1,5 mL centrifugeglas (30 delprøver). Spin ned på 8.000 x g i 10 min. ved stuetemperatur, supernatanten fjernes og opbevares ved-80 ° C beskyttet mod lyset.
-
Måle mærkning effektivitet ved hjælp af et microvolume Spektrofotometer.
- Tage 1 µL af den oprindelige Atto 488 løsning holdt fra trin 3.3 og yderligere fortynde det i DMSO (f.eks.1:20 efter volumen forhold). Dette er den diskenhed, der bruges til at få det molære forholdet mellem protein nanopartikel og Atto 488 mix på trin 3.4.
- Tage 1 µL af den gemte supernatanten fra mærkning reaktionen i trin 3.5. Måle absorption (abs) på = 501 nm. Procentdelen af mærkning er:
(
- Før forsøget, forberede nanopartikel suspension på den ønskede koncentration ved hjælp af 1 x PBS løsning.
4. zebrafisk Anesthetization og mundtlige Intubation
- Hurtig fisk (> 0,5 g) mindst 48 timer før forsøget at tømme tarmen.
- Flytte fisk (12 fisk) til de eksperimentelle kampvogne (6 L) en nat før forsøget at tillade akklimatisering12.
- Vortex nanopartikel løsning godt (fx 2,500 rpm og 30 s) og udarbejde den ønskede mængde af nanopartikel suspension (f.eks. 20 – 50 µL) ind i sprøjten knyttet til beskyttede nålen.
- Læg fisken i porebeton 150 mg/L MS-222 løsning (Se afsnit 2) indtil de synker til bunden af tanken og ikke reagerer på en halefinnen knivspids; denne proces tager mindre end 5 min.
- Hurtigt overføre den bedøvede fisk med et net til en våd plast bakke, orientere dyret vandret for at ansigt nål og straks begynde den mundtlige intubation.
- Omhyggeligt støtte fisk med den ene hånd og åbne munden med den anden hånd, ved hjælp af den beskyttede nål. Forsigtigt indsætte nålen ned i spiserøret til ca 1 cm fra munden åbning.
Bemærk: Erhvervsdrivende kan føle en lille modstand når slutningen af pipette tip har bestået gill. Passe på ikke for at vinkel posten nål, for meget som kan perforere gill. - Langsomt injicere nanopartikel suspension til fisk. Kontroller, at suspensionen ikke flow passiv gennem gællerne eller mund.
- Forsigtigt fjerne nålen og læg fisken i recovery tank (Se afsnit 2). Recovery tager normalt inden for 1 min.
- Kontrollere fisk omhyggeligt for enhver abnormitet (fx, blødning ved gællerne er et tegn på perforation).
- Når fisken har genvundet, bringe dem tilbage til de eksperimentelle kampvogne.
5. zebrafisk tarmen dissektion
- Efter en angivet tidsperiode post intubation (f.eks. 5 h og/eller 24 timer), læg fisken ved hjælp af et net til 300 mg/L MS-222 løsning for dødshjælp (Se afsnit 2). Kontroller laag stopper flytter og der er ingen hale knivspids refleks. Fem minutter er normalt tilstrækkeligt.
- Afhente det aflivede dyr med net og placere den på et filtrerpapir.
Bemærk: Filteret papir er meget nyttigt for at fjerne den selvklæbende væv langs tarmen. - Brug skarpe dissektion saks, lave et semi-cirkulært snit fra anus til Laag og åbne indsnit ved hjælp af fine pincet. Skær begge ender af tarmen, tage ud alle de indre organer og placere dem på filtrerpapir.
Forsigtig: Arbejde hurtigt for at reducere cellestofskiftet og død.
Bemærk: Alternativt, fjerne den selvklæbende væv i PBS og på is. - Adskille tarmen fra indre organer og sørg for at holde sin orientering (forreste til bageste intestinal segment) og strække det ud. Normalt, er den forreste del af tarmen bredere end bageste segment. Sørge for at få alle af tarmen når dissekere.
Bemærk: Den bageste ende er ganske fine og skrøbelige i små fisk og kan knække, især i dyr < 0,7 g. - Rulle tarmen på filtret med pincet for at frigøre den selvklæbende væv fra tarmen.
- Gå videre til at forberede tarmen til forskellige downstream analyser (rubrik 6, 7 og 8).
6. forberede tarmcellerne til flowcytometri
- Forberede sig på forhånd delprøver af 0,15% collagenase løsning (Se afsnit 2.4).
Bemærk: Delprøver skal være ved stuetemperatur, før du fortsætter. - Valgfrit: Fortsætter fra trin 5.5, spalteformede åben tarmen på langs og vask med 1 x PBS.
- Brug af pincet, placere tarmen i 2 mL centrifugeglas fyldt med 0,15% collagenase løsning.
- Sted rør på en lodret laboratorium rotator i 1 time ved stuetemperatur i mørke.
- Placer tarmen på en 100 µm celle si understøttes i et 50 mL-centrifugerør. Bryde op i tarmen med en 5 mL sprøjte stemplet, vask 3 gange med 1 x PBS, indsamle flow gennem prøven i 50 mL-centrifugerør.
- Centrifugeres 50 mL-centrifugerør på 400 x g i 10 min. ved 4 ° C.
- Omhyggeligt pipette ud de fleste af supernatanten mens ikke mister celler, hvoraf nogle kan være forbundet til slim.
- Resuspend tarmcellerne nederst i centrifugeglasset med 500 µL 1 x PBS og holde på is indtil flowcytometri analyse
- Filter prøver gennem en 30 µm celle filter til 5 mL rund bund rør til flowcytometri.
- Indstil parametrene (f.eks. antallet af celler for analyse, region af interesse, spænding og kompensation, udvalg af detektorer) på en forskellige udstyr (Se materialer).
- Straks analysere celler på en Flowcytometret, ifølge vejledningen i brug13.
7. at forberede tarmen snit frosset organmateriale konfokalmikroskopi
- Fylde den plast skimmel (Se Tabel af materialer) til halv mængde med optimal opskæring temperatur (O.C.T.) sammensatte.
- Fortsætter fra trin 5.5 og umiddelbart efter dissektion, Anbring forsigtigt tarmen i plast støber. Sørg for tarmen er helt integreret i O.C.T. sammensat. Om nødvendigt tilsættes mere O.C.T. sammensatte til plast støber.
Bemærk: Det anbefales at placere tarmen med et "Z" form i O.C.T. sammensatte nemt følge sin naturlige orientering. - Placer den plast skimmel på tøris, indtil det går uigennemsigtige (mindre end et minut).
- Gemme den plast skimmel ved-80 ° C for lang tids brug eller proces straks ved hjælp af følgende procedure.
Bemærk: Protokollen kan pause her. - Skær den frosne tarmen i 10 µm sektioner eller passende tykkelse ved hjælp af en kryostaten ved-20 ° C.
- Indsamle afsnittet tarmen med en fin børste på et dias.
- Fordyb dias i 4% PFA i 15 min. ved stuetemperatur kan lave prøven.
Forsigtig: PFA er giftigt. Læs venligst det materiale sikkerhedsdatablad før arbejdet med det. Handsker og sikkerhedsbriller, bør bæres, og altid forlade løsninger inde i et stinkskab. - Vask diaset 3 gange med 1 x PBS, 10 min.
- Tilføj en dråbe af montering medium og placere en coverslip over modellen.
Bemærk: Protokollen kan pause her. - Observere prøve under en Konfokal mikroskop på passende forstørrelse.
8. forberedelse tarmen for realtid qPCR (RT-qPCR)
- Fortsætter fra trin 5.5, sætte tarmen i en kryogene hætteglas og hurtigt fryse tarmen i flydende nitrogen og opbevares ved-80 ° C indtil brug.
Bemærk: Protokollen kan pause her. - For homogenisering, tilføje 200 µL af 2% (v/v) kølet 1-Thioglycerol/homogenisering løsning (Se Tabel af materialer) eller alternative homogenisering løsning til tarmen prøven.
- Arbejde hurtigt, homogeniseres tarmen prøven på isen med et laboratorium homogeniseringsapparat ved høj hastighed (sat til 25-30.000 rpm) indtil ingen synlige væv forbliver fragmenter. 3 gange for 5 s er som regel tilstrækkelig.
- Isolere RNA ved hjælp af en kommerciel kit (Se Tabel af materialer) ifølge producentens instruktioner14 eller en egnet alternativ metode. Efter behov, gemme RNA ved-80 ° C til lang tids brug.
Bemærk: Protokollen kan pause her. - Kvantificere RNA-koncentrationen ved hjælp af et spektrofotometer15 og vurdere kvaliteten bruger et RNA analyzer16.
- Forberede 1 µg eller en passende mængde af cDNA ved hjælp af en cDNA syntese kit ifølge producentens anvisninger.
Bemærk: Protokollen kan pause her. For qPCR analyse, skal du følge MIQE retningslinjer17. - Udforme passende primer par for gen/s af interesse.
- Vælg et passende gen og analysere udtryk for hvert gen ved en RT-qPCR detection system ved hjælp af en kommerciel kit (Se materialer).
Bemærk: For eksempel tilføje 5 µL af SYBR green supermix, 0,5 µM primere, 2,5 µL fortyndede cDNA og 1,5 µL vand i en endelige mængden af 10 µL til hver brønd af qPCR plade.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Zebrafisk (gennemsnitlig vægt: 1,03 ± 0,16 g) af blandet køn var med held intuberet med forskellige rekombinante protein nanopartikler (bakteriel optagelse organer) ved hjælp af vores hjemmelavede mundtlige intubation enhed (figur 1). Vi har med held udført den mundtlige intubation og opnåede en lav gennemsnitlig procent dødelighed (6,8%) (Tabel 1). Zebrafisk var enten intuberet med 30 µL eller 50 µL af nanopartikel suspensioner og dødeligheden var beregnet inden for 24 timer post intubation. Forsøgene blev udført af to operatører, R havde mindre erfaring med zebrafisk mundtlige intubation end J. Resultaterne viste, at selv en ny operatør selvstændigt kunne udføre de mundtlige intubation eksperimentere og opnå nemt en høj overlevelse af denne protokol. Fra vores erfaring, den optimale fisk størrelse er 1 g, men vi har med held intuberet fisk så små som 0.5 g.
For bedre at forstå om de fluorescerende nanopartikler IBsTNFα (en rekombinant cytokin protein nanostrukturerede som inklusion organer) blev leveret til zebrafisk af vores metode og taget af zebrafisk tarmen eller ej, vi udførte flowcytometri analyse. Nanopartikler (100 µg/fisk, 50 µL) og PBS (kontrol) blev oralt administreret (ved intubation) til zebrafisk og tarmen blev dissekeret på 5 h og 24 h post intubation. Samlede tarmcellerne blev udarbejdet af trin 6 og analyseres ved at afsløre fluorescens emission signal. De repræsentative histogrammer af fluorescens intensitet og dot parceller af fluorescerende celler procent er vist i figur 2. Tætheden af fluorescerende celler er klart højere i nanopartikel intuberet gruppen sammenlignet med kontrolgruppen i både 5 og 24 h (fig. 2A). Procenter af fluorescerende celler er betydeligt højere i både 5 h (46,3%) og 24 h (43,0%) af nanopartikel intuberet grupper (figur 2B).
Til yderligere undersøgelse som en del af den intestinale lag er involveret i nanopartikel optagelse, udførte vi konfokalmikroskopi analyse. Nanopartikler (20 µg/fisk, 50 µL) og PBS (kontrol) blev mundtligt intuberet til zebrafisk og tarmen blev dissekeret på 5 h post intubation. Afsnittene tarmen blev udarbejdet af en frossen væv metode efter trin 7 (fig. 3A). Konfokal billederne af fluorescerende nanopartikler i tarmen er vist i figur 3B. De fluorescerende nanopartikler blev fundet i zebrafisk tarmen. Vi observerede fluorescens i epitelceller, lamina propria og muskelceller.
For at kontrollere, om vi kunne udpakke høj kvalitet RNA ved vores protokol, analyserede vi RNA ekstraheret fra tarmen med en bioanalyzer (også kaldet RNA analyzer her). Zebrafisk var intuberet mundtligt med PBS (50 µL) eller nanopartikler (20 µg/fisk, 50 µL). Tarmene var dissekeret for RNA udvinding på 24 h post intubation. Vi valgte syv RNA prøver at teste med analysatoren. Vi fandt, at alle de testede RNA prøver har høj RNA integritet numre lige fra 7,9 til 8.9 (figur 4).
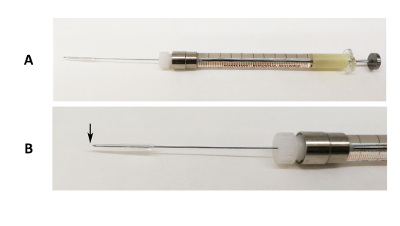
Figur 1 : Mundtlige intubation enhed. (A) billede af en 31 G Luer lock nål fast på en 100 µL sprøjte med silicon tube og pipette spids ende dækker spidsen af nålen. (B) et forstørret billede af nål del. Den sorte pil angiver, hvor pipette spids ende overstiger spidsen af nålen. Venligst klik her for at se en større version af dette tal.

Figur 2 : Flow flowcytometri analyse af fluorescerende nanopartikler i zebrafisk tarmen via mundtlige intubation. Zebrafisk blev behandlet med PBS eller fluorescerende IBsTNFα (100 µg) for 5 h og 24 h, henholdsvis. (A) repræsentative histogrammer af fluorescens intensitet. (B) Dot observationsområder graf af fluorescerende celler procent. Hver Grøn prik repræsenterer procentdelen af fluorescerende celler i en individuel, n ≥4. Data repræsenterer gennemsnit ± standardfejl af middelværdien (SEM). Forskelle blev analyseret ved hjælp af en-vejs ANOVA. Betydelige forskelle med hensyn til kontrol (**, p < 0,01) venligst klik her for at se en større version af dette tal.

Figur 3 : Billeder af konfokalmikroskopi analyse. Fisk blev mundtligt intuberet med PBS eller 20 µg/fisk fluorescerende nanopartikler. Tarmen var dissekeret på 5 h post intubation. (A) zebrafisk tarmen indlejret i OCT forbindelser. Tarmen blev placeret med den naturlige orientering af et "Z" figur (a: forreste ende; p: bageste ende). (B) konfokalmikroskopi billeder af zebrafisk tarmen. De hvide pile viser, at de fluorescerende nanopartikler er taget op i tarmslimhinden. Venligst klik her for at se en større version af dette tal.

Figur 4 : RNA analyzer virtuelle gel billede viser RNA ekstraheret fra 7 zebrafisk tarme stikprøven post intubation. Sample nummer 1 og 2 er PBS intuberet grupper og sample nummer 3 til 7 er nanopartikel intuberet grupper. RNA integritet numre (RIN) gives nederst lige fra 7,9 til 8,9. Venligst klik her for at se en større version af dette tal.
| Operatør | Volumen | # fisk intuberet | Gennemsnitlig vægt (g ± SD) |
# dødsfald | Dødelighed (%) |
| RASMUSSEN | 30 ΜL | 22 | 0,88 ± 0,14 | 3 | 13.6 |
| RASMUSSEN | 30 ΜL | 17 | 0,93 ± 0,19 | 0 | 0 |
| JØRGENSEN | 50 ΜL | 19 | 1.23 ± 0.31 | 1 | 5.2 |
| JØRGENSEN | 50 ΜL | 30 | 1.08 ± 0,40 | 2 | 6.6 |
| I alt | 88 | 1,03 ± 0,16 | 6 | 6.8 | |
| SD: standardafvigelsen for middelværdien | |||||
Tabel 1: Sammenligning af zebrafisk dødelighed forårsaget af to operatører, der anvender protokollen. Operatør identifikationskode, intuberet volumen, nummeret fisk og fisk gennemsnitlige vægt i gram (g) er vist.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne protokol er en forbedring af den tidligere beskrevne teknik til mundtlige intubation af Collymore et al. 4 vores protokol beskriver i detaljer den mundtlige intubation metode og omfatter udarbejdelse af tarmen for downstream analyser. Vores metode forbedrer fisk manipulation hastighed giver mulighed for en person til at udføre den hele protokol hurtigt, uden megen variation mellem operatører. Et væsentligste forskel i vores protokol med de foregående er at vi evaluere succesen med en mundtlig intubation eksperiment ikke kun ved observation af dyr for trivsel (f.eks. ingen blødning) og for ingen lækage af væske administreres, men også ved at kontrollere optagelsen af en bioaktive nanopartikel i tarmen ved hjælp af downstream analyse (flowcytometri, Konfokal mikroskopi og qPCR). Vi viser, at intuberet fluorescently mærket nanopartikler blev fundet i tarmen.
På den praktiske side, intubation udstyr er billige, præcise og kan genbruges: den grundlæggende enhed er lavet af genbrugeligt 100 µL glas (fxHamilton) sprøjte koblet til en 31 G kanyle med et stykke af silicium på toppen. Et snit sterile tip er placeret over silicium tube og kan ændres for hver individuel administration. Sprøjten er genanvendelige, og de tynde nåle tillader intubere små fisk med en høj mulighed for succes. Derudover kunne cut sterile spidsen placeres direkte over nålen uden silikone slange, som tillader intubation udstyr lettere skal foretages i et laboratorium. Den administrerede bioaktive foderblandinger er klart synlig, og en korrekt forvaltning kan overvåges nemt. Et kritisk trin i proceduren intubation er posten nål. Det er vigtigt, at nålen ikke vippes eller indsat for meget for at undgå perforering gællerne. Dødelighed observeret med denne metode er meget lav (ca. 7%) og afhænger af størrelsen på fisken. Gill perforation er den mest almindelige årsag til fisk død, og når det sker fisk dør inden for den første time. Selv om fisk på 0,5 g kan nemt intubated er optimal fisk størrelse ca. 1 g. En anden forskel med metoden udviklet af Collymore et al. er, at fisken er fastede for 48 h for at være sikker på at mave-tarmkanalen er tom. Hele intubation procedure kan gøres meget hurtigt (30 dyr/h) ved én operatør og vigtigere, metoden er overensstemmelse mellem forskellige operatører4. Metoden intubation er let at lære og kræver ikke meget praksis at mestre.
Tarmen dissektion procedure skal udføres korrekt for at opnå god kvalitet prøver til flowcytometri, Konfokal og qPCR analyser. Det vigtige skridt er på dette tidspunkt dissektion af hele tarmen; den bageste del er skrøbelige og let at miste. Når tarmen er dissekeret, kan det behandles yderligere til flowcytometri (2 h protokol), qPCR analyse (2 h protokol indtil total RNA isolering) eller Konfokal mikroskopi (1 h har prøver klar til cryosection). Det er meget vigtigt at holde styr på orienteringen af tarmen, især for Konfokal mikroskopi. Flowcytometri analyse kræver hurtig behandling, og proceduren kan ikke stoppes før afslutningen. Mens RNA isolering og prøver forberedt til cryosection kan blive korrekt gemt og forarbejdet til enhver tid. Til flowcytometri, god kvalitet prøver uden vragrester sammenklumpning maskinen kan isoleres med denne metode og hurtig analyse for tilstedeværelse af fluorescerende celler kan udføres nemt på enkeltpersoner. RNA overvågning viste, at høj kvalitet RNA kan isoleres fra tarmen tillader analyse af enkelte fisk af qPCR. Endelig trinvis cryosection forberedelse til Konfokal mikroskopi vigtige strukturelle protein nanopartikel optagelse. Vores metoder giver således en model for at teste dynamikken i mundtlig forebyggelse eller andre forbindelser i tarmen.
Begrænsninger i vores undersøgelse er størrelsen af fisken, da vi ikke teste administration i fisk mindre end 0,5 g og anvendelse af en kemisk anæstesi til adstadige dyrene. Nogle forfattere bruge koldt vand (0-4 ° C) til bedøver zebrafisk18 men i forbindelse med dyrs velfærd og europæiske retlige begrænsninger har vi besluttet at MS-222 var den foretrukne metode.
For zebrafisk tilbyder mange fordele i forhold til andre modelsystemer, herunder et komplet sæt af genet data og de tilgængelige transgene linjer. Immunologists angive de transgene linjer (f.eks. Tg mpx:GFP og Tg mpeg1:GFP) en scene til i vivo observation af immunceller såsom makrofager og neutrofiler19,20. Kombinere vores mundtlige intubation og downstream analyse med transgene linjer, kunne være ideel til at identificere de celletyper, der involverer i optrækket, transport og behandling af orale vacciner, nanopartikler og patogener i fisk.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer, at ingen konkurrerende interesser findes.
Acknowledgments
Dette arbejde blev støttet af tilskud fra det spanske ministerium for videnskab, Europa-Kommissionen og AGAUR midler til NN (AGL2015-65129-R MINECO/FEDER og 2014SGR-345 AGAUR). RT afholder et PhD legat fra AGAUR (Spanien), JJ blev støttet af et ph.d.-stipendium fra Kina stipendium Rådet (Kina) og NN er understøttet af Ramón y Cajal-programmet (RYC-2010-06210, 2010, MINECO). Vi takker Dr. Torrealba for ekspertrådgivning i protein produktion, N. Barba fra "Servei de Microscopia" og Dr. M. Costa fra "Servei de Citometria" af Universitat Autònoma de Barcelona for nyttige tekniske bistand.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




