Summary
Protokollet beskrivs intubating vuxen zebrafiskar med en biologisk; sedan dissekera och förbereder tarmen för flödescytometri, konfokalmikroskopi och qPCR. Denna metod tillåter administration av bioaktiva föreningar att övervaka tarmens upptag och den lokala immunförsvaret stimulans framkallat. Det är relevant för att testa intestinal dynamiken i oral profylax.
Abstract
De flesta patogener invadera organismer genom deras slemhinna. Detta är särskilt sant i fisk eftersom de utsätts kontinuerligt för mikrobiell-rika vatten. Det är önskvärt att utveckla effektiva metoder för muntliga leverans av immunstimulatorer eller vacciner, som aktiverar immunförsvaret mot infektionssjukdomar. Utforma förebyggande verktyg, behövs bra experimentella modeller för att testa deras prestanda. Här visar vi en metod för oral intubation av vuxen zebrafiskar och en uppsättning förfaranden att dissekera och förbereda tarmen för flödescytometri, konfokalmikroskopi och kvantitativa polymerasen kedjar reaktion (qPCR) analys. Med detta protokoll, kan vi just administrera volymer upp till 50 µL till fisk väger cirka 1 g snabbt och enkelt, utan att skada djuren. Denna metod tillåter oss att utforska direkt i vivo upptaget av fluorescently märkta föreningar genom tarmslemhinnan och immunmodulerande kapacitet sådan biologics på den lokala platsen efter intubation. Genom att kombinera nedströms metoder såsom flödescytometri, histologi, qPCR och konfokalmikroskopi av intestinal vävnad, kan vi förstå hur immunstimulatorer eller vacciner ska kunna passera intestinal mucosal hindren, passera genom lamina propria, och nå muskeln, att utöva en effekt på tarmens slemhinnor immunsystemet. Modellen kan användas för att testa kandidaten oral profylax och leveranssystem eller lokala effekten av oralt administrerat bioaktiva föreningar.
Introduction
Målet med denna artikel är att beskriva på djupet en enkel metod för oral intubation av zebrafiskar, tillsammans med användbar associerade nedströms förfaranden. Muntliga intubation med zebrafisk har blivit en praktisk modell i studien av infektionssjukdom dynamics, oral vaccin/immunostimulant, drog/nanopartiklar upptag och effekt och tarmens slemhinnor immunitet. Zebrafiskar muntliga intubation har exempelvis använts i studien av Mycobacterium marinum och Mycobacterium peregrinum infektion1. Lovmo et al. även använt framgångsrikt denna modell för att leverera nanopartiklar och M. marinum till mag-tarmkanalen av vuxen zebrafiskar2. Dessutom används Chen et al. zebrafiskar muntliga intubation för att visa att droger inkapslat av nanopartiklar, när administrerade via mag-tarmkanalen, transporterades över blod hjärna barriären3. Dessa författare utförs intubation baserat på den gauvage metod som beskrivs av Collymore o.a. 4 med vissa ändringar. De dock inte ge ett mycket detaljerade protokoll som beskriver förfarandet för oral intubation. Här presenterar vi en metod för oral intubation av vuxen zebrafiskar byggnad på Collymore o.a. 4 vi ytterligare omfattar utarbetandet av tarmen för relevanta efterföljande analys av flödescytometri, konfokalmikroskopi och qPCR.
Tarmen och särskilt dess slemhinna är den första linjen försvar mot infektion och den primära platsen näringsupptag5. När de epitelceller och antigen-presenterande celler inom slemhinnor hinder uppfatta varningssignaler, utlöses en omedelbar medfödda immunsvar. Nästa, mycket specifika adaptiva immunsvaret är etablerad av T- och B-lymfocyter6,7. Utvecklingen av orala vacciner är ett nuvarande fokusområde i vaccinologi. Sådana vacciner skulle vara ett effektivt verktyg att skydda organismen på utsatta platser på grund av den specifika Svaren av immunceller i mukosa-associerad lymfoid vävnad (MALT)8,9. I vattenbruk har mucosal vacciner uppenbara fördelar jämfört med injicerbara vacciner. De är praktiska för massvaccinering, mindre arbetsintensiva, är mindre stressande för fisken, och kan ges till unga fiskar. Dock måste slemhinnor vaccinkandidater nå det andra gut-segmentet utan att denatureras i den orala miljön. De måste också passera slemhinnor hinder för att få tillgång till antigenpresenterande celler (APC) att förmå lokala eller systemiska Svaren10. Provning av slemhinnor upptaget genom kandidat muntliga antigener och deras leverans system, är samt immunsvar framkallat, därför viktiga i utvecklingen av orala vacciner.
I biomedicinsk sammanhang, utveckla en modell för att testa biologiska effekter av föreningar efter oral intubation är av växande intresse. Många av de anatomiska och fysiologiska funktionerna i tarmen bevaras mellan tidigkambriska härstamningar, med däggdjur och bony fiskar11. Denna muntliga intubation modell ansluten till nedströms analys kan vara ett verktyg för att ge insikter i människans biologi, liksom en testbana för biologiska läkemedel eller andra ämnen i vivo.
Protokollet muntliga intubation kan utföras av en operatör, t.ex., framgångsrikt administrera upp till 50 µL av den protein nanopartiklar suspensionen att fiska väger 1 g, med en hög överlevnad. Proceduren är enkel att konfigurera och snabb; 30 fisk kan vara intuberade i 1 h. Protokollet för tarmen förberedelse är nyckeln till att ge kvalitet cell- och prover för efterföljande analys. Det ges exempel på nedströms resultat som visar protokollets nyttan i att erhålla data relaterade till tarmens upptag och isolera kvalitet RNA för qPCR. Protokollet skulle vara till stor nytta för dem som behöver en passande modell att testa dynamiken i oral profylax eller andra föreningar i tarmen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alla experimentella rutiner som innefattar zebrafiskar (Danio rerio) bemyndigades av etikkommitté av Universitat Autònoma de Barcelona (CEEH nummer 1582) i samförstånd med de internationella vägledande principer för forskning som involverar djur ( EU 2010/63). Alla experiment med levande zebrafiskar framfördes på 26 – 28 ° C.
1. förbereda utrustningen för Oral Intubation
- Placera ca 1 cm på en fin silikon tub på 31 G Luer lås nål att täcka nålspetsen.
- Skär 10 µL sterilt filter pipett spets (cirka 2 cm), ta finare slutet och placera den över silikon röret som en slida. Kontrollera pipetten sträcker sig bortom spetsen på nålen att undvika skadade djuret.
- Fäst nålen en 100 µL Luer lås spruta.
Obs: Skölj alltid med etanol och sedan fosfatbuffrad koksaltlösning (PBS, se material) grundligt mellan behandlingarna.
2. de lösningar som krävs
- Förbereda 150 mg/L (för anestesi) eller 300 mg/L (för dödshjälp) etyl 3-aminobensoat methanesulfonate (MS-222) lösning med vatten från akvariet där zebrafiskar bibehålls. Fyll en liten tank med 1 L av bedövningsmedel lösning och hålla det kolsyrat.
- Fyll en annan liten tank med 1 L akvarievatten utan MS-222 för fisk återhämtning och hålla det kolsyrat.
- Gör 50 mL 1 x PBS från en 10 x sterila stamlösning.
- För flödescytometri analys/intestinal cell isolering, förbereda tillräckligt frisk 0,15% kollagenas typ IV lösning för 1 mL per fisk från en stamlösning eller pulver i Dulbeccos modifierade eagle medium (DMEM) med 1% v/v penicillin och streptomycin (se material). Gör alikvoter (1 per fisk) med 1 mL i 2 mL centrifugrör. Hålla vid 4 ° C fram till 30 min innan steget dissektion.
- För confocal microscopy/prov fixering, bereda 50 mL färsk 4% PARAFORMALDEHYD (PFA) lösning i PBS eller Tina en stamlösning från-20 ° C frys i dragskåp.
Varning: PFA är giftiga. Läs materialsäkerhetsuppgifter innan du arbetar med den. Handskar och skyddsglasögon bör användas, och alltid lämna lösningar inuti ett dragskåp.
3. förberedelse av fluorescerande nanopartiklar Suspension
- Etikett protein nanopartikelportföljen med Atto-488 NHS ester (se Tabell för material) eller en lämplig fluorescerande färgämne enligt tillverkarens anvisningar.
- Återsuspendera nanopartiklarna i 0,1 M natriumbikarbonat buffert på koncentrationen av 2 mg/mL.
- Lös den Atto 488 NHS estern i amine-fri dimetyl sulfoxid (DMSO) vid 2 mg/mL. Hålla en alikvot av 10 µL kontrollera märkning effektiva (steg 3,7 – 3.8).
- Blanda nanopartiklarna och Atto 488 NHS ester på en molar förhållandet 1:2 (protein: färgämne) under omrörning i mörkret.
- Snurra ner de märkta nanopartiklarna genom centrifugering vid 8000 x g under 10 minuter vid rumstemperatur, avlägsna supernatanten och hålla den för att kontrollera märkning effektivitet (steg 3,7 – 3.8).
- Tvätta de märkta nanopartiklarna genom omblandning i 1 mL 0,1 M natriumbikarbonat buffert av vortexa och pipettering upp och ner. Sedan Kassera supernatanten genom centrifugering vid 8000 x g under 10 minuter vid rumstemperatur. Upprepa steg 3.6 för 5 gånger.
- Återsuspendera pelleten i 5 mL 0,1 M natriumbikarbonat buffert i en 15 mL centrifugrör och göra alikvoter av den fluorescerande nanopartiklar i 1,5 mL centrifugrör (30 portioner). Snurra ner vid 8000 x g under 10 minuter vid rumstemperatur, avlägsna supernatanten och förvaras vid-80 ° C skyddas från ljus.
-
Mäta märkning effektiviteten med hjälp av en microvolume spektrofotometer.
- Ta 1 µL av den ursprungliga Atto 488 lösningen hålls från steg 3.3 och späd det ytterligare i DMSO (t.ex., 1:20 enligt volymförhållandet). Detta är den volym som brukade få molar förhållandet av protein nanopartiklar och Atto 488 mix vid steg 3,4.
- Ta 1 µL sparade supernatanten från märkning reaktionen i steg 3.5. Mäta absorptionen (abs) på = 501 nm. Andelen av märkning är:
(
- Innan experimentet, utarbeta nanopartiklar fjädringen på önskad koncentration med 1 x PBS lösning.
4. zebrafiskar Anesthetization och muntliga Intubation
- Snabb fisk (> 0,5 g) minst 48 h innan experimentet att tömma tarmen.
- Flytta fisken (12 fisk) till de experimentella tankarna (6 L) en natt innan experimentet att tillåta acklimatisering12.
- Vortex nanopartiklar lösningen väl (t.ex. 2500 rpm och 30 s) och dra upp önskad volym nanopartiklar suspension (t.ex. 20 – 50 µL) in i sprutan som bifogas den skydda nålen.
- Placera fisken i en pärlande 150 mg/L MS-222 lösning (se avsnitt 2) tills de sjunker till botten av tanken och inte svarar på en stjärtfena nypa; denna process tar mindre än 5 min.
- Snabbt överföra sövda fisken med netto till en våt plastbricka, orientera djuret horisontellt för att möta nålen och omedelbart börja den muntliga intubation.
- Försiktigt stödja fisken med ena handen och öppna munnen med den andra handen som använder den skydda nålen. Försiktigt in nålen ner matstrupen till ca 1 cm från munöppningen.
Obs: Operatören kan känna ett lätt motstånd när slutet av pipettspetsen har passerat gill. Se till att inte vinkla posten nål för mycket som kan perforera gill. - Injicera långsamt nanopartiklar suspensionen till fisken. Kontrollera upphängningen inte flödar utåt genom gälarna eller mun.
- Försiktigt ta bort nålen och placera fisken i återhämtning tanken (se avsnitt 2). Återhämtningen tar vanligtvis inom 1 min.
- Kontrollera fisken noga för någon avvikelse (t.ex., blödning vid gälarna är ett tecken på perforation).
- När fisken har återhämtat sig, återföra dem till de experimentella tankarna.
5. zebrafiskar tarmen dissektion
- Efter en angiven tidsperiod efter intubation (t.ex. 5 h eller 24 h), placera fisken med ett netto till 300 mg/L MS-222 lösning för dödshjälp (se avsnitt 2). Kontrollera operculum slutar röra sig och det finns ingen svans nypa reflex. Fem minuter är normalt tillräckligt.
- Plocka upp euthanized djuret med ett nät och placera den på ett filterpapper.
Obs: Pappersfiltret är mycket användbar för att ta bort den självhäftande vävnaden längs tarmen. - Använda skarp dissektion sax, göra en halvcirkelformad snitt från anus till operculum och öppet snitt med fin pincett. Skär båda ändarna av tarmen, ta ut alla de inre organen och placera dem på pappersfiltret.
FÖRSIKTIGHET: Arbeta snabbt för att minska cellernas ämnesomsättning och död.
Obs: Ta bort alternativt självhäftande vävnaden i PBS och på is. - Separata tarmen från inre organ och se till att hålla sin inriktning (Anterior bakre intestinal segment) och sträcka ut. Den främre delen av tarmen är oftast bredare än bakre segment. Var noga med för att få alla tarmen när dissekera.
Obs: Bakre slutet är ganska fina och ömtåliga i småfisk och kan bryta av, särskilt i djur < 0,7 g. - Rulla tarmen på filterpapperet med pincett för att lossa den självhäftande vävnaden från tarmen.
- Fortsätta att förbereda tarmen för nedströms analyser (avsnitt 6, 7 och 8).
6. förbereda intestinala celler för flödescytometri
- Förbered i förväg alikvoter av 0,15% kollagenas lösning (se avsnitt 2.4).
Obs: Alikvoter bör vara rumstempererat innan du fortsätter. - Valfritt: Fortsätta från steg 5,5, springa öppen tarmen längdriktningen och tvätta med 1 x PBS.
- Använd pincett, placera tarmen i de 2 mL centrifugrör fylld med 0,15% kollagenas lösning.
- Placera rören på en vertikal laboratorium rotator för 1 h i rumstemperatur i mörkret.
- Placera tarmen på en 100 µm cell SIL stöds över ett 50 mL centrifugrör. Bryta upp tarmen med en 5 mL sprutkolven, tvätta 3 gånger med 1 x PBS, samla flödet genom prov i de 50 mL centrifugröret.
- Centrifugera i 50 mL centrifugrör vid 400 x g i 10 minuter vid 4 ° C.
- Pipettera försiktigt bort de flesta av supernatanten samtidigt inte förlora de celler, som kan kopplas till slem.
- Omsuspendera intestinal cellerna längst ned i centrifugröret med 500 µL 1 x PBS och hålla på is tills flödescytometri analys
- Filterprov genom en 30 µm cell filter i 5 mL runda botten rör för flödescytometri.
- Ställa in parametrar (t.ex. antalet celler för analys, regionen av intresse, spänning och ersättning, urval av detektorer) på en cytometer utrustning (se material).
- Omedelbart analysera cellerna på en cytometer, följa instruktionerna för användning13.
7. förbereda inälvan kryosnitt konfokalmikroskopi
- Fyll plast mögel (se Tabell för material) till halva volymen med optimal skärtemperatur (O.C.T.) förening.
- Fortsätter från steg 5,5 och omedelbart efter dissektion, Placera försiktigt tarmen i plast mögel. Kontrollera att tarmen är helt inbäddade i O.C.T. förening. Om det behövs, lägga till mer O.C.T. förening i plast mögel.
Obs: Det rekommenderas att placera tarmen med en ”Z” form i O.C.T. förening för att enkelt följa dess naturliga läggning. - Placera plast mögel på torris tills den går ogenomskinlig (mindre än en minut).
- Lagra plast mögel vid-80 ° C för långtidsanvändning eller process omedelbart med hjälp av följande procedur.
Obs: Protokollet kan pausas här. - Skiva den frysta inälvan 10 µm sektioner eller lämplig tjocklek med en kryostat vid-20 ° C.
- Samla in avsnittet tarmen med en fin pensel på ett objektglas.
- Fördjupa bilden i 4% PFA under 15 minuter vid rumstemperatur fixar provet.
Varning: PFA är giftiga. Läs materialsäkerhetsuppgifter innan du arbetar med den. Handskar och skyddsglasögon bör användas, och alltid lämna lösningar inuti ett dragskåp. - Tvätta i bilden 3 gånger med 1 x PBS, 10 min varje.
- Lägg en droppe av monteringsmedium och placera ett täckglas över preparatet.
Obs: Protokollet kan pausas här. - Iaktta provet under en confocal Mikroskop vid lämplig förstoring.
8. förbereder tarmen för realtid qPCR (RT-qPCR)
- Fortsätter från steg 5,5, satte tarmen i en kryogen flaska och snabbt frysa tarmen i flytande kväve och förvaras vid-80 ° C fram till användning.
Obs: Protokollet kan pausas här. - För homogenisering, tillsätt 200 µL av 2% (v/v) kyld 1-Thioglycerol/homogenisering lösning (se Tabell för material) eller alternativa homogenisering lösning i inälvan urvalet.
- Arbeta snabbt, homogenisera inälvan provet på is med en laboratorium Homogenisatorer med hög hastighet (inställd på 25-30.000 varv/min) tills ingen synlig vävnad fragment återstår. 3 gånger för 5 s är oftast tillräcklig.
- Isolera RNA med hjälp av ett kommersiellt kit (se Tabell för material) enligt tillverkarens anvisningar14 eller en lämplig alternativ metod. Som behövs, lagra RNA vid-80 ° C för långvarig användning.
Obs: Protokollet kan pausas här. - Kvantifiera den RNA-koncentrationen med en spektrofotometer15 och utvärdera kvaliteten med en RNA analyzer16.
- Laga 1 µg eller en lämplig mängd cDNA använder ett cDNA syntes kit enligt tillverkarens anvisningar.
Obs: Protokollet kan pausas här. För qPCR-analys, vänligen följ de MIQE riktlinjer17. - Utforma lämpliga primer par för gen/s intresse.
- Välj en lämplig referens-gen och analysera uttrycket av varje gen genom en RT-qPCR-detection system med hjälp av ett kommersiellt kit (se material).
Obs: exempelvis lägga till 5 µL SYBR green supermix, 0,5 µM grundfärg, 2,5 µL utspädda cDNA och 1,5 µL av vatten i en slutlig volym av 10 µL för varje brunn av qPCR plattan.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Sebrafisken (Genomsnittlig vikt: 1,03 ± 0,16 g) av blandade kön var framgångsrikt intuberade med olika rekombinant protein nanopartiklar (bakteriell inkludering organ) med vår hemgjorda muntliga intubation enhet (figur 1). Vi har framgångsrikt utfört den muntliga intubation och uppnått en låg genomsnittlig andel dödlighet (6,8%) (Tabell 1). Zebrafiskar var antingen intuberade med 30 µL eller 50 µL av nanopartiklar suspensioner och dödligheten beräknades inom 24 h efter intubation. Experimenten utfördes av två aktörer, R hade mindre erfarenhet av att arbeta med zebrafiskar muntliga intubation än J. Resultaten visade att även en ny operatör självständigt kunde utföra den muntliga intubation experimentera och uppnå enkelt en hög överlevnad av detta protokoll. Från vår erfarenhet, den optimala storleken är 1 g, men vi har framgångsrikt intuberade fisk så liten som 0,5 g.
Att bättre förstå om de fluorescerande nanopartiklarna IBsTNFα (ett cytokin som rekombinant protein nanostrukturerade som inkludering organ) var levereras till zebrafiskar av vår metod och tas upp av zebrafisk tarmen eller inte, vi utfört flödescytometri analys. Nanopartiklarna (100 µg/fisk, 50 µL) och PBS (kontroll) administrerades oralt (genom intubation) till zebrafiskar och tarmen var dissekeras på 5 h och 24 h post intubation. Totala intestinala celler var förbereds för steg 6 och analyseras av detekterar fluorescens utsläpp signalen. De representativa histogrammen för fluorescensintensiteten och dot tomterna av fluorescerande cell procentsats visas i figur 2. Tätheten av fluorescerande celler är klart högre i nanopartiklar intuberade gruppen jämfört med kontrollgruppen i både 5 och 24 h (figur 2A). Procentsatserna för fluorescerande celler är betydligt högre i både 5 h (46,3%) och 24 h (43,0%) av nanopartiklar intuberade grupper (figur 2B).
Fortsätta att undersöka vilken del av intestinal lagret är involverad i nanopartiklar upptaget, genomförde vi konfokalmikroskopi analys. Nanopartiklarna (20 µg/fisk, 50 µL) och PBS (kontroll) var oralt intuberade till zebrafiskar och tarmen var dissekeras på 5 h post intubation. De inälvan delarna utarbetades av en fryst vävnad metod enligt steg 7 (figur 3A). Confocal bilderna av fluorescerande nanopartiklar i tarmen visas i figur 3B. De fluorescerande nanopartiklarna hittades i zebrafiskar tarmen. Vi observerade fluorescensen i epitelceller, lamina propria och muskelceller.
För att kontrollera om vi kunde extraktet högkvalitativa RNA av våra protokoll, analyserade vi RNA extraherade från tarmen med en bioanalyzer (också kallad RNA analyzer här). Zebrafiskar var intuberade oralt med PBS (50 µL) eller nanopartiklarna (20 µg/fisk, 50 µL). Tarmen var dissekeras för RNA-extraktion på 24 h efter intubation. Vi valt ut sju RNA prover att testa med analyzer. Vi fann att alla testade RNA prover har hög RNA integritet nummer från 7,9 till 8,9 (figur 4).
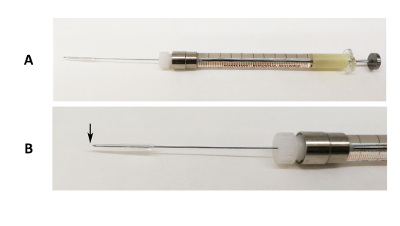
Figur 1 : Oral intubation enhet. (A) bild av en 31 G Luer lås nål fast på en 100 µL spruta med kisel tube och pipett tip slutet som täcker spetsen på nålen. (B) en förstorad bild å nålen. Den svarta pilen anger där pipett tip slutet överstiger spetsen på nålen. Klicka här för att se en större version av denna siffra.

Figur 2 : Flow flödescytometri analys av fluorescerande nanopartiklar i zebrafiskar tarmen via oral intubation. Zebrafiskar behandlades med PBS eller fluorescerande IBsTNFα (100 µg) för 5 h och 24 h, respektive. (A) representativa histogrammen för fluorescensintensiteten. (B) Dot tomter grafen av fluorescerande celler procentsats. Varje grön prick representerar procentandelen av fluorescerande celler i en individuell, n ≥4. Uppgifterna representerar medelvärde ± standardavvikelsen för medelvärdet (SEM). Skillnader analyserades med envägs ANOVA. Signifikanta skillnader med avseende på kontroll (**, p < 0,01) Klicka här för att se en större version av denna siffra.

Figur 3 : Bilder av konfokalmikroskopi analys. Fisk var oralt intuberade med PBS eller 20 µg/fisk fluorescerande nanopartiklar. Tarmen var dissekerade på 5 h post intubation. (A) zebrafiskar tarmen inbäddade i OCT föreningar. Tarmen var placerad med naturliga orienteringen för en ”Z” form (a: framändan; p: bakre änden). (B) konfokalmikroskopi bilder av zebrafisk tarmen. De vita pilarna visar att de fluorescerande nanopartiklarna tas upp i tarmslemhinnan. Klicka här för att se en större version av denna siffra.

Figur 4 : RNA analyzer virtuella gel bilden visar RNA extraherade från 7 zebrafiskar tarmar provtas post intubation. Prov nummer 1 och 2 är PBS intuberade grupper och prov nummer 3 till 7 finns nanopartiklar intuberade grupper. RNA integritet nummer (RIN) ges längst ned allt från 7,9 till 8,9. Klicka här för att se en större version av denna siffra.
| Operatör | Volym | # fisk intuberade | Medelvikten (g ± SD) |
# dödsfall | Dödlighet (%) |
| R | 30 ΜL | 22 | 0,88 ± 0,14 | 3 | 13,6 |
| R | 30 ΜL | 17 | 0,93 ± 0,19 | 0 | 0 |
| JANSSON | 50 ΜL | 19 | 1,23 ± 0,31 | 1 | 5.2 |
| JANSSON | 50 ΜL | 30 | 1,08 ± 0,40 | 2 | 6.6 |
| Totalt | 88 | 1,03 ± 0,16 | 6 | 6,8 | |
| SD: standardavvikelsen för medelvärdet | |||||
Tabell 1: Jämförelse av zebrafisk dödlighet orsakad av två aktörer som använder protokollet. Operatör identifieringskoden, intuberade volymen, antalet fisk och fisk genomsnittliga vikt i gram (g) visas.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Detta protokoll är en förbättring av den tidigare beskrivna tekniken för oral intubation av Collymore o.a. 4 våra protokoll i detalj beskriver metoden muntliga intubation och omfattar utarbetande av tarmen för nedströms analyser. Vår metod förbättrar fisk manipulation hastigheten att tillåta en person att utföra hela protokollet snabbt, utan mycket variation mellan operatörer. En största skillnaden i våra protokoll med tidigare är att vi utvärdera framgången för ett muntligt intubation experiment inte bara genom observation av djuret för välbefinnande (t.ex. ingen blödning) och inget läckage av vätska ges, men också genom att kontrollera intaget av en bioaktiva nanopartiklar i tarmen med efterföljande analys (flödescytometri, konfokalmikroskopi och qPCR). Vi visar att intuberade fluorescently märkt nanopartiklar hittades i tarmen.
På den praktiska sidan, intubation utrustningen är billig, exakt och återanvändbara: grundläggande enheten är gjord av en återanvändbar 100 µL glas (t.ex., Hamilton) spruta kopplad till en 31 G nål med en bit av kisel på toppen. En skär sterila spets placeras över kisel röret och kan ändras för varje enskild administrering. Sprutan är återanvändbara och tunna nålen tillåter intubating liten fisk med hög möjlighet till framgång. Dessutom kunde skära sterila spetsen placeras direkt över nålen utan silicon röret som tillåter intubation utrustning lättare att göras i ett laboratorium. Den administrerade bioaktiva föreningen syns tydligt, och en korrekt administrering kan övervakas enkelt. Ett avgörande steg under förfarandet för intubation är posten nål. Det är viktigt att nålen inte lutas eller införas för mycket för att undvika perforerande gälarna. Den dödlighet som observerats med denna metod är mycket låg (cirka 7%) och beror på storleken på fisken. Gill perforation är den vanligaste orsaken till fisk död och när det händer fisk dör inom den första timmen. Även om fisk av 0,5 g kan vara enkelt intuberade är den optimala storleken ca 1 g. En annan skillnad med den metod som utvecklats av Collymore o.a. är att fisken fastar 48 h för att vara säker på att mag-tarmkanalen är tom. Förfarandet för hela intubation kan göras mycket snabbt (30 djur/h) av en operatör och allt metoden är konsekvent mellan olika operatörer4. Metoden intubation är lätt att lära och kräver inte mycket praktik att bemästra.
Inälvan dissektion proceduren måste utföras korrekt för att få bra kvalitet prover för flödescytometri, confocal och qPCR analyser. Det kritiska steget är på denna punkt dissektion av hela tarmen; den bakre delen är bräcklig och lätt att förlora. När tarmen är dissekeras, kan det bearbetas vidare för flödescytometri (2 h protokoll), qPCR-analys (2 h protokoll förrän total RNA isolering) eller konfokalmikroskopi (1 h ha prov redo för cryosection). Det är mycket viktigt att hålla koll på orienteringen för tarmen, särskilt för konfokalmikroskopi. Flödescytometri analys kräver snabb behandling, och förfarandet kan inte stoppas innan den är slutförd. Medan RNA isolering och prover förberedd för cryosection ordentligt kan lagras och bearbetas när som helst. För flödescytometri, god kvalitet prover utan skräp klumpar maskinen kan isoleras med denna metod och snabb analys för förekomst av fluorescerande celler kan utföras enkelt på individer. RNA kvalitetsövervakning visade att hög kvalitet RNA kan isoleras från inälvan möjliggör analys av enskilda fiskar av qPCR. Slutligen ger cryosection förberedelserna för konfokalmikroskopi viktig strukturell information om protein nanopartiklar upptaget. Våra metoder ger således en modell för att testa dynamiken i oral profylax eller andra föreningar i tarmen.
Begränsningar i vår studie är storleken på fisken eftersom vi inte testa administration i fisk mindre än 0,5 g och användning av en kemisk bedövningsmedel till lugna djur. Vissa författare använda kallt vatten (0 – 4 ° C) att söva zebrafiskar18 men i samband med djurens välbefinnande och europeiska rättsliga begränsningar vi beslutat att MS-222 var metoden för val.
Zebrafiskar erbjuder många fördelar jämfört med andra modellsystem inklusive en komplett uppsättning av genen data och de tillgängliga transgena linjerna. För Immunologer ange de transgena linjerna (t.ex. Tg mpx:GFP och Tg mpeg1:GFP) en scen för i vivo observationen av immunceller som makrofager och neutrofiler19,20. Kombinera våra muntliga intubation och efterföljande analys med transgena linjerna, kunde vara perfekt för att identifiera de celltyper som involverar upptaget, transport och behandling av orala vacciner, nanopartiklar och patogener i fisk.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna förklarar att det finns inga konkurrerande intressen.
Acknowledgments
Detta arbete stöds av bidrag från det spanska ministeriet för vetenskap, Europeiska kommissionen och AGAUR medel till NR (AGL2015-65129-R MINECO/FEDER och 2014SGR-345 AGAUR). RT innehar en pre doktorand stipendium från AGAUR (Spanien), JJ stöddes av en PhD stipendium från Kina stipendium rådet (Kina) och NR stöds av programmet Ramón y Cajal (RYC-2010-06210, 2010, MINECO). Vi tackar Dr. Torrealba för expertråd i proteinproduktion, N. Barba från den ”Servei de Microscopia” och Dr. M. Costa från den ”Servei de Citometria” av den Universitat Autònoma de Barcelona för bra tekniskt stöd.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




