Summary
הפרוטוקול מתאר נלוקסון דג זברה למבוגרים עם ביולוגי; לאחר מכן לנתח, הכנת המעי עבור cytometry, מיקרוסקופיה קונפוקלית ו- qPCR. שיטה זו מאפשרת ניהול של תרכובות ביו לעקוב אחר ספיגת מעיים ואת הגירוי המערכת החיסונית המקומית עורר. זה רלוונטי לבדיקה את הדינמיקה מעיים של אמצעי מניעה שבעל-פה.
Abstract
רוב פתוגנים פולשים אורגניזמים דרך רירית שלהם. זה נכון במיוחד בדגים כפי שהם נחשפים באופן רציף סביבה מים עתירי חיידקים. פיתוח שיטות יעילות עבור משלוח אוראלי של immunostimulants או חיסונים, אשר מפעיל את מערכת החיסון כנגד מחלות זיהומיות, רצוי מאוד. בהמצאת כלי מניעתי, ניסיוניות טוב יש צורך לבחון את הביצועים שלהם. כאן, אנו מראים שיטה לצנרור שבעל-פה של דג זברה בוגרת וערכה של ההליכים כדי לנתח ולהתכונן המעי cytometry, מיקרוסקופיה קונפוקלית וניתוח תגובת שרשרת (qPCR) פולימראז כמותית. עם פרוטוקול זה, אנחנו יכולים בדיוק לנהל אמצעי אחסון עד 50 µL לדוג במשקל כ 1 g בפשטות ובמהירות, מבלי לפגוע החיות. שיטה זו מאפשרת לנו לבחון תפיסה ישירה ויוו של תרכובות fluorescently עם תוויות ברורות על ידי רירית המעי לבין יכולת immunomodulatory של תכשירים כאלה באתר המקומי לאחר צנרור. על ידי שילוב שיטות במורד הזרם כמו cytometry זרימה, היסטולוגיה, qPCR ומיקרוסקופיה קונפוקלית של רקמת המעי, נוכל להבין איך immunostimulants או חיסונים הם מסוגלים לחצות את המחסומים הרירית מעיים, עוברים פרופריה. מוסקולריס, ו להגיע לשריר, הפעלת השפעה על מערכת החיסון הרירית מעיים. המודל יכול לשמש כדי לבחון אמצעי מניעה אוראלי המועמד ו מערכות אספקה או אפקט מקומיים של כל המתחם ביואקטיביות אוראלית.
Introduction
מטרת מאמר זה היא לתאר עומק שיטה פשוטה לצנרור שבעל-פה של דג זברה, יחד עם שימושי משויך הליכים במורד הזרם. אוראלי צנרור באמצעות דג זברה הפך מודל מעשי במחקר של מחלות זיהומיות dynamics, חיסון אוראלי/immunostimulant, ספיגת התרופה/nanoparticle ואת היעילות וחסינות מעיים הרירית. לדוגמה, דג זברה צנרור אוראלי שימש במחקר של זיהום של התחממות עולמית , Mycobacterium peregrinum -1. . Lovmo et al. גם משתמשים בהצלחה מודל זה למסור חלקיקים, התחממות עולמית מ . מערכת העיכול של דג זברה בוגרת2. בנוסף, צ'ן. et al. משמש צנרור אוראלי דג זברה להראות כי סמים כמוס על ידי חלקיקים, כאשר מנוהל באמצעות מערכת העיכול, הוסעו על פני מחסום דם המוח3. מחברים אלה לבצע צנרור המבוסס על שיטת gauvage מתוארת על ידי. Collymore et al. 4 עם מספר שינויים. עם זאת, הם לא סיפקו פרוטוקול מאוד מפורט המתאר את ההליך צנרור אוראלי. כאן, אנו מציגים שיטה לצנרור שבעל-פה של דג זברה בוגרת בונים על. Collymore et al. 4 בהמשך נשלב את הכנת המעי לבדיקה במורד הזרם הרלוונטי על ידי cytometry, מיקרוסקופיה קונפוקלית qPCR.
המעי ורירית במיוחד שלה הוא את השורה הראשונה להגנה מפני זיהום האתר העיקרי של ספיגת התזונתי5. כאשר תאים אפיתל של אנטיגן תאים בתוך מחסומים הרירית תופסים אותות סכנה, תגובה חיסונית מולדת מיידי מופעלת. הבא, התגובה החיסונית מסתגלת ספציפי מאוד היא הוקמה על ידי T ו- B לימפוציטים6,7. פיתוח חיסונים שבעל פה הוא אזור המיקוד הנוכחי ב- vaccinology. חיסונים כאלה יהיה כלי יעיל כדי להגן על האורגניזם באתרים חשופים בשל התגובה ספציפי של תאים חיסוניים ב8,רירית הקשורים רקמות הלימפה (מאלט)9. עופות ומידגה, חיסונים הרירית יש יתרונות ברורים לעומת זריקות חיסונים. הם שימושיים לקבלת חיסון המוני, פחות עתירי עבודה, הן פחות מלחיץ לדג, יכול להיות מנוהל על מנת דגים צעירים. ובכל זאת, החיסון הרירית מועמדים חייבים להגיע על קטע בטן שני מבלי להיות שפגע בסימני בסביבת אוראלי. הם גם חייבים לחצות הרירית המחסומים על מנת לקבל גישה אנטיגן הצגת תאים (נגמ שים) כדי לגרום תגובות מקומיות ו/או מערכתית10. לכן, בדיקה של תפיסה הרירית מושגת על ידי אנטיגנים אוראלי המועמד ומערכות אספקת שלהם, כמו גם התגובה החיסונית עורר, חיוני בפיתוח של חיסונים שבעל-פה.
בהקשר הביו-רפואי, פיתוח מודל לבחון השפעות ביולוגיות של תרכובות לאחר צנרור אוראלי הוא עניין הולך וגדל. רבות מהתכונות אנטומית, פיזיולוגית של המעי נשמרים בין שושלות bilaterian, עם יונקים ודגים כחוש11. מודל זה צנרור אוראלי מחובר ניתוח במורד הזרם יכולה להיות כלי כדי לספק תובנות הביולוגיה האנושית, כמו גם בסיס ביולוגי או אחרים תרכובות ויוו.
פרוטוקול צנרור אוראלי יכול להתבצע על ידי מפעיל אחד, למשל, בהצלחה וניהול עד 50 µL של חלבון nanoparticle ההשעיה לדוג במשקל 1 g, עם שיעור הישרדות גבוהה. ההליך הוא פשוט להגדיר ומהירה; 30 דגים יכול לצנר ב 1 h. הפרוטוקול עבור הכנת המעי היא המפתח לספק דגימות תאים ורקמות איכות לצורך ניתוח מאוחר יותר. דוגמאות של הזרם תוצאות ניתנות אשר מראים את התועלת של הפרוטוקול בקבלת נתונים הקשורים ספיגת מעיים לבודד RNA איכות עבור qPCR. הפרוטוקול תהיה תועלת רבה לאלו הזקוקים מודל מתאים כדי לבדוק את הדינמיקה של אמצעי מניעה אוראלי או תרכובות אחרות במעי.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
כל ההליכים ניסיוני לערב דג זברה (רזבורה rerio) היו מורשה על ידי ועדת האתיקה של Universitat Autònoma דה ברצלונה (CEEH מספר 1582) מסכים עם העקרונות המנחים הבינלאומי עבור המחקר מעורבים חיות ( EU 2010/63). כל הניסויים עם דג זברה בשידור חי בוצעו ב 26 – 28 º C.
1. מכינים את הציוד לצנרור אוראלי
- במקום כ- 1 ס מ של שפופרת סיליקון בסדר על מחט נעל זכוכית 31 G כדי לכסות את מחט.
- גזור פיפטה מסנן סטרילי 10 µL עצה (בערך 2 ס מ), את הקצה עדינה יותר, מעל צינור סיליקון כמו נדן. ודא שפיפטה חורג קצה המחט כדי להימנע ופצעו את החיה.
- לצרף את המחט מזרק נעל זכוכית 100 µL.
הערה: תמיד לשטוף עם אתנול ולאחר מכן buffered פוספט תמיסת מלח (PBS, ראה חומרים) ביסודיות בין הטיפולים.
2. הפתרונות הנדרשים
- להכין 150 מ ג/ליטר (עבור הרדמה) או 300 מ ג/ליטר (עבור המתת חסד) של אתיל 3-aminobenzoate methanesulfonate (MS-222) פתרון עם מים מהאקווריום של איפה נשמרים על דג זברה. למלא טנק קטן עם 1 ליטר של פתרון הרדמה ולשמור אותו מוגזים.
- למלא אחר טנק קטן עם 1 ליטר מים באקווריום ללא MS-222 להחלמה דגים ולשמור אותו מוגזים.
- להפוך 50 מ של PBS x 1 מ 10 x פתרון סטרילי מניות.
- לבידוד תא ניתוח/מעיים cytometry, להכין מספיק collagenase 0.15% טרי IV סוג פתרון 1 מ"ל לכל דג פתרון מניות או אבקת במדיום נשר שונה של Dulbecco (DMEM) עם פניצילין v 1% / v, סטרפטומיצין (ראה חומרים). להפוך aliquots (1 לכל דג) של 1 מ"ל ב 2 mL צינורות צנטריפוגה. שמור ב 4 ° C עד 30 דקות לפני השלב לנתיחה.
- עבור קיבעון מיקרוסקופ קונפוקלי/המדגם, להכין 50 מ של 4% טרי paraformaldehyde (PFA) פתרון PBS או להפשיר פתרון מניות מ-20 ° C מקפיא בשכונה fume.
התראה: PFA רעיל. אנא קרא את גיליון בטיחות חומרים לפני עובד עם זה. כפפות בטיחות משקפיים לענידה ואני תמיד משאירים פתרונות בתוך ברדס fume.
3. הכנת ההשעיה Nanoparticle פלורסנט
- תווית של ננו-חלקיק חלבון עם אסתר NHS אטו-488 (ראה טבלה של חומרים) או של הפלורסנט המתאים על פי הוראות היצרן.
- Resuspend חלקיקים במאגר סודיום ביקרבונט 0.1 M-הריכוז של 2 מ"ג/מ"ל.
- להמיס אסתר אטו 488 NHS ב ללא אמין דימתיל סולפוקסיד (דימתיל סולפוקסיד) ב 2 מ"ג/מ"ל. לשמור על aliquot של µL 10 כדי לבדוק את יעילות תיוג (שלב 3.7 – 3.8).
- לערבב חלקיקים, אסתר אטו 488 NHS-טוחנת יחס של 1:2 (חלבון: צבען) על ידי ערבוב בחושך.
- ספין למטה חלקיקים עם תוויות על ידי צנטריפוגה ב x 8000 g 10 דקות בטמפרטורת החדר, להסיר את תגובת שיקוע ולשמור אותו כדי לבדוק את יעילות תיוג (שלב 3.7 – 3.8).
- רחץ חלקיקים עם תוויות על ידי resuspending ב 1 מ"ל של 0.1 M סודיום ביקרבונט מאגר vortexing ו pipetting למעלה ולמטה. ואח כ לזרוק את תגובת שיקוע על ידי צנטריפוגה ב x 8000 g 10 דקות בטמפרטורת החדר. חזור על צעד 3.6 5 פעמים.
- Resuspend בגדר ב 5 מ של מאגר סודיום ביקרבונט 0.1 M בשפופרת צנטרפוגה 15 מ"ל ולעשות aliquots של ננו-חלקיק פלורסנט צינורות צנטריפוגה 1.5 mL (30 aliquots). ספין למטה ב x 8000 g 10 דקות בטמפרטורת החדר, למחוק את תגובת שיקוע ולאחסן ב-80 מעלות צלזיוס מוגן מפני האור.
-
למדוד את היעילות תיוג באמצעות ספקטרופוטומטרים microvolume.
- 1 µL של הפתרון אטו 488 המקורי מנע שלב 3.3 ואין עוד למהול אותו ב דימתיל סולפוקסיד (למשל, 1:20 על פי היחס בין נפח). זהו אמצעי האחסון המשמש כדי לקבל את היחס טוחנת של חלבון ננו-חלקיק, אטו 488 מיקס בשלב 3.4.
- קח 1 µL של תגובת שיקוע שנשמרו פי התגובות labelling בשלב 3.5. למדוד את הספיגה (abs) ב = 501 ננומטר. אחוז labelling הוא:
(
- לפני הניסוי, להכין את המתלים ננו-חלקיק-הריכוז הרצויה באמצעות פתרון PBS x 1.
4. דג זברה ההרדמה ו אוראלי צנרור
- מהר הדג (> 0.5 ג'י) לפחות 48 שעות לפני הניסוי כדי לרוקן את המעי.
- להעביר את הדגים (12 דגים) הטנקים ניסיוני (6 L) לילה אחד לפני הניסוי כדי לאפשר הסתגלות12.
- מערבולת הפתרון nanoparticle היטב (למשל, 2,500 סל"ד ו- 30 s) וצייר את עוצמת הקול הרצוי של ננו-חלקיק השעיה (למשל 20 – 50 µL) לתוך המזרק מחובר המחט מוגן.
- מניחים את הדגים קצף 150 מ ג/ליטר MS-222 פתרון (ראה סעיף 2) עד שהם שוקעים לתחתית המיכל מגיב קמצוץ סנפיר הזנב; תהליך זה לוקח פחות מ 5 דקות.
- במהירות להעביר את הדגים anesthetized עם רשת מגש פלסטיק רטוב, להתמצא החיה אופקית כדי להתמודד עם המחט ולהתחיל מיד את צנרור אוראלי.
- בזהירות את הדג עם יד אחת ותמיכה פתח את הפה עם היד השנייה בעזרת המחט מוגן. הכנס בעדינות את המחט במורד הוושט כ-1 ס מ מן הפה פתיחה.
הערה: האופרטור עשוי לחוש בהתנגדות קלה כאשר הקצה של הקצה פיפטה עבר את גיל. הקפידו לא זווית הכניסה המחט מדי אשר עלולה לנקב את גיל. - לאט לאט להחדיר ההשעיה nanoparticle דגים. ודא כי ההשעיה אינה זורמת כלפי חוץ דרך זימים או הפה.
- הסר את המחט ובעדינות מניחים את הדג לתוך המיכל השחזור (ראה סעיף 2). התאוששות בדרך כלל לוקח בתוך 1 דקות.
- בדוק את הדגים היטב על אי-תקינות (למשל, דימום על הזימים הוא סימן ניקוב).
- לאחר הדג התאוששו, לחזור עליהם הטנקים ניסיוני.
5. דג זברה המעי לנתיחה
- לאחר תקופת זמן שצוינה פוסט צנרור (למשל, 5 שעות או 24 שעות), מניחים את הדג באמצעות רשת לתוך 300 mg/L MS-222 לפתרון המתת חסד (ראה סעיף 2). ודא operculum יפסיק לזוז יש רפלקס קמצוץ אין זנב. חמש דקות מספיקה בדרך כלל.
- לאסוף את החיה לאללה עם רשת ומניחים אותו על נייר הסינון.
הערה: נייר הסינון הוא מאוד שימושי עבור הסרת הרקמה דבק לאורך המעי. - באמצעות מספריים חדות לנתיחה, עושים חתך חצי-עגולות מפי-הטבעת כדי operculum החתך פתוח באמצעות פינצטה משובחים. חותכים בשני קצוות המעי, להוציא את כל האיברים הפנימיים, ומניחים אותם על נייר הסינון.
התראה: לפעול במהירות כדי להפחית את מטבוליזם התא ומוות.
הערה: לחלופין, להסיר את הרקמה דבק ב- PBS, על קרח. - להפריד את המעי לאיברים פנימיים מקפיד לשמור את האוריינטציה שלו (והשתרשה עמוק בלבה קטע מעי אחורי) ומתח אותו. בדרך כלל, החלק הקדמי של המעי הוא רחב יותר קטע האחורי. לטפל כדי להשיג את כל המעי כאשר לנתח.
הערה: לסוף האחורי די בסדר, שביר בדגים קטנים, עלולה לשבור, במיוחד אצל בעלי חיים < 0.7 g. - לגלגל את המעי על נייר הסינון עם פינצטה על מנת לנתק את הרקמה דבק מהמעי.
- להמשיך להתכונן המעי ניתוחים שונים במורד הזרם (סעיפים 6, 7 ו- 8).
6. הכנת את תאי המעי עבור Cytometry
- להכין מראש aliquots של 0.15% collagenase פתרון (ראו סעיף 2.4).
הערה: Aliquots צריך להיות בטמפרטורת החדר לפני שתמשיך. - אופציונלי: המשך מ שלב 5.5, לחתוך פתח המעי longitudinally, לשטוף עם 1 x PBS.
- באמצעות פינצטה, מקם את המעי בצינור צנטריפוגה 2 mL מלא 0.15% collagenase פתרון.
- במקום הצינורות על מסובב מעבדה אנכי לשעה בטמפרטורת החדר בחושך.
- מניחים את המעי על מסננת תא 100 מיקרומטר נתמך על שפופרת צנטרפוגה 50 מ. תפסיקו עם המעי עם פומפה מזרק 5 מ ל, כביסה 3 פעמים עם PBS 1 x, אוסף את הזרימה מדגם בצינור צנטריפוגה 50 מ
- Centrifuge הצינור צנטריפוגה 50 מ ב x 400 g למשך 10 דקות, ב 4 º C.
- פיפטה בקפידה את מרבית תגובת שיקוע תוך כדי לא לאבד את התאים, אשר עשוי להיות קשור עם הליחה.
- Resuspend תאי המעי בתחתית הצינורית צנטריפוגה עם µL 500 ל- PBS 1 x ולשמור בקירור עד cytometry ניתוח
- דוגמאות מסנן דרך מסנן תא 30 מיקרומטר לתוך מ ל עגול התחתון צינורות עבור cytometry.
- קבע את הפרמטרים (למשל, מספר התאים לניתוח, האזור של מתח ועניין, פיצויים, מבחר של גלאי) ציוד cytometer (ראה חומרים).
- מיד לנתח את התאים על cytometer, ביצוע ההוראות של שימוש13.
7. הכנת המעי Cryosections קונפוקלית
- מילוי כייר פלסטיק (ראה טבלה של חומרים) לנפח חצי עם חיתוך אופטימום טמפרטורה (O.C.T.) מורכב.
- המשך מהשלב 5.5, ומיד לאחר הקרע, מקם בזהירות המעי כייר פלסטיק. ודא המעי לגמרי מוטבעות במתחם O.C.T.. אם יש צורך, להוסיף מורכבות יותר O.C.T. כייר פלסטיק.
הערה: מומלץ למקם המעי בצורת "Z" ב- O.C.T. מתחם לעקוב בקלות אחר הכיוון הטבעי שלה. - במקום כייר פלסטיק על קרח יבש עד שהוא מגיע אטום (פחות מדקה).
- חנות כייר פלסטיק ב-80 מעלות צלזיוס עבור שימוש ארוך טווח או תהליך באופן מיידי באמצעות ההליך הבא.
הערה: הפרוטוקול אפשר לעצור כאן. - פורסים המעי קפוא 10 מיקרומטר מקטעים או עובי המתאים באמצעות cryostat ב-20 ° C.
- לאסוף את המקטע במעי עם מברשת בסדר לשקופית.
- לטבול את השקופית ב 4% PFA למשך 15 דקות בטמפרטורת החדר כדי לתקן את הדגימה.
התראה: PFA רעיל. אנא קרא את גיליון בטיחות חומרים לפני עובד עם זה. כפפות בטיחות משקפיים לענידה ואני תמיד משאירים פתרונות בתוך ברדס fume. - לשטוף את השקופית 3 פעמים עם 1 x PBS, 10 דקות כל אחד.
- להוסיף טיפה של הרכבה בינונית ומניחים על coverslip על הדגימה.
הערה: הפרוטוקול אפשר לעצור כאן. - לבחון את הדגימה תחת מיקרוסקופ קונפוקלי בהגדלה המתאים.
8. הכנת המעי בזמן אמת qPCR (RT-qPCR)
- המשך מהשלב 5.5, להכניס את המעי בקבוקון קריוגני ומקפיאים במהירות המעי חנקן נוזלי, חנות ב-80 מעלות צלזיוס עד השימוש.
הערה: הפרוטוקול אפשר לעצור כאן. - עבור המגון, הוסף 200 פתרון 1-Thioglycerol/המגון µL של 2% (v/v) מקורר (ראה טבלה של חומרים) או פתרון חלופי המגון המדגם במעי.
- לעבוד מהר, homogenize את הדגימה המעי על הקרח עם מהמגן מעבדה במהירות גבוהה (נקבע על 25 – 30,000 סל"ד) עד אין רקמות גלוי קטעים נשארים. 3 פעמים עבור 5 s מספיקה בדרך כלל.
- לבודד RNA באמצעות פרסומת קיט (ראה טבלה של חומרים) לפי הוראות היצרן14 או שיטה חלופית מתאימה. לפי הצורך, לאחסן את הרנ א ב-80 מעלות צלזיוס לשימוש ארוך טווח.
הערה: הפרוטוקול אפשר לעצור כאן. - לכמת את ריכוז ה-RNA באמצעות ספקטרופוטומטרים15 ולהעריך את איכות באמצעות מנתח רנ א16.
- להכין 1 µg או כמות מספקת של cDNA באמצעות ערכת סינתזה cDNA בהתאם להוראות היצרן.
הערה: הפרוטוקול אפשר לעצור כאן. לניתוח qPCR, אנא עקוב אחר ההנחיות MIQE17. - עיצוב זוגות פריימר מתאים עבור הגן/s של ריבית.
- בחר גנים התייחסות מתאימה ולנתח את הביטוי של כל גן על ידי זיהוי RT-qPCR מערכת באמצעות פרסומת קיט (ראה חומרים).
הערה: לדוגמה, הוסף 5 µL של supermix SYBR ירוק, 0.5 מיקרומטר תחל, µL 2.5 של cDNA מדולל, µL 1.5 מים באמצעי אחסון הסופי של µL 10 במשך כל צלחת qPCR.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
דג זברה (ממוצע משקל: 1.03 ± 0.16 g) מין מעורבים היו בהצלחה לצינורות עם חלקיקים שונים חלבון רקומביננטי (גופים הכללה חיידקי) באמצעות המכשיר תוצרת בית צנרור אוראלי שלנו (איור 1). יש לבצע צנרור אוראלי ואנו מושגת התמותה נמוכה האחוז הממוצע (6.8%) בהצלחה (טבלה 1). דג זברה היו גם לצינורות עם 30 µL או 50 µL של ננו-חלקיק המתלים התמותה חושבה בתוך 24 שעות פוסט צנרור. הניסויים בוצעו על ידי שני אופרטורים, R היה פחות ניסיון בעבודה עם דג זברה צנרור אוראלי מאשר ג'יי תוצאות הבדיקה הראו כי אפילו מפעיל חדש באופן עצמאי יכול לבצע צנרור אוראלי את הניסוי, בקלות להשיג סיכויי הישרדות גבוהים על ידי פרוטוקול זה. מהניסיון שלנו, גודל אופטימלי דגים 1 g, אבל לנו יש בהצלחה לצינורות דג קטן כמו 0.5 ג'י.
כדי להבין טוב יותר אם חלקיקים פלורסנט IBsTNFα (ציטוקין רקומביננטי חלבון nanostructured גופות הכללה) היו להישלח דג זברה בשיטה שלנו, נלקח על ידי המעי דג זברה או לא, ביצענו cytometry ניתוח. חלקיקים (µg 100/דגים, 50 µL), PBS (בקרה) אורלית נוהלו (על-ידי צנרור) דג זברה, המעי היה גזור 5 שעות, 24 שעות ביממה פוסט צנרור. סה כ תאי המעי שהוכנו על ידי שלב 6, נותחו על ידי זיהוי האות פליטת קרינה פלואורסצנטית. את היסטוגרמות נציג של עוצמת קרינה פלואורסצנטית החלקות נקודה אחוז תא פלורסנט מוצגים באיור2. הצפיפות של תאים פלורסנט הוא ללא ספק גבוה בקבוצה שעברו צנרור nanoparticle לעומת קבוצת הביקורת 5 שעות והן 24 שעות (איור 2א). האחוזים של תאים פלורסנט הן גבוהות באופן משמעותי 5 שעות (46.3%) והן 24 h (43.0%) של קבוצות nanoparticle לצינורות (איור 2B).
כדי להמשיך לחקור איזה חלק של השכבה מעיים מעורב את ספיגת ננו-חלקיק, ביצענו ניתוח מיקרוסקופיה קונפוקלית. חלקיקים (µg 20/דגים, 50 µL), PBS (בקרה) היו בעל-פה לצינורות כדי דג זברה, המעי היה גזור-צנרור פוסט 5 שעות. הסעיפים במעי הוכנו על ידי שיטה רקמות קפוא על פי שלב 7 (איור 3א). תמונות קונאפוקלית של חלקיקים פלורסנט במעי מוצגים באיור 3. חלקיקים פלורסנט נמצאו במעי דג זברה. נצפו על ידי קרינה פלואורסצנטית בתאי אפיתל, פרופריה. מוסקולריס ולאחר תאי שריר.
כדי לוודא אם שיכולנו לחלץ באיכות גבוהה RNA על-ידי פרוטוקול שלנו, ניתחנו את הרנ א שחולצו מן המעי עם bioanalyzer (המכונה גם ה-RNA מנתח כאן). דג זברה היו לצינורות אוראלית עם PBS (50 µL) או על חלקיקים (µg 20/דגים, 50 µL). המעיים היו גזור לחילוץ RNA-צנרור פוסט 24 שעות ביממה. בחרנו שבע דגימות RNA כדי לבדוק במנתח. מצאנו כי כל הדגימות שנבדקו RNA יש מספר גבוה שלמות RNA ועד 7.9 8.9 (איור 4).
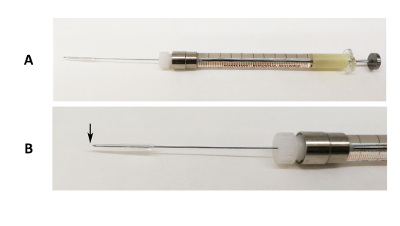
איור 1 : התקן צנרור אוראלי. (א) תמונה של מחט נעל זכוכית 31 G קבוע על מזרק 100 µL עם סיליקון שפופרת, פיפטה עצה סוף המכסה את קצה המחט. (B) תמונה מוגדלת של החלק המחט. החץ השחור מציין היכן הסוף עצה פיפטה חורג על הקצה של המחט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 : Flow cytometry ניתוח של חלקיקים פלורסנט במעי דג זברה ויה צנרור אוראלי. דג זברה שטופלו PBS או פלורסנט IBsTNFα (100 µg) עבור 5 שעות ו- 24 שעות, בהתאמה. (א) היסטוגרמות נציג של עוצמת קרינה פלואורסצנטית. (B) נקודה חלקות גרף של אחוז תאים פלורסנט. כל נקודה ירוקה מייצג את אחוז תאים פלורסנט אחת ≥4 הפרט, n. נתונים מייצגים זאת אומרת ± שגיאת התקן של הממוצע (SEM). ההבדלים נותחו באמצעות חד-כיווני אנובה. הבדלים משמעותיים ביחס שליטה (* *, p < 0.01) אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3 : תמונות של ניתוח מיקרוסקופיה קונפוקלית- הדגים היו לצינורות אוראלית עם PBS או 20 µg/דגים חלקיקים פלורסנט. המעי היה גזור-צנרור פוסט 5 שעות. (א) במעי דג זברה נעוץ OCT תרכובות. המעי הוצב עם הכיוון הטבעי של צורה "Z" (קצה קדמי ת; p: הקצה האחורי). (B) מיקרוסקופיה קונפוקלית תמונות של דג זברה המעי. החצים הלבנים מראים כי חלקיקים פלורסנט נלקחים ב רירית המעי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : RNA מנתח ג'ל וירטואלי תמונת מראה RNA שחולצו מן המעיים דג זברה 7 שנדגמו צנרור פוסט. דוגמית מספר 1 ו- 2 הן קבוצות PBS לצינורות, דוגמית מספר 3-7 קבוצות nanoparticle לצינורות. RNA תקינות מספרי (RIN) ניתנות בתחתית ועד 7.9 8.9. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| אופרטור | נפח | # דגים לצינורות | כלומר משקל (g ± SD) |
מקרי מוות # | התמותה (%) |
| R | 30 ΜL | 22 | 0.88 ± 0.14 | 3 | 13.6 |
| R | 30 ΜL | 17 | 0.93 ± 0.19 | 0 | 0 |
| J | 50 ΜL | 19 | 1.23 ± 0.31 | 1 | 5.2 |
| J | 50 ΜL | 30 | 1.08 ± 0.40 | 2 | 6.6 |
| סה | 88 | 1.03 ± 0.16 | 6 | 6.8 | |
| SD: סטיית התקן של הממוצע | |||||
טבלה 1: השוואה של דג זברה התמותה הנגרמת על ידי שני אופרטורים באמצעות הפרוטוקול. את קוד זיהוי של המפעיל, אמצעי האחסון שעברו צנרור, מספר דגים, דגים ממוצע המשקל בגרמים (g) מוצגים.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
פרוטוקול זה הוא שיפור של הטכניקה שתואר לעיל לצנרור אוראלי על-ידי. Collymore et al. 4 פרוטוקול שלנו מתאר בפירוט את השיטה צנרור אוראלי, כולל הכנת המעי עבור ניתוחים במורד הזרם. השיטה שלנו משפר את מהירות מניפולציה דגים המאפשר אחד לבצע את כל הפרוטוקול במהירות, ללא הרבה שינויים בין מפעילי. הבדל העיקרי של פרוטוקול שלנו עם קודמו הוא לנו להעריך את ההצלחה של ניסוי צנרור אוראלי לא רק על ידי התבוננות החיה על רווחה (למשל, אין דימום) ועבור אין דליפה של נוזל מנוהל, אלא גם על-ידי בדיקת ספיגת ננו-חלקיק ביואקטיביות במעי באמצעות ניתוח במורד הזרם (cytometry, מיקרוסקופיה קונפוקלית ו- qPCR). אנו מראים כי חלקיקים fluorescently שכותרתו שעברו צנרור נמצאו במעי.
על הצד המעשי, הציוד צנרור הוא זול, מדויק לשימוש חוזר: המכשיר הבסיסי הוא עשוי זכוכית 100 µL לשימוש חוזר (למשל, המילטון) מזרק מצמידים מחט 31 G עם פיסת הסיליקון על גבי. טיפ סטרילי לחתוך מונחת על צינור סיליקון, והוא ניתן לשינוי עבור כל ניהול בודדים. המזרק הניתן לשימוש חוזר, ומאפשר המחט דק נלוקסון דגים קטנים עם אפשרות גבוהה של הצלחה. יתר על כן, קצהו עקר לחתוך יכול להיות ממוקם ישירות על המחט ללא הצינור סיליקון המאפשר את הציוד צנרור קל בעבודת מעבדה. Bioactive המתחם מנוהל נראה בבירור, ניהול נכון ניתן לנטר בקלות. שלב קריטי במהלך ההליך צנרור הוא הערך המחט. חשוב כי המחט אינה מוטה או להוסיף יותר מדי כדי להימנע ניקוב הזימים. התמותה נצפתה בשיטה זו הוא מאוד נמוך (כ 7%), תלוי בגודל של הדג. גיל ניקוב הוא הגורם השכיח ביותר המוות דגים, וכאשר זה קורה דגים מתים בתוך השעה הראשונה. למרות דגים של 0.5 g יכול לצנר בקלות גודל אופטימלי דגים הוא בסביבות 1 g. הבדל נוסף עם השיטה שפותחה על ידי. Collymore et al. נמצא כי הדגים הם צמתי במשך 48 שעות לוודא שכי מערכת העיכול ריקה. ההליך כולו צנרור יכול להיעשות מהר מאוד (30 חיות/h) על ידי מפעיל אחד וחשוב, השיטה היא עקבית בין מפעילי שונים4. השיטה צנרור קל ללמוד, לא דורשת הרבה ניסיון לשלוט.
ההליך ניתוח במעי חייב להתבצע כראוי כדי לקבל איכות טובה הדוגמאות עבור cytometry, קונאפוקלית וניתוחים qPCR. השלב הקריטי הוא בשלב זה הקרע של המעי כולו; המקטע האחורי הוא קל לאבד ושבירה. ברגע המעי הוא גזור, זה יכול להיות מעובד יותר עבור cytometry (פרוטוקול 2 h), ניתוח qPCR (פרוטוקול 2 h עד הכולל בידוד ה-RNA) או מיקרוסקופיה קונפוקלית (1h יש דוגמאות מוכן cryosection). . זה מאוד חשוב לעקוב אחר הכיוון של המעי, במיוחד עבור מיקרוסקופיה קונפוקלית ניתוח Cytometry דורש עיבוד מהיר, וזה אי אפשר לעצור את ההליך לפני השלמת הפעולה. בעוד ה-RNA בידוד ודוגמאות מוכן לכל cryosection יכול כראוי יאוחסן ויעובד בכל עת. עבור cytometry, דגימות איכות טובה ללא פסולת clumping המכונה ניתן לבודד באמצעות שיטה זו, ניתן לבצע ניתוח מהיר נוכחות של תאים פלורסנט בקלות על אנשים. ניטור איכות RNA הראה כי RNA באיכות גבוהה יכול להיות מבודד מן המעי המאפשר ניתוח של דגים בודדים על-ידי qPCR. לבסוף, ההכנה cryosection קונפוקלית מספק מידע חשוב מבניים על ספיגת ננו-חלקיק חלבון. השיטות שלנו ובכך מספקות מודל כדי לבדוק את הדינמיקה של אמצעי מניעה אוראלי או תרכובות אחרות במעי.
המגבלות של המחקר שלנו הם בגודל של הדג מאז אנחנו לא נבדקים ניהול בדגים קטנים יותר 0.5 ג'י ושימוש של הרדמה כימיים להרדים את החיות. יש מחברים השתמש במים קרים (0 – 4 ° C) כדי עזים ומתנגד דג זברה18 אבל בהקשר של רווחת בעלי חיים והאילוצים משפטי האירופית החלטנו כי MS-222 היה לשיטת הבחירה.
דג זברה מציע יתרונות רבים על פני מערכות אחרות-מודל כולל ערכה מלאה של הגן ונתונים הקווים הטרנסגניים זמינים. Immunologists, הקווים הטרנסגניים (למשל, Tg mpx:GFP ו- Tg mpeg1:GFP) להגדיר סצינה עבור התצפית ויוו של תאים חיסוניים כגון macrophages, נויטרופילים19,20. שילוב צנרור אוראלי וניתוח במורד הזרם שלנו עם קווים מהונדס, יכול להיות אידיאלי עבור זיהוי של סוגי תאים מעורבים תפיסה, תחבורה ועיבוד של אוראלי חיסונים, חלקיקים, פתוגנים בדגים.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים קיימים.
Acknowledgments
עבודה זו נתמכה על ידי מענקים ממשרד ספרדית של המדע, הנציבות האירופית וקרנות AGAUR ל ע נ (AGL2015-65129-R MINECO/פדר, AGAUR 2014SGR-345). RT מחזיקה מראש דוקטורט במלגת לימודים AGAUR (ספרד), ג'יי-ג'יי נתמכה על ידי מלגת דוקטורט מטעם המועצה מלגה סין (סין), ע"נ נתמכת על-ידי התוכנית Ramón y Cajal (RYC-2010-06210, 2010, MINECO). אנו מודים Torrealba ד ר על ייעוץ מומחה בייצור חלבונים, הוותיק ש מ "Microscopia דה Servei", ר קוסטה מ מ "Servei דה Citometria" של ברצלונה דה Autònoma Universitat לסיוע טכני מועיל.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




