Summary
وصف البروتوكول تنبيب الزرد الكبار مع البيولوجية؛ ثم تشريح وإعداد الأمعاء للخلوي والفحص المجهري [كنفوكل] وقبكر. هذا الأسلوب يسمح لإدارة مركبات النشطة بيولوجيا لرصد امتصاص الأمعاء والتحفيز المناعي المحلية آثار. أنها ذات صلة لاختبار المعوية ديناميات الوقائية عن طريق الفم.
Abstract
معظم مسببات الأمراض تغزو الكائنات عن طريق الغشاء المخاطي بهم. وهذا صحيح بصفة خاصة في الأسماك كما أنهم يتعرضون باستمرار لبيئة مياه الغنية بالجراثيم. تطوير أساليب فعالة لإيصال الفم immunostimulants أو اللقاحات، وتنشيط الجهاز المناعي ضد الأمراض المعدية، مرغوب فيه للغاية. في استنباط أدوات وقائية، هناك حاجة جيدة نماذج تجريبية لاختبار أدائها. هنا، نحن إظهار أسلوب تنبيب الشفوي من الزرد الكبار ومجموعة من الإجراءات لتشريح وإعداد الأمعاء للخلوي ومجهرية [كنفوكل] وتحليل سلسلة من ردود الفعل (qPCR) بوليميريز الكمية. مع أحكام هذا البروتوكول، ونحن تحديداً إدارة وحدات تخزين ما يصل إلى 50 ميليلتر الأسماك تزن حوالي 1 ز ببساطة وسرعة، دون الأضرار بالحيوانات. هذا الأسلوب يسمح لنا باستكشاف مباشرة في فيفو امتصاص مركبات فلوريسسينتلي المسمى مخاطية الأمعاء، وقدرة immunomodulatory مثل البيولوجي في الموقع المحلي بعد التنبيب. عن طريق الجمع بين أساليب المصب مثل التدفق الخلوي، علم الأنسجة، وقبكر ومجهرية [كنفوكل] الأنسجة المعوية، يمكننا أن نفهم كيف إيمونوستيمولانتس أو اللقاحات قادرة على عبور الحواجز المخاطية المعوية، وتمر من خلال بروبريا الصفيحة، و تصل العضلات، وممارسة تأثير على جهاز المناعة المخاطية المعوية. يمكن استخدام النموذج لاختبار المرشح عن طريق الفم الوقائية ومنظومات إيصالها أو تأثير المحلية أي مركب النشطة بيولوجيا تدار شفويا.
Introduction
والهدف من هذه المادة وصف في عمق طريقة واضحة تنبيب الشفوي من الزرد، جنبا إلى جنب مع الإجراءات المتلقين للمعلومات المفيدة المرتبطة بها. تنبيب الشفوي استخدام الزرد أصبح نموذج عملي في دراسة ديناميات الأمراض المعدية واللقاحات الفموية/منبه المناعة والإقبال على المخدرات/نانوحبيبات ونجاعة وحصانة المخاطية المعوية. على سبيل المثال، استخدمت الزرد تنبيب الشفوي في دراسة الإصابة بكتريا مارينوم و بكتريا بيريجرينوم 1. لوفمو et al. كما استخدمت بنجاح هذا النموذج لتقديم جسيمات نانوية و M. marinum للقناة الهضمية الزرد الكبار2. وبالإضافة إلى ذلك، يستخدم تشن et al. الزرد تنبيب الشفوي لإظهار أن المخدرات مغلفة بجسيمات نانوية، عندما تدار عبر المسالك المعدية المعوية، ونقلت عبر حاجز الدم الدماغ3. أجرى المؤلفون هذه تنبيب استناداً إلى أسلوب جوفاجي وصف كوليمور et al. 4 مع بعض التعديلات. بيد أنها لا توفر بروتوكول مفصلة للغاية وصف الإجراء تنبيب الشفوي. وهنا نقدم طريقة للفم تنبيب للكبار الزرد بناء على كوليمور et al. 4 ونحن كذلك تشمل إعداد الأمعاء لتحليل المتلقين للمعلومات ذات الصلة الخلوي والفحص المجهري [كنفوكل] و qPCR.
الأمعاء، ولا سيما في الغشاء المخاطي هو الخط الأول للدفاع ضد العدوى والموقع الرئيسي لامتصاص المغذيات5. عند الخلايا الظهارية وعرض مستضد الخلايا ضمن الحواجز المخاطية يرون إشارات الخطر، يتم تشغيل استجابة فورية للمناعة فطرية. المقبل، هي الاستجابة المناعية التكيفية محددة للغاية الذي حددته تي وب لمفاوية6،7. تطوير اللقاحات الفموية مجال تركيز الحالي في اللقاحات. هذه اللقاحات ستكون أداة فعالة لحماية الكائنات الحية في مواقع مكشوفة نظراً لاستجابة محددة من الخلايا المناعية في8،الأنسجة اللمفاوية المرتبطة بالغشاء المخاطي (الشعير)9. في تربية الأحياء المائية، واللقاحات المخاطية قد مزايا واضحة مقارنة باللقاحات عن طريق الحقن. أنها هي العملية لتطعيم، أقل كثيفة العمالة وهي أقل إرهاقاً للأسماك ويمكن أن تدار لصغار الأسماك. ومع ذلك، يجب أن تصل إلى المرشحين لقاح مخاطية الجزء الثاني المتعلق بالقناة الهضمية دون يجري التشويه والتحريف في البيئة عن طريق الفم. أنها أيضا يجب أن تعبر الحواجز المخاطية بغية الوصول إلى مستضد تقديم الخلايا (Apc) للحث على الاستجابات المحلية و/أو النظمية10. ومن ثم اختبار امتصاص المخاطية التي حققها مرشح المستضدات الشفوي ومنظومات إيصالها، فضلا عن الاستجابة المناعية أثارت، أمر ضروري في تطوير اللقاحات الفموية.
في إطار الطب الحيوي، وضع نموذج لاختبار الآثار البيولوجية للمركبات بعد تنبيب الشفوي باهتمام متزايد. العديد من الميزات التشريحية والفسيولوجية للامعاء يتم المحافظة عليها بين الأنساب بيلاتيريان، مع الثدييات والأسماك العظمية11. نموذج تنبيب الشفوي هذا متصلاً بتحليل المتلقين للمعلومات يمكن أن يكون أداة لتوفير رؤى في البيولوجيا البشرية، فضلا عن ساحة اختبار للبيولوجي أو المركبات الأخرى في فيفو.
يمكن أن يؤديها البروتوكول تنبيب الشفوي إلى عامل واحد، مثلاً، إدارة بنجاح يصل إلى 50 ميليلتر من تعليق نانوحبيبات بروتين الأسماك تزن 1 غ، مع معدل البقاء على قيد الحياة عالية. الإجراء إجراء بسيط لإعداد وسريعة؛ يمكن تنبيب الأسماك 30 في ح 1. البروتوكول المتعلق بإعداد الأمعاء هو المفتاح لتوفير نوعية الخلايا والأنسجة وعينات لتحليلها لاحقاً. ترد أمثلة للنتائج النهائية التي تظهر فائدة البروتوكول في الحصول على البيانات ذات الصلة بامتصاص الأمعاء وعزل الحمض النووي الريبي نوعية ل qPCR. البروتوكول ستكون ذات فائدة كبيرة لأولئك الذين يحتاجون إلى نموذج مناسب لاختبار ديناميات الوقائية عن طريق الفم أو غيرها من المركبات في الأمعاء.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
إذن جميع الإجراءات التجريبية التي تنطوي على الزرد (دانيو rerio) لجنة الأخلاقيات التابعة لجامعة المستقلة دي برشلونة (سيه رقم 1582) يتفق مع "المبادئ التوجيهية الدولية" "البحوث المتعلقة بالحيوانات" ( EU 2010/63). أجريت جميع التجارب مع الزرد يعيش في 26-28 درجة مئوية.
1. إعداد المعدات التنبيب الشفوية
- ضع 1 سم تقريبا من أنبوب سيليكون غرامة على إبرة قفل اللوير ز 31 لتغطية طرف الإبرة.
- قص 10 ميليلتر تصفية عقيمة ماصة تلميح (حوالي 2 سم)، واتخاذ نهاية الدقيقة ووضعه على أنبوب السيليكون غمد. تأكد من ماصة يمتد إلى أبعد من طرف الإبرة لتجنب إصابة الحيوان.
- إرفاق الإبرة حقنه قفل اللوير 100 ميليلتر.
ملاحظة: دائماً شطف مع الإيثانول وثم الفوسفات مخزنة المالحة (برنامج تلفزيوني، انظر المواد) دقيق بين العلاجات.
2-الحلول المطلوبة
- إعداد 150 مغ/لتر (للتخدير) أو 300 ملغ/لتر (للقتل الرحيم) إيثيل 3-أمينوبينزواتي ميثانيسولفوناتي (مرض التصلب العصبي المتعدد-222) الحل مع المياه من حوض السمك حيث يتم الاحتفاظ الزرد. ملء خزان صغير مع 1 لتر حل مخدر والحفاظ عليه الرغوة.
- ملء خزان صغير آخر مع 1 لتر مياه حوض السمك بدون مرض التصلب العصبي المتعدد-222 لاسترداد الأسماك والحفاظ عليه الرغوة.
- جعل 50 مل من برنامج تلفزيوني x 1 من 10 × الحل الأسهم العقيمة.
- لعزل الخلية المعوية/التحليل الخلوي، إعداد كافية كولاجيناز 0.15% الطازجة الحل "الرابع نوع" 1 مل كل الأسماك من حل أسهم أو من مسحوق في تعديل النسر المتوسطة دولبيكو (دميم) مع البنسلين 1% v/v وستربتوميسين (انظر المواد). جعل مختبرين (1 كل الأسماك) 1 مل في 2 مل أنابيب الطرد المركزي. تبقى عند 4 درجة مئوية حتى 30 دقيقة قبل أن الخطوة التشريح.
- للفحص المجهري/عينة [كنفوكل] التثبيت، إعداد 50 مل الطازجة الحل بارافورمالدهيد (PFA) 4% في برنامج تلفزيوني أو ذوبان الجليد حلاً أسهم من الثلاجة-20 درجة مئوية في غطاء دخان.
تنبيه: منهاج عمل بيجين السامة. يرجى قراءة ورقة بيانات السلامة المادية قبل العمل معها. قفازات ونظارات السلامة ينبغي أن ترتديه، وتترك دائماً الحلول داخل غطاء دخان.
3-إعداد تعليق نانوحبيبات نيون
- تسمية نانوحبيبات البروتين مع إستر أتو-488 "دائرة الصحة الوطنية" (انظر الجدول للمواد) أو صبغة فلورسنت مناسب وفقا لإرشادات الشركة المصنعة.
- ريسوسبيند جسيمات نانوية في المخزن المؤقت بيكربونات الصوديوم 0.1 M في تركيز 2 ملغ/مل.
- حل إستر "أتو 488 دائرة الصحة الوطنية" في خالية من أمين ثنائي ميثيل سلفوكسيد ([دمس]) في 2 ملغ/مل. الاحتفاظ قاسمة 10 ميليلتر للتحقق من كفاءة وضع العلامات (الخطوة 3.7-3.8).
- مزج جسيمات نانوية واستر "أتو 488 دائرة الصحة الوطنية" بنسبة 1:2 (البروتين: صبغ) مولى بالتحريك في الظلام.
- تدور أسفل جسيمات نانوية المسمى بالطرد المركزي في س 8,000 ز لمدة 10 دقائق في درجة حرارة الغرفة وإزالة المادة طافية والاحتفاظ بها للتحقق من كفاءة وضع العلامات (الخطوة 3.7-3.8).
- أغسل جسيمات نانوية المسمى ريسوسبيندينج في 1 مل من المخزن المؤقت بيكربونات الصوديوم 0.1 متر فورتيكسينج وبيبيتينج صعودا وهبوطاً. ثم تجاهل المادة طافية بالطرد المركزي في س 8,000 ز لمدة 10 دقائق في درجة حرارة الغرفة. كرر الخطوة 3، 6 5 مرات.
- ريسوسبيند بيليه في 5 مل من 0.1 م بيكربونات الصوديوم العازلة في أنبوب الطرد مركزي 15 مل ومختبرين نانوحبيبات نيون في 1.5 مل أنابيب الطرد المركزي (30 مختبرين). زيادة ونقصان لأسفل في س 8,000 ز لمدة 10 دقائق في درجة حرارة الغرفة وتجاهل المادة طافية وتخزينها في-80 درجة مئوية محمية من الضوء.
-
قياس كفاءة وضع العلامات باستخدام جهاز المطياف الضوئي ميكروفولومي.
- 1 ميليلتر من الحل 488 أتو الأصلي من الخطوة 3، 3 وكذلك تمييع في [دمس] (مثلاً، 01:20 وفقا لنسبة الحجم). هذا هو المجلد المستخدم للحصول على نسبة المولى نانوحبيبات البروتين ومزيج 488 أتو في الخطوة 3.4.
- تأخذ 1 ميليلتر من المادة طافية المحفوظة من رد فعل الوسم في الخطوة 3، 5. قياس الامتصاص (abs) في = 501 شمال البحر الأبيض المتوسط. النسبة المئوية لوضع العلامات:
(
- قبل التجربة، إعداد تعليق نانوحبيبات في تركيز المطلوب باستخدام حل برنامج تلفزيوني x 1.
4-الزرد أنيسثيتيزيشن والشفوي تنبيب
- سريع الأسماك (> ز 0.5) على الأقل 48 ساعة قبل التجربة لإفراغ الأمعاء.
- نقل الأسماك (الأسماك 12) إلى الخزانات التجريبية (6 لتر) ليلة واحدة قبل التجربة للسماح لتأقلم12.
- دوامة الحل نانوحبيبات جيدا (مثلاً، 2,500 لفة في الدقيقة و 30 s) ووضع وحدة التخزين المطلوبة لتعليق نانوحبيبات (مثلاً، 20 – 50 ميليلتر) في محقن المرفقة بإبرة المحمية.
- ضع السمك في التهوية 150 مغ/لتر MS-222 الحل (انظر القسم 2) حتى تنزل إلى أسفل الخزان ولا تستجيب لقرصة زعنفة الذيل؛ وتستغرق هذه العملية أقل من 5 دقائق.
- بسرعة نقل الأسماك أنيسثيتيزيد مع صافية إلى علبة بلاستيكية رطب، وتوجيه الحيوان أفقياً لمواجهة الإبرة والبدء فورا في تنبيب الشفوي.
- دعم الأسماك مع جهة وفتح الفم باليد الأخرى باستخدام إبرة المحمية بعناية. برفق إدراج الإبرة أسفل المريء إلى حوالي 1 سم من فم فتح.
ملاحظة: قد يشعر المشغل بمقاومة طفيفة عند نهاية طرف ماصة اجتاز جيل. الحرص على عدم زاوية دخول إبرة الكثير الذي قد انثقب جيل. - حقن ببطء بتعليق نانوحبيبات للأسماك. تأكد من أن التعليق لا يتدفق إلى الخارج عن طريق الخياشيم أو الفم.
- بلطف إزالة الإبرة ووضع الأسماك في خزان الاسترداد (انظر القسم 2). عادة ما يستغرق الشفاء داخل 1 دقيقة.
- فحص الأسماك بعناية لأي شذوذ (مثلاً، نزيف في الخياشيم علامة على تثقيب).
- مرة واحدة قد شُفي الأسماك، إعادتها إلى الدبابات التجريبية.
5-تشريح الأمعاء الزرد
- بعد فترة محددة من الوقت بعد التنبيب (مثلاً، ح 5 و/أو 24 ساعة)، وضع الأسماك باستخدام الشباك إلى 300 مغ/لتر MS-222 الحل للقتل الرحيم (انظر القسم 2). تأكد من operculum توقف عن التحرك وليس هناك أي منعكس قرصه الذيل. يكفي عادة بخمس دقائق.
- التقاط الحيوان euthanized مع صافية ووضعه على ورقة عامل التصفية.
ملاحظة: ورقة تصفية مفيد جداً لإزالة الأنسجة لاصقة على طول الأمعاء. - باستخدام مقص تشريح حاد، جعل شق نصف دائري من فتحه الشرج إلى أوبيركولوم وشق مفتوحة باستخدام الملقط غرامة. قص طرفي الأمعاء وتأخذ بها جميع الأجهزة الداخلية ووضعها على ورق الترشيح.
تنبيه: العمل بسرعة لتقليل استقلاب الخلية والموت.
ملاحظة: بدلاً من ذلك، إزالة الأنسجة لاصقة في برنامج تلفزيوني وعلى الجليد. - فصل الأجهزة الداخلية مع التأكد من الحفاظ على توجهها (عرفت الجزء الخلفي المعوية) وتمتد من الأمعاء. عادة، الجزء الأمامي من الأمعاء أوسع من الجزء الخلفي. الحرص على الحصول على كل من الأمعاء عند تشريح.
ملاحظة: نهاية الخلفي جيد جداً وهشة في الأسماك الصغيرة وقد قطع، وبخاصة في الحيوانات < ز 0.7. - لفة الأمعاء على ورق الترشيح مع ملاقط بغية فصل الأنسجة لاصقة من الأمعاء.
- المضي قدما لإعداد الأمعاء لمختلف التحليلات المصب (المادتان 6 و 7 و 8).
6-إعداد الخلايا المعوية للخلوي
- إعداد مقدما مختبرين لحل كولاجيناز 0.15 في المائة (انظر الفرع 2-4).
ملاحظة: ينبغي أن يكون مختبرين في درجة حرارة الغرفة قبل المتابعة. - اختياري: مستمرة من الخطوة 5.5، شق فتح الأمعاء طوليا وتغسل مع برنامج تلفزيوني 1 x.
- استخدام الملقط، مكان الأمعاء في أنبوب الطرد المركزي 2 مل مملوءة بمحلول كولاجيناز 0.15%.
- وضع الأنابيب على المدورة مختبر رأسي ح 1 في درجة حرارة الغرفة في الظلام.
- ضع الأمعاء في مصفاة خلية 100 ميكرومتر أيد عبر أنبوب الطرد مركزي 50 مل. كسر الأمعاء مع المكبس حقنه 5 مللي، الغسيل 3 مرات مع برنامج تلفزيوني 1 x، جمع التدفق من خلال العينة في أنبوب 50 مل أجهزة الطرد المركزي.
- الطرد المركزي أنبوب الطرد المركزي 50 مل في 400 x ز لمدة 10 دقيقة، في 4 درجات مئوية.
- ماصة بعناية قبالة معظم المادة طافية بينما لم تفقد الخلايا، والبعض منها قد تكون مرتبطة بالمخاط.
- ريسوسبيند الخلايا المعوية في الجزء السفلي من الأنبوب الطرد المركزي مع 500 ميليلتر من برنامج تلفزيوني 1 x والحفاظ على الجليد حتى التحليل الخلوي
- جولة تصفية عينات من خلال عامل تصفية خلية ميكرومتر 30 إلى 5 مل أنابيب أسفل للخلوي.
- تعيين المعلمات (مثلاً، عدد الخلايا للتحليل، ومنطقة الاهتمام والجهد والتعويض، واختيار من كاشفات) على جهاز سيتوميتير (انظر المواد).
- تحليل الخلايا على سيتوميتير، اتباع الإرشادات لاستخدام13فورا.
7-إعداد كريوسيكشنز الأمعاء للفحص المجهري [كنفوكل]
- ملء القالب البلاستيك (انظر الجدول للمواد) بحجم نصف درجة الحرارة المثلى قطع (O.C.T.) مجمع.
- المستمرة من الخطوة 5.5 وفورا بعد التشريح، بعناية وضع الأمعاء في القالب البلاستيك. تأكد من الأمعاء مضمن تماما في مجمع O.C.T.. إذا لزم الأمر، إضافة O.C.T. أكبر مجمع للعفن البلاستيك.
ملاحظة: من المستحسن وضع الأمعاء بشكل "Z" في O.C.T. مجمع سهولة تتبع اتجاهها الطبيعي. - مكان العفن البلاستيك على الثلج الجاف حتى يذهب كامد (أقل من دقيقة).
- تخزين القالب البلاستيك في-80 درجة مئوية للاستخدام على المدى الطويل أو عملية مباشرة باستخدام الإجراء التالي.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. - شريحة الأمعاء المجمدة إلى 10 ميكرون أقسام أو سمك المناسب باستخدام كريوستات في-20 درجة مئوية.
- جمع القسم الأمعاء بفرشاة الجميلة إلى شريحة.
- تزج الشريحة في 4% منهاج العمل لمدة 15 دقيقة في درجة حرارة الغرفة لإصلاح العينة.
تنبيه: منهاج عمل بيجين السامة. يرجى قراءة ورقة بيانات السلامة المادية قبل العمل معها. قفازات ونظارات السلامة ينبغي أن ترتديه، وتترك دائماً الحلول داخل غطاء دخان. - تغسل الشريحة 3 مرات مع برنامج تلفزيوني x 1، 10 دقيقة.
- إضافة قطره من تصاعد المتوسطة ومكان ساترة أكثر من العينة.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. - مراقبة العينة تحت مجهر [كنفوكل] في التكبير المناسبة.
8-إعداد الأمعاء للوقت الحقيقي قبكر (RT-قبكر)
- المستمرة من الخطوة 5.5، وضع الأمعاء في قنينة مبردة وسرعة تجميد الأمعاء في النتروجين السائل ومخزن في-80 درجة مئوية حتى الاستخدام.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. - للتجانس، إضافة 200 ميليلتر من 2% (v/v) تبريد 1-ثيوجليسيرول/التجانس حل (انظر الجدول للمواد) أو الحل البديل التجانس إلى عينة الأمعاء.
- العمل بسرعة، ومجانسة العينة الأمعاء على الجليد مع الخالطون مختبر سرعة عالية (تعيين 25 – 30,000 لفة في الدقيقة) حتى لا تظهر الأنسجة تبقى الشظايا. 3 مرات ل 5 s عادة ما تكون كافية.
- عزل الحمض النووي الريبي استخدام تجاري كيت (انظر الجدول للمواد) وفقا لتعليمات الشركة المصنعة14 أو طريقة بديلة مناسبة. حسب الحاجة، تخزين الجيش الملكي النيبالي في-80 درجة مئوية للاستخدام على المدى الطويل.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. - قياس تركيز الجيش الملكي النيبالي باستخدام جهاز المطياف الضوئي15 وتقييم نوعية استخدام محلل الحمض النووي الريبي16.
- إعداد 1 ميكروغرام أو مبلغ مناسب لكدنا استخدام عدة توليف كدنا وفقا لإرشادات الشركة المصنعة.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. لتحليل قبكر، يرجى اتباع المبادئ التوجيهية ميكي17. - تصميم أزواج التمهيدي المناسبة للجينات/s للفائدة.
- تحديد جينات مرجع مناسب وتحليل التعبير عن كل الجينات بالكشف عن قبكر RT نظام استخدام تجاري كيت (انظر المواد).
ملاحظة: على سبيل المثال، إضافة 5 ميليلتر من سوبيرميكس سيبر الخضراء، 0.5 ميكرومتر كبسولة تفجير، 2.5 ميليلتر من كدنا المخفف و 1.5 ميليلتر من الماء بحجم نهائي في 10 ميليلتر لكل بئر من لوحة قبكر.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
الزرد (متوسط الوزن: 1.03 ± ز 0.16) من الجنس المختلط تم تنبيب بنجاح مع البروتين المؤتلف مختلفة جسيمات نانوية (البكتيرية إدراج الهيئات) باستخدام لدينا جهاز محلية الصنع تنبيب الشفوي (الشكل 1). لدينا بنجاح إجراء تنبيب الشفوي وتحقق من معدل وفيات منخفض متوسط النسبة مئوية (6.8%) (الجدول 1). وكانت الزرد أما تنبيب مع ميليلتر 30 أو 50 ميليلتر من المعلقات نانوحبيبات وتم حساب معدل الوفيات داخل ح 24 وظيفة التنبيب. أجريت التجارب باثنين من المشغلين، وكان R أقل خبرة في العمل مع تنبيب الزرد الشفوي من ج. تجربة النتائج التي أظهرت أن مشغل جديد حتى يمكن أن تؤدي بشكل مستقل تنبيب الشفوي وسهولة تحقيق معدل بقاء عالية بموجب هذا البروتوكول. من خلال تجربتنا، حجم الأسماك الأمثل ز 1، ولكن نحن لها بنجاح تنبيب الأسماك صغيرة مثل 0.5 ز.
لفهم ما إذا كانت جسيمات نانوية الفلورسنت IBsTNFα (سيتوكين المؤتلف بروتين ذات البنية النانومترية كهيئات إدراج) وسلمت إلى الزرد باسلوبنا وتناولها من الأمعاء الزرد أو لا، أجرينا الخلوي تحليل. جسيمات نانوية (100 ميكروغرام/الأسماك، 50 ميليلتر) وبرنامج تلفزيوني (الرقابة) كانت شفويا يديرها (التنبيب) إلى الزرد وكان تشريح الأمعاء في ح 5 وح 24 وظيفة تنبيب. وأعدت الخطوة 6 مجموع الخلايا المعوية وتحليلها عن طريق الكشف عن إشارة الانبعاثات الأسفار. رسوم بيانية الممثل من شدة الأسفار وقطع نقطة مئوية خلية الفلورسنت مبينة في الشكل 2. كثافة الخلايا الفلورسنت وضوح أعلى في المجموعة المنببين نانوحبيبات مقارنة بمجموعة التحكم في ح 5 وح 24 (الشكل 2أ). النسب المئوية لخلايا الفلورسنت أعلى بكثير في ح 5 (46.3 في المائة) و 24 ح (43.0 في المائة) من المجموعات نانوحبيبات تنبيب (الشكل 2ب).
لمزيد من الدراسة التي يشارك فيها جزء من طبقة الأمعاء في امتصاص نانوحبيبات، أجرينا التحليل المجهري [كنفوكل]. جسيمات نانوية (20 ميكروغرام/الأسماك، 50 ميليلتر) وبرنامج تلفزيوني (الرقابة) كانت تنبيب شفويا إلى الزرد وكان تشريح الأمعاء في تنبيب وظيفة ح 5. وأعدت أقسام الأمعاء بطريقة أنسجة مجمدة وفقا للخطوة 7 (الشكل 3أ). يبين الشكل 3بالصور [كنفوكل] من جسيمات نانوية مضيئة في الأمعاء. تم العثور على جسيمات نانوية مضيئة في الأمعاء الزرد. ولاحظنا الأسفار في الخلايا الظهارية، بروبريا الصفيحة، وخلايا العضلات.
للتحقق عما إذا كان يمكن أن نستخلص عالية الجودة الحمض النووي الريبي لدينا بروتوكول، قمنا بتحليل الحمض النووي الريبي المستخرج من الأمعاء مع بيواناليزير (المشار إليها أيضا كمحلل الجيش الملكي النيبالي هنا). تم تنبيب الزرد شفويا مع برنامج تلفزيوني (50 ميليلتر) أو جسيمات نانوية (20 ميكروغرام/الأسماك، 50 ميليلتر). تم تشريح الأمعاء لاستخراج الحمض النووي الريبي في تنبيب بعد 24 ساعة. نحن نخبة من سبع عينات الحمض النووي الريبي لاختبار مع المحلل. وجدنا أن جميع عينات الحمض النووي الريبي اختبار الحمض النووي الريبي عالية سلامة أرقام تتراوح بين 7.9 8.9 (الشكل 4).
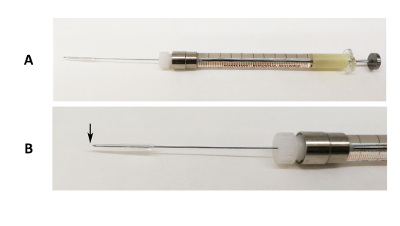
الشكل 1 : الجهاز تنبيب الشفوي. (أ) صورة من إبرة قفل اللوير ز 31 ثابتة على حقنه 100 ميليلتر مع سيليكون الأنبوب وماصة نصيحة نهاية تغطي غيض الإبرة. (ب) صورة موسعة للجزء الإبرة. السهم الأسود يشير إلى حيث يتجاوز نهاية طرف ماصة غيض الإبرة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : تدفق التحليل الخلوي لجسيمات نانوية مضيئة في الأمعاء الزرد عن طريق تنبيب الشفوي. الزرد تعامل مع برنامج تلفزيوني أو الفلورسنت IBsTNFα (100 ميكروغرام) ح 5 وح 24، على التوالي. (أ) رسوم بيانية الممثل من شدة الأسفار. النقطة (ب) يرسم الرسم البياني نسبة الخلايا الفلورسنت. كل نقطة خضراء تمثل النسبة المئوية للخلايا الفلورسنت في إيه فور الفردية، ن واحد. وتمثل البيانات يعني ± الخطأ المعياري للوسط (SEM). تم تحليل الاختلافات استخدام ANOVA أحادي الاتجاه. اختلافات كبيرة فيما يتعلق بمراقبة (* *، ف < 0.01) الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3 : الصور للتحليل المجهري [كنفوكل]- تم تنبيب الأسماك شفويا مع برنامج تلفزيوني أو 20 ميكروغرام/الأسماك جسيمات نانوية الفلورسنت. وكان تشريح الأمعاء في تنبيب وظيفة ح 5. (أ) الأمعاء الزرد جزءا لا يتجزأ من مركبات OCT. وكان وضع الأمعاء مع التوجه الطبيعي لشكل "Z" (ج: نهاية الأمامي؛ نهاية الخلفي p:). (ب) الفحص المجهري [كنفوكل] الصور الزرد من الأمعاء. وتظهر الأسهم البيضاء أن جسيمات نانوية الفلورسنت يتم تناولها في مخاطية الأمعاء. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4 : عينات الحمض النووي الريبي محلل جل الظاهري صورة عرض الحمض النووي الريبي المستخرج من 7 الزرد الأمعاء تنبيب وظيفة. نموذج رقم 1 و 2 مجموعات برنامج تلفزيوني تنبيب ونموذج رقم 3 إلى 7 مجموعات نانوحبيبات تنبيب. يتم إعطاء أرقام سلامة الحمض النووي الريبي (رين) في أسفل تتراوح بين 7.9 8.9. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| عامل التشغيل | وحدة التخزين | # الأسماك تنبيب | يعني الوزن (غ ± SD) |
وفاة # | معدل الوفيات (%) |
| R | 30 ميليلتر | 22 | 0.88 ± 0.14 | 3 | 13.6 |
| R | 30 ميليلتر | 17 | 0.93 ± 0.19 | 0 | 0 |
| ي | 50 ميليلتر | 19 | 1.23 ± 0.31 | 1 | 5.2 |
| ي | 50 ميليلتر | 30 | 1.08 ± 0.40 | 2 | 6.6 |
| المجموع | 88 | 1.03 ± 0.16 | 6 | 6.8 | |
| التنمية المستدامة: الانحراف المعياري للوسط | |||||
الجدول 1: مقارنة بين الزرد الوفيات الناجمة عن هذين المشغلين باستخدام البروتوكول. يتم عرض رمز تعريف عامل التشغيل وحجم المنببين وعدد الأسماك ومتوسط وزن الأسماك في غرام (ز).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
هذا البروتوكول تحسين تقنية هو موضح سابقا تنبيب الشفوي من كوليمور et al. 4 لدينا بروتوكول يصف بالتفصيل طريقة تنبيب الشفوي ويشمل إعداد الأمعاء لتحليلات المتلقين للمعلومات. لدينا طريقة تحسين سرعة التلاعب الأسماك السماح لشخص واحد لتنفيذ البروتوكول كله سريعاً، دون تباين كبير بين المشغلين. فرق رئيسية لدينا بروتوكول مع السابق أن نقيم نجاح تجربة تنبيب الشفوي ليس فقط عن طريق مراقبة الحيوان لرفاه (مثلاً، لا النزيف) ولا تسرب للسوائل التي تديرها، ولكن أيضا عن طريق التحقق من على الإقبال نانوحبيبات النشطة بيولوجيا في الأمعاء باستخدام تحليل المتلقين للمعلومات (الخلوي والفحص المجهري [كنفوكل] و qPCR). ونحن تبين أنه تم العثور على جسيمات نانوية فلوريسسينتلي المسمى المنببين في الأمعاء.
على الجانب العملي، ومعدات التنبيب رخيصة ودقيقة وقابلة لإعادة الاستخدام: الجهاز الأساسية مصنوعة من الزجاج 100 ميليلتر القابل لإعادة الاستخدام (مثلاً، هاملتون) حقنه بالإضافة إلى إبرة ز 31 مع قطعة من السيليكون في الجزء العلوي. تلميح عقيمة قطع يوضع عبر أنبوب السيليكون، ويمكن تغييرها لكل الإدارة الفردية. المحاقن القابل لإعادة الاستخدام، ويسمح إبرة رقيقة تنبيب الأسماك الصغيرة مع إمكانية عالية للنجاح. وعلاوة على ذلك، يمكن أن توضع تلميح العقيمة قطع مباشرة عبر الإبرة دون أنبوب السيليكون الذي يسمح معدات التنبيب أسهل في مختبر. مجمع النشطة بيولوجيا تدار مرئية بوضوح، وإدارة صحيحة يمكن رصدها بسهولة. هو خطوة حاسمة أثناء إجراء تنبيب دخول الإبرة. من المهم أن الإبرة لا يميل أو إدراج الكثير لتجنب تثقيب الخياشيم. الوفيات بهذا الأسلوب جداً منخفضة (حوالي 7%)، ويعتمد على حجم الأسماك. تثقيب، جيل هو السبب الأكثر شيوعاً لموت الأسماك وعندما يحدث تموت الأسماك خلال الساعة الأولى. على الرغم من تنبيب الأسماك من 0.5 غ يمكن أن تكون بسهولة حجم الأسماك الأمثل حوالي 1 ز. فرق آخر مع الأسلوب الذي وضعته كوليمور et al. هو أن الأسماك هي صام عن 48 ساعة للتأكد من أن الجهاز الهضمي فارغ. إجراء تنبيب كله يمكن أن يتم بسرعة كبيرة (30 الحيوانات/h) من مشغل واحد، والأهم من ذلك، الأسلوب يتسق بين مختلف العاملين4. الأسلوب تنبيب سهلة التعلم ولا يتطلب الكثير من الممارسة لإتقان.
يجب أن يتم إجراء تشريح الأمعاء بشكل صحيح للحصول على عينات ذات نوعية جيدة للخلوي، [كنفوكل] والتحليلات قبكر. أن الخطوة الحاسمة في هذه المرحلة هو تشريح كامل من الأمعاء؛ الجزء الخلفي هشة ومن السهل أن تفقد. حالما يتم تشريح الأمعاء، فإنه يمكن معالجة بالمزيد للخلوي (2 حاء من البروتوكول)، تحليل قبكر (ح 2 من البروتوكول حتى عزل الحمض النووي الريبي) أو [كنفوكل] مجهرية (ح 1 إلى عينات جاهزة كريوسيكشن). من المهم جداً أن تتبع اتجاه الأمعاء، خاصة بالنسبة للفحص المجهري [كنفوكل]. التحليل الخلوي يتطلب المعالجة السريعة، ولا يمكن إيقاف هذا الإجراء قبل الإكمال. ولما عزل الحمض النووي الريبي والعينات المعدة من أجل يمكن تخزينها ومعالجتها في أي وقت كريوسيكشن بشكل صحيح. للخلوي، عينات ذات نوعية جيدة دون الحطام التثاقل الجهاز يمكن أن تكون معزولة بهذا الأسلوب، ويمكن إجراء تحليل سريع لوجود خلايا الفلورسنت بسهولة على الأفراد. رصد نوعية الجيش الملكي النيبالي وأظهرت أن الحمض النووي الريبي عالية الجودة يمكن أن تكون معزولة من الأمعاء التحليل يسمح للأسماك الفردية التي قبكر. وأخيراً، إعداد كريوسيكشن للفحص المجهري [كنفوكل] يوفر معلومات هيكلية هامة حول استيعاب نانوحبيبات البروتين. وهكذا توفر أساليب عملنا نموذجا لاختبار ديناميات الوقائية عن طريق الفم أو غيرها من المركبات في الأمعاء.
القيود المفروضة على دراستنا هي حجم الأسماك نظراً لأننا لا اختبار الإدارة في الأسماك أقل من 0.5 ز واستخدام مخدر الكيميائية رصانة الحيوانات. بعض المؤلفين استخدام المياه الباردة (0-4 درجة مئوية) تخدير الزرد18 ولكن في سياق رعاية الحيوان والقيود القانونية الأوروبية، قررنا أن مرض التصلب العصبي المتعدد-222 هو الأسلوب المفضل.
الزرد يوفر مزايا عديدة أكثر النظم النموذجية الأخرى بما في ذلك مجموعة كاملة من البيانات الجينية وخطوط المعدلة وراثيا المتوفرة. بالنسبة للمناعة، تعيين الخطوط المعدلة وراثيا (مثلاً، تيراغرام mpx:GFP و mpeg1:GFP تيراغرام) مشهد للمراقبة في فيفو للخلايا المناعية مثل الضامة والعدلات19،20. الجمع بين دولنا تنبيب الشفوي وتحليل المتلقين للمعلومات مع خطوط محوره وراثيا، يمكن أن تكون مثالية لتحديد أنواع الخلايا التي تنطوي الامتصاص، النقل والتجهيز من اللقاحات الفموية وجسيمات نانوية ومسببات الأمراض في الأسماك.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب يعلن وجود لا تضارب في المصالح.
Acknowledgments
وأيد هذا العمل المنح المقدمة من الوزارة الإسبانية للعلوم واللجنة الأوروبية والصناديق عجور للمجلة (AGL2015-65129 آر مينيكو/FEDER وعجور 2014SGR-345). RT يحمل دكتوراه قبل منحة دراسية من عجور (إسبانيا)، ي ي وأيده على زمالة دكتوراه من "مجلس المنح الدراسية الصيني" (الصين) وتقرير وطني معتمد من قبل البرنامج رامون y كيال (تأهيل-2010-06210، 2010، مينيكو). ونحن نشكر الدكتور توريالبا على مشورة الخبراء في إنتاج البروتين، باربا أ من "ميكروسكوبيا دي سيرفي" والدكتور م. كوستا من "سيتوميتريا دي سيرفي" للمستقلة جامعة برشلونة للمساعدة التقنية مفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




